特异性靶向B7-H4的抗体及其制备方法和应用
本发明涉及生物医药领域,特别涉及一种特异性靶向b7-h4(b7 homolog 4,b7同源体4)的抗体及其制备方法和应用。
背景技术:
1、恶性肿瘤已成为威胁人类健康,降低预期寿命的首要因素。每年新增肿瘤患者达到数千万。传统的肿瘤治疗手段如化疗、放疗和手术治疗效果局限,且毒副作用大,肿瘤免疫治疗的建立及蓬勃发展改变了恶性肿瘤的常规治疗方式。在利用阻断ctla-4(cytotoxict lymphocyte-associated antigen-4,细胞毒t淋巴细胞相关抗原4)和pd-1(programedcell death-1,程序性死亡受体1)这两个首先检测到的免疫检查点在肿瘤治疗方面取得显著成果后,出现了基于免疫检查点配体和受体阻断的肿瘤治疗新探索浪潮。到目前为止,fda(food and drug administration,食品药品监督管理局)批准了近50种用于肿瘤治疗的单克隆抗体药物,然而这些批准的针对免疫检查点单克隆抗体或小分子抑制剂的临床反应率仍然很低,仅有部分肿瘤患者从中受益,且单独使用的疗效也有限。因此,深入研究肿瘤免疫的调控机制,探索其他靶向药物和抑制途径是肿瘤免疫领域的重点。
2、过去几年,越来越多的研究表明b7-h4是治疗肿瘤的潜在靶点。b7分子是一个跨膜蛋白家族,与cd28受体家族相互作用,调节刺激或抑制性免疫信号。b7-h4是b7家族中的一员,于2003年被三个实验室通过与b7家族其他分子的dna序列同源性进行鉴定。在健康个体中,许多非淋巴组织(如胎盘、肺、肝、卵巢和脾脏)中检测到较低的b7-h4 mrna水平;而在各种类型的癌症组织中均可观察到b7-h4的异常高表达,如乳腺癌、胃癌、结直肠癌、肺癌、前列腺癌、黑色素瘤和肾细胞癌等,且表达水平与患者预后和总生存期呈负相关。作为b7家族中与pd-l1(programmed cell death 1ligand 1,细胞程序性死亡-配体1)的共同抑制免疫检查点,b7-h4与pd-l1表达的重叠最小。chen,di等人基于从tcga和cgga中获得的两个已发表的胶质瘤患者rna-seq数据集分析了pd-l1和b7-h4的mrna表达水平观察到pd-l1和b7-h4之间存在显著的负相关。在肺腺癌、肺癌、宫颈癌等肿瘤中也观察到类似的结果。此外,在临床或临床前试验中被证实为治疗靶点的大多数其他与pd-l1密切相关的靶向免疫调控分子同时表现出与b7-h4的互斥表达。因此,b7-h4有望成为与pd-l1相互补偿的免疫检查点分子,在pd-l1低表达或者pd-l1疗法耐药的病人中起到抑制免疫抗肿瘤的功能。另外,b7-h4在乳腺癌细胞上高表达,并且在三阴性乳腺癌细胞中的表达有升高的趋势,b7-h4有可能成为治疗原发和复发乳腺癌的新的替代靶点,包括对her2靶向治疗无效的三阴性乳腺癌。iizuka,akira等人利用抗b7-h4 bsab(bispecific antibody,双特异性抗体)在体内对b7-h4阳性的乳腺癌细胞株(hcc-1954和hcc-1569)显示出很强的抗肿瘤作用,而这两株细胞已被证实是her2阳性,曲妥珠单抗耐药。研究表明,b7-h4可以通过抑制t细胞介导的免疫应答反应参与肿瘤的免疫逃逸,肿瘤细胞中的b7-h4是cd8 t细胞活化、扩增和细胞毒性的负调控因子,提示肿瘤细胞相关的b7-h4可能是基于t细胞的癌症免疫治疗的靶点。因此,如果抑制b7-h4蛋白的功能,就可以阻断其与t细胞上假定的b7-h4受体或配体接触,影响信号传递,从而抑制肿瘤细胞的增殖或逃逸。
3、尽管b7-h4作为抗肿瘤靶点前景广阔,然而迄今为止,仍没有靶向b7-h4的抗体药物上市,也没有针对人b7-h4的有效全人源中和型抗体。已有一些关于靶向b7-h4抗体的体内外抗肿瘤活性研究的报道。prasad,durbaka v.r.等人的研究表明,在b7-h4抗体存在的情况下,il-2分泌增加,t细胞增殖和活化水平提高。sica,gabriel l.等人开发了一种抗小鼠b7-h4单克隆抗体,在与b7-h4转染的细胞孵育后显示出部分中和对t细胞增殖的抑制作用。另一种抗小鼠b7-h4抗体(3e8)显示逆转b7-h4介导的小鼠t细胞激活后细胞因子分泌减少。此外,抗小鼠b7-h4抗体能够增加t细胞体内抗肿瘤反应并减少表达同基因b7-h4的小鼠肺癌模型中的肿瘤负荷。xue,qun等人利用一种抗人b7-h4抗体,可显著减弱人骨髓源性间充质干细胞(hbmscs)表达的b7-h4的t细胞抑制作用,但在异种移植模型中对抗b7-h4单抗减轻人类肿瘤负担的能力的体内分析尚未得到评估。然而,小鼠单抗与人类fc受体的结合较差,这将导致一系列间接保护机制的缺失,如抗体依赖细胞介导的细胞毒性,补体依赖细胞毒性,吞噬作用和调理素作用。此外,小鼠单抗对新生受体(fcrn)的亲和力较差,导致这些igg分子循环不良,导致半衰期较短(小鼠抗体1.5天、人鼠嵌合抗体10天、人源化抗体12-20天、全人源抗体15-20天)。因此,在治疗过程中需要更多的小鼠单抗,才能达到理想的治疗效果。更重要的是,鼠源抗体具有较强的免疫原性,限制了它们的临床应用。综上分析,全人源化抗体是最适合用于治疗的。目前在国外仅有1个由人源化小鼠获得的b7-h4抗体即fpa150及经过人源化改造的b7-h4抗体nc762分别进入临床i期和临床ⅱ期进行评估,这种将人类抗体恒定区及鼠可变区结合的人源化抗体其鼠源成分仍占10%。而国内的研究仍是一片空白。还有7个鼠源抗体进入ⅰ期临床试验,其中3个抗体与其他靶点抗体药物联合制备成双特异性抗体(bsab),即hbm7008(b7-h4×4-1bb bsab)、gen-1047(b7-h4×cd3 bsab)、pf-07260437(b7-h4×cd3 bsab),另外4个抗体(azd-8205、hs-20089、xmt-1660、sgn-b7h4v)与小分子药物偶联制备成抗体偶联药物(adc)。这些联用方案的策略是利用b7-h4抗体的靶向性,同时借助另一个联用抗体或小分子药物的抗肿瘤功能“双管齐下”,发挥二者的协同作用,然而如何能实现双特异性抗体“1+1>2”的升级是近几十年来科研及药企研发人员需要克服的困难与挑战,因此产生一种高度特异性的抗人b7-h4中和型抗体将强有力打开临床前研究的大门。
4、有鉴于此,特提出本技术。
技术实现思路
1、本技术实施例的目的包括提供一种特异性靶向b7-h4的抗体及其制备方法和应用。
2、在本技术的第一方面,提供一种特异性靶向b7-h4的抗体,所述抗体的重链cdr1如seq id no.6所示、重链cdr2如seq id no.7所示以及重链cdr3如seq id no.8所示;
3、所述抗体的轻链cdr1如seq id no.9所示、轻链cdr2如seq id no.10所示以及轻链cdr3如seq id no.11所示。
4、在本技术的一些实施方式中,所述抗体的重链可变区如seq id no.4所示。
5、在本技术的一些实施方式中,所述中和抗体的轻链可变区如seq id no.5所示。
6、在本技术的一些实施方式中,所述抗体还包括重链恒定区和轻链恒定区。
7、在本技术的一些实施方式中,所述的重链恒定区和轻链恒定区的独立地选自人、鼠、兔、羊、牛、马、猪、狗、猫、骆驼、驴、鹿、貂、鸡、鸭和鹅任何其中之一的种属来源。
8、在本技术的一些实施方式中,所述重链恒定区和所述轻链恒定区独立地具有igg1、igg2、igg3、igg4、iga、igm、ige和igd任何其中之一恒定区的序列。
9、在本技术的第二方面,提供一种重组蛋白,所述重组蛋白包括第一方面中定义的所述重链cdr1、所述重链cdr2、所述重链cdr3、所述轻链cdr1、所述轻链cdr2、所述轻链cdr3、所述重链可变区和所述轻链可变区中的一个或者多个。
10、在本技术的第三方面,提供一种检测试剂、检测试剂盒或者药物,包含第一方面中所述的抗体或者第二方面中所述的重组蛋白。
11、在本技术的第四方面,提供一种核酸,含有用于编码如第一方面中所述的抗体或者第二方面中所述的重组蛋白的核酸片段。
12、在本技术的第五方面,提供一种重组表达载体,包含第四方面中所述的核酸。
13、在本技术的一些实施方式中,所述重组表达载体为抗体表达载体。
14、在本技术的一些实施方式中,所述重组表达载体选自细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其组合。
15、在本技术的一些实施方式中,所述重组表达载体为pcdna3.1表达载体。
16、在本技术的第六方面,提供一种宿主细胞,包含第四方面中所述的核酸或者第五方面中任一项所述的重组表达载体。
17、在本技术的一些实施方式中,所述宿主细胞为cho细胞、cos细胞、nso细胞、hela细胞、bhk细胞或者hek293细胞。
18、在本技术的第七方面,提供第一方面中所述的抗体或者第二方面中所述的重组蛋白的制备方法,所述制备方法包括如下步骤:
19、培养第六方面中所述的宿主细胞,从所得培养物中分离抗体或者重组蛋白。
20、在本技术的第八方面,提供第一方面中所述的抗体或者第二方面中所述的重组蛋白在制备治疗肿瘤的药物中的应用。
21、在本技术的一些实施方式中,所述肿瘤为b7-h4表达阳性的结直肠癌。
22、相对于传统技术,本技术的有益效果包括:
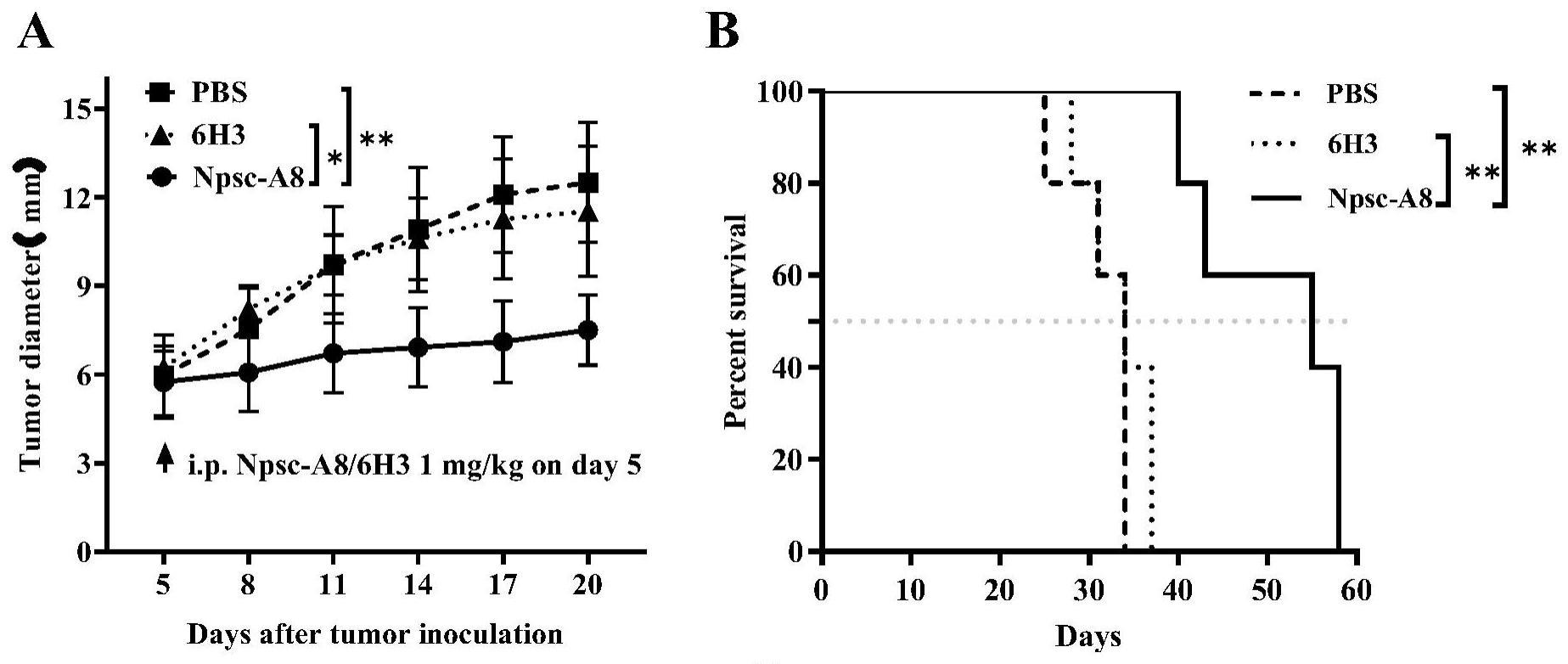
23、本技术基于噬菌体展示技术筛选靶向b7-h4的抗体可变区,再将其改造成全长抗体,通过构建表达载体、真核表达、纯化获得特异性靶向b7-h4的抗体。该抗体具有良好的靶向性:能与内源性表达及过表达b7-h4的人肿瘤细胞结合且能与过表达b7-h4的小鼠肿瘤细胞结合。其结合表位位于b7-h4的igv功能结构域。npsc-a8以剂量依赖的方式阻断b7-h4分子对t细胞增殖及杀伤功能的抑制作用。npsc-a8在体内能够抑制b7-h4阳性肿瘤生长并延长小鼠的生存期,提示其具有逆转b7-h4的免疫抑制效应。总之,npsc-a8有望成为靶向b7-h4治疗癌症的极具前途的潜在候选抗体药物。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺