双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
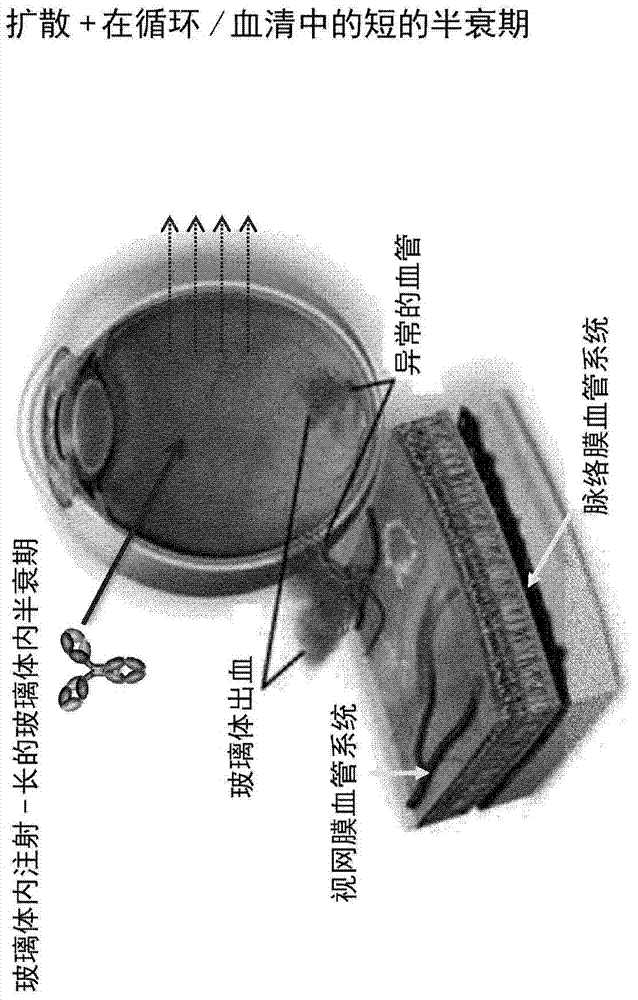
双特异性抗-VEGF/抗-ANG-2抗体及其在治疗眼血管疾病中的应用本发明涉及一种用于减少人IgG1或人IgG4亚类的抗体(包括双特异性抗体)的粘性的方法,涉及针对人血管内皮生长因子(VEGF/VEGF-A)且针对人血管生成素-2(ANG-2)的抗体,其制备方法,包含所述抗体的药物组合物,及其应用。发明背景血管发生参与各种病症的发病机理,所述疾病包括实体瘤、眼内新血管综合征(intraocularneovascularsyndromes)如增生性视网膜病(proliferativeretinopathies)或年龄相关的黄斑变性(age-relatedmaculardegeneration,AMD)、类风湿性关节炎(rheumatoidarthritis)和银屑病(psoriasis)(Folkman,J.,等,J.Biol.Chem.(生物化学杂志)267(1992)10931-10934;Klagsbrun,M.,等,Annu.Rev.Physiol.(物理学年度综述)53(1991)217-239;和Garner,A.,Vasculardiseases(血管疾病),在:Pathobiologyofoculardisease,Adynamicapproach(眼科疾病的病理学,即动力学途径),Garner,A.,和Klintworth,G.K,(编辑),第二版,MarcelDekker,纽约,(1994),第1625-1710页)。雷珠单抗(Ranibizumab)(商品名称为)是一种与贝伐珠单抗(bevacizumab)(Avastin)来源于相同的亲本鼠源抗体的单克隆抗体片段。然而,其已被亲和力成熟从而提供更强的与VEGF-A的结合(WO98/45331)。已知VEGF-A阻断可能与一些系统毒性相关,因此,雷珠单抗缺失Fc部分,从而减少血清半衰期并且因此降低系统毒性。其是一种已被核准用于治疗“湿”型年龄相关的黄斑变性(ARMD)(一种常见的年龄相关的视觉丧失)的抗血管生成剂。角膜血管发生测定已经表明ANG-1和ANG-2具有相似的作用,与VEGF协同作用以促进新血管生长。Asahara,T.,等,Circ.Res.83(1998)233-40。存在剂量依赖性的内皮反应的可能性是由下述观察引起的:在体外以高浓度存在时,ANG-2也可能是促血管形成的(Kim,I.,等,Oncogene(癌基因)19(2000)4549-52)。在血清饥饿凋亡(serumdeprivationapoptosis)过程中,高浓度ANG-2通过经由PI-3激酶和Akt途径激活Tie2而作用为内皮细胞的凋亡存活因子(Kim,I.,等,Oncogene(癌基因)19(2000)4549-52)。WO2010/040508A9和WO2011/117329涉及双特异性抗-VEGF/抗-ANG-2抗体。WO2008/132568涉及与生长因子结合的融合蛋白。WO2009/136352涉及抗血管形成的化合物。WO2009/080253与WO2011/117330涉及双特异性二价抗体形式。WO2010/069532涉及Ang2抗体。眼血管疾病,如年龄相关的黄斑变性(ARMD)和糖尿病性视网膜病变(diabeticretinopathy,DR),分别是由于异常的脉络膜或视网膜新血管形成所导致。它们是工业化国家中视觉丧失的主要原因。由于视网膜由界限明确的神经元、神经胶质和血管元件层组成,相对小的干扰,如在血管增生或水肿中观察到的那些,可以导致显著的视功能丧失。遗传性视网膜变性,诸如色素性视网膜炎(RetinitisPigmentosa,RP)也与血管遗传相关,诸如小动脉狭窄和血管萎缩。它们多至在每3500名个体中影响1人,并且特征在于进行性的夜盲(progressive)、视野丧失(visualfieldloss)、视神经萎缩(opticnerveatrophy)、小动脉变细(arteriolarattenuation)和通常进展为完全的失明的中央视觉丧失(centrallossofvision)。缺血性视网膜病变(Ischemicretinopathies)特征在于视网膜血管的丧失或功能障碍,其引起血流减少和缺氧。视网膜通过产生生长新血管的信号来响应缺氧,但是这些新血管通常是脆弱的和无组织性的。由于它们可能渗漏、出血或导致可能引起视网膜脱离的瘢痕,因此,正是这些异常新血管的生长产生大部分的视觉威胁。目前对于缺血性视网膜病变的治疗寻找终止病理性血管生长,但是没有解决推动其生长的潜在的缺血。此外,对糖尿病性视网膜病变(一种影响数百万人的缺血性视网膜神经病变)的标准治疗包括用激光破坏一部分视网膜,以尝试终止新血管生长并且保持中央视觉。已经应用一些策略来阻断血管内皮生长因子(VEGF)的功能,血管内皮生长因子是血管生长的主要促进剂。短期内,抗-VEGF治疗可以改善视觉,但是其没有解决潜在的缺血,并且事实上,由于其抑制所有的血管生长,包括有益的侧支的生长,可能加重这种病症。在老年人和/或糖尿病患者(在缺血性的脑、心脏或肢体中可能需要新血管生长)中,还存在对于系统性暴露于这些药物的严重的关注。典型地,对于眼部疾病,通常使用通过玻璃体内应用的较小的抗体片段,如Fab或Fab(2),原因在于其具有低血清半衰期,并且系统性毒性的危险较低。然而,这种较小的片段典型地导致较低的玻璃体内半衰期(例如,由于较快地扩散到血清中)并且必须典型地更频繁地给药。Kim等,MolecularVision(分子视觉),15(2009)2803-2812涉及在眼中玻璃体内施用的全长抗体,其中在野生型小鼠中,具有FcRn结合的IgG被清除到血液中,而不具有FcRn结合的IgY不被清除到血液系统中。此外,在FcRn敲降的小鼠(FcRnknockdown-mice)中,具有FcRn结合的IgG不被清除到血液系统中。本领域中对于用于治疗和预防诸如缺血性视网膜病变的各种眼血管疾病的更好的方式存在需要。发明概述本发明的一个方面是用于减少抗体的粘性的方法,其中所述抗体包含(来源于人源的)人IgG1或人IgG4亚类的恒定重链区,并且其中所述方法包括用突变I253A、H310A和H435A(按照Kabat的EU索引编号)修饰人IgG1或人IgG4亚类的抗体恒定重链区。在本发明的一个实施方案中,所述方法特征在于,所述抗体是双特异性抗体,包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点,其中i)所述特异性结合VEGF的第一抗原结合位点在重链可变结构域包含SEQIDNO:1的CDR3H区、SEQIDNO:2的CDR2H区和SEQIDNO:3的CDR1H区,并且在轻链可变结构域包含SEQIDNO:4的CDR3L区、SEQIDNO:5的CDR2L区和SEQIDNO:6的CDR1L区;和ii)所述特异性结合ANG-2的第二抗原结合位点在重链可变结构域包含SEQIDNO:9的CDR3H区、SEQIDNO:10的CDR2H区和SEQIDNO:11的CDR1H区,并且在轻链可变结构域包含SEQIDNO:12的CDR3L区、SEQIDNO:13的CDR2L区和SEQIDNO:14的CDR1L区,并且其中iii)所述双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)的(来源于人源的)人IgG1或人IgG4亚类的恒定重链区。在本发明的一个实施方案中,所述方法特征在于,上文所述的双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)并且还含有突变L234A、L235A和P329G(按照Kabat的EU索引编号)的(来源于人源的)人IgG1亚类的恒定重链区。本发明的一个实施方案是通过所述方法获得的抗体。本发明的一个实施方案是突变I253A、H310A和H435A(按照Kabat的EU索引编号)用于减少抗体的粘性的应用,其中所述抗体包含(来源于人源的)人IgG1或人IgG4亚类的恒定重链区。在本发明的一个实施方案中,所述应用特征在于所述抗体是双特异性抗体,其包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点,其中i)所述特异性结合VEGF的第一抗原结合位点在重链可变结构域包含SEQIDNO:1的CDR3H区、SEQIDNO:2的CDR2H区和SEQIDNO:3的CDR1H区,并且在轻链可变结构域包含SEQIDNO:4的CDR3L区、SEQIDNO:5的CDR2L区和SEQIDNO:6的CDR1L区;和ii)所述特异性结合ANG-2的第二抗原结合位点在重链可变结构域包含SEQIDNO:9的CDR3H区、SEQIDNO:10的CDR2H区和SEQIDNO:11的CDR1H区,并且在轻链可变结构域包含SEQIDNO:12的CDR3L区、SEQIDNO:13的CDR2L区和SEQIDNO:14的CDR1L区,并且其中iii)所述双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)的(来源于人源的)人IgG1或人IgG4亚类的恒定重链区。在本发明的一个实施方案中,所述具体的应用的特征在于,所述双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)并且还含有突变L234A、L235A和P329G(按照Kabat的EU索引编号)的(来源于人源的)人IgG1亚类的恒定重链区。本发明还涉及双特异性二价抗体,其包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点,其中i)所述特异性结合VEGF的第一抗原结合位点在重链可变结构域包含SEQIDNO:1的CDR3H区、SEQIDNO:2的CDR2H区和SEQIDNO:3的CDR1H区,并且在轻链可变结构域包含SEQIDNO:4的CDR3L区、SEQIDNO:5的CDR2L区和SEQIDNO:6的CDR1L区;和ii)所述特异性结合ANG-2的第二抗原结合位点在重链可变结构域包含SEQIDNO:9的CDR3H区、SEQIDNO:10的CDR2H区和SEQIDNO:11的CDR1H区,并且在轻链可变结构域包含SEQIDNO:12的CDR3L区、SEQIDNO:13的CDR2L区和SEQIDNO:14的CDR1L区,并且其中iii)所述双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)的(来源于人源的)人IgG1或人IgG4亚类的恒定重链区。在一个实施方案中,所述双特异性抗体特征在于i)所述特异性结合VEGF的第一抗原结合位点包含SEQIDNO:7的氨基酸序列作为重链可变结构域VH,和SEQIDNO:8的氨基酸序列作为轻链可变结构域VL;和ii)所述特异性结合ANG-2的第二抗原结合位点包含SEQIDNO:15的氨基酸序列作为重链可变结构域VH,和SEQIDNO:16的氨基酸序列作为轻链可变结构域VL。在一个实施方案中,所述双特异性抗体特征在于iii)中的恒定重链区是人IgG1亚类的。在一个实施方案中,所述IgG1亚类的双特异性抗体特征在于所述IgG1亚类的恒定重链区还包含突变L234A、L235A和P329G(按照Kabat的EU索引编号)。在一个实施方案中,所述双特异性抗体特征在于iii)中的恒定重链区是人IgG4亚类的。在一个实施方案中,所述IgG4亚类的双特异性抗体特征在于所述IgG4亚类的恒定重链区还包含突变S228P和L235E(按照Kabat的EU索引编号)。在一个实施方案中,所述IgG4亚类的双特异性抗体特征在于所述IgG4亚类的恒定重链区还包含突变S228P、L235E和P329G(按照Kabat的EU索引编号)。本发明的另一个方面是包含所述双特异性抗体的药物组合物,所述药物组合物用于治疗眼血管疾病,所述双特异性抗体用于制备用于治疗眼血管疾病的药物的应用,通过给需要这样的治疗的患者施用所述双特异性抗体来治疗患有限血管疾病的患者的方法。在一个实施方案中,包含所述双特异性抗体的所述双特异性抗体或所述药物组合物通过玻璃体内应用进行施用。本发明的另一方面是编码本发明所述的双特异性抗体的重链和/或轻链的核酸分子。本发明还提供包含本发明所述的核酸的表达载体,所述表达载体能够在原核或真核宿主细胞中表达所述核酸,并且提供包含所述载体的宿主细胞,所述宿主细胞用于重组生产本发明所述的双特异性抗体。本发明还包括包含本发明所述的载体的原核或真核宿主细胞。本发明还包括用于生产本发明所述的双特异性抗体的方法,其特征在于在原核或真核宿主细胞中表达本发明所述的核酸,并且从所述细胞或细胞培养物上清中回收所述双特异性抗体。一个实施方案是用于制备本发明所述的双特异性抗体的方法,所述方法包括下述步骤:a)用包含编码所述抗体的核酸分子的载体转化宿主细胞;b)在允许合成所述抗体分子的条件下培养所述宿主细胞;和c)从所述培养物回收所述抗体分子。本发明还包括通过所述用于生产双特异性抗体的方法获得的抗体。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:21、SEQIDNO:22、SEQIDNO:23和SEQIDNO:24的氨基酸序列。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:25、SEQIDNO:26、SEQIDNO:27和SEQIDNO:28的氨基酸序列。本发明所述的抗体由于其在Fc部分/恒定区中的特异性修饰而具有高度有价值的特性,所述特异性修饰引起对患有眼血管疾病的患者的益处。其在玻璃体内环境中具有高度的稳定性和从眼睛的缓慢扩散(与不具有恒定重链区的较小的抗体片段相比),其中实际的疾病位于此并且在此处治疗(因此,与非IgG样抗体,例如,Fab和(Fab)2片段相比,治疗时间安排可能得到改善)。与未修饰的IgG抗体相比,令人吃惊地,在玻璃体内应用所述在恒定区具有突变I253A、H310A和H435A的抗体(不再有FcRn结合)后在眼中的半衰期是相似的(仅略微减小)(表17a和18a以及图7D和7E),而从眼到血清中的扩散是相似的(表15和图7B)。由于对于治疗与ANG2和/或VEGF相关的眼血管疾病需要从眼部消除VEGF和Ang2(例如,通过将抗-ANG2/ANG2抗体复合物或抗-VEGF/VEGF抗体复合物转运至血清中),所以这是高度有价值的。另一方面,当与未修饰的IgG抗体相比时,本发明所述的抗体非常快速地从血清中清除(对于减少由系统性暴露引起的潜在的副作用这是高度合乎需要的)。令人吃惊地,它们还表现出较低的粘性(参见图2)(与在恒定区不具有突变I253A、H310A和H435A的版本相比),并且因此在眼部疾病的治疗过程中特别有效的用于通过细针进行玻璃体内应用(对于此类应用,典型地使用细针进行,并且高粘性使得适当的应用变得相当困难)。所述较低的粘性还允许更高浓度的制剂。还令人吃惊地,本发明所述的抗体在储存过程中表现出较低的聚集倾向性(图4)(与在Fc部分不具有突变I253A、H310A和H435A的版本相比),这对于在眼中玻璃体内的应用是至关重要的(由于在所述治疗过程中,在眼中的聚集可能导致并发症)。本发明所述的双特异性抗体表现出抑制眼部疾病的良好功效。在某些实施方案中,本发明所述的双特异性抗体由于其在恒定区中的特异性修饰(例如P329GLALA)表现出有价值的特性,如不结合Fcγ受体,这减少如血栓形成和/或不需要的细胞死亡(例如,由于ADCC引起)的副作用的危险性。附图描述图1具有AAA突变(突变I253A、H310A和H435A-按照Kabat的EU索引编号)的<VEGF-ANG-2>IgG1或IgG4抗体的概念和优点的示意图图2小规模基于DLS的粘度测量以在200mM精氨酸/琥珀酸酯pH5.5中150mg/mL外推的粘度(本发明所述的<VEGF-ANG-2>抗体VEGFang2-0016(具有AAA突变)与参比VEGFang2-0015(不具有所述AAA突变)比较)图3在20mMHis,140mMNaCl,pH6.05中取决于温度的DLS聚集(包括DLS聚集起始温度)(本发明所述的<VEGF-ANG-2>抗体VEGFang2-0016(具有AAA突变)与参比VEGFang2-0015(不所述具有AAA突变)比较)图4以100mg/ml在40℃储存7天(降低的主峰减少和高分子量/HMW)增加)(显示出较低的聚集的本发明所述的<VEGF-ANG-2>抗体VEGFang2-0016(具有AAA突变)与参比VEGFang2-0015(不具有所述AAA突变)的比较)图5AVEGFang2-0015(不具有AAA突变)的FcRn稳态亲和力:不同浓度Biacore传感图的重叠显示出VEGFang2-0015(不具有AAA突变)与FcRn的浓度依赖性的结合图5BA:VEGFang2-0015(不具有AAA突变)的FcRn稳态亲和力:VEGFang2-0015(不具有AAA突变)的浓度依赖性结合反应曲线显示出与FcRn的结合图5CVEGFang2-0016(具有AAA突变)的FcRn稳态亲和力:不同浓度Biacore传感图的重叠表示在所有浓度都不与FcRn结合图5DVEGFang2-0016(具有AAA突变)的FcRn稳态亲和力:VEGFang2-0016(具有AAA突变)的浓度依赖性结合反应曲线不显示与FcRn的结合图5EVEGFang2-0016(具有AAA突变)的FcRn稳态亲和力:VEGFang2-0016(具有AAA突变)的浓度依赖性结合反应曲线显示不与FcRn的结合(响应范围从-0.6到0.2RU/浓度规模范围从0到0.35M)图6不具有AAA突变的VEGFang2-0015和具有AAA突变的VEGFang2-0016的FcγRIIIa相互作用测量(二者均为具有P329GLALA突变的IgG1亚类;IgG1亚类的抗-Dig和基于IgG4的抗体用作对照)图7A确定血清和全眼裂解物中<VEGF/Ang2>双特异性抗体的浓度的示意性Pk-ELISA测定原理图7B静脉内应用后的血清浓度:化合物比较-不具有AAA突变的VEGFang2-0015与具有AAA突变的VEGFang2-0016图7C玻璃体内应用后的血清浓度:化合物比较-不具有AAA突变的VEGFang2-0015与具有AAA突变的VEGFang2-0016图7D右眼和左眼中VEGFang2-0016(具有AAA突变)的眼裂解物浓度(在仅对右眼玻璃体内应用后,与静脉内应用相比较):在玻璃体内应用后仅在右眼中能够检测到明显的浓度。在静脉内应用后,由于VEGFang2-0016(具有AAA突变)的低血清半衰期,在眼裂解物中不能检测到其浓度图7E右眼和左眼中VEGFang2-0015(不具有AAA突变)的眼裂解物浓度(在仅对右眼玻璃体内应用后,与静脉内应用相比较):在右眼中(并且在左眼中在一定程度上)在玻璃体内应用后,可以检测到VEGFang2-0015浓度。这表明从右眼到血清中的扩散以及从血清到左眼的扩散,这可以由VEGFang2-0015(不具有AAA突变)的长半衰期进行解释。静脉内应用后,由于血清稳定的VEGFang2-0015(不具有AAA突变)扩散到眼中,也可以在双眼的眼裂解物中检测到明显的浓度发明详述在本发明的一个实施方案中,本发明所述的双特异性抗体是二价的。在本发明的一个方面中,本发明所述的双特异性二价抗体特征在于,其包含a)特异性结合VEGF的第一全长抗体的重链和轻链;b)特异性结合ANG-2的第二全长抗体的修饰的重链和修饰的轻链,其中恒定结构域CL和CH1各被其他替换。关于特异性结合人血管内皮生长因子(VEGF)和人血管生成素-2(ANG-2)的双特异性抗体的这种双特异性二价抗体形式记述在WO2009/080253中(包含凸起-进-孔洞修饰的CH3结构域)。基于这种双特异性二价抗体形式的抗体命名为CrossMabs。在一个实施方案中,所述双特异性二价抗体特征在于,其包含:a)SEQIDNO:25的氨基酸序列作为第一全长抗体的重链,和SEQIDNO:27的氨基酸序列作为第一全长抗体的轻链,和b)SEQIDNO:26的氨基酸序列作为第二全长抗体的修饰的重链,和SEQIDNO:28的氨基酸序列作为第二全长抗体的修饰的轻链。在一个实施方案中,所述双特异性二价抗体特征在于,其包含:a)SEQIDNO:21的氨基酸序列作为第一全长抗体的重链,和SEQIDNO:23的氨基酸序列作为第一全长抗体的轻链,和b)SEQIDNO:22的氨基酸序列作为第二全长抗体的修饰的重链,和SEQIDNO:24的氨基酸序列作为第二全长抗体的修饰的轻链。在一个实施方案中,所述双特异性二价抗体特征在于,其包含:a)SEQIDNO:29的氨基酸序列作为第一全长抗体的重链,和SEQIDNO:31的氨基酸序列作为第一全长抗体的轻链,和b)SEQIDNO:30的氨基酸序列作为第二全长抗体的修饰的重链,和SEQIDNO:32的氨基酸序列作为第二全长抗体的修饰的轻链。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:25、SEQIDNO:26、SEQIDNO:27和SEQIDNO:28的氨基酸序列。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:21、SEQIDNO:22、SEQIDNO:23和SEQIDNO:24的氨基酸序列。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:29、SEQIDNO:30、SEQIDNO:31和SEQIDNO:32的氨基酸序列。在本发明的另一方面,本发明所述的双特异性抗体特征在于,其包含:a)特异性结合VEGF的第一全长抗体的重链和轻链;b)特异性结合ANG-2的第二全长抗体的重链和轻链,其中所述重链的N端通过肽接头与所述轻链的C端连接。关于特异性结合人血管内皮生长因子(VEGF)和人血管生成素-2(ANG-2)的双特异性抗体的这种双特异性二价抗体形式记述在WO2011/117330中,其包含凸起-进-孔洞修饰的CH3结构域。基于这种双特异性二价抗体形式的抗体命名为OAscFabs。在一个实施方案中,所述双特异性二价抗体特征在于,其包含:a)SEQIDNO:33的氨基酸序列作为第一全长抗体的重链,和SEQIDNO:35的氨基酸序列作为第一全长抗体的轻链,和b)SEQIDNO:34的氨基酸序列作为通过肽接头与第二全长抗体的轻链连接的第二全长抗体的重链。在一个实施方案中,所述双特异性二价抗体特征在于,其包含:a)SEQIDNO:36的氨基酸序列作为第一全长抗体的重链,和SEQIDNO:38的氨基酸序列作为第一全长抗体的轻链,和b)SEQIDNO:37的氨基酸序列作为通过肽接头与第二全长抗体的轻链连接的第二全长抗体的重链。在一个实施方案中,第二全长抗体的重链和轻链的抗体重链可变结构域(VH)和抗体轻链可变结构域(VL)通过在下述位置之间引入二硫键而进行二硫化物稳定:重链可变结构域位置44-轻链可变结构域位置100(总是按照Kabat的EU索引编号(Kabat,E.A.,等,SequencesofProteinsofImmunologicalInterest(免疫学感兴趣的蛋白的序列),第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991))。此类其他二硫化物稳定通过在第二全长抗体重链和轻链的可变结构域VH和VL之间引入二硫键而实现。例如,引入非天然二硫键进行稳定的技术记述在WO94/029350,Rajagopal,V.,等,Prot.Engin.(蛋白质工程)10(1997)1453-59;Kobayashi等,NuclearMedicine&Biology(核医学与生物学)25(1998)387-393;或Schmidt,M.,等,Oncogene(癌基因)18(1999)1711-1721中。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:33、SEQIDNO:34和SEQIDNO:35的氨基酸序列。因此,本发明的一个实施方案是包含特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点的双特异性二价抗体,其特征在于包含SEQIDNO:36、SEQIDNO:37和SEQIDNO:38的氨基酸序列。在一个实施方案中,本发明所述的双特异性二价抗体的CH3结构域通过“凸起-入-孔洞”技术改变,所述“凸起-入-孔洞”技术例如在WO96/027011,RidgwayJ.B.,等,ProteinEng(蛋白质工程)9(1996)617-621;和Merchant,A.M.,等,NatBiotechnol(自然生物技术)16(1998)677-681中以一些实施例详细描述。在这种方法中,两个CH3结构域的相互作用表面被改变,以增加包含这两个CH3结构域的两个重链的异源二聚体化。(这两个重链的)这两个CH3结构域中的每一个都可以是“凸起”,而另一个是“孔洞”。引入二硫键稳定该异源二聚体(Merchant,A.M,等,NatureBiotech(自然生物技术)16(1998)677-681;Atwell,S.,等J.Mol.Biol.(分子生物学杂志)270(1997)26-35)并且增加产量。在本发明的优选方面中,本发明所述的所有的双特异性抗体特征在于:一条重链的CH3结构域与另一条重链的CH3结构域分别在包含所述抗体CH3结构域之间的原始界面的界面处相接;其中所述界面被改变以促使形成双特异性抗体,其中所述改变特征在于:a)一条重链的CH3结构域被改变,以致在一条重链的CH3结构域与所述双特异性抗体内的另一条重链的CH3结构域的原始界面相接的原始界面内,氨基酸残基被具有更大侧链体积的氨基酸残基替换,由此在一条重链的CH3结构域的界面内产生凸起,该凸起可放置在另一条重链的CH3结构域的界面内的空穴内;并且b)另一条重链的CH3结构域被改变,以致在第二CH3结构域与所述双特异性抗体内的第一CH3结构域的原始界面相接的原始界面中,氨基酸残基被具有更小侧链体积的氨基酸残基置换,由此在第二CH3结构域内产生空穴,第一CH3结构域的界面内的凸起可放置在在该空穴内。因此,本发明所述的抗体优选地特征在于:a)的全长抗体的重链的CH3结构域和b)的全长抗体的重链的CH3结构域分别在这样的界面处相接,所述界面包含在抗体CH3结构域之间的原始界面中的改变;其中i)在一条重链的CH3结构域中,氨基酸残基被具有较大侧链体积的氨基酸残基置换,由此在一条重链的CH3结构域的界面内产生凸起,所述凸起可放置在另一条重链的CH3结构域的界面内的空穴中;并且其中ii)在另一条重链的CH3结构域中,氨基酸残基被具有较小侧链体积的氨基酸残基置换,由此在第二CH3结构域的界面内产生空穴,第一CH3结构域的界面内的凸起可放置在所述空穴中。优选地,所述具有较大侧链体积的氨基酸残基选自由下述组成的组:精氨酸(R),苯丙氨酸(F),酪氨酸(Y),色氨酸(W)。优选地,所述具有较小侧链体积的氨基酸残基选自由下述组成的组:丙氨酸(A),丝氨酸(S),苏氨酸(T),缬氨酸(V)。在本发明的一个方面中,两个CH3结构域通过引入半胱氨酸(C)作为在每个CH3结构域的相对应的位置的氨基酸而进一步被改变,以致可以在两个CH3结构域之间形成二硫键。在一个实施方案中,所述双特异性抗体在“凸起链”的CH3结构域中包含T366W突变并且在“孔洞链”的CH3结构域中包含T366S、L368A、Y407V突变。也可以使用CH3结构域之间的另外的链间二硫键(Merchant,A.M,等,NatureBiotech(自然生物技术)16(1998)677-681),例如,通过向“凸起链”的CH3结构域中引入Y349C突变,和向“孔洞链”的CH3结构域中引入E356C突变或S354C突变。在另一个实施方案中,本发明所述的双特异性抗体在两个CH3结构域中的一个中包含Y349C、T366W突变,并且在两个CH3结构域中的另一个中包含E356C、T366S、L368A、Y407V突变。在另一个优选的实施方案中,所述双特异性抗体在两个CH3结构域中的一个中包含Y349C、T366W突变,并且在两个CH3结构域中的另一个中包含S354C、T366S、L368A、Y407V突变(在一个CH3结构域中包含另外的Y349C突变,和在另一个CH3结构域中包含另外的E356C或S354C突变,形成链间二硫键)(总是按照Kabat的EU索引编号(Kabat,E.A.,等,SequencesofProteinsofImmunologicalInterest(免疫学感兴趣的蛋白的序列),第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991))。但是,还可以备选地或另外应用EP1870459A1所述的其他凸起-入-孔洞技术。因此,关于双特异性抗体的另一个实例是在“凸起链”的CH3结构域中的R409D;K370E突变,和在“孔洞链”的CH3结构域中的D399K;E357K突变(总是按照Kabat的EU索引编号(Kabat,E.A.,等,SequencesofProteinsofImmunologicalInterest(免疫学感兴趣的蛋白的序列),第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991))。在另一个实施方案中,所述双特异性抗体在“凸起链”的CH3结构域中包含T366W突变,并且在“孔洞链”的CH3结构域中包含T366S、L368A、Y407V突变,以及另外的在“凸起链”的CH3结构域中的R409D;K370E突变,和在“孔洞链”的CH3结构域中的D399K;E357K突变。在另一个实施方案中,所述双特异性抗体在两个CH3结构域中的一个中包含Y349C、T366W突变,并且在两个CH3结构域中的另一个中包含S354C、T366S、L368A、Y407V突变,或所述三价双特异性抗体在两个CH3结构域中的一个中包含Y349C、T366W突变,并且在两个CH3结构域中的另一个中包含S354C、T366S、L368A、Y407V突变,和另外的在“凸起链”的CH3结构域中的R409D;K370E突变,和在“孔洞链”的CH3结构域中的D399K;E357K突变。在本发明的一个实施方案中,本发明所述的双特异性抗体特征在于具有下述特性中的一种或多种(在如实施例6所述的测定中确定):-与不具有iii)中所述的突变的相对应的双特异性抗体相比,表现出较低的血清浓度(在小鼠中玻璃体内应用后96小时,所述小鼠缺失小鼠FcRn,但是关于人FcRn是半合子转基因的);-与不具有iii)中所述的突变的相对应的双特异性抗体相比,在全右眼裂解物中表现出相似的浓度(因子0.8-1.2)(在缺失小鼠FcRn但关于人FcRn是杂合子转基因的小鼠中,在右眼中玻璃体内应用后96小时)。在一个实施方案中,所述双特异性二价抗体特征在于,其包含:特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点,特征在于i)所述第一抗原结合位点包含SEQIDNO:7作为重链可变结构域(VH),和SEQIDNO:8作为轻链可变结构域(VL);和ii)所述第二抗原结合位点包含SEQIDNO:15作为重链可变结构域(VH),并且SEQIDNO:16作为轻链可变结构域(VL);和iii)所述双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)的(来源于人源的)IgG1或IgG4亚类的恒定重链区;并且具有下述特性中的一种或多种(在如实施例6所述的测定中确定):-与不具有iii)中所述的突变的相对应的双特异性抗体相比,表现出较低的血清浓度(在小鼠中玻璃体内应用后96小时,所述小鼠缺失小鼠FcRn,但是关于人FcRn是杂合子转基因的);-与不具有iii)中所述的突变的相对应的双特异性抗体相比,在全右眼裂解物中表现出相似的浓度(因子0.8-1.2)(在缺失小鼠FcRn但关于人FcRn是杂合子转基因的小鼠中,在右眼中玻璃体内应用后96小时)。在一个实施方案中,所述双特异性抗体特征在于,其包含:特异性结合人VEGF的第一抗原结合位点和特异性结合人ANG-2的第二抗原结合位点,特征在于:i)所述第一抗原结合位点包含SEQIDNO:7(具有1、2或3个氨基酸残基置换)作为重链可变结构域(VH),和SEQIDNO:8(具有1、2或3个氨基酸残基置换)作为轻链可变结构域(VL);和ii)所述第二抗原结合位点包含SEQIDNO:15(具有1、2或3个氨基酸残基置换)作为重链可变结构域(VH),并且SEQIDNO:16(具有1、2或3个氨基酸残基置换)作为轻链可变结构域(VL);和iii)所述双特异性抗体包含含有突变I253A、H310A和H435A(按照Kabat的EU索引编号)的(来源于人源的)IgG1或IgG4亚类的恒定重链区;并且具有下述特性中的一种或多种(在如实施例6所述的测定中确定):-与不具有iii)中所述的突变的相对应的双特异性抗体相比,表现出较低的血清浓度(在小鼠中玻璃体内应用后96小时,所述小鼠缺失小鼠FcRn,但是关于人FcRn是杂合子转基因的);-与不具有iii)中所述的突变的相对应的双特异性抗体相比,在全右眼裂解物中表现出相似的浓度(因子0.8-1.2)(在缺失小鼠FcRn但关于人FcRn是杂合子转基因的小鼠中,在右眼中玻璃体内应用后96小时)。用于本文时,“抗体”是指包含抗原结合位点的结合蛋白。术语“结合位点”或“抗原结合位点”用在本文中表示配体实际结合的抗体分子的区域。术语“抗原结合位点”包含抗体重链可变结构域(VH)和抗体轻链可变结构域(VL)(VH/VL对)。抗体特异性是指抗体对抗原的特定表位的选择性识别。例如,天然抗体是单特异性的。本发明所述的“双特异性抗体”是具有两种不同的抗原结合特异性的抗体。本发明的抗体特异于两种不同的抗原,即作为第一抗原的VEGF和作为第二抗原的ANG-2。术语“单特异性”抗体用在本文中表示具有一个或多个分别结合于相同抗原的相同表位的结合位点的抗体。术语“价”在本申请中使用时表示结合位点在抗体分子上存在的具体数量。象这样,术语“二价”、“四价”和“六价”表示在抗体分子上分别存在两个结合位点、四个结合位点和六个结合位点。本发明所述的双特异性抗体优选是“二价”的。术语“VEGF”用在本文中是指人血管内皮生长因子(VEGF/VEGF-A),是一种165个氨基酸的人血管内皮生长因子(人VEGF165的前体序列的氨基酸27-191:SEQIDNO:17;氨基酸1-26表示信号肽),和相关的121、189和206血管内皮细胞生长因子同种型(isoform),如Leung,D.W.,等,Science(科学)246(1989)1306-9;Houck等,Mol.Endocrin.(分子内分泌学)5(1991)1806-1814;Keck,P.J.,等,Science(科学)246(1989)1309-12和Connolly,D.T.,等,J.Biol.Chem.(生物化学杂志)264(1989)20017-24所述;以及这些生长因子的天然存在的等位基因形式和加工的形式。VEGF参与与肿瘤和眼内病症相关的正常和异常的血管发生与新血管生成的调控(Ferrara,N.,等,Endocr.Rev.(内分泌综述)18(1997)4-25;Berkman,R.A.,等,J.Clin.Invest.(临床研究杂志)91(1993)153-159;Brown,L.F.,等,HumanPathol.(人类病理学)26(1995)86-91;Brown,L.F.,等,CancerRes.(癌症研究)53(1993)4727-4735;Mattern,J.,等,Brit.J.Cancer.(英国癌症学杂志)73(1996)931-934;和Dvorak,H.F.,等,Am.J.Pathol.(美国病理学杂志)146(1995)1029-1039)。VEGF是同二聚体糖蛋白,已经从数种来源分离,并且包括一些同种型。VEGF对内皮细胞显示出高度特异性的促有丝分裂活性。术语“ANG-2”用在本文中是指人血管生成素-2(ANG-2)(替代地缩写为ANGPT2或ANG2)(SEQIDNO:18),其在Maisonpierre,P.C.,等,Science(科学)277(1997)55-60和Cheung,A.H.,等,Genomics(遗传学)48(1998)389-91中描述。发现血管生成素-1(SEQIDNO:19)和-2是Ties的配体,Ties是选择性在血管内皮内表达的酪氨酸激酶家族(Yancopoulos,G.D.,等,Nature(自然)407(2000)242-48)。现在有四种明确的血管生成素家族的成员。血管生成素-3和-4(Ang-3和Ang-4)可代表小鼠和人中相同基因位点的非常不同的对应物(Kim,I.,等,FEBSLet,443(1999)353-56;Kim,I.,等,JBiolChem(生物化学杂志)274(1999)26523-28)。ANG-1和ANG-2最初在组织培养实验中分别作为激动剂和拮抗剂而鉴定(对于ANG-1:参见Davis,S.,等,Cell(细胞)87(1996)1161-69;对于ANG-2:Maisonpierre,P.C.,等,Science(科学)277(1997)55-60)。所有已知血管生成素基本上都结合Tie2(SEQIDNO:20),且Ang-1和-2均以3nM(Kd)的亲和力结合Tie2(Maisonpierre,P.C.,等,Science(科学)277(1997)55-60)。本发明的双特异性抗体的抗原结合位点可包含六个互补性决定区(CDRs),其在不同程度上有助于结合位点对于抗原的亲和力。存在三个重链可变结构域CDRs(CDRH1,CDRH2和CDRH3)和三个轻链可变结构域CDRs(CDRL1,CDRL2和CDRL3)。CDR和构架区(FRs)的程度通过与氨基酸序列的汇编数据库进行比较来确定,所述氨基酸序列中那些区域根据序列之间的可变性来确定。本发明的抗体包含来源于一种或多种免疫球蛋白种类的人源免疫球蛋白恒定区,其中,所述免疫球蛋白种类包括IgG,IgM,IgA,IgD和IgE种类,并且,在IgG和IgA的情形中,包括它们的亚类,特别是IgG1和IgG4。术语“单克隆抗体”或“单克隆抗体组合物”用于本文中时,指单一氨基酸组成的抗体分子制剂。术语“嵌合抗体”指一种抗体,其包含来自一种来源或物种的可变区,即结合区,以及源自不同来源或物种的恒定区的至少一部分,其通常通过重组DNA技术进行制备。优选包括鼠可变区和人恒定区的嵌合抗体。本发明涵盖的“嵌合抗体”的其它优选形式是这样的那些,其中恒定区已经被从初始抗体的恒定区开始进行修饰或改变以产生本发明所述的特性,特别是关于Clq结合和/或Fc受体(FcR)结合的特性。也将这种嵌合抗体称作“类别转换抗体“。嵌合抗体是被表达的免疫球蛋白基因的产物,该基因包括编码免疫球蛋白可变区的DNA区段和编码免疫球蛋白恒定区的DNA区段。制备嵌合抗体的方法包括目前在本领域众所周知的常规重组DNA和基因转染技术。参见,例如,Morrison,S.L.,等,Proc.Natl.AcadSci.USA(美国国家科学院学报)81(1984)6851-6855;US5,202,238和5,204,244。术语“人源化抗体”指这样的抗体,其中的构架或“互补性决定区”(CDR)已经被修饰为包含与亲本免疫球蛋白相比特异性不同的免疫球蛋白的CDR。在一个优选实施方案中,将鼠CDR移植到人抗体的构架区以制备“人源化抗体”。参见,例如,Riechmann,L.,等,Nature(自然)332(1988)323-327;和Neuberger,M.S.,等,Nature(自然)314(1985)268-270。特别优选的CDRs对应于识别以上关于嵌合抗体指出的抗原的那些代表性序列。本发明涵盖的“人源化抗体”的其它形式是这样的那些,其中恒定区已经另外被从初始抗体的恒定区开始进行修饰或改变以产生本发明所述的特性,特别是关于Clq结合和/或Fc受体(FcR)结合的特性。用于本文时,术语“人抗体”意欲包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。人抗体是现有技术中公知的(vanDijk,M.A.,和vandeWinkel,J.G.,Curr.Opin.Chem.Biol(当前化学生物学观点).5(2001)368-374)。人抗体还可以在转基因动物(例如小鼠)中产生,所述转基因动物在免疫时能够在缺乏内源免疫球蛋白生成的条件下产生人抗体的全部所有组成成分或选择部分(selection)。在所述种系突变小鼠中转移人种系免疫球蛋白基因阵列将导致在抗原攻击时产生人抗体(见例如Jakobovits,A.,等.,Proc.Natl.Acad.Sci.USA(美国国家科学院学报)90(1993)2551-2555;Jakobovits,A.,等.,Nature(自然)362(1993)255-258;Brueggemann,M.,等.,YearImmunol.(免疫学年度)7(1993)33-40)。人抗体还可以在噬菌体展示文库中产生(Hoogenboom,H.R.,和Winter,G.,J.Mol.Biol.(分子生物学杂志)227(1992)381-388;Marks,J.D.,等.,J.Mol.Biol.(分子生物学杂志)222(1991)581-597)。Cole,A.等和Boerner,P.,等的技术也可以用于制备人单克隆抗体(Cole,A.,等.,MonoclonalAntibodiesandCancerTherapy(单克隆抗体和癌症治疗),LissA.L.,p.77(1985);和Boerner,P.,等.,J.Immunol.(免疫学杂志)147(1991)86-95)。如已经对本发明所述的嵌合和人源化抗体所提及地,术语“人抗体”用于本文中时还包括这样的抗...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺