用于双特异性抗体的纯化平台的制作方法
发明领域
提供了通过亲和层析从蛋白质的复杂混合物中纯化特定多聚体蛋白质的方法。具体地,提供了使用离液剂通过亲和层析(包括蛋白a层析)从单体和同二聚体的复杂混合物中分离异二聚体(包括双特异性抗体)的方法。
发明背景
已经提出了多种双特异性抗体形式,并且目前正在开发中。一种这样的形式基于具有改进的药代动力学特征和最小免疫原性的标准完全人igg抗体(参见美国专利号8,586,713,其全文并入本文)。单个共同轻链和两个不同重链组合以形成双特异性。重链之一含有取代fc序列(以下称为“fc*”),其降低或消除fc*与蛋白a的结合。例如一个这样的fc*序列在ch3结构域中含有h435r/y436f(由eu编号系统编号;由imgt外显子编号系统编号则其为h95r/y96f)的取代。作为两条重链和共同轻链的共表达的结果,产生三种产物:其中两种对于重链是同二聚体的,并且其中一种是所需的异二聚体双特异性产物。由于与高亲合力fcfc重链同二聚体或弱结合fc*fc*同二聚体相比的对于蛋白a的中间结合亲和力,fc*序列允许在市售亲和柱上选择性纯化fcfc*双特异性产物。
为了实现双特异性异二聚体的商业规模纯化,需要fcfc同二聚体、fc*fc异二聚体和fc*fc*同二聚体之间的良好分辨率。这里,本发明的申请人描述了优化这三种分子形式的分辨率的改进的分离工艺。
发明概述
在本发明的一个或多个方面和实施方案中,本发明涉及通过使用亲和捕获洗脱工艺从包括同二聚体和异二聚体的蛋白质的复杂混合物中纯化异二聚体蛋白质例如双特异性抗体的方法。一方面,本发明涉及通过这些方法中的任一种产生的纯化的异二聚体蛋白。
在第一方面,本发明涉及制备蛋白质的方法,该方法包括以下步骤:将多聚体蛋白质的混合物加载到亲和基质上,然后在特定的ph范围和在含有离液剂的缓冲液中从该基质洗脱并收集异二聚体蛋白质。在一个实施方案中,亲和基质最初加载有5至50克蛋白质/升亲和基质。在一些情况下,多聚体蛋白质的混合物由多种真核细胞产生,例如细胞培养物中的中国仓鼠卵巢(cho)细胞。
在一个实施方案中,多聚体蛋白质的混合物含有(i)包含两个拷贝的第一多肽的第一同二聚体,(ii)包含第一多肽和第二多肽的异二聚体,和任选地(iii)包含两个拷贝的第二多肽的第二同二聚体。这里,第一和第二多肽对亲和基质具有不同的亲和力,使得可以基于与亲和基质的差别结合来分离第一同二聚体、异二聚体和第二同二聚体。
可以通过特别是改变通过亲和基质的溶液的ph和/或离子强度来操纵与亲和基质的差别结合。向溶液中加入离液剂增强了从亲和基质中洗脱每种二聚体物质,从而提高了每种个体二聚体物质的纯度。在一个实施方案中,在具有第一ph范围的缓冲液中从亲和基质洗脱异二聚体,并且在具有第二ph范围的缓冲液中从亲和基质洗脱第一同二聚体。收集异二聚体。在任选的实施方案中,其中第二同二聚体包括在多聚体的混合物中,第二同二聚体或者流穿柱而不结合,或者在具有第三ph范围的洗涤缓冲液中从亲和基质洗脱第二同二聚体。第三ph范围包括比第一ph范围更高的ph,第一ph范围包括比第二ph范围更高的ph。
在一个实施方案中,亲和基质包含固定于基材的蛋白a配体。在一些情况下,基材是珠或颗粒,使得亲和基质是固定有蛋白a的多个颗粒。蛋白a可以是天然存在的或修饰的葡萄球菌蛋白a,或其可以是经改造的蛋白a。经改造的蛋白a可以是例如z-结构域四聚体、y-结构域四聚体或缺少d和e结构域的经改造的蛋白a。这些经改造的蛋白a范本不能结合(或者以非常低的亲和力结合,如果有的话)免疫球蛋白的vh3结构域,但仍然可以结合igg1、igg2和igg4的ch3结构域。
在一些情况下,亲和基质基材含有琼脂糖,聚(苯乙烯二乙烯基苯),聚甲基丙烯酸酯,受控的孔隙玻璃,球形二氧化硅,纤维素等或由其制成。在其中基材成形为珠或颗粒的实施方案中,颗粒的平均直径为25μm至100μm。在一些实施方案中,颗粒具有35μm、45μm、60μm、75μm或85μm的平均直径。在一个具体实施方案中,颗粒具有45μm的平均直径为,并且含有平均直径为
在一些实施方案中,在用蛋白质混合物初始加载亲和基质之后,用大于ph5的ph的缓冲液洗涤基质。在一些情况下,缓冲液包含ph为7.2的20mm磷酸钠。当第二同二聚体包括在蛋白质混合物中时,在洗涤缓冲液中从亲和基质洗涤第二同二聚体。因此,此处洗涤缓冲液具有第三ph范围。
在一些实施方案中,将缓冲的ph梯度施加于已加载的亲和基质,或者在替代的实施方案中,将各自具有不同ph的顺序洗脱缓冲液施加于已加载的亲和基质。在一个实施方案中,ph梯度从ph6到ph3运行。在其范围内从亲和基质洗脱异二聚体的第一ph范围为约ph5.5至约ph3.6。在一些情况下,洗脱缓冲液和/或缓冲的ph梯度含有合适的缓冲液(例如柠檬酸盐,乙酸盐,4-吗啉乙磺酸盐(mes),柠檬酸盐-磷酸盐,琥珀酸盐等,在一个实施方案中缓冲液为40mm乙酸盐)和离液剂。离液剂可以是具有选自锂、镁、钙和胍
在一个实施方案中,异二聚体是双特异性抗体。这里,第一多肽包含能够结合蛋白a的ch3结构域(“fc”),并且第二多肽包含不能结合蛋白a的ch3结构域(“fc*”)。在一些情况下,第二多肽在其ch3结构域中包含h435r/y436f(由eu编号系统编号;由imgt外显子编号系统编号则其为h95r/y96f)的取代(亦称作“fc*”或“星号取代”)。因此,在一些实施方案中,第一同二聚体是具有两个未取代的ch3结构域的单特异性抗体(即fcfc);第二同二聚体是具有两个h435r/y436f取代的ch3结构域的单特异性抗体(即fc*fc*);并且异二聚体是具有一个未取代的ch3结构域和一个h435r/y436f取代的ch3结构域的双特异性抗体(即fc*fc)。
在一个实施方案中,从亲和基质收集的异二聚体随后在更酸性的ph下加载到层析介质上,并在没有离液剂(或具有更低的量或痕量的离液剂)的更碱性缓冲液中从该介质洗脱。在一种情况下,层析介质是多峰层析树脂。异二聚体可以被进一步纯化。
在第二方面,通过将混合物施加于第一亲和基质,使得第一同二聚体和异二聚体保持结合于基质,而第二同二聚体流穿并丢弃,从而从蛋白质混合物中首先除去第二同二聚体。随后从第一亲和基质洗脱第一同二聚体和异二聚体,然后随后施加于第二亲和基质。在一个实施方案中,第一亲和基质最初加载有5至50克蛋白质/升亲和基质。多聚体蛋白质的混合物在一些情况下由多种真核细胞产生,例如细胞培养物中的中国仓鼠卵巢(cho)细胞。
在一个实施方案中,施加于第一亲和基质的多聚体蛋白质混合物含有(i)包含两个拷贝的第一多肽的第一同二聚体,(ii)包含第一多肽和第二多肽的异二聚体,和(iii)包含两个拷贝的第二多肽的第二同二聚体。这里,第一和第二多肽对第一亲和基质以及第二亲和基质具有不同的亲和力,使得第一同二聚体、异二聚体和第二同二聚体可以基于与第一和/或第二亲和基质的差别结合而被分开。
在一个实施方案中,第一亲和基质包含固定在基材上的经改造的蛋白a配体,其缺乏结合免疫球蛋白vh3结构域的能力。在一些情况下,蛋白a缺少d-结构域和e-结构域,例如包含z-四聚体或y-四聚体的经改造的蛋白a。
可以通过特别是改变通过亲和基质的溶液的ph和/或离子强度来操纵第一同二聚体和异二聚体与第二亲和基质的差别结合。向溶液中加入离液剂增强了在非重叠级分中从第二亲和基质洗脱每种二聚体物质,从而提高每种二聚体物质的纯度。在一个实施方案中,在具有第一ph范围的缓冲液中从第二亲和基质洗脱异二聚体,并且在具有第二ph范围的缓冲液中从第二亲和基质洗脱第一同二聚体。收集异二聚体。这里,第一ph范围包括比第二ph范围更高的ph。
在一个实施方案中,第二亲和基质包含固定于基材的蛋白a配体。在一些情况下,基材是珠或颗粒,使得第二亲和基质是固定有蛋白a配体的多个颗粒。蛋白a可以是天然存在的或修饰的葡萄球菌蛋白a,或者其可以是经改造的蛋白a。经改造的蛋白a可以是例如z-结构域四聚体、y-结构域四聚体或缺少d和e结构域的另一经改造的蛋白a。这些经改造的蛋白a分子不能结合(或者以非常低的亲和力结合,如果有的话)免疫球蛋白的vh3结构域,但是仍然能够结合igg1、igg2和igg4的ch3结构域。
在一些情况下,基材含有琼脂糖,聚(苯乙烯二乙烯基苯),聚甲基丙烯酸酯,受控的孔隙玻璃,球形二氧化硅,纤维素(例如hypercel)等或由其制成。在其中基材成形为珠或颗粒的那些实施方案中,颗粒的平均直径为30μm至90μm。在一些实施方案中,颗粒具有35μm、45μm、60μm、75μm或85μm的平均直径。在一个具体实施方案中,颗粒的平均直径为45μm,并且含有平均直径为
在一些实施方案中,在用含有第一同二聚体和异二聚体的混合物初始加载第二亲和基质之后,用大于ph5的ph的缓冲液洗涤基质。在一些情况下,缓冲液包含ph5-8.5、例如ph7.2的20mm磷酸钠。在一些实施方案中,将缓冲的ph梯度施加于已加载的亲和基质,或者在替代的实施方案中,将各自具有不同ph的顺序洗脱缓冲液施加于已加载的第二亲和基质。在一个实施方案中,ph梯度从ph6至ph2.5运行。在其范围内异二聚体从亲和基质洗脱的第一ph范围为约ph5.5至约ph3.6。在一些情况下,洗脱缓冲液和/或缓冲的ph梯度含有乙酸盐和离液剂,乙酸盐在一个实施方案中为40mm乙酸盐。离液剂可以是具有选自锂、镁、钙和胍
在一个实施方案中,异二聚体是双特异性抗体。这里,第一多肽包含能够结合蛋白a的ch3结构域(“fc”),并且第二多肽包含不能结合蛋白a的ch3结构域(“fc*”)。在一些情况下,第二多肽在其ch3结构域中包含h435r/y436f(也称为“星号”)取代(“fc*”)。因此,在一些实施方案中,第一同二聚体是具有两个未取代的ch3结构域的单特异性抗体(即fcfc);第二同二聚体是具有两个h435r/y436f取代的ch3结构域的单特异性抗体(即fc*fc*);并且异二聚体是具有一个未取代的ch3结构域和一个h435r/y436f取代的ch3结构域的双特异性抗体(即fc*fc)。
在一个实施方案中,从第二亲和基质收集的异二聚体随后在酸性ph下加载到层析介质上,并在更碱性缓冲液中并且在没有离液剂(或减少水平或痕量的离液剂)的情况下从该介质洗脱。在一种情况下,层析介质是多峰层析树脂。异二聚体可以被进一步纯化。
在第三方面,本发明涉及根据上述方面的方法制备的纯化异二聚体。在一个实施方案中,异二聚体是双特异性抗体。
附图说明
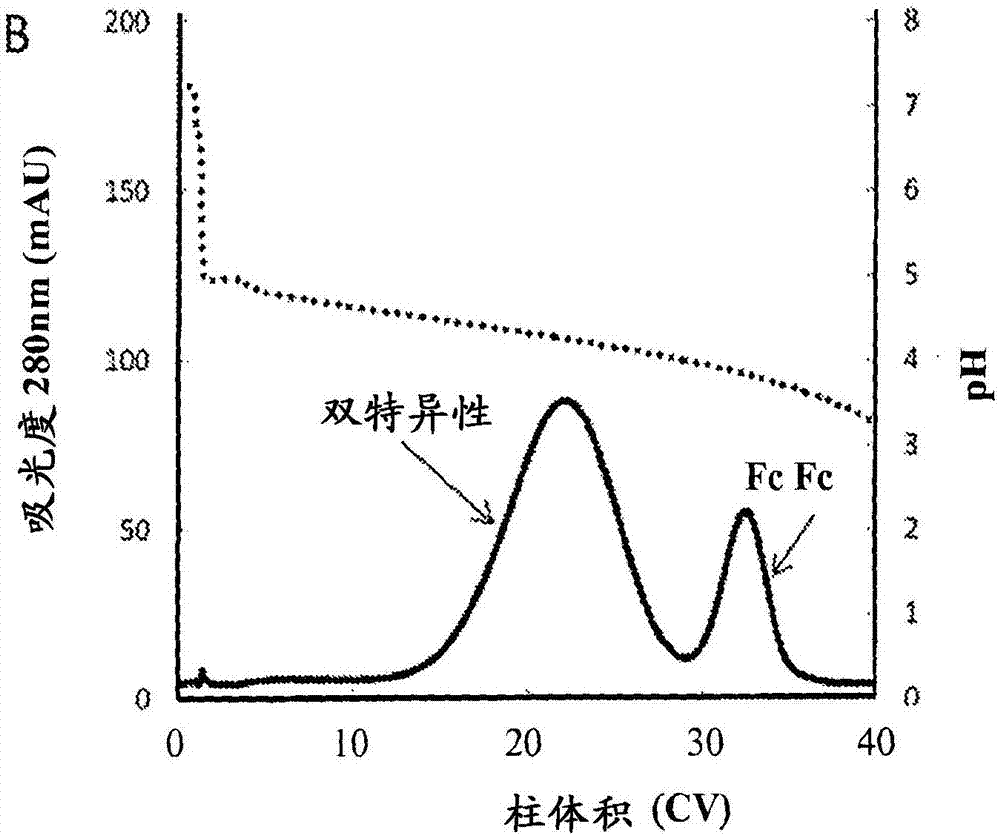
图1描述了示出用于用重组蛋白a树脂(mabselectxtratm,图a)以及基于经改造的缺乏vh结合的蛋白a树脂(mabselectsuretm,图b)纯化bsabe的洗脱步骤期间的ph(点线)和280nm处的吸光度(实线)的层析图。
图2描绘了在40mm乙酸盐、500mm氯化钙中用mabselectsuretm(空心圆圈)或porosmabcaptureatm(实心正方形)作为固定相在30个柱体积(“cv”)梯度洗脱期间作为停留时间的函数的双特异性(fc*fc)和非ch3取代的同二聚体(fcfc)峰之间获得的峰值分辨率(rs)。
图3描述了示出用于用柠檬酸钠(图a)、氯化钠(图b)、氯化镁(图c)或氯化钙(图d)作为改性剂加入洗脱流动相中纯化bsaba的洗脱步骤期间的ph(点线)和280nm处的吸光度(实线)的层析图。双特异性峰级分分离用垂直点线标记。
图4描述了显示(图a)和不显示(图b)vh结构域spa结合的含星号取代(ch3取代的,fc*)双特异性抗体(fc*fc)的纯化工艺的流程图。
发明详述
本发明不限于的具体方法和实验条件,因为这些方法和条件可以变化。还应当理解,本文所使用的术语仅用于描述特定实施方案的目的,并且不旨在限制,因为本发明的范围由权利要求书限定。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。尽管与本文所述相似或等同的任何方法和材料可用于本发明的实践或测试,现在描述特定的方法和材料。所提及的所有出版物通过引用并入本文。
本文所用的术语“抗体”包括由通过二硫键互连的四条多肽链:两条重(h)链和两条轻(l)链组成的免疫球蛋白分子。每条重链包含重链可变区(本文缩写为hcvr或vh)和重链恒定区。重链恒定区包含三个结构域:ch1、ch2和ch3。每条轻链包含轻链可变区(本文中缩写为lcvr或vl)和轻链恒定区。轻链恒定区包含一个结构域:cl。vh和vl区可以进一步细分为称为互补决定区(cdr)的高变区,其被更保守的称为框架区(fr)的区域分隔开。每个vh和vl由三个cdr和四个fr组成,从氨基末端到羧基末端按照以下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4(重链cdr可以缩写为hcdr1,hcdr2和hcdr3;轻链cdr可以缩写为lcdr1,lcdr2和lcdr3)。术语“高亲和力”抗体是指对其靶标具有至少10-9m、至少10-1m、至少10-11m或至少10-12m的结合亲和力,如通过表面等离振子共振,例如biacoretm或溶液亲和力elisa所测量。
短语“双特异性抗体”包括能够选择性结合两个或更多个表位的抗体。双特异性抗体通常包含两条不同的重链,其中每条重链特异性结合两个不同分子(例如抗原)或相同分子(例如相同抗原)上的不同表位。如果双特异性抗体能够选择性结合两种不同的表位(第一表位和第二表位),则第一重链对第一表位的亲和力通常比第一重链对第二表位的亲和力低至少1至2或3或4个数量级,反之亦然。由双特异性抗体识别的表位可以在相同或不同的靶上(例如在相同或不同的蛋白质上)。双特异性抗体可以例如通过组合识别相同抗原的不同表位的重链来制备。例如编码识别相同抗原的不同表位的重链可变序列的核酸序列可以与编码不同重链恒定区的核酸序列融合,并且这样的序列可以在表达免疫球蛋白轻链的细胞中表达。典型的双特异性抗体具有两条重链,每条重链具有三个重链cdr,随后是(n末端至c末端)ch1结构域,铰链,ch2结构域和ch3结构域,并且免疫球蛋白轻链没有或不赋予抗原结合特异性,但是可以与每条重链缔合,或者可以与每条重链缔合并且可以结合由重链抗原结合区结合的一个或多个表位,或者可以与每条重链缔合并使得能够一条或两条重链与一个或两个表位结合。
短语“重链”或“免疫球蛋白重链”包括来自任何生物体的免疫球蛋白重链恒定区序列,并且除非另有说明,否则包括重链可变结构域。重链可变结构域包括三个重链cdr和四个fr区,除非另有说明。重链的片段包括cdr、cdr和fr、以及其组合。典型的重链具有可变结构域之后是(从n末端到c末端)ch1结构域,铰链,ch2结构域和ch3结构域。重链的功能片段包括能够特异性识别抗原(例如以微摩尔、纳摩尔或皮摩尔范围内的kd识别抗原)的片段,其能够从细胞表达和分泌以及其包含至少一个cdr。
短语“轻链”包括来自任何生物体的免疫球蛋白轻链恒定区序列,并且除非另有说明,包括人κ和λ轻链。除非另有说明,否则轻链可变(vl)结构域通常包括三个轻链cdr和四个框架(fr)区。通常,全长轻链从氨基末端到羧基末端包括vl结构域和轻链恒定结构域,vl结构域包含fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。可用于本发明的轻链包括例如不选择性结合由抗原结合蛋白选择性结合的第一或第二抗原的那些。合适的轻链包括可以通过筛选现有抗体文库中最常用的轻链(湿文库或在计算机中模拟)来鉴定的轻链,其中轻链基本上不干扰抗原结合蛋白的抗原结合结构域的亲和力和/或选择性。合适的轻链包括可以结合由抗原结合蛋白的抗原结合区结合的一个或两个表位的轻链。
短语“可变结构域”包括从n末端到c末端(除非另有说明)顺序包含以下氨基酸区的免疫球蛋白轻链或重链(根据需要修饰)的氨基酸序列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。“可变结构域”包括能够折叠成具有双重β片层结构的规范结构域(vh或vl)的氨基酸序列,其中β片层通过第一β片层的残基和第二β片层的残基之间的二硫键连接。
短语“互补决定区”或术语“cdr”包括由生物体免疫球蛋白基因的核酸序列编码的氨基酸序列,其通常(即在野生型动物中)出现在免疫球蛋白分子(例如抗体或t细胞受体)的轻链或重链的可变区中的两个框架区之间。cdr可以由例如种系序列或重排或未重排序列编码,并且例如由原始或成熟b细胞或t细胞编码。在一些情况下(例如对于cdr3),cdr可以由不连续(例如在未重排的核酸序列中)但在b细胞核酸序列中连续的两个或更多个序列(例如种系序列)编码,例如作为剪接或连接序列的结果(例如v-d-j重组以形成重链cdr3)。
短语“含fc的蛋白”包括抗体、双特异性抗体、免疫粘附素和包含免疫球蛋白ch2和ch3区的至少一个功能部分的其它结合蛋白。“功能部分”是指可以结合fc受体(例如fcγr或fcrn,即新生儿fc受体)和/或可参与补体活化的ch2和ch3区。如果ch2和ch3区含有使其不能结合任何fc受体并且也不能激活补体的缺失、取代和/或插入或其他修饰,ch2和ch3区不起作用。
含fc的蛋白质可包含免疫球蛋白结构域中的修饰,包括其中修饰影响结合蛋白的一种或多种效应子功能(例如影响fcγr结合、fcrn结合并因此影响半衰期和/或cdc活性的修饰)。这样的修饰包括但不限于下列修饰及其组合,参考免疫球蛋白恒定区的eu编号:238,239,248,249,250,252,254,255,256,258,265,267,268,269,270,272,276,278,280,283,285,286,289,290,292,293,294,295,296,297,298,301,303,305,307,308,309,311,312,315,318,320,322,324,326,327,328,329,330,331,332,333,334,335,337,338,339,340,342,344,356,358,359,360,361,362,373,375,376,378,380,382,383,384,386,388,389,398,414,416,419,428,430,433,434,435,437,438和439。
例如但不限于,结合蛋白是含fc的蛋白,并且表现出增加的血清半衰期(与不具有所述的相同的含fc的蛋白相比),并且具有在以下位置:250(例如e或q);250和428(例如l或f);252(例如l/y/f/w或t),254(例如s或t)和256(例如s/r/q/e/d或t)的修饰;或在以下位置:428和/或433(例如l/r/si/p/q或k)和/或434(例如h/f或y)的修饰;或在250和/或428的修饰;或在307或308(例如308f、v308f)和434的修饰。在另一个实例中,修饰可包括428l(例如m428l)和434s(例如n434s)的修饰;428l、259i(例如v259i)和308f(例如v308f)的修饰;433k(例如h433k)和434(例如434y)的修饰;252、254和256(例如252y、254t和256e)的修饰;250q和428l的修饰(例如t250q和m428l);307和/或308的修饰(例如308f或308p)。
术语“星号取代”、“fc*”和“hc*”包括含有在ch3结构域内的序列的任何分子、免疫球蛋白重链、fc片段、含fc的分子等,其消除了与蛋白a的结合。之前已经注意到(lindhofer,h.等人(1995)j.immunol.155:219-225)),因为人igg3不结合蛋白a,它可以潜在地与任何其它三种人igg亚类一起用在类似于用于小鼠-大鼠杂交体的纯化策略中。然而,尽管所有四种人igg亚类的序列是高度同源的,但不知道igg1、igg2和igg4的fc部分如何容易地与igg3形成异二聚体;甚至仅优先形成同二聚体将在某些情况下(例如从四价杂交瘤中分离)对所需异二聚体的总产量具有负面影响。已经报道(jendeberg,l.等人,(1997)j.immunologicalmeth.201:25-34),igg3不能结合蛋白a由单个氨基酸残基arg435(eu编号;imgt编号则为arg95),其中其他igg亚类中的相应位置被组氨酸残基占据。因此,可以使用其中his435突变为arg的igg1序列,而不是igg3。因此,igg1中的单点突变应当足以产生适合于新纯化方案的不同结合亲和力。该修饰将被称为igg1δa,以表示其不能结合蛋白a(以及类似地,igg2δa和igg4δa——或更一般地,fcδa)。
然而,指定的点突变在突变上引入新的肽序列,其可能是免疫原性的。在理论上,点突变可以加载到ii类mhc分子上,并呈递给t细胞,因此引发免疫应答。为了避免这种缺陷,可以使用二肽突变,h435r/y436f(eu编号;由imgt编号则其为h95r/y96f)。在该改变附近的所得序列与igg3的序列相同,因此预期是免疫学上“不可见的”,因为不存在可用于呈递给t细胞的非天然短肽。据报道,该双突变体仍然不结合蛋白a(jendeberg,l.等人,(1997)j.immunologicalmeth.201:25-34)。最后,二肽突变不包括形成fc二聚体界面的任何残基,因此不可能干扰异二聚体的形成。该二肽突变被称为“星号取代”。
术语“细胞”包括适于表达重组核酸序列的任何细胞。细胞包括原核生物和真核生物(单细胞或多细胞),细菌细胞(例如大肠杆菌(e.coli)、芽孢杆菌属的某些种(bacillusspp.)、链霉菌属的某些种(streptomycesspp.)等的菌株),分枝杆菌细胞,真菌细胞,酵母细胞(例如酿酒酵母(s.cerevisiae),粟酒裂殖酵母(s.pombe),巴斯德毕赤酵母(p.pastoris),甲醇毕赤酵母(p.methanolica)等),植物细胞,昆虫细胞(例如sf-9,sf-21,杆状病毒感染的昆虫细胞,粉纹夜蛾(trichoplusiani))非人动物细胞,人细胞或细胞融合体,例如杂交瘤或四体杂交瘤。在一些实施方案中,细胞是人,猴,猿,仓鼠,大鼠或小鼠细胞。在一些实施方案中,细胞是真核的,并且选自以下细胞:cho(例如chok1,dxb-11cho,veggie-cho),cos(例如cos-7),视网膜细胞,vero,cv1,肾(例如hek293,293ebna,msr293,mdck,hak,bhk),hela,hepg2,wi38,mrc5,colo205,hb8065,hl-60(例如bhk21),jurkat,daudi,a431(表皮),cv-1,u937,3t3,l细胞,c127细胞,sp2/0,ns-0,mmt060562,支持细胞,brl3a细胞,ht1080细胞,骨髓瘤细胞,肿瘤细胞,衍生自前述细胞的细胞系。在一些实施方案中,细胞包含一种或多种病毒基因,例如表达病毒基因的视网膜细胞(例如per.c6tm细胞)。
短语“流动相改性剂”包括降低蛋白质之间的非特异性(即非亲和力)离子和其它非共价相互作用的影响或破坏蛋白质之间的非特异性(即非亲和力)离子和其它非共价相互作用的部分。“流动相改性剂”包括例如盐,i族和ii族金属与乙酸盐、碳酸氢盐、碳酸盐、卤素(例如氯化物或氟化物)、硝酸盐、磷酸盐或硫酸盐的离子组合。“流动相改性剂”的非限制性说明性列表包括乙酸的铍、锂、钠和钾盐;碳酸氢钠和碳酸氢钾;碳酸锂、钠、钾和铯;氯化锂、钠、钾、铯和镁;氟化钠和氟化钾;硝酸钠、钾和钙;磷酸钠和磷酸钾;以及硫酸钙和硫酸镁。
“流动相改性剂”还包括离液剂,其弱化或以其它方式干扰非共价力并增加生物分子系统内的熵。离液剂的非限制性实例包括丁醇,氯化钙,乙醇,盐酸胍,高氯酸锂,乙酸锂,氯化镁,苯酚,丙醇,十二烷基硫酸钠,硫脲和脲。离液剂包括影响蛋白质溶解度的盐。更离液的阴离子包括例如氯离子,硝酸根离子,溴离子,氯酸根离子,碘离子,高氯酸根离子和硫氰酸根离子。更离液的阳离子包括例如锂,镁,钙和胍
“流动相改性剂”包括影响离子或其它非共价相互作用的那些部分,其在加入到ph梯度或步骤中时,或在“流动相改性剂”中的蛋白a载体的平衡和施加于ph步骤或梯度导致同二聚igg和异二聚igg(例如野生型人igg和相同的igg但带有如本文的其ch3结构域的一个或多个修饰)的洗脱之间的ph单位距离变宽。“流动相改性剂”的合适浓度可以通过使用相同的柱、ph步骤或梯度,随“流动相改性剂”浓度的增加而确定,直到在给定的ph步骤或ph梯度下达到最大ph距离。“流动相改性剂”还可以包括非极性改性剂,包括例如丙二醇、乙二醇等。
如本文所用的“亲和层析”是利用生物分子之间的特异性可逆相互作用而不是生物分子的一般性质(例如等电点、疏水性或大小)进行层析分离的层析法。“蛋白a亲和层析”或“蛋白a层析”是指利用蛋白a的igg结合结构域对免疫球蛋白分子的fc部分的亲和力的特异性亲和层析法。该fc部分包含基本上与这些相似的人或动物免疫球蛋白恒定域ch2和ch3或免疫球蛋白结构域。蛋白a包括来自金黄色葡萄球菌(staphylococcusaureus)的细胞壁的天然蛋白,通过重组或合成方法产生的蛋白a和保留结合fc区的能力的变体。实际上,蛋白a层析涉及使用固定在固体支持物上的蛋白a。参见gagnon,proteinaaffinitychromotography,purificationtoolsformonoclonalantibodies,pp.155-198,validatedbiosystems,1996。proteing和proteinl也可用于亲和层析。固体支持物是蛋白a粘附于其上的非水基质。这种载体包括琼脂糖,sepharose,玻璃,二氧化硅,聚苯乙烯,硝酸纤维素,木炭,沙子,纤维素和任何其它合适的材料。此类材料是本领域众所周知的。可以使用任何合适的方法将第二蛋白质固定到固体支持物上。将蛋白质固定在合适的固体支持物上的方法是本领域众所周知的。参见例如这种具有和不具有固定化蛋白a的固体支持物可以容易地从许多商业来源获得,包括例如vectorlaboratory(burlingame,calif.),santacruzbiotechnology(santacruz,calif.),biorad(hercules,calif.),amershambiosciences(gehealthcare的一部分,uppsala,sweden),pall(portwashington,ny)和emd-millipore(billerica,mass.)。固定在孔隙玻璃基质上的蛋白a可作为
亲和层析还包括可用于选择性结合并因此纯化含有免疫球蛋白结构域和/或序列的抗体、抗体片段或嵌合融合蛋白的介质。抗体包括igg、iga、igm、igy、igd和ige类型。抗体还包括单链抗体,例如骆驼抗体,经改造的骆驼抗体,单链抗体,单结构域抗体,纳米抗体等。抗体片段包括vh、vl、cl、ch序列。含有抗体序列的抗体片段和融合蛋白包括例如f(ab')3,f(ab')2,fab,fc,fv,dsfv,(scfv)2,scfv,scab,微抗体,双抗体,三抗体,四抗体,fc-融合蛋白,俘获分子等(参见ayyar等人,methods56(2012):116-129)。这样的亲和层析介质可以含有选择性结合抗体、其片段和含有那些片段的融合蛋白的配体。这样的配体包括针对靶分子的抗体结合蛋白,细菌衍生的受体,抗原,凝集素或抗抗体。该抗体需要纯化。例如针对igg-ch1,igg-fc,igg-ch3,igg1,lc-κ,lc-λ,igg3/4,iga,igm等中的任何一种或多种的骆驼科衍生的亲和配体可以是用作亲和配体(可作为captureselect层析树脂,lifetechnologies,inc.,carlsbad,calif.市售可得)
实施例1:峰分辨率方法
使用如下的星号取代通过蛋白a层析从污染性同二聚体中分离双特异性抗体。由于fc*fc*同二聚体在fc区缺失了两个蛋白a结合位点,预期该产物相关杂质流穿柱并被除去,而双特异性和fcfc同二聚体预期保留在柱上。应用一系列洗涤以除去过程相关的污染物,诸如chodna或宿主细胞蛋白质(hcp)。然后通过ph梯度或步骤选择性洗脱双特异性,同时保留fcfc污染物,因为其相对于双特异性更强的结合。
当使用重组葡萄球菌蛋白a(spa)层析树脂进行初始实验时,观察到从双特异性到双特异性的分离性能的广泛变异性。尽管在一些情况下获得结合fcfc同二聚体和双特异性产物之间的基线分辨率,但是双特异性抗体(“bsab”)的亚组显示非常差的分辨率。对于这些分子,当在经改造以显示改善的碱稳定性的亲和树脂上进行分离时,可获得良好的分辨率。其一个实例是bsabe,其中将收获的澄清细胞培养液加载5g/l在spa树脂(mabselectxtratm,图1a)或经改造的基于蛋白a的树脂(mabselectsuretm,图1b)上。在一系列(例如ph6-8)缓冲液洗涤步骤后,应用在40mm乙酸盐500mmnacl中ph5至3的40柱体积(“cv”)梯度以洗脱结合的物质。在mabselectxtratm(图1a)上,25-35个cv之间的洗脱峰含有双特异性和fcfc同二聚体,没有分辨率。此外,尽管在fc*fc*污染物的fc区中缺少蛋白a结合,但是前导的浅洗脱峰(0-25cv)由fc*fc*同二聚体蛋白组成。然而,施加到mabselectsuretm的相同bsabe加载分别产生包含双特异性和fcfc同二聚体的两个良好分辨的峰(图1b),其中在加载期间所有fc*fc*同二聚体流穿柱。这可能是由igg与天然蛋白a(“spa”)和经改造的sure配体之间的不同相互作用引起的。
除了经典结合位点,一些抗体已显示在重链可变区(“vh”)上含有替代的spa结合位点。特别地,含有来自人vh3基因家族的重链的一些igg已经被证实表现出这种行为,几乎一半的人vh种系基因属于vh3亚家族。(参见sasso等人,journalofimmunology1989;142:2778-83;sasso等人,journalofimmunology1991;147:1877-83;schroeder等人,internationalimmunology1990;2:41-50;和walter,m.a.和d.w.cox,americanjournalofhumangenetics1988;42:446-51.)因此,似乎在基于spa的树脂上,双特异性抗体如bsabe显示两种结合物质的分辨率差,由于vh结合,“非结合”fc*fc*同二聚体树脂的保留。因此认为vh结合降低了双特异性和fcfc同二聚体之间的亲合力差异和fc*fc*的低亲和力结合。
该假设通过用mabselectsuretm观察到的改进的纯化得到支持。spa和抗体之间的结合研究已经显示,尽管spa(e,d,a,b和c)的所有五个结构域通过fc区结合igg,但是仅结构域d和e显示出显著的fab结合。(参见例如starovasnik等人,proteinscience1999;8:1423-31)。经改造的mabselectsuretm亲和配体是z-结构域的四聚体,z-结构域是天然的非fab结合spab结构域的蛋白质经改造的版本。已知z结构域对抗体可变区具有可忽略的结合(starovasnik,同上)。因此,当使用携带mabselectsuretm配体的这种树脂时,双特异性和fcfc同二聚体之间增加的亲合力差异允许改善那些峰的分辨率;并且fc*fc*同二聚体不被保留。
筛选基于多种蛋白a的层析树脂以鉴定用于双特异性临床和商业生产的树脂。选择两个bsab用于评估,一个先前观察到通过vh区结合spa(bsaba)和一个缺乏这种能力的bsabb。加载材料先前经过标准正模式亲和层析以除去fc*fc*杂质。对于bsaba和bsabb,起始双特异性纯度(fc*fc/[fc*fc+fc*fc*+fcfc])分别为84%和76%。所有树脂加载10g总蛋白/l树脂。在一系列洗涤后,使用500mmnacl或500mmcacl2作为流动相改性剂的ph6至3的30个cv梯度洗脱抗体。
六种选择的市售蛋白a树脂表现出多种基础基质、珠尺寸和配体类型。四种使用spa的树脂中,一种是z-结构域的四聚体(mabselectsuretm),一种是非fab结合c结构域(称为y结构域)的碱稳定形式的多聚体(toyopearlaf-rproteina-650f)。在双特异性产物和结合fcfc同二聚体之间获得的这些数据和峰分辨率(rs=1.18[tr2–tr1]/[w1/22+w1/21];其中rs是峰分辨率,w1/2半高处的峰宽,tr是停留时间)详见表1。
表1:使用一系列具有两种抗体:vh-蛋白a结合(bsaba)和非vh结合(bsabb)的蛋白a介质获得的双特异性与结合杂质的分离效率的比较。a使用半高处的宽度计算的分辨率。如果由于峰收敛而无法计算半高处的峰宽,则分辨率标记为“无分辨率”。
当在洗脱缓冲液中使用nacl作为流动相改性剂时,注意到增加的分辨率与珠尺寸成反比,对于平均颗粒大于45μm的spa树脂则没有观察到分辨率。有趣的是,mabselectsuretm(rs=0.92)显示与具有bsaba的toyopearlaf-rproteina-650f(rs=0.87)相当的性能。这不是预期的,这是由于(i)对于toyopearlaf-rproteina-650f(45cf.85μm)更小的平均珠尺寸和(ii)基于y-结构域(源自c结构域)并因此被预期缺乏vh结合的亲和配体的相似性(starovasnik,同上)。对于bsabb,与toyopearlaf-rproteina-650f和absolutehicaptm相比,porosmabcaptureatm表现出优异的分辨率(2.50分别相比于2.37和2.41),尽管不具有更小的粒径。这被假设是由于在这种基础基质中流动的易散发的元素被大的通孔以及有助于传质的1100埃的平均孔径所促进。porosmabcaptureatm还表现出比任何其它spa树脂更好的bsaba分辨率,具有与toyopearlaf-rproteina-650f和mabselectsuretm的非vh结合树脂相当的分辨率(0.70分别相比于0.87和0.92)。
当用cacl2代替nacl作为流动相改性剂时,观察到porosmabcaptureatm大大提高分辨能力,性能优于mabselectsuretm相当大的余裕(rs分别为1.83c.f.1.08)。基于该数据的总体,进一步评价porosmabcaptureatm和mabselectsuretm作为可能的用于等度洗脱的分辨层析树脂。
由于树脂的比较在400cm/h的相对快的线速度下进行,因此mabselectsure树脂相对于porosmabcapurea的功效可能降低,因为(i)较大的珠尺寸和(ii)缺乏易散发的流动。因此,在生产相关的停留时间范围内对树脂进行比较。选择bsaba作为模型分子,是因为观察到其通过其vh区与spa的结合(从而在双特异性和fcfc杂质之间产生与非vh结合mabselectsure更大的亲合力差异)。注意,选择vh结合抗体用于本评价,因为没有这种亲合力优势,预期mabselectsure将由于mabcapturea的更小的珠尺寸而较差。使用用于树脂评价研究的相同的亲和捕获的bsaba加载材料以10g总蛋白/l树脂挑战。所有层析步骤在3分钟停留时间进行,除了洗脱,其从2-8分钟(600-150cm/h)变化。来自fcfc同二聚体峰的双特异性峰的分辨率的计算显示,虽然树脂的分辨率随着停留时间而增加,但是mabselectsure的效果比porosmabcapurea更显著(rs分别增加0.7和0.3,图2)。此外,porosmabcapurea树脂在所有测试条件下显示出比mabselectsure优异的分辨率,尽管该树脂具有vh结合的缺点,证实该树脂在两种结合物质的分辨能力方面的总体优越性。
在洗脱缓冲液中包含流动相改性剂改变并潜在改善了来自fcfc同二聚体的双特异性产物的分辨率(参见表1)。因此,假设使用霍夫迈斯特系列上不同位置的盐通过调节抗体种类和蛋白a配体之间的疏水相互作用来提高树脂选择性。将vh结合bsaba以10g/l加载到mabcapturea树脂上。在一系列洗涤后,使用ph6至3的30个cv梯度洗脱抗体,使用以下洗脱流动相改性剂:柠檬酸钠、氯化钠、氯化镁和氯化钙,它们在霍夫迈斯特系列中以从亲液剂至离液剂排列。对于除了柠檬酸钠之外的所有盐使用500mm的盐水平,其中柠檬酸钠使用250mm,因为当掺入浓度高于300mm时,蛋白质沉淀在加载材料中。用更多的离液盐获得双特异性产物和结合fcfc同二聚体之间的优异分辨率(图3)。如图3所详细示出的,从第一峰提升到峰谷拐点收集双特异性峰。测量双特异性产率百分比、双特异性纯度百分比、峰分辨率(rs)和可溶性聚集物百分比(表2)。还从层析图计算双特异性顶点处的ph。使用更多的离液盐(氯化钙和氯化镁)显示出提高的产率和双特异性纯度。蛋白质也在较高ph下用氯化镁和氯化钙洗脱。所使用的最离液的盐和最亲液的盐都不能在双特异性的洗脱期间引起显著的聚集。因此,使用离液盐如氯化钙作为洗脱缓冲液中的流动相改性剂显示增强bsab的峰分辨率和随后的纯化。
表2:在使用多种洗脱流动相改性剂从porosmabcaptureatm梯度洗脱bsaba期间收集的双特异性级分中测量的产率、可溶性聚集物、峰顶点ph、峰分辨率和双特异性纯度。
实施例2:商业方法的开发
为了确定基于星号取代的平台用于纯化双特异性抗体的可行性,开发了用于纯化bsabc的可扩展的方法。选择该蛋白作为平台的最坏情况测试,因为发现其显示出显著的vh与spa的结合。关键的开发目标是:(i)实现等度(步骤)洗脱以简化工厂适配和技术转移,同时还减少缓冲液消耗和处理时间,(ii)鉴定与亲和解析步骤接合的精制步骤,几乎没有或没有加载调节。
使用96孔板形式中的高通量筛选(htpd)进行初始因子筛选和设计空间评价。洗脱ph、柱加载(g/l总蛋白)和流动相改性剂浓度被鉴定为关键过程输入(参见图2)。还考虑洗脱停留时间。用于该研究的加载材料先前已经进行标准阳模式亲和层析以除去fc*fc*杂质,得到64%的双特异性纯度。进行两个18-运行中央复合实验设计研究(ccddoe),以便以等度洗脱模式评估mabselectsure和porosmabcapurea。研究用于porosmabcapturea树脂的因素是柱加载(范围为10-25g总蛋白/l)、洗脱ph(4.5-5.5)和洗脱缓冲液中氯化钙的浓度(250-500mm)。停留时间保持恒定在3分钟(400cm/h)。然后根据柱加载(范围为10-25g总蛋白/l)、洗脱ph(3.8-5.0)和洗脱停留时间(5-11分钟)评价mabselectsure。洗脱缓冲液中氯化钙的浓度保持恒定在500mm。
对于mabcapturea,使用标准最小二乘拟合算法获得了双特异性产率(r2=0.97)和双特异性纯度(r2=0.92)的良好模型。在所有条件下,观察到洗脱缓冲液中250-500mm增加的氯化钙水平增加10-20%的双特异性产率,而不降低双特异性纯度(数据未显示)。使用该模型,在500mmcacl2下进行最佳点(sweetspot)分析。分析表明,洗脱ph为5.0-5.1将允许以17-25g/l的树脂挑战来满足纯度目标>95%,产率>80%。类似的层析条件已经用于高达2kl的生产规模,并且在进一步优化后获得超过99%的双特异性纯度。
评价mabselectsure数据,获得了双特异性产率(r2=0.99)和双特异性纯度(r2=1.00)的良好的模型拟合。停留时间未显示是任一反应的显著因素。对于mabcapurea,在8分钟停留时间对等高线图施加约束,以排除其中获得双特异性产率<80%和双特异性纯度<95%的区域。期望的操作窗口或最佳点比用mabcapturea所观察到的小得多。因此,mabselectsure的使用可能导致在生产规模下表现出不足够的稳健性的方法,因为小的ph或加载变化可能导致不可接受的双特异性纯度或产率。
实施例3:亲和后精制
亲和分辨步骤后,双特异性抗体可以进行精制步骤,旨在以与标准单克隆抗体高度相似的方式除去工艺和产物相关的杂质。然而,在亲和分辨步骤的洗脱缓冲液中使用高浓度的氯化钙可能潜在地使下游单元操作复杂化。超滤/渗滤(uf/df)可以用于降低合并物(pool)的电导率,以便于传统的mab精制步骤,例如阳离子交换或阴离子交换层析。然而,耐盐阳性模式层析步骤的鉴定可以避免引入这种额外的单元操作。多峰或混合模式层析结合了各种类型的相互作用,例如疏水相互作用、氢键和与单一树脂的离子相互作用。已经注意到这可以促进耐盐吸附。
各种多峰树脂被认为是精制步骤:(i)captoadhere和(ii)captoadhereimpres(这两种的n-苄基-甲基乙醇胺配体都含有阴离子交换基团、疏水基团和氢键相互作用基团),(iii)陶瓷羟基磷灰石和(iv)captommc,具有疏水相互作用和氢键电位的多峰阳离子交换树脂。最终,开发了captommc以同时去除与工艺和产物相关的杂质,同时降低工艺流的导电性。在工艺开发之后,使用具有bsabc和bsabd的阳性模式captommc层析在制造规模上证实了概念验证(见表3)。在这两种情况下,获得合理的动态结合能力(19-25g/l),产率≥85%,可溶性聚集物降低3倍,中和(0.2-0.7log去除)cho宿主细胞蛋白清除率。
表3:使用加载了含有250mmcacl2的亲和分辨合并物的captommc介质通过阳性模式多峰层析法获得的产量和污染物去除。
实施例4:纯化策略
基于完成的发现和上述描述,设想了两个下游双特异性工艺平台(图4)。如果双特异性抗体衍生自vh3基因片段家族并且能够通过vh区结合spa,则可以使用称为亲和捕获层析的额外的亲和层析单元操作(图4a)。在通过收获除去细胞和碎片后,使用mabselectsure树脂进行亲和捕获层析,因为缺乏通过z-结构域的vh结合确保了fc*fc*亲本抗体杂质的去除。该步骤可以使用标准用于商业单克隆抗体的蛋白a结合、洗涤和洗脱条件进行,并且还用于增加蛋白质浓度并除去工艺和产物相关的杂质。由于蛋白质在低ph下被洗脱,所以进行保持用于合并产物的病毒灭活的低ph也是方便的。此后,通过称为“亲和分辨层析”的第二阳性模式蛋白a步骤实现fcfc杂质的去除。使用与洗脱缓冲液中的离液改性剂偶联的porosmabcapturea树脂可以产生>95%的双特异性纯度的合并物。在亲和分辨层析之后,使用阳性模式耐盐多峰层析促进与亲和分辨步骤的直接接合,因此避免了对于从工艺流中去除离液盐的介入式uf/df操作的需要。结合额外的精制步骤如阴离子交换层析和病毒保持过滤、聚集物、hcp、dna、病毒和其他杂质可以被去除至可接受的水平。最后,通过标准超滤/渗滤方法将纯化的产物浓缩入最终制剂缓冲液。如果双特异性分子通过去除亲和捕获步骤不显示与spa的vh结合(图4b),则可以简化该纯化系列。在这种情况下,可通过亲和分辨层析除去fcfc和fc*fc*杂质。
实施例5:材料与方法
在cho细胞中表达在这些实施例中使用的所有双特异性抗体和细胞培养液。从层析树脂制造商获得这些树脂:mabselectsure、mabselectxtra、captommc(gehealthcare),porosmabcapturea(lifetechnologies),toyopearlaf-rproteina-650f(tosohbiosciences),absolutehighcap(novasepinc.)prosepultraplus(emdmillipore)。所使用的所有化学品由j.t.baker供应。
使用来自gehealthcare的aktaavant层析系统和1.0cm内径(i.d.)omnifitbenchmark层析柱(omnifitltd)进行实验室规模的层析分离。中试规模层析应用来自gehealthcare的aktapilot层析系统和7.0cmi.d.index层析柱。生产规模层析法在aktaprocess层析板和40cmi.d.chromoflow柱(gehealthcare)。uplc分析利用了waterscorporation的acquityuplc系统。使用2lbiostatb-dcu台式生物反应器(sartorius),50、250或2000lhyclone一次性生物反应器(thermoscientific)或160l不锈钢生物反应器(abecinc.)进行细胞培养。
当不直接使用澄清的细胞培养液时,通过使用20±1cm床高mabselectsure柱的亲和捕获层析产生用于开展亲和分辨的加载材料。在用两个柱体积(cv)的20mm磷酸钠ph7.2平衡后,用澄清的细胞培养液加载柱至10-40g结合抗体/l。通过双特异性和fcfc滴度的总和测定结合抗体浓度。洗涤柱,并在2个cv柱剥洗(strip)之前用专有缓冲系统洗脱蛋白质。收集整个洗脱峰并用2mtris碱中和至ph7.5±0.5。
使用20±1cm床高度柱进行所有亲和分辨层析。在施加加载之前,用两个cv的20mm磷酸钠ph7.2平衡所研究的蛋白a柱。加载后,用专用洗涤缓冲液系统洗涤柱子,并按照说明用梯度洗脱或等度洗脱进行洗脱。对于等度洗脱使用四个cv的洗脱体积,在洗脱步骤开始后收集0.5-4个cv的合并物。梯度洗脱缓冲液和等度洗脱缓冲液都含有40mm乙酸盐作为缓冲物质。洗脱后,柱用2个cv的缓冲液进行剥洗。除非另有说明,否则所有步骤在400cm/h的线速度下进行。使用unicorn6.1软件(gehealthcare)进行层析分析,包括计算使用半高宽度方法假设高斯峰的峰分辨率(rs)。当进行自动分级分离时,峰值提升由基线uv280的增加>50mau定义。使用jmp11.1.1(sasinstituteinc.)进行实验的统计设计、分析和建模。
使用25.1l柱(20cm床高;40cmi.d.)在4分钟的停留时间(线速度300cm/h)执行的所有步骤进行captommc层析法。亲和分辨合并物用水稀释50%并调节至ph5.0±0.1。用2个cv的2mnacl预平衡柱,然后在40mm乙酸钠、250mm氯化钙、ph5.0±0.1中平衡2个cv。在施加加载之后,用3个cv的40mmtris、40mm的乙酸盐、ph5.0±0.1洗涤柱,然后产物用8个cv的20mmtris、60mm的乙酸盐、ph8.0±0.1(bsabc)或20mmtris、40mm乙酸盐、ph8.0±0.1(bsabd)进行洗脱。从uv280nm提升至洗脱步骤结束时收集合并物。洗脱后,用2个cv的2mnacl接着用2个cv的1mnaoh清洗柱子。
使用市售elisa试剂盒货号#f550(cygnustechnologies)进行宿主细胞蛋白(“hcp”)定量。由两个acquityuplcprstsec层析柱,
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺