用于多重呼吸道病原菌和耐药基因检测的引物探针组合物、试剂盒
本技术涉及生物,尤其是涉及一种用于多重呼吸道病原菌和耐药基因检测的引物探针组合物、试剂盒。
背景技术:
1、呼吸道感染分为上呼吸道感染和下呼吸道感染。下呼吸道感染是门诊就诊的最常见原因,包括急性气管-支气管炎、慢性支气管炎、肺炎、支气管扩张等,病因由病毒、细菌、支原体、衣原体、真菌等微生物引起。根据中国医院和社区获得性肺炎诊断和治疗指南,导致下呼吸道感染的主要病原体分为三类,分别为:a(一线):肺炎链球菌、肺炎克雷伯菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌、肺炎支原体、大肠杆菌、结核杆菌、耶氏肺孢子菌和曲霉;b(二线):嗜麦芽窄食单胞菌、嗜肺军团菌、阴沟肠杆菌、洋葱伯克霍尔德菌;c(三线):化脓链球菌、卡他莫拉菌、流感嗜血杆菌、百日咳杆菌和肺炎衣原体。下呼吸道感染的防治应遵循预防为主、准确诊断、及时治疗的原则,治疗时必须明确引起感染的病原体以选择有效的抗生素。
2、尽管呼吸道病原体的检测方法多种多样,但确诊感染病原仍非常困难。临床上常用的有以下几种方法:(1)直接镜检法,收费低、快速预测培养结果,能够直接细胞计数,但是灵敏度差、不能准确识别病原体、检测通量低、不能检测病毒性肺炎;(2)培养法,细菌的病原体分离培养及病毒的组织培养、细胞培养法过去常作为“金标准”,其优点是有效区分定植和感染,检测通量较高,但其操作复杂、培养时间长、技术难度大、阳性率低等;(3)血清学检测,抗原抗体体外检测,用已知抗原检测血清中是否有相应的抗体,能够实现快速检测,但是检测受病程的影响较大,不同的抗体产生的时间不同,且需要两份血清样本。
3、自从20世纪将抗生素引入医疗保健和临床实践以来,抗生素已经彻底改变了医学。令人担忧的是,这些药物越来越受到细菌的威胁,使细菌形成了广泛多样的耐药机制。2017年初,世界卫生组织发布了一份优先病原体清单,需要对这些病原体进行抗生素疗法的研究和开发,包括耐碳青霉烯类、耐甲氧西林等抗生素的各种呼吸道常见病原菌。近些年来随着人们对细菌耐药现象的研究和重视,已看到遏制耐药菌流行播散的希望,但细菌对抗菌药物的耐药形势仍较严重。2021年上半年,chinet中国细菌耐药监测结果显示碳青霉烯类耐药革兰阴性杆菌的检出率仍保持高位,耐甲氧西林金黄色葡萄球菌(mrsa)的检出率虽然呈下降趋势,但其检出率仍在30%以上。目前关于细菌耐药性的检测方法主要是纸片扩散法和自动化药敏系统检测等,但其仍受培养时间长等因素的限制。
4、针对病原体的检测还可以采用核酸检测手段,目前应用较为广泛的核酸检测方法包括:聚合酶链式反应(pcr)、实时荧光pcr技术(real-time pcr,rt-pcr)、pcr毛细电泳片段分析法、核酸等温扩增技术和dna测序法等。传统的pcr法和pcr毛细电泳片段分析法实验操作步骤频繁耗时;基因测序的通量高,可检测未知病原体,但是检测周期较长,检测费用昂贵,不适合临床推广使用;核酸等温扩增技术能够实现快速扩增,但其检测灵敏度较差。rt-pcr法具有高灵敏度、高特异性等特点,已广泛用于呼吸道感染中多种病毒和细菌的快速检测,但目前临床检测遇到的问题包括实验操作复杂,尤其是一些特殊样本(痰液样本)的处理,常规rt-pcr法需要进行痰液液化、核酸提取和上机检测,要分区进行,对于检测人员的要求比较高,检测时间长、检测指标少等。
技术实现思路
1、为了解决现有技术的不足,本技术提供一种用于多重呼吸道病原菌和耐药基因检测的引物探针组合物和包括所述引物探针组合物的基于微流控芯片结合荧光pcr探针的试剂盒,利用所述试剂盒在一张微流控芯片中,一次注样,可以同时完成11种呼吸道病原菌和2种耐药基因的检测,检测方法简便、高效,检测结果灵敏度高、特异性强。
2、为此,本技术第一方面提供了一种用于多重呼吸道病原菌和耐药基因检测的引物探针组合物,所述引物探针组合物中包括13组分别用于对待检测的呼吸道病原菌和耐药基因进行检测的引物探针组;且13组分别用于对待检测的呼吸道病原菌和耐药基因进行检测的引物探针组中的正、反向引物和探针的核苷酸序列分别如seq id no:1~42所示。
3、本技术中,所述引物探针组合物中的正、反向引物和探针均针对各病原菌和耐药基因的保守区域设计,保障检测结果的准确度,且通过比对分析和优化设计,确认了不同病原菌和耐药基因间的特异性,且通过引物和探针的双重设计保障靶点识别的特异性。
4、本技术中,术语“引物”表示这样的寡核苷酸:其能够通过模板依赖性dna聚合酶“引发”dna合成,即例如寡核苷酸的3’-末端提供游离3’-oh基团,可以通过模板依赖性dna聚合酶将更多的“核苷酸”连接至所述3’-oh基团,建立3’至5’磷酸二酯键,由此使用脱氧核苷三磷酸,并且由此释放焦磷酸。
5、本技术中,术语“正向引物”,是沿着负链进行不间断延长的寡核苷酸;术语“反向引物”,是沿着正链进行不间断延长的寡核苷酸。应理解,当正链和反链的指定发生互换时,对应的正向引物和反向引物的命名也可随之互换。也即,本技术中的正向引物和反向引物是相对而言的。
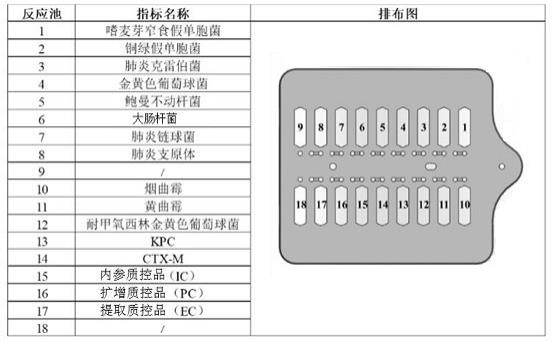
6、本技术中,所述待检测的呼吸道病原菌和耐药基因中包括11种呼吸道病原菌和2种耐药基因;所述11种呼吸道病原菌分别为嗜麦芽窄食单胞菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌、鲍曼不动杆菌、大肠杆菌、肺炎链球菌、肺炎支原体、烟曲霉、黄曲霉和耐甲氧西林金黄色葡萄球菌;所述2种耐药基因分别为碳青霉烯耐药基因kpc和超广谱β-内酰胺酶ctx-m型耐药基因 。
7、在一些具体实施方式中,用于检测嗜麦芽窄食单胞菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:1~3所示;
8、用于检测铜绿假单胞菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:4~6所示;
9、用于检测肺炎克雷伯菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:7~9所示;
10、用于检测金黄色葡萄球菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:10~12所示;
11、用于检测鲍曼不动杆菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:13~15所示;
12、用于检测大肠杆菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seqid no:16~18所示;
13、用于检测肺炎链球菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:19~21所示;
14、用于检测肺炎支原体的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:22~24所示;
15、用于检测烟曲霉的引物探针组中正、反向引物和探针的核苷酸序列分别如seq idno:25~27所示;
16、用于检测黄曲霉的引物探针组中正、反向引物和探针的核苷酸序列分别如seq idno:28~30所示;
17、用于检测耐甲氧西林金黄色葡萄球菌的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:31~33所示;
18、用于检测碳青霉烯耐药基因kpc的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:34~36所示;
19、用于检测超广谱β-内酰胺酶ctx-m型耐药基因的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:37~42所示。
20、本技术中,所检测的超广谱β-内酰胺酶ctx-m型耐药基因包括两种型别,分别为酶ctx-m1型和ctx-m9型。具体地,用于检测ctx-m1型耐药基因的正、反向引物和探针的核苷酸序列分别如seq id no:37~49所示;用于检测ctx-m9型耐药基因的正、反向引物和探针的核苷酸序列分别如seqid no:40~42所示。
21、在一些实施方式中,所述引物探针组合物中还包括3组分别针对3种质控品的引物探针组,所述的3种质控品分别为提取质控品、扩增质控品和内参质控品,且针对所述提取质控品的引物探针组中正、反向引物和探针的核 苷酸序列分别如seq id no:43~45所示,针对所述扩增质控品的引物探针组中正、反向引物和探针的核苷酸序列分别如seq id no:46~48;所示针对所述内参质控品的引物探针组中正、反向引物和探针的核苷酸序列分别如seqid no:49~51所示。
22、本技术中,通过设置质控品(提取质控品、扩增质控品和内参质控品)能够检测样本提取和扩增的情况以及监测全流程的检测过程,以确保检测过程的准确性。
23、在一些实施方式中,所述引物探针组合物中每条探针的5’端均修饰有一个荧光报告基团,3’端均修饰有一个荧光淬灭基团。
24、本技术中,所述引物探针组合物中的探针为taqman荧光探针,其5’端均修饰有一个荧光报告基团(例如fam、tet、vic、hex等),3’端均修饰有一个荧光淬灭基团(tamra、bhq等)。pcr扩增时在加入一对引物(正、反向引物)的同时加入一个特异性的荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收;pcr扩增时,taq酶的5'-3'外切酶活性将探针酶切降解,使荧光报告基团和荧光淬灭基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积与pcr产物形成完全同步。因此阳性样本扩增时会产生“s”形实时荧光扩增曲线。
25、本技术所述引物探针组合物覆盖了11种临床常见下呼吸道病原菌和2种抗生素耐药基因,覆盖范围广,可以为临床治疗的有效实施提供更为可靠的依据。
26、本技术第二方面提供了一种用于多重呼吸道病原菌和耐药基因检测的试剂盒,其包括如本技术第一方面所述的引物探针组合物。
27、在一些实施方式中,所述试剂盒中包括微流控芯片,所述微流控芯片上设置有分别针对所述11种呼吸道病原菌、2种耐药基因和3种质控品的16个独立的反应池,且16组引物探针组分别包埋固定于所述的16个独立的反应池中。
28、本技术中,所述16个独立的反应池中均包括一组针对不同待测靶标(11种呼吸道病原菌、2种耐药基因和3种质控品)的引物探针组。
29、在一些实施方式中,所述反应池中每条引物的含量为0.5~1 μm,每条探针的含量为0.1 ~0.5 μm。在一些具体实施方式中,所述反应池中每条引物的含量可以为0.5μm、0.6μm、0.7μm、0.8μm、0.9μm或1.0μm等,每条探针的含量可以为0.1μm、0.2μm、0.3μm、0.4μm或0.5μm等。
30、在一些优选的实施方式中,所述反应池中每条引物的含量为0.6 μm,每条探针的含量为0.3 μm。
31、本技术中,核酸扩增时所采用的引物和探针的含量对扩增结果的影响较为明显,引物和探针的含量过高或过低均会对扩增结果带来负面影响。本技术通过将反应池内每条引物和探针的含量控制在上述范围内,能使得扩增效果最佳。
32、本技术中,所述试剂盒采用pcr荧光探针法和微流控芯片相结合的方法,所述微流控芯片上设置有分别针对所述11种呼吸道病原菌、2种耐药基因和3种质控品的16个独立的反应池,在一张微流控芯片中,一次注样,可以同时完成13种呼吸道病原菌和耐药基因的检测,同时通过在检测过程中对3种质控品进行同时检测,能够对检测结果进行有效把控,提升检测结果的准确性。
33、值得注意的是,本技术中所述微流控芯片上设置的独立反应池的个数不限于16个,其可以为16个以上(例如为18个),只要能包括针对所述11种呼吸道病原菌、2种耐药基因和3种质控品的16个独立的反应池即可,多设置的独立反应池可以不添加任何试剂。
34、本技术中,所述试剂盒的原理是基于磁珠法进行核酸提取,结合微流控芯片,采用taqman荧光探针法对病原菌的核酸和耐药基因进行扩增和检测。所述试剂盒适用于芯片核酸扩增分析仪(onestart-1000),该仪器将核酸提取纯化、检测等功能集于一体。
35、在一些实施方式中,所述微流控芯片上还设置有冻干组件,所述冻干组件中包括冻干的核酸扩增试剂;所述核酸扩增试剂中包括mgcl2、冻干保护剂和包含dna聚合酶、ung酶、dutp和dntps的pcr缓冲液。所述dna聚合酶为taq聚合酶。
36、本技术中使用的pcr缓冲液为现成的市售成品,本领域技术人员可以根据需要在现有的市售成品中进行常规选择。本技术中,对样本中提取的核酸模板进行扩增时的pcr条件为本领域的常规条件,本领域技术人员可以进行常规选择。
37、本技术中,所述微流控芯片冻干组件内包含的核酸扩增试剂(主要包括pcr混合液、mgcl2和冻干保护剂等成分)为冻干试剂,通过将液体形态的核酸扩增试剂进行冻干制成冻干试剂,实现试剂盒室温(10℃~30℃)保存,与传统的核酸检测试剂相比不需要低温运输,方便使用者长途运输往来。
38、在一些实施方式中,所述试剂盒内还包括裂解液,用于对样本进行裂解,进而释放出样本内的核酸模板,所述裂解液的成分为edta-2na 10~200mm、氯化钠 1~5m、胍盐2~7m、曲拉通-100 10~100ml/l。
39、采用所述试剂盒对样本进行检测时,仅需将样本与裂解液混合对其进行简单处理(样本与裂解液混合后在95~100℃下孵育8~10分钟)后即可进行上样检测,样本处理步骤简单,不需要在机器外进行样本核酸提取纯化,一次加样可完成11种临床常见下呼吸道病原菌和2种抗生素耐药基因的检测,节省了人工操作时间,降低了不同样本之间污染的概率;同时一张芯片可同时检测13种下呼吸道感染常见细菌、真菌和耐药基因,90分钟出检测报告,具有灵敏度高、特异性强等优点,与培养法相比周期更短、操作更简单;与测序法相比价格更低,更适合做临床推广使用。
40、本技术第三方面提供了一种如本技术第一方面所述的引物探针组合物或第二方面所述的试剂盒在对样本中的呼吸道病原菌和耐药基因进行检测中的应用;所述样本为痰液样本。
41、本技术开发了一种基于痰液样本的检测产品,利用本技术所述的引物探针组合物或所述的试剂盒能够一次对痰液样本中的11种临床常见下呼吸道病原菌和2种抗生素耐药基因进行同时检测,检测时无需对痰液样本进行液化,样本直接与裂解液混合进行简单处理后即可进行上样检测,90分钟出检测报告,检测时间短、检测指标多,且对检测人员的要求低,因此能较好地应用于样本中呼吸道病原菌和耐药基因的检测中。
42、本技术的有益技术效果为:本技术所提供的用于多重呼吸道病原菌和耐药基因检测的引物探针组合物和包括所述引物探针组合物的试剂盒,能够一次对样本中的11种临床常见下呼吸道病原菌和2种抗生素耐药基因进行同时检测,节省了人工操作时间,90分钟出检测报告,且降低了不同样本之间污染的概率,具有灵敏度高、特异性强等优点;同时检测时样本的处理步骤简单,不需要在机器外进行样本核酸提取纯化,且对检测人员的要求低,能较好地应用于样本中呼吸道病原菌和耐药基因的检测中。另外,试剂盒内的核酸扩增试剂为冻干试剂,实现试剂盒室温保存,与传统的核酸检测试剂相比不需要低温运输,方便使用者长途运输往来。
- 还没有人留言评论。精彩留言会获得点赞!