一种以驼源纳米抗体为靶标的针对赭曲霉毒素A的表位模拟肽及其筛选方法和应用
本发明属于免疫分析化学,具体涉及一种以驼源纳米抗体为靶标的针对赭曲霉毒素a的表位模拟肽及其筛选方法和应用。
背景技术:
1、赭曲霉毒素主要由曲霉属(aspergillus)和青霉属(penicillium)等真菌产生的对人体或动物机体造成毒害作用的次级代谢产物。其中,赭曲霉毒素a(ochratoxin a,ota)的毒性最高、分布范围最广、对农副产品污染最严重。大量研究表明,ota可以抑制蛋白质的合成,干扰代谢途径,破坏钙的平衡,并损害人类和动物的dna,长期接触或暴露在存在ota的环境中具有潜在的肾毒性、肝毒性、免疫毒性、致畸性、致癌性和致突变等毒性作用风险,严重威胁着人类和动物有机体的健康。与此同时,ota的化学稳定性和热稳定性高,日常对农产品的加工处理难以将其完全除去。因此,开发快速、灵敏的ota检测技术对于支持食品安全监管是非常必要的。
2、随着当代仪器分析技术的发展,具有高精度和高灵敏度的色谱法已经被检测机构和政府食品安全监管部门作为检测ota的普遍方法,尤其是高效液相色谱法(hplc)。进一步发展的高效液相色谱质谱联用(hplc-ms)、高效液相色谱串联质谱(hplc-ms-ms)、气相色谱质谱联用(lc-ms)等的使用,使ota检测更方便,更灵敏。然而,仪器分析方法具有仪器昂贵、样品前处理复杂以及对操作人员要求高的缺陷,限制了它们在基本监管机构或领域的广泛应用,无法实现快速检测食品中的有害物质。作为色谱法的替代品,免疫分析法具有快速、低成本和高灵敏度的优势,能够实现样品的高通量测试。以ota为代表的常见小分子有毒物(真菌毒素、农药、兽药等)通常只具有一个抗原决定簇,在免疫检测中不可避免的会引入化学偶联全抗原。化学偶联全抗原合成过程复杂且涉及到大量的有毒物质,这对研究者和环境容易产生危害。因此,可以作为化学偶联全抗原替代品的表位模拟肽有效地避免了这些风险。
3、目前,表位模拟肽通常是以噬菌体展示技术为基础、单克隆抗体(mab)为靶标来获取。由于mab的获取步骤复杂且涉及到可能的动物伦理道德问题。选取其他靶标来筛选针对赭曲霉毒素a的表位模拟肽成为目前需要解决的问题
技术实现思路
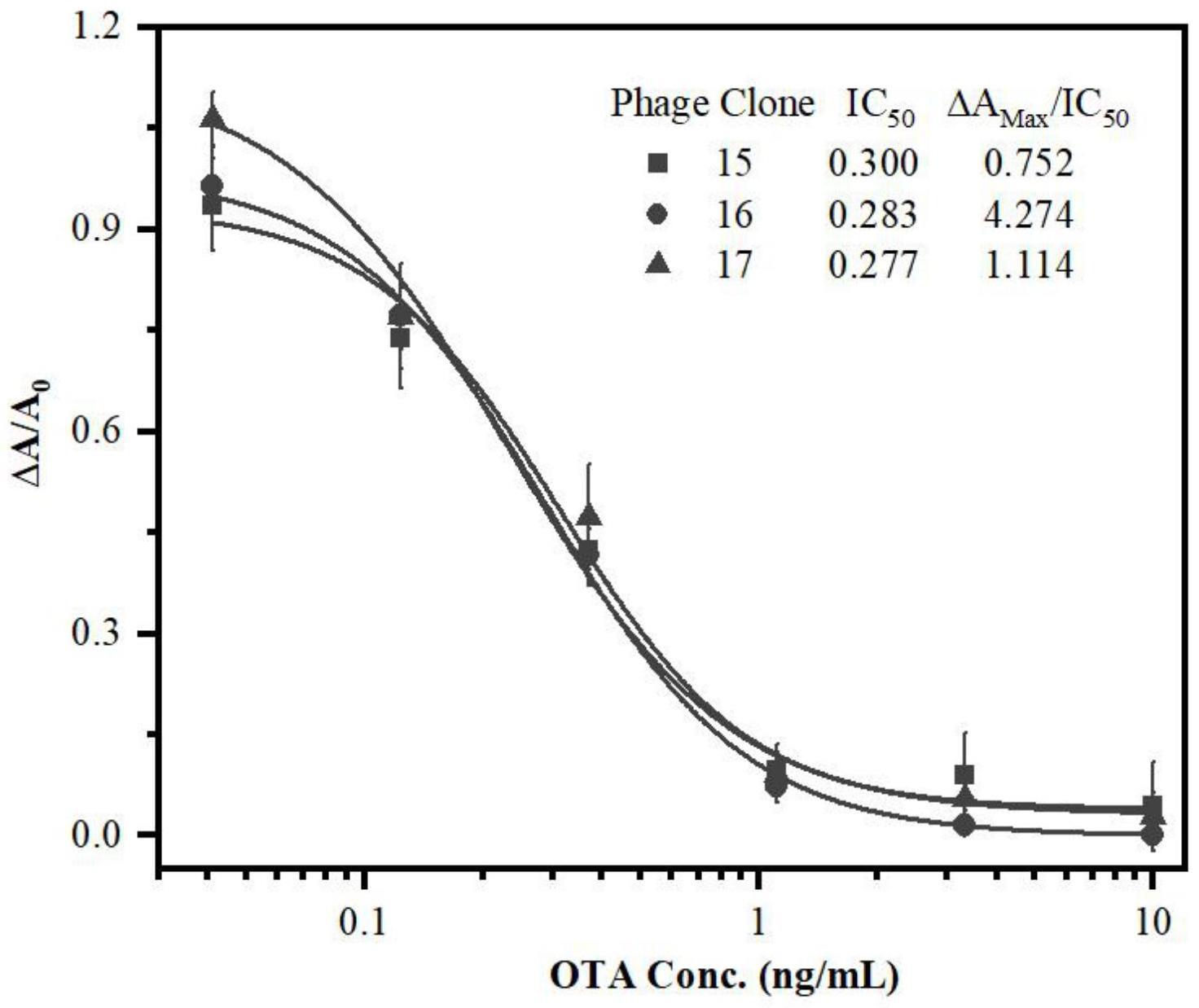
1、本发明的目的在于提供一种以驼源纳米抗体为靶标的针对赭曲霉毒素a的表位模拟肽及其筛选方法和应用。
2、本发明提供了一种以驼源纳米抗体为靶标的针对赭曲霉毒素a的表位模拟肽的筛选方法,包括以下步骤:
3、1)将驼源纳米抗体和ni-ida琼脂糖磁珠混合,进行第一螯合,得到第一螯合物;将所述第一螯合物和噬菌体环形七肽库混合,进行第一孵育,得到第一结合物;将所述第一结合物置于磁场分离磁珠和液体,弃上清,对剩余磁珠依次进行第一洗涤和酸洗脱,调节所述酸洗脱后的洗脱液的ph至7~8,得到第一洗脱液;采用所述第一洗脱液转染大肠杆菌后依次进行扩增、纯化和滴度测定,调节产物中噬菌体的滴度为1012~1013pfu/ml,得到第一纯化物;
4、2)将驼源纳米抗体和ni-ida琼脂糖磁珠混合,进行第二螯合,得到第二螯合物;将所述第二螯合物和所述第一纯化物混合,进行第二孵育,得到第二结合物;将所述第二结合物置于磁场分离磁珠和液体,弃上清,对剩余磁珠依次进行第二洗涤和采用ota标准品进行第一竞争洗脱,得到第二洗脱液;采用所述第二洗脱液转染大肠杆菌后依次进行扩增、纯化和滴度测定,调节产物中噬菌体的滴度为1012~1013pfu/ml,得到第二纯化物;
5、3)将驼源纳米抗体和ni-ida琼脂糖磁珠混合,进行第三螯合,得到第三螯合物;将所述第三螯合物和所述第二纯化物混合,进行第三孵育,得到第三结合物;将所述第三结合物置于磁场分离磁珠和液体,弃上清,对剩余磁珠依次进行第三洗涤和采用ota标准品进行第二竞争洗脱,得到第三洗脱液;采用所述第三洗脱液转染大肠杆菌后依次进行扩增和滴度测定;
6、4)在转染有第三洗脱液的大肠杆菌的滴度平板中挑取大肠杆菌单菌落进行噬菌体克隆的扩增,得到扩增后的噬菌体培养物;
7、5)对所述噬菌体培养物进行phage-elisa鉴定,以阴性孔od450/阳性孔od450≥2.1作为阳性克隆的判断依据,鉴定得到阳性克隆并进行dna测序,得到表位模拟肽;
8、步骤1)中所述驼源纳米抗体的工作浓度为10~20μg/ml;
9、步骤1)中所述噬菌体环形七肽库中噬菌体的添加量为1011~1012pfu;
10、步骤2)中所述驼源纳米抗体的工作浓度为4~8μg/ml;
11、步骤3)中所述驼源纳米抗体的工作浓度为0.5~2μg/ml;
12、步骤2)中所述ota标准品的工作浓度为80~100ng/ml;
13、步骤3)中所述ota标准品的工作浓度为1~10ng/ml。
14、优选的,步骤1)中所述第一洗涤的次数为5~10次;步骤1)中所述第一洗涤采用的试剂包括第一pbst;所述第一pbst以水为溶剂,包括以下浓度的组分:10mm pbs和体积浓度为0.05%~0.1%的tween-20。
15、优选的,步骤1)中所述酸洗脱采用的试剂包括浓度为0.2m的gly-hcl。
16、优选的,步骤2)中所述第二洗涤的次数为15~20次;步骤2)中所述第二洗涤采用的试剂包括第二pbst;所述第二pbst以水为溶剂,包括以下浓度的组分:10mm pbs和体积浓度为0.25%~0.3%的tween-20。
17、优选的,步骤3)中所述第三洗涤的次数为20~25次;步骤2)中所述第三洗涤采用的试剂包括第三pbst;所述第三pbst以水为溶剂,包括以下浓度的组分:10mm pbs和体积浓度为0.5%~0.8%的tween-20。
18、本发明还提供了以驼源纳米抗体为靶标的针对赭曲霉毒素a的表位模拟肽,包括第一环状短肽、第二环状短肽和第三环状短肽中的一种或几种;
19、所述第一环状短肽的氨基酸序列如seq id no.1所示;
20、所述第二环状短肽的氨基酸序列如seq id no.2所示;
21、所述第三环状短肽的氨基酸序列如seq id no.3所示。
22、本发明还提供了上述方案所述表位模拟肽的编码基因。
23、优选的,所述编码基因包括编码所述第一环状短肽的第一基因、编码所述第二环状短肽的第二基因和编码所述第三环状短肽的第三基因中的一种或几种;
24、所述第一基因的核苷酸序列如seq id no.4所示;
25、所述第二基因的核苷酸序列如seq id no.5所示;
26、所述第三基因的核苷酸序列如seq id no.6所示。
27、本发明还提供了一种用于检测赭曲霉毒素a的试剂盒,包含上述方案所述的表位模拟肽。
28、本发明还提供了上述方案所述的表位模拟肽或者所述的编码基因或者所述的试剂盒在检测赭曲霉毒素a中的应用。
29、本发明提供了一种以驼源纳米抗体为靶标的针对赭曲霉毒素a的表位模拟肽的筛选方法。本发明以抗ota的驼源纳米抗体nb为靶标筛选模拟表位肽,利用噬菌体展示技术从噬菌体环七肽库中筛选针对ota的表位模拟肽,经过酸洗脱和竞争洗脱的多轮筛选方法,筛选得到针对赭曲霉毒素a的表位模拟肽。本发明所述靶标驼源纳米抗体nb与传统mab相比具有分子量低、产量高、成本低的特点。本发明的筛选方法筛选得到的表位模拟肽具有高特异性和亲和力,能够作为绿色、经济、高效的ota化学偶联全抗原替代品,直接用于ota的检测或者利用基因工程技术将表位模拟肽与其他蛋白质构建融合蛋白用于其他免疫分析检测方法的建立,不仅能够降低检测成本,同时避免了ota及相关有毒化学品对研究者健康和环境的危害,有利于实现ota的绿色检测。
- 还没有人留言评论。精彩留言会获得点赞!