一种CRISPR-Cas9介导的同步双基因编辑系统及其在曲霉中的应用
本发明属于基因工程,具体涉及一种crispr-cas9介导的同步双基因编辑系统及其在曲霉中的应用。
背景技术:
1、crispr-cas9系统由切割dna双链的cas9核酸酶和导向功能的sgrna(singleguide rna)两部分组成。在细胞内,当cas9蛋白和sgrna同时存在并结合为复合体时,经由sgrna导引至特异性的靶序列处,由cas9蛋白进行切割,并产生dna双链断裂(dna doublestrand breaks,dsbs),进而引发胞内的dna修复机制。在真核生物中有两种修复方式:同源重组修复(homology directed repair,hdr)和非同源重组修复(non-homologous dnaendjoining,nhej)。虽然经过十几年的发展,crispr-cas9基因组编辑方法已被广泛应用于多个物种的基因编辑,成为生物育种和合成生物学中基因改造的有效工具,但是仍有很多不足如精准编辑位点效率低导致脱靶、筛选标记在野生型菌株中的缺乏、转化体系在不同物种中不能通用等等问题。因此,各领域的研究者仍然在寻找适合不同物种的高效基因编辑体系。丝状真菌是一类多细胞(少数也为无膈膜单细胞)的真菌类别,由于它们都具有坚硬的细胞壁使得外源dna等物质进入难度大,且多样性丰富的丝状真菌大多来自于工、农业和临床医学等环境,这些菌株均缺少筛选标记,使得基因编辑尤其是多基因编辑难度大,因此,丝状真菌基因编辑技术远远落后于其它高等动、植物等物种。
2、构巢曲霉中多个菌株具备了基因组测序的数据,它也是用于基础研究的模式丝状真菌,因此其形态、生理、代谢途径和遗传调控方面的研究已经具备了一定的积累。然而,目前大多研究聚焦在构巢曲霉产酶领域,而其他初级产物如有机酸产生的调控则鲜有报道,这在一定程度上限制了构巢曲霉潜力的开发和应用的扩展。同时在构巢曲霉中,目前主要采用的是同源重组基因替换的方法来完成目的基因的敲除,比较低效和费时、费力。目前存在的技术问题包括以下三点:(1)缺乏有效的筛选标记,导致多基因编辑无法完成;(2)由于丝状真菌具有很强的非同源dna修复能力,目的基因编辑效率不高且脱靶发生造成非目的基因的编辑的副作用;(3)多基因编辑经常需要多次转化完成造成费时费力,效率低下是合成生物学的限速因子。
技术实现思路
1、发明目的:针对现有技术中存在的不足,本发明提供一种crispr-cas9介导的同步双基因编辑系统,在构巢曲霉的菌株中构建一个高效的基因编辑体系,以提高工程菌株基因编辑的效率。同时,通过使用所建立的基因编辑技术快速的对构巢曲霉胞内的rtca途径进行改造,以获得高产目的产物的工程菌株底盘细胞,同时有效提高构巢曲霉产l-苹果酸。
2、本发明还提供所述crispr-cas9介导的同步双基因编辑系统的应用。
3、技术方案:为了实现上述目的,本发明所述一种crispr-cas9介导的同步双基因编辑系统,所述同步双基因编辑系统包括crispr-cas9系统和cre-loxp系统,所述crispr-cas9系统对靶基因进行定点敲除,cre-loxp系统与高表达的基因组成修复模板,修复模板在微同源臂的引导下整合在敲除靶基因的位置;所述修复模板包括组成型启动子、营养筛选标记、高表达的基因以及来自靶基因的微同源臂。
4、本发明所述一种构巢曲霉的crispr-cas9介导的同步双基因编辑系统,所述同步双基因编辑系统包括crispr-cas9系统和cre-loxp系统,所述crispr-cas9系统对靶基因进行定点敲除,cre-loxp系统与高表达的基因组成修复模板,在微同源臂的引导下整合在敲除靶基因的位置,通过一次转化完成对靶基因a的敲除,以及对目的基因b的过表达;其中基因a设计成能被cas9-sgrna复合物识别的靶基因,所述修复模板包括组成型启动子、营养筛选标记、基因b以及来自靶基因a的微同源臂。
5、作为优选,所述同步双基因编辑系统包括crispr-cas9敲除系统和cre-loxp系统,通过一次转化完成目的基因a的敲除,插入另一个带有高表达启动子的基因b,其中基因a设计成能被cas9-sgrna复合物识别的靶基因,同时设计修复模板包括组成型启动子、营养筛选标记、目标基因b以及来自基因a的微同源臂。
6、其中,所述启动子为长度为700bp的gpda(3-磷酸甘油醛脱氢酶)启动子或者长度为1400bp的tef(翻译延伸因子)启动子。
7、其中,所述营养筛选标记为pyroa。
8、其中,所述微同源臂长度为25-35bp。优选为30bp。
9、其中,所述启动子设计成和基因a反向的方式。
10、其中,由木糖诱导的启动子(pxylp)编码的cre重组酶基因调控的cre-loxp技术体系进行pyroa基因的删除从而达到营养标记再次使用。
11、本发明所述的构巢曲霉的crispr-cas9介导的同步双基因编辑系统在构巢曲霉中完成一次转化实现同步敲除一个基因和高调另一个基因中的应用。
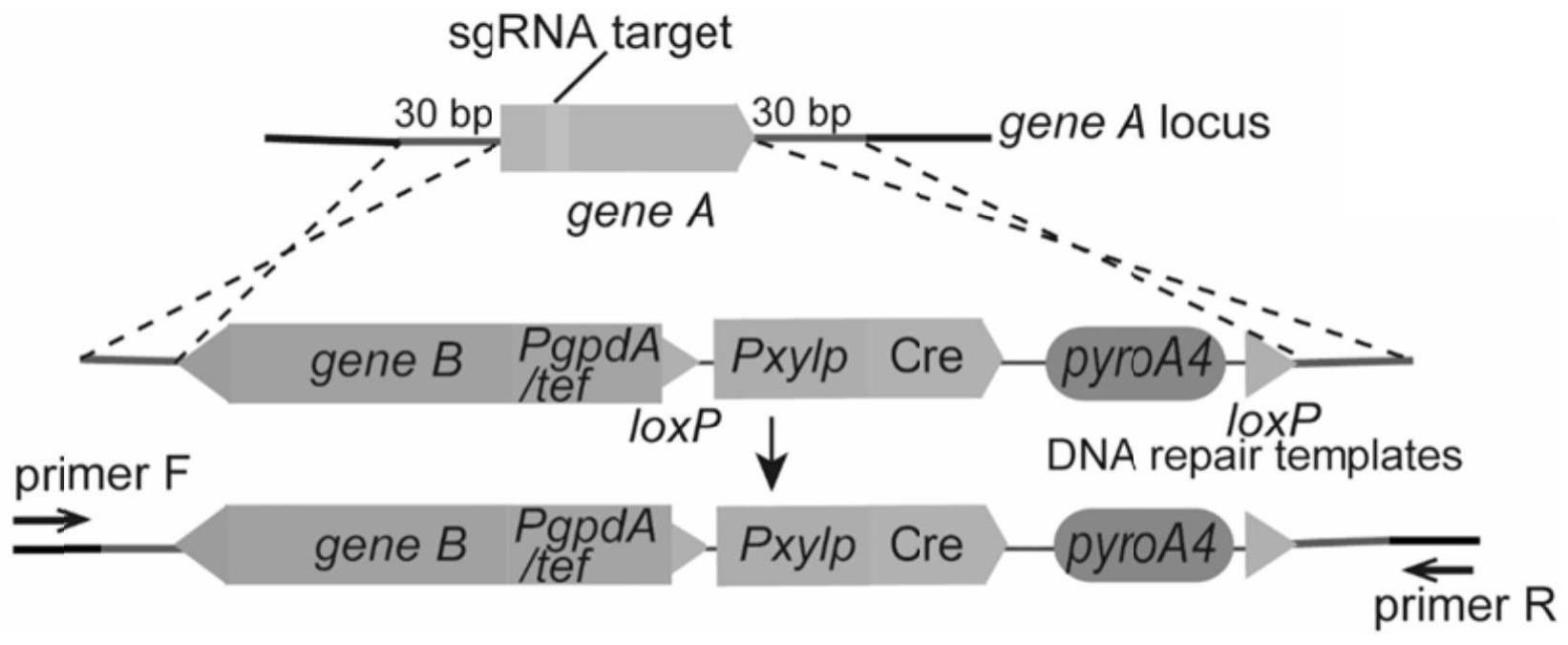
12、本发明所述的构巢曲霉的crispr-cas9介导的同步双基因编辑系统在构巢曲霉多基因的连续编辑中的应用。
13、其中,所述系统对构巢曲霉细胞中的还原性tca途径及产生草酸和柠檬酸的两条支路途径上的的五个关键基因进行编辑,所述五个关键基因编码分别是丙酮酸羧化酶的编码基因、草酸乙酰水解酶的编码基因、苹果酸脱氢酶的编码基因、c4-二羧酸转运蛋白的编码基因和柠檬酸转运蛋白的编码基因。
14、本发明所述的构巢曲霉的crispr-cas9介导的同步双基因编辑系统在提升构巢曲霉产l-苹果酸中的应用。
15、本发明所述一株基因工程菌,以构巢曲霉tn02a7为出发菌株,通过所述的crispr-cas9介导的同步双基因编辑系统,对丙酮酸羧化酶的编码基因pyc、苹果酸脱氢酶的编码基因mdhc、c4-二羧酸转运蛋白的编码基因dcta高表达;对草酸乙酰水解酶oaha、柠檬酸转运蛋白的编码基因cexa敲除。
16、本发明利用构建crispr-cas9组成性表达的构巢曲霉受体菌株,并结合由木糖诱导的启动子(pxylp)编码的cre重组酶基因调控的cre-loxp技术体系,完成一次转化实现同步缺失编辑一个目的基因和原位插入高调另一个基因的高效的双基因编辑系统,并通过cre-loxp技术进行营养标记pyroa的重复利用,从而实现多基因的连续编辑如在构巢曲霉rtca苹果酸合成途径中多个基因编辑后的应用。
17、具体地,为了在构巢曲霉中建立一个高效的基因表达体系,设计了一种基于crispr的同步双基因编辑系统,能通过一次转化实验中快速实现敲除一个基因a并同时过表达另一个基因b。其中在基因a上寻找符合规律的编辑pam位点,将基因a设计成能被cas9-sgrna复合物识别的靶基因。以质粒作为模板扩增修复模板,来修复由sgrna-cas9复合物切割产生的切口,即以构建好的质粒(包含待高调的基因、tef强启动子、cre-loxp系统、pyroa标记),将要整合到上述切口处的修复模板,通过pcr的方式,从质粒上扩增出来。修复模板包括组成型启动子(pgpd或ptef)、营养筛选标记pyroa、目标基因b(待高调基因)以及约30bp来自基因a(待敲除基因)的微同源臂。为了避免组成型启动子对其他基因产生影响,设计扩增模板的时候将启动子设计成和基因a反向的方式。sgrna采用体外合成的方式,合成根据需要编辑靶序列的信号rna,这与通过体内表达持续供应基因产物不同,不仅避免了体内表达所需的复杂质粒构建过程,而且还降低了由sgrna的瞬时产生而导致的脱靶效应的风险。同时,30bp左右的微同源臂足够让修复模板将额外的dna整合到被cas9-sgrna复合物切割产生的“缺口”处,该方法避免使用融合pcr或其他方法对长同源臂进行复杂分子克隆技术及组装。同时,在修复模板中,带有pxylp-cre-pyroa条带(其两侧是两段方向相同的loxp位点)。经过木糖诱导,两个loxp位点中间所有条带被表达的cre酶一起删除,使得菌株重新成为pyroa缺失菌,在下一轮转化中,又可以作为营养筛选标记,实现多基因编辑。
18、本发明采用丝状真菌构巢曲霉菌株tn02a7作为受体菌株,成功构建了crispr-cas9和cre-loxp技术体系,完成一次转化实现同步敲除一个基因和高调另一个基因的双基因编辑系统,并通过cre-loxp技术进行营养标记pyroa的重复利用,从而实现多基因的连续编辑。本发明所建立的体系能够成功应用于构巢曲霉细胞中的还原性tca(rtca)途径及产生草酸和柠檬酸的两条支路途径上的的五个关键基因的编辑,这些基因编码的蛋白酶分别是丙酮酸羧化酶pyc,草酸乙酰水解酶oaha,苹果酸脱氢酶mdhc,c4-二羧酸转运蛋白dcta和柠檬酸转运蛋白的编码基因cexa。该体系可以完成曲霉工程菌株副产物基因的敲除,主产物基因的高调,并回收筛选的营养标记,为构建合成生物学生产食品和药品的其它丝状真菌提供底盘细胞提供应用技术。
19、本发明首次提出了构巢曲霉的crispr-cas9介导的同步双基因编辑系统,其核心在于准确性高和效率高,可以有效实现目的基因敲除,以及另一种基因高调,并且使得筛选标记放在一起完成,对于多基因连续编辑就非常方便,这一点在合成生物学中很重要。本发明首次通过的cre-loxp和crispr-cas9的结合,实现了上述作用,并得到了非常好的效果,为曲霉工业菌株以及丝状真菌的工程菌株构建提供重要技术平台。具体而言:本发明(1)利用cre-loxp系统对筛选标记进行回收,这样可以一直重复使用一个筛选标记;(2)利用crisrp-cas9技术,通过微同源臂介导的方式,对基因编辑的效率非常高;(3)本发明的系统能在一次转化中,同时完成对两个基因的编辑,减少了转化的次数。
20、本发明以构巢曲霉tn02a7为出发菌株,以crispr-cas9技术和cre-loxp系统为基础,设计开发了一种适合曲霉属菌株的同步双基因编辑系统,该系统在一次转化实验中,能同时实现两个基因的编辑,其中利用crispr-cas9技术对靶基因进行敲除,cre-loxp系统与高表达的基因组成修复模板,在微同源臂(30bp)的引导下整合在敲除基因的位置,实现高效的基因敲除和定点的dna片段整合。结果显示,该基因编辑技术具有高效和准确的特征,在随机选择的独立转化子中,预测位置全部实现了基因编辑,准确率为100%。利用上述建立的基因编辑系统,对构巢曲霉细胞中的还原性tca(rtca)途径及产生草酸和柠檬酸的两条支路途径上的的五个关键基因进行了有效的编辑,最终得到了一株代谢工程菌株zq07。通过摇瓶液体发酵方法比较了构建的工程菌株zq07和对照出发菌株zq01的苹果酸产量,大约提升了9倍。
21、虽然传统的同源重组策略方法需将包括两段同源臂(长度约1000bp)、组成型的强启动子、目标基因的开放阅读框(orf)及筛选标记五个片段融合在一起,复杂的过程以及低靶向性阻碍其发展,本发明双基因编辑系统仅仅依靠30bp左右的微同源臂就能将上述片段插入到靶点位置,并且通过实验表明,依托本发明中的crispr-cas9系统,该整合效率很高,在实施例中随机挑选多个转化子,经过验证发现挑选的转化子均成功进行靶基因的敲除和目标基因的过表达,由此认为该系统的基因编辑效率为100%。
22、本发明基于cre-loxp系统和crispr-cas9技术介导的双基因编辑系统满足多轮基因编辑的需求,并且相较于随机插入,该系统能定点整合所要过表达的片段,能有效地避免因为随机插入导致的表型的缺失甚至有关基因功能的丧失。同时,该系统的基因编辑效率很高,在150μl的原生质体中共转入4μg sgrna和5μg修复模板,得到将近1000个转化子。随机挑选了5个转化子进行诊断pcr验证均显示出修复模板的正确整合,这表明仅仅依靠30bp的微同源臂就能在构巢曲霉中实现修复模板的整合。实际上该双基因编辑系统也可用于对曲霉属的其他物种甚至其他丝状真菌的基因编辑。
23、本发明通过两轮基因编辑,成功的对构巢曲霉rtca途径的四个基因oaha、pyc、cexa和mdhc进行编辑,得到两株菌株zq03和zq05。通过增强rtca途径只能实现苹果酸的胞内积累或者苹果酸的少量积累,并不能在构巢曲霉中实现苹果酸的大量产出。进一步地,通过对构巢曲霉的c4-二羧酸转运蛋白的编码基因dcta进行编辑,实现了构巢曲霉中苹果酸产量显著提高。尽管该产量依旧低于黑曲霉和米曲霉,但是实验结果表明,构巢曲霉具备大量积累初级代谢产物的潜力。这也是首次证明构巢曲霉通过改造具备产生相对丰量的苹果酸的能力。有益效果:与现有技术相比,本发明具有以下优点:
24、本发明成功构建了crispr-cas9和cre-loxp技术体系,完成一次转化实现同步敲除一个基因和高调另一个基因的双基因编辑系统,并通过cre-loxp技术进行营养标记pyroa的重复利用,从而实现多基因的连续编辑。
25、本发明所建立的体系能够成功应用于构巢曲霉细胞中的还原性tca(rtca)途径及产生草酸和柠檬酸的两条支路途径上的的五个关键基因的编辑,可以完成曲霉工程菌株副产物基因的敲除,主产物基因的高调,并回收筛选的营养标记,为构建合成生物学生产食品和药品的其它丝状真菌提供底盘细胞提供应用技术。
26、具体而言:(1)本发明系统中整合了cre-loxp使得筛选标记可以连续使用,解决了现有技术中缺乏有效的筛选标记,导致多基因编辑无法完成。(2)由于丝状真菌具有很强的非同源dna修复能力,目的基因编辑效率不高且脱靶发生造成非目的基因的编辑的副作用;本发明系统中的crispr-cas9在供体dna中加入了微同源臂,增加了定点编辑的准确性,测试的转化子全部完成了定点编辑。(3)本发明整个系统的设计使得高调b基因放在a基因敲除的位置,它们在同一位点发生且通过一次转化就可完成,解决了多基因编辑经常需要多次转化完成造成费时费力,效率低下是合成生物学的限速因子的问题。
27、本发明在构巢曲霉中成功表达人源密码子优化的cas9蛋白,并基于建立的crispr-cas9和cre-loxp双基因编辑系统,在菌株tn02a7-cas9(zq01)中通过三轮转化,对其相关的5个基因进行编辑:副产物生成相关的两个基因oaha和cexa进行敲除,对rtca途径上相关的三个基因pyc、mdhc和dcta进行过表达,最终得到一株构巢曲霉的工程菌株zq07。在摇瓶发酵条件下其l-苹果酸产量相较于背景菌株,其产量增加近9倍。
- 还没有人留言评论。精彩留言会获得点赞!