一种ω-转氨酶突变体及其编码基因与应用
本发明涉及生物工程,尤其涉及一种ω-转氨酶突变体及其编码基因与应用。
背景技术:
1、手性胺是许多生物活性化合物、农用化学品和精细化学品的手性砌块。在过去的几十年里,可持续地、有效的手性胺合成方法取得了重大的进展,包括传统的金属催化化学还原反应,以及由亚胺还原酶/胺脱氢酶、转氨酶、单胺氧化酶和裂解酶等催化的酶促方法。生物催化法在生产手性胺产品的化学合成中具有吸引力,因为其中温和的反应条件,避免使用潜在污染的金属催化剂和较低的环境影响。转氨酶介导的不对称还原胺化反应,具有高立体选择性和最大理论产率100%等优点,是一种应用广泛的手性胺合成方法。ω-转氨酶(ω-ta,ec 2.6.1.x)是一种磷酸吡哆醛(plp)依赖酶,催化氨基供体(通常为丙氨酸或异丙胺(ipa))氨基可逆转移到前手性酮,酮酸,或醛生成相应的手性氨基化合物。ω-tas通常属于plp依赖酶超家族中的折叠i型和折叠iv型亚家族。ω-折叠i型(iii类转氨酶)的tas催化的底物具有多样性,但立体特异性只有(s)-选择性。(r)-ω-tas存在于折叠iv型亚家族(iv类转氨酶),其中还包括支链氨基酸转氨酶(bcat)和d-氨基酸转氨酶(daat)。(r)-ω-tas因其不对称合成(r)-胺而受到研究者的关注,因此折叠iv型plp依赖的酶是挖掘(r)-tas的关键来源。
2、ω-tas的活性形式一般是同源二聚体,活性口袋由两个单体的残基组成,位于二聚体的界面上,形成一个大口袋和一个小口袋。转氨反应遵循乒乓双双反应机制,催化中心是高度保守的赖氨酸。ω-tas严格的立体选择性使其对合成手性胺具有吸引力,但天然存在的(r)-选择性ω-tas较少,阻碍了这类产品的合成。到目前为止,只有几十个可查询的(r)-ω-tas,且大部分不能应用于产业化(r)-胺的合成。ω-tas的大口袋可以容纳一个大的取代基,如长烷基或芳基,但小口袋里往往只能容纳一个甲基,其底物范围较窄,这进一步障碍了ω-ta的应用。因此,快速、有效地获取(r)-ta具有重要意义。除了在自然界中发现的少数(r)-ω-tas外,由hohne组成的研究人员基于数据库挖掘和(r)-ω-tas序列分析,提出了经验性的决定(r)-ω-tas选择性的多个关键序列(m.s.h.jochens,k.robins,u.t.bornscheuer,rational assignmentofkeymotifs forfunctionguidesinsilico enzyme identification,nat.chem.biol.6(2010)807-813)。然而,已有的(r)-ω-tas的底物范围有限并很难结合体积庞大的底物。利用蛋白质改造的方法,如定向进化、半理性设计和理性设计等可以有效地裁剪(r)-ω-tas的活性口袋,以扩大tas底物范围,进而用于生物合成具有重要药物意义的手性胺。例如,savile等人合理设计了节杆菌ata117,开发出一个强大的(r)-选择性ata,用于不对称制备西格列汀(c.k.savile,j.m.janey,e.c.mundorff,j.c.moore,s.tam,w.r.jarvis,j.c.colbeck,a.krebber,f.j.fleitz,j.brands,p.n.devine,g.w.huisman,g.j.hughes,biocatalytic asymmetric synthesisofchiral amines from ketones applied to sitagliptin manufacture,science(newyork,n.y.)329(2010)305-309)。目前,基于数据库中已有的ω-tas,仍然很难精准的利用蛋白质工程改造选择性高、活性强的(r)-ω-tas。
技术实现思路
1、本发明的目的在于克服现有技术中存在的不足,提供一种ω-转氨酶突变体及其编码基因,并应用于微生物催化前西他列汀酮不对称合成西他列汀中间体中,以克服现有技术中自然界中存在的(r)-转氨酶稀少、难以催化长侧链底物等问题。
2、为实现上述目的,本发明通过以下技术方案实现:
3、第一方面,本发明提供了一种ω-转氨酶突变体,将如seq id no.3所示的氨基酸序列的第290位,第292位,第163位,第130位,第144位,第142位,第101位和第140位进行单位点突变或者定点半饱和突变后获得。
4、本发明提供了一种具有(r)-立体选择性的ω-转氨酶突变体,获得该ω-转氨酶突变体的筛选和改造策略包括:首先以已知的严格r选择性(r)-ω-转氨酶(pdb:5fr9)为探针,在ncbi数据库中筛选序列相似性高且三维结构模型符合折叠类型iv的plp依赖型转氨酶,以前西他列汀酮的截断(羰基侧链的短链为一个甲基)类似物为底物,催化表征数据库挖掘的ω-转氨酶,获得潜在的能够催化前西他列汀酮的候选ω-转氨酶mwta,所述ω-转氨酶mwta源自mycolicibacterium wolinskyi,其氨基酸序列如seq id no.1所示,编码基因的核苷酸序列如seq id no.2所示。通过与严格的(r)-ω-转氨酶(pdb:5fr9,其氨基酸序列如seq id no.7所示)序列比对后,确定5fr9的(r)-选择性控制的2个关键序列motif,通过片段替换技术,将如seq id no.1所示氨基酸序列第69位至81位(记为motif1,36bp)和第130位至148位(记为motif2,48bp)与(r)-转氨酶5fr9对应片段进行motif替换后获得嵌合体mwtamc,该mwtamc嵌合体的氨基酸序列如seq id no.3所示,其编码基因的核苷酸序列如seq id no.4所示,该mwtamc嵌合体首次对底物前西他列汀酮具有催化活性,且表现出严格的(r)-选择性。
5、为提高酶活,第一步将所述mwtamc嵌合体工程菌e.coli bl21(de3)/pet28b(+)-mwtamc活化并提取质粒pet28b(+)-mwtamc,并保存于-20℃。第二步通过swiss-model进行同源建模,获得嵌合体mwtamc的三维结构;然后再通过hotspot wizard预测嵌合体mwtamc的活性中心和相关的氨基酸;再通过同源模型与底物的分子对接,考察底物范围内的氨基酸。分析二种方法获得的氨基酸,确定重叠的氨基酸为突变热点,发现影响酶活的关键氨基酸位点。以pet28b(+)-mwtamc为模板质粒,通过对以上位点进行单位点突变或者定点饱和突变,获得突变质粒,并转化,获得一系列突变体,即将如seq id no.3所示的氨基酸序列的第290位,第292位,第163位,第130位,第144位,第142位,第101位和第140位进行单位点突变或者定点半饱和突变后获得的所述ω-转氨酶突变体。
6、作为优选,所述ω-转氨酶突变体是将如seq id no.3所示的氨基酸序列进行下列之一或其中两种以上的组合突变后获得:(1)第290位苏氨酸突变为丝氨酸;(2)第292位丙氨酸突变为甘氨酸;(3)第163位亮氨酸突变为异亮氨酸;(4)第130位甲硫氨酸突变为缬氨酸;(5)第144位苯丙氨酸突变为丝氨酸;(6)第142为苏氨酸突变为色氨酸;(7)第101位赖氨酸突变为精氨酸;(8)第130位缬氨酸突变为组氨酸;(9)第140位丝氨酸突变为精氨酸。
7、作为优选,所述ω-转氨酶突变体的氨基酸序列如seq id no.8或seq id no.9或seq id no.10或seq id no.5所示。
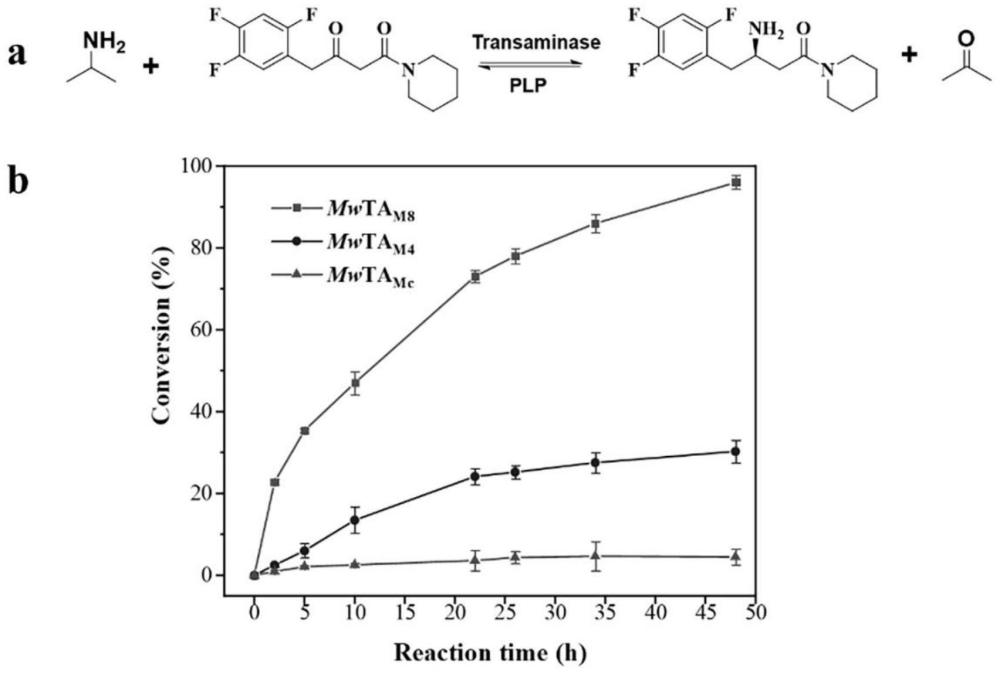
8、用邻亚二甲苯二胺作为氨基供体在转氨反应中的颜色变化(亮黄色变为黑褐色)建立高通量筛选方法,利用高通量方法对mwtamc单位点突变或者定点饱和突变后获得一系列突变体进行优势突变菌株的筛选,得到优势体,再利用气相复筛获得优势突变t290s,a292g和l163iv,接着对三个优势突变进行组合突变获得三突变体mwtam3(t290s/s292g/l163i),其氨基酸序列如seq id no.8所示。再以三突变体的重组质粒pet28b(+)-mwtam3为模板,通过对m130进行定点饱和突变,获得突变质粒,并转化。利用上述同样的高通量方法得到优势突变体,再利用气相复筛获得优势突变m130v,获得四突体mwtam4(t290s/s292g/l163i/m130v),其氨基酸序列如seq id no.9所示。以叠加饱和突变技术和高通量筛选方法及气相复筛,获得优势七突变体mwtam7(t290s/s292g/l163i/m130v/f144s/t142w/k101r),其氨基酸序列如seq id no.10所示。发现突变体mwtam7、mwtam4和mwtam3相较于其出发菌株mwtamc的比细胞活力分别提高了42.33倍、20.33倍和11.28倍。
9、进一步地,对突变体mwtam7与mwta进行序列比对,分析片段替换和分子改造后改变的氨基酸,即g69y,h70t,l73a,v77t,a78f,m130v,n132t,l133v,v135i,g140s,k141s,r142t,k143p和g144f。以pet28b(+)-mwtam7为模板质粒,通过对以上位点进行定点饱和突变,获得突变质粒并转化,获得突变体文库。利用高通量方法对mwtam7定点饱和突变文库进行优势突变菌株的筛选,得到优势体,再利用气相复筛获得优势突变v130h,s140r,w142k和s144r。接着pet28b(+)-mwtam7-v130h为模板质粒,组合叠加另外三个优势突变获得优势八突变体mwtam8(t290s/s292g/l163i/f144s/t142w/k101r/v130h/s140r),其氨基酸序列如seq id no.5所示。八突变体的比细胞活力是七突变体的6.44倍。
10、作为优选,所述ω-转氨酶突变体的氨基酸序列如seq id no.8所示,其构建方法包括以下步骤:将ω-转氨酶的氨基酸序列的第69至81位和第130至148位,与(r)-ω-转氨酶的氨基酸序列中的对应序列进行片段替换后获得氨基酸序列如seq id no.3所示的ω-转氨酶嵌合体,将所述ω-转氨酶嵌合体的氨基酸序列的第290位苏氨酸突变为丝氨酸,第292位丙氨酸突变为甘氨酸,第163位亮氨酸突变为异亮氨酸,其中所述ω-转氨酶的氨基酸序列如seq id no.1所示,所述(r)-ω-转氨酶的氨基酸序列如seq id no.7所示。
11、作为优选,所述ω-转氨酶突变体的氨基酸序列如seq id no.9所示,其构建方法包括以下步骤:将ω-转氨酶的氨基酸序列的第69至81位和第130至148位,与(r)-ω-转氨酶的氨基酸序列中的对应序列进行片段替换后获得氨基酸序列如seq id no.3所示的ω-转氨酶嵌合体,将所述ω-转氨酶嵌合体的氨基酸序列的第290位苏氨酸突变为丝氨酸,第292位丙氨酸突变为甘氨酸,第163位亮氨酸突变为异亮氨酸,第130位甲硫氨酸突变为缬氨酸,其中所述ω-转氨酶的氨基酸序列如seq id no.1所示,所述(r)-ω-转氨酶的氨基酸序列如seq id no.7所示。
12、作为优选,所述ω-转氨酶突变体的氨基酸序列如seq id no.10所示,其构建方法包括以下步骤:将ω-转氨酶的氨基酸序列的第69至81位和第130至148位,与(r)-ω-转氨酶的氨基酸序列中的对应序列进行片段替换后获得氨基酸序列如seq id no.3所示的ω-转氨酶嵌合体,将所述ω-转氨酶嵌合体的氨基酸序列的第290位苏氨酸突变为丝氨酸,第292位丙氨酸突变为甘氨酸,第163位亮氨酸突变为异亮氨酸,第130位甲硫氨酸突变为缬氨酸,第144位苯丙氨酸突变为丝氨酸,第142为苏氨酸突变为色氨酸,第101位赖氨酸突变为精氨酸,其中所述ω-转氨酶的氨基酸序列如seq id no.1所示,所述(r)-ω-转氨酶的氨基酸序列如seq id no.7所示。
13、作为优选,所述ω-转氨酶突变体的氨基酸序列如seq id no.5所示,其构建方法包括以下步骤:将ω-转氨酶的氨基酸序列的第69至81位和第130至148位,与(r)-ω-转氨酶的氨基酸序列中的对应序列进行片段替换后获得氨基酸序列如seq id no.3所示的ω-转氨酶嵌合体,将所述ω-转氨酶嵌合体的氨基酸序列的第290位苏氨酸突变为丝氨酸,第292位丙氨酸突变为甘氨酸,第163位亮氨酸突变为异亮氨酸,第144位苯丙氨酸突变为丝氨酸,第142为苏氨酸突变为色氨酸,第101位赖氨酸突变为精氨酸,第130位缬氨酸突变为组氨酸,第140位丝氨酸突变为精氨酸,其中所述ω-转氨酶的氨基酸序列如seq id no.1所示,所述(r)-ω-转氨酶的氨基酸序列如seq id no.7所示。
14、进一步优选,所述ω-转氨酶突变体的氨基酸序列如seq id no.5所示,其编码基因的核苷酸序列如seq id no.6所示。
15、第二方面,本发明提供了一种含有编码所述的ω-转氨酶突变体的基因的重组载体或基因工程菌。
16、第三方面,本发明提供了所述的ω-转氨酶突变体在微生物催化前西他列汀酮不对称合成西他列汀中间体中的应用。
17、所述应用的方法为:将ω-转氨酶突变体重组表达的工程菌经诱导培养获得的湿细胞作为催化剂,以2g/l前西他列汀酮为底物,以1m异丙胺为氨基供体,以100mm三乙醇胺(tea)-hcl缓冲液(ph 7.5),1mm磷酸吡哆醛(plp)为辅酶,100g/l湿细胞和10%(v/v)dmso助溶剂为反应介质构成转化体系,在30~40℃、600~800rpm(优选30℃、800rpm)条件下进行反应,定期取样检测底物和产物的浓度。
18、进一步优选,所述湿细胞按如下方法制备:将含ω-转氨酶突变体的工程菌接种到含终浓度50μg/ml卡那霉素的lb液体培养基中,37℃培养10h,获得种子液;将种子液以体积浓度1.0%的接种量接种到新鲜的含终浓度50μg/ml卡那霉素的lb液体培养基中,37℃、180rpm培养2h(od600=0.6-0.8),培养液中加入终浓度为0.1mm异丙基硫代半乳糖苷(isopropylβ-d-thiogalactoside,iptg),28℃培养12h后,4℃、8000rpm离心10min,获得含ω-转氨酶突变体蛋白的湿菌体。
19、纯酶按如下方法制备:将含ω-转氨酶嵌合体及突变体的湿菌体以50g/l的量重悬于含0.1mm plp的ph 7.5、50mm pb缓冲液中,在冰水混合物上超声破碎30min,超声破碎条件:振幅50%,破碎1s、暂停2s,取破碎混合液,8000rpm,4℃下离心10min,收集上清液,通过0.45μm膜微过滤后,获得粗酶液,采用镍亲和柱(1.6×10cm,bio-rad公司,美国)纯化突变体蛋白,具体操作如下:①用缓冲液a(含300mm nacl、20mm nah2po4、0.1mm plp、ph 7.5)进行预平衡;②以1.0ml/min的流速将粗酶液上样至镍亲和柱;③用缓冲液a以1.0ml/min的流速洗去未结合的杂质,直至电导率稳定;③然后用缓冲液b(含300mm nacl、20mm nah2po4、50mm咪唑、0.1mm plp、ph 7.5)洗去非特异性结合的杂蛋白脱;③再用缓冲液c(含300mmnacl、20mm nah2po4、500mm咪唑、0.1mm plp、ph 7.5)洗脱、收集目标蛋白。将收集的洗脱液用含0.1mm plp的20mm pb缓冲液(ph 7.5)透析过夜,取截留液,即为ω-转氨酶的纯酶液。
20、与现有技术相比,本发明具有以下有益效果:
21、本发明构建的ω-转氨酶嵌合体mwtamc对底物前西他列汀酮第一次出现催化活性,且表现出严格的(r)-立体选择性。针对mwtamc的酶活改造,获得一系列优势突变菌株。突变体mwtam3、mwtam4、mwtam7和mwtam8的比细胞活力较过表达嵌合体的菌株mwtamc分别提高了11.28倍、20.33倍、42.33倍和278.48倍。其中,嵌合体和突变体催化2g/l前西他列汀酮时,底物转化率由mwtamc的4.5%提高到mwtam4的30.3%,以及mwtam8的95.6%。最佳优势突变体mwtam8基本实现了2g/l前西他列汀酮的全转化,具有一定的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!