一种新型重组C因子及其制备方法和应用与流程
本发明属于内毒素检测领域,具体公开了一种新型重组c因子及其制备方法和应用。
背景技术:
1、细菌内毒素,又称为“热原”,是革兰氏阴性菌细胞壁上的特有结构。细菌在存活状态时不释放出来,只有当细菌死亡自溶时才释放到细胞外,表现多种毒性作用。微量的内毒素进入机体将会出现发热、血压降低、寒颤、内毒素败血症等一系列临床反应,因此内毒素快速定量检测,对临床对症治疗具有很深的现实意义。
2、鲎试剂是由海洋节肢动物鲎的血液变形细胞溶解物制成的无菌冷冻干燥品,含有能被微量细菌内毒素和真菌葡聚糖激活的凝固酶原,凝固蛋白原,是从栖生于海洋的节肢动物"鲎"的蓝色血液中提取变形细胞溶解物,经低温冷冻干燥而成的生物试剂,能够准确、快速地定性或定量检测样品中是否含有细菌内毒素和(1,3)-β-葡聚糖。鲎试剂被广泛用于制药、临床以及科研等领域的细菌内毒素和真菌葡聚糖检测。能够用于鲎试剂生产的仅有美国鲎和中国鲎两种,对应的鲎试剂分别称之为lal(limulus amoebocyte lysate)和tal(tachypleus amebocyte lysate),二者反应原理及功效基本相同。
3、但是,鲎试剂只能通过收集鲎血淋巴生产,使得海洋中鲎的数量逐渐减少,随着生物制药和疫苗等生物制品企业迅速增长,定量内毒素检测试剂的需求越来越大。并且由于受国家政策影响,内毒素检测试剂所用原料鲎(tal及圆尾鲎)被列为国家二级保护动物,意味着内毒素检测试剂原料将受到严格管控。所以,建立一套不依赖鲎生物进行细菌内毒素检测的快捷、高效的补充替代方法尤为重要。
4、鲎凝血c因子(limulus clotting factor c)是鲎血细胞中的一种对内毒素敏感的丝氨酸蛋白酶原,在内毒素介导的鲎血凝集系统反应中,它可以被内毒素激活而启动整个鲎血细胞中的血凝级联系统。它的结构中包括羧基端的典型丝氨酸蛋白酶结构域、表皮生长因子样结构域、凝集素样结构域、富半胱氨酸以及富脯氨酸等各种结构域。
5、随着鲎资源的逐渐减少和重组技术的发展,新一代重组c因子(recombinationfactor c,rfc)内毒素检测法重磅登场。2020版药典已正式引入重组c因子法,并于2020年12月30日正式生效。其消除了对鲎血的需要,与经典的鲎试剂内毒素检查方法相比,rfc内毒素检测法具有更高的特异性,更好的专属性、精密度、准确度、线性范围及定量限。
6、目前已有专利(cn103290054a)将中国鲎c因子基因整合到杆状病毒基因组中,制备含中国鲎c因子的重组杆粒。但该专利中rfc蛋白在细胞内表达,不利于后续检测。另外,rfc蛋白对内毒素极其敏感,会受内毒素影响而被激活,此过程不可逆。因此在纯化过程中引入过量内毒素会导致rfc蛋白被激活,进而无法作为c因子法检测的供体(试剂材料)被应用。同时,cn103290054a专利文献中采用wb(western blot,蛋白免疫印迹)法检测rfc蛋白表达,操作繁琐耗时长。
技术实现思路
1、针对现有技术不足,本文公开了一种新型重组c因子及其制备方法和应用。
2、本发明包括以下技术方案:
3、本发明公开了一种新型重组c因子,含有如1)-4)中任一项所述的氨基酸序列:
4、1)如seq id no.1所示的氨基酸序列;
5、2)在seq id no.1所示的氨基酸序列的n端和/或c端连接信号肽和/或标签得到的融合蛋白质的氨基酸序列;
6、3)与将seq id no.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质的氨基酸序列;
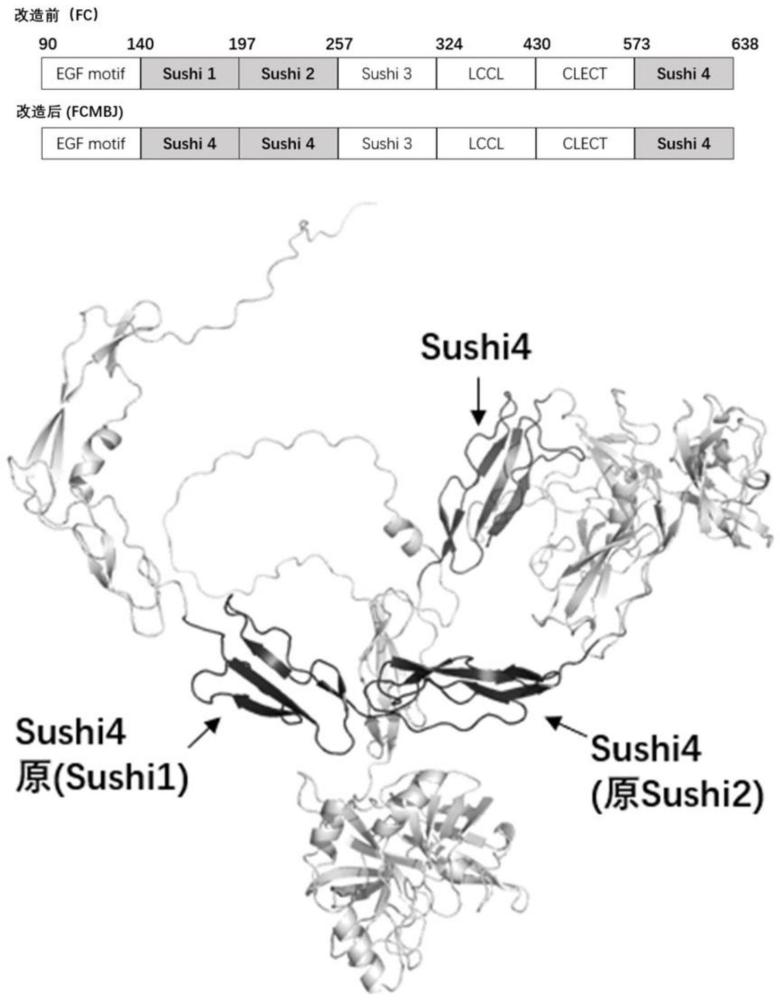
7、4)与seq id no.1所示的氨基酸序列相似度在95%以上的,并具有相同功能的蛋白质的氨基酸序列。
8、(1)进一步的,上述一种新型重组c因子,所述重组c因子的氨基酸序列如seq idno.2所示。在蛋白序列n端添加信号序列帮助蛋白穿膜分泌表达至胞外,在c端添加6×his-tag便于重组蛋白的检测和亲和纯化。
9、本发明还公开了一种生物材料,包括a)-d)中任一项的生物材料,
10、a)含有编码如seq id no.1或2所示氨基酸序列的核酸分子;
11、b)含有a)中所述核酸分子的重组载体;
12、c)含有a)中所述核酸分子或含有b)中所述重组载体的重组微生物;
13、d)含有a)中所述核酸分子或含有b)中所述重组载体的重组细胞。
14、本发明还公开了上述重组c因子或生物材料在制备内毒素检测试剂或试剂盒中的用途。
15、进一步的,本发明还公开了一种内毒素检测试剂或试剂盒,包括如权利要求1-2任一项所述的重组c因子或权利要求3所述的生物材料。
16、进一步的,本发明还公开了新型重组c因子的制备方法,其特征在于,包括以下步骤:对现有鲎凝血c因子序列进行改造,维持轻链区原有序列不变,将重链中的sushi1、sushi2区替换为轻链中的sushi4区。
17、进一步的,上述新型重组c因子的制备方法,其特征在于,包括以下步骤:
18、1)合成表达seq id no.1所示氨基酸序列的核苷酸序列;
19、2)选择pfastbac-dual为载体,在bam hi,eco ri酶切位点之间插入目的基因,构建pfastbac-dual-factor c载体;
20、3)经转化后通过蓝白斑筛选方法获得重组质粒;
21、4)重组质粒转染sf9细胞后,获得p1、p2代病毒,通过sds-page确认蛋白rfc-mbj的表达情况;
22、5)rfc-mbj蛋白的纯化:通过ni-nta亲和层析纯化。
23、本发明还公开了检测上述新型重组c因子(rfc-mbj)活性的方法,所述方法为底物荧光法。
24、本发明还公开了一种内毒素检测试剂或试剂盒,包括如seq id no.2所示的新型重组c因子以及缓冲溶液,所述缓冲溶液含有碳酸胍、辅酶a和triton x-100。
25、进一步的,上述内毒素检测试剂或试剂盒,所述缓冲溶液中含有50mm tris,100mmnacl,ph 8.0,1mm coa,5mm碳酸胍,1%triton x-100。
26、本发明具有以下有益效果:
27、1)本发明对现有rfc-mbj序列进行改造,维持轻链区原有序列(功能域)不变,将重链中的sushi1、sushi2区替换为轻链中的sushi4区。在不改变factor c整体结构及功能域的前提下降低蛋白自身的自由能,使蛋白自身更稳定,也提高了结合底物能力,设计出改造蛋白rfc-mbj。
28、2)本发明围绕rfc-mbj建立完整的昆虫细胞表达体系,在蛋白序列n端添加信号序列使目的蛋白在胞外表达,更利于后续检测及纯化。
29、3)本发明建立一种低内毒素的rfc-mbj纯化方法,可得到纯度高于90%的rfc-mbj蛋白。
30、4)本发明建立一种特定的检测方法,通过添加碳酸胍、辅酶a、triton x-100,可以简便快捷的提高c因子蛋白检测的灵敏度。
- 还没有人留言评论。精彩留言会获得点赞!