基于荧光RAA技术检测PEDVM基因的方法及应用与流程
本发明属于病毒检测,具体涉及一种基于荧光raa技术检测pedv m基因的方法及应用。
背景技术:
1、猪流行性腹泻病毒(porcine epidemic diarrhea virus,pedv)是一种主要感染猪类的冠状病毒,pedv感染可引起仔猪急性腹泻和呕吐,导致仔猪的高死亡率,对全球养猪业造成严重损失。据流行病学调查结果显示,我国大部分猪场都使用了tgev-pedv二联疫苗(基于cv777),但pedv的检出率仍然较高,说明疫苗不能针对现有的流行毒株提供有效的免疫保护。因此,为了及早发现感染病例并采取有效的控制措施,快速、便捷的检测方法显得至关重要。
2、目前,常见的检测方法有pcr、rt-pcr、荧光rt-pcr、elisa等,但是这些方法各具有一定的缺陷,例如pcr、rt-pcr、荧光rt-pcr具有高度敏感性,能够检测病毒核酸,但高度依赖荧光pcr/pcr等仪器,这导致无检测设备的养殖场无法使用该方法,不适应用临床推广;elisa可以检测抗体,但特异性和灵敏度有限,同时也需要配备相应的酶标仪才能完成结果判读。重组酶介导核酸等温扩增(recombinase-aid amplification,raa)技术能够在37~42℃的恒温条件下于30min内快速完成扩增。与传统的pcr经过变性、退火、延伸三个步骤进行的扩增相比,raa的扩增避免了变性过程,缩短了反应时间,且在恒温环境下即可反应,无需pcr仪器提供的温度梯度。有望实现不依赖pcr仪器支持,使之成为小型养殖场等场景中广泛应用的技术。
3、部分研究人员对利用重组酶介导核酸等温扩增技术对检测猪流行性腹泻病毒的方法进行了研究,例如cn113930547b专利公开了一种猪流行性腹泻病毒n基因的rt-raa荧光法检测引物对、试剂盒及检测方法;cn110283938b专利公开了一种pedv和pdcov的双重rt-raa检测引物组、试剂盒及应用。但值得关注的是,目前暂未检索到基于重组酶介导核酸等温扩增技术检测猪流行性腹泻病毒m基因的方法,并且目前针对pedv的分子检测技术,都需要提取病毒核酸作为扩增的模板,增加了检测的时间和操作难度。
技术实现思路
1、有鉴于此,为了解决现有pedv的分子检测技术的所存在的检测时间长、操作难度大等技术问题,提升pedv的检测灵敏度和特异性,本发明提出了一种猪流行性腹泻病毒荧光raa检测方法、检测试剂及应用,该方法具有操作简单,检测时间短,灵敏度高,特异性好的特点。
2、本发明的目的之一在于提供一种基于荧光raa法检测猪流行性腹泻病毒的组合物。
3、为实现上述目的,本发明采用以下技术方案:
4、基于荧光raa法检测猪流行性腹泻病毒m基因的组合物,所述组合物包括上游引物、下游引物和探针;所述上游引物的核苷酸序列如seq id no:13所示;所述下游引物的核苷酸序列如seq id no:4所示;所述探针的核苷酸序列如seq id no:16所示。
5、pedv的基因组由正链单股rna组成,基因组包括至少7个开放阅读框(orfs),分别编码4种结构蛋白,分别为纤突蛋白s、小膜蛋白e、膜糖蛋白m和核衣壳蛋白n。m基因和n基因通常被认为具有较高的保守性。但不同pedv毒株之间的n基因序列略有差异,强毒和弱毒之间差异较大,lee c等人在《genetic differentiation of the nucleocapsid protein ofkorean isolates of porcine epidemic diarrhoea virus by rt-pcr basedrestriction fragment length polymorphism analysis》中证实,临床分离株和疫苗毒株的n基因存在一定程度的差异。与n基因相比,不同pedv毒株之间的m基因却很保守,不同冠状病毒间m蛋白同源性较低,因此m基因具备良好的保守性和特异性。这意味着pedv m是更为理想的分子检测靶标。基于对pedv基因组的深刻理解,本研究以m基因作为pedv分子检测的目标,利用m基因序列的保守性来设计特异性引物和探针,用于pedv的检测和分析。
6、进一步,所述探针的5’-端采用fitc进行修饰,3’-端采用c3 spacer进行修饰,中间/thf/间隔及bhq修饰。
7、本发明的目的之二在于提供一种基于荧光raa法检测猪流行性腹泻病毒m基因的试剂盒。
8、为实现上述目的,本发明采用以下技术方案:
9、基于荧光raa法检测猪流行性腹泻病毒m基因的试剂盒,所述试剂盒包含前述基于荧光raa法检测猪流行性腹泻病毒m基因的组合物。
10、进一步,所述试剂盒还包括阳性对照、阴性对照和/或反应缓冲液。
11、进一步,所述阴性对照为depc水。
12、本发明的目的之三在于提供一种基于荧光raa法检测猪流行性腹泻病毒m基因的方法,本发明采用病毒核酸释放剂(免核酸提取)替代常规核酸提取过程,结合荧光raa检测技术,特异性检测pedv,操作更简化,同时缩短检测时间。
13、为实现上述目的,本发明采用以下技术方案:
14、基于荧光raa法检测猪流行性腹泻病毒m基因的方法,所述方法为非疾病诊疗目的的方法;所述方法包括如下步骤:
15、(1)采用免核酸提取技术处理待测病毒样本,获得样本提取液;
16、(2)以步骤(1)获得的样本提取液为扩增模板,利用前述组合物和/或前述试剂盒进行进行raa扩增反应;
17、(3)根据raa扩增结果判断待测样本中是否含有猪流行性腹泻病毒。
18、进一步,步骤(1)中,将所述待测病毒样本与样品核酸释放剂1:1体积比混合,获得样本提取液;所述样品核酸释放剂为trishcl、nacl、mgcl2、nonidet p-40、rnaseinhibitor和dtt的混合溶液。
19、作为优选,所述病毒核酸释放剂由50~60mm trishcl、120~140mm nacl、1.0~1.5mm mgcl2、0.5%(v/v)nonidet p-40(1.06g/ml)、1000u/ml rnase inhibitor和1mmdtt组成。
20、进一步,所述raa扩增的反应条件为:39℃预热1min;39℃扩增,30s为1个循环并采集荧光信号,共40个循环。
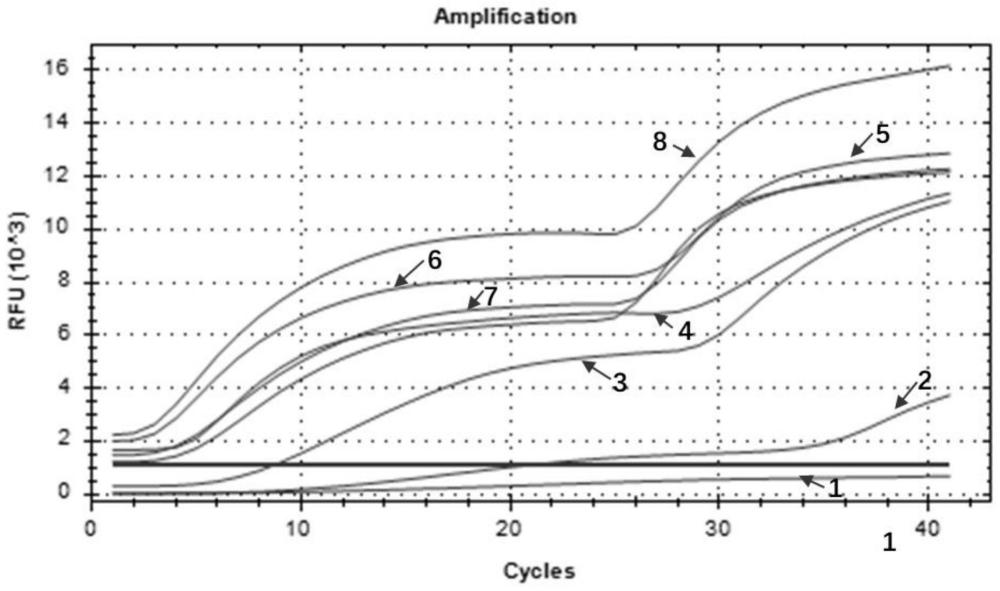
21、进一步,模板浓度在8.86×1010~8.86×100copies/μl范围内,所述方法具有较高的灵敏度。
22、进一步,raa反应的反应温度优选35℃~41℃,反应时间为21min。
23、进一步,所述raa扩增的反应体系为50μl体系,包括:a buffer 25.0μl、上游引物2μl、下游引物2μl、探针0.6μl、depc水12.9μl、标准质粒5μl、b buffer 2.5μl。
24、进一步,所述上游引物、下游引物、探针的浓度均为10μm。
25、进一步,待测样本包括粪便样本、组织样本、pedv细胞培养病毒液和/或pedv疫苗毒株样本。
26、进一步,结果判定标准如下:在阴性对照无扩增曲线,阳性对照出现扩增曲线的前提下,若无扩增曲线,待测样品为猪流行性腹泻病毒阴性;若出现扩增曲线,待测样品则为猪流行性腹泻病毒阳性。
27、本发明的目的之四在于提供一种前述组合物在制备用于检测猪流行性腹泻病毒m基因的检测试剂或试剂盒中的应用。
28、本发明的有益效果在于:
29、1.本发明提出的检测方法是基于免核酸提取技术,适用于常温下对病毒样本进行处理。与现有核酸提取方法相比,省去了蛋白酶k水解和过柱纯化等步骤,大大缩短了整个检测环节时间;同时避免了操作过程中因样本转移导致的交叉污染和核酸丢失现象,提高了检测结果的准确性。
30、2.本发明设计的引物对和探针具有更高的特异性性和扩增效率。实验结果显示,在荧光raa反应中,f6/r1引物能够产生明显的扩增曲线,其ct值<10。这表明f6/r1引物在pedv荧光raa检测方法中表现出了良好的扩增效率。这种高效率的扩增使得该方法能够迅速且准确地检测到pedv核酸,为早期诊断提供了重要的优势。
31、3.本发明方法具有较低的检测限。结合荧光raa检测试剂盒,最低检测限达到了8.86×100copies/μl,突显了该方法在扩增效率方面的优势。表明f6/r1引物对与pedv核酸的高度特异性结合,实现了高灵敏的检测,有助于检测低病毒载量样本,提高了该方法的实用性。
32、4.本发明方法具有良好的温度范围适用性。实验结果显示,在35~41℃的温度范围内,该检测方法均表现出良好的效果。这说明该方法在不同温度条件下都能够可靠工作,为实验条件的选择提供了更大的灵活性,这在不同实验室和环境中都具备广泛应用的潜力。
33、5.本发明方法具有良好的特异性。本发明选择pedv的m基因作为检测靶标,设计的引物和探针表现出良好的特异性。这确保了只有pedv核酸能够实现扩增,而不被其他病毒和细菌的核酸干扰。这是该方法成功的重要因素之一,为其在pedv检测领域的应用提供了可靠性和准确性。
34、6.本发明方法具有良好的重复性。经过3次重复试验的验证,每次试验都观察到明显的扩增曲线。这表明建立的荧光型raa扩增检测技术在扩增反应的重复性方面表现出良好的一致性。这增加了实验结果的可信度,强调了该方法的稳定性和可靠性。
- 还没有人留言评论。精彩留言会获得点赞!