一种DNA链置换反应介导的时序性荧光编码的高维度成像标签及其应用
本发明涉及生物领域,尤其涉及一种dna链置换反应介导的时序性荧光编码的高维度成像标签及其应用。
背景技术:
1、自然界复杂万千的生命体中,每一个细胞都不是一座孤岛,它们存在于特定的组织器官中、行使着各自独特的功能,并且在其生命周期内与其周围环境相互作用、相互影响1。一个典型的组织微环境中包含很多执行特定功能的细胞,如起辅助和杀伤作用的t细胞、起免疫应答作用的b细胞、起杀伤作用的nk细胞、起抗原递呈作用的树突状细胞和起吞噬作用的巨噬细胞等,除了细胞以外,复杂的组织微环境中还存在细胞外基质,包裹有成纤维细胞,贯穿着许多血管和淋巴管等。因此,在空间层面全面探讨组织微环境中的细胞机制和生物学过程至关重要。
2、空间蛋白成像技术使用抗体、多肽、适配体等试剂靶向组织微环境,通过检测试剂上修饰的酶、荧光、金属或dna序列等信息进行成像和定量。其中,基于酶促色素沉积的免疫组织化学技术(简称免疫组化)是最经典的成像手段,该技术利用酶作为标记物,并采用底物被分解后的显色反应显示抗原抗体的结合与否,染色结果用普通光学显微镜的明场模式即可观察2,3。然而,肉眼可分辨的不同颜色在叠加之后会产生新的颜色(例如黄色与蓝色的靶标重合后会变成绿色);浅颜色与深颜色的叠加会导致前者被后者的深度所覆盖4;并且多种颜色的叠加可能使某些区域不透光,影响光学成像5。以上这些限制使得免疫组化一次只能成像2-3个且定位不同的靶标6。
3、荧光具有独特的激发波长和发射波长,即便定位重叠也可以被各自独特的荧光通道所检测,因此基于荧光团为检测信号的免疫荧光技术不受限于靶标的空间定位,成像更加灵活。作为蛋白可视化的一种经典工具,免疫荧光技术具有操作简便、成本低、定位准确等优点,已被广泛应用于蛋白质形态、定位及相互作用的观察与分析。然而,若两种荧光团的光谱相距较近,则彼此之间可能存在光谱重叠的情况,这限制了免疫荧光一次成像的靶标数量不能太多(≤5),无法满足研究日渐复杂与深入的科学研究。为了减少光谱重叠带来的困扰,一方面,研究者们尝试寻找光谱更窄的荧光染料。哈佛大学seok-hyun yun团队发展出超窄波的荧光试剂,可以实现小于1nm的光谱带宽,并验证了10种不互相干扰的染料。不足之处是所合荧光标签的尺寸在微米量级,难以与纳米量级的抗体偶联7。另一方面,研究者们尝试使用类似于流式技术中采用的光谱拆分和算法补偿来区分更多的荧光8。例如,美国akoya公司使用数学方法纠正光学检测器件由于荧光重叠造成的检测误差,将光谱精准拆分成7色9,10至9色11染色信号。ronald n germain课题组基于高光谱方法,通过利用具有不同激发和发射光谱的荧光团、先进的仪器和能够补偿光谱重叠的方法,实现多达21个通道的单次复用成像12。然而,高光谱成像所得信号强度低于单独荧光通道检测的荧光强度。此外,高光谱图片的分析需要借助复杂的机器学习解码,随着高光谱成像数量的增加,光谱解析难度大幅度增加,因此能成像的靶标数量较难突破。
4、为了进一步提高荧光成像的数量,研究者尝试通过反复迭代“染色-洗脱-再染色”步骤的方式,在一张片子上按照一定顺序成像不同的靶标,最后将所得图片叠加,赋予不同靶标以伪彩,绘制成完整的多重靶标图像,上述过程被称为“迭代荧光成像”,本质是多次免疫荧光结果的叠加。由于每次成像都有f种荧光出现的可能,迭代n次则可成像f×n种蛋白,随着成像次数的增加,成像的蛋白数量会逐步增多,理论上能成像的蛋白数量无上限。在“染色-洗脱-再染色”的迭代过程中,通过热、微波等方式与化学试剂联用将抗体移除是“洗脱信号”最直接的方式。在一项新的研究中,来自瑞士苏黎世大学的研究人员开发出一种分析细胞及其组分的新方法,即迭代间接免疫荧光成像(iterative indirectimmunofluorescence imaging,4i)。该技术利用0.5m l-甘氨酸、低ph及高盐离子的组合去除抗体,使得在从组织到细胞器的不同水平下同时观察至少40种蛋白13。由于每次都将抗体移除,因此上一轮实验所用抗体的种属不会影响下一轮实验,可以用二抗进行荧光成像,从而提高荧光强度。然而,因为抗原抗体识别是不可逆的共价结合,洗脱较为困难,对样本损害也较大。荧光淬灭是另一种迭代成像信号的洗脱方式,常见的淬灭方式包括通过强激发光淬灭的“光漂白”[如melc(multi-epitope ligand cartography)技术]14,通过化学试剂氧化荧光团的“化学漂白”[如ibex(iterative bleaching extends multiplexity)技术15和mxif(multiplexed fluorescence microscopy)技术16],以及光和化学试剂同时作用的“联合漂白”[如cycif(cyclic immunofluorescence)技术17和t-cycif(tissue-basedcyclic immunofluorescence)18技术]。其中,光漂白引发的荧光淬灭的速度相对较慢;化学漂白利用化学氧化灭活荧光染料,需有氧化剂的参与,可能会对样本造成损害。正如前文所言,无论是光漂白还是抗体移除,对样本的损害都比较大。为了减小迭代过程对样本造成的损害,近些年研究者们尝试在抗体与荧光之间加入可以被温和切断的linker用于多重蛋白成像。郭嘉团队提出了一种以叠氮基为主的小分子量linker,该linker可以在30min被tcep切断,获得图像的信噪比高达20:1,作者证明了该技术在成像12个蛋白的可行性20。ralphweissleder课题组提出了一种基于对称反式环烯的切割速度更快的linker,该linker可以在数秒内被切断。并且由于切断是通过生物正交反应实现的,具有生物相容性,可以用于活细胞的蛋白成像。作者将该化学切断方式与迭代荧光成像技术结合,实现了对14种靶标的成像21。由于切断条件比较温和,对样本的损害比较少,可以获得质量更高的图像。此外,核酸之间通过氢键相互杂交,并且可以通过调节杂交环境改变杂交状态(高盐离子浓度、低ph条件下杂交;在低盐离子浓度、高ph条件下洗脱),也是一种温和“切断”的linker,并且相比于前述linker更易获得,无需特殊的化学合成。目前,基于核酸杂交/去杂交原理发展来的迭代荧光成像技术包括codex(co-detection by indexing)22、dei(dna exchangeimaging)23、prism(probe-based imaging for sequential multiplexing)24等。由于抗体在与荧光链杂交之前不发光,在实际操作过程中可以通过“all-in-one”的方式将所有抗体都染上,以节省抗体孵育时间。得益于dna信号放大技术的成熟,利用dna杂交/去杂交进行迭代荧光成像不仅可以增加多重蛋白成像的数量,还可以进一步提高成像的灵敏度25-29。目前该技术可以稳定成像30~50种蛋白22,然而,随着成像数量的增加,实验对偶联dna的正交性要求越来越高,反应也愈发复杂。此外,该技术在抗体上偶联的dna尺寸相较于普通荧光团更大,可能会影响抗体自身的性能,尤其是当成像数量增加或者对dna进行信号放大之后,影响会更加显著。
5、不同于荧光标签的检测,采用质谱对金属标签进行检测可以达到很高的标签分辨率,即便两个金属元素之间的相对分子质量只相差1da也能被轻易地分辨出来;并且自然界中金属种类多,在抗体上标记金属标签可以表征生物样品更多蛋白质的空间分布;且组织中一般没有金属的存在,可以避免组织自发荧光的干扰。基于该原理,近年来发展了基于元素质量分辨的多路离子束成像技术(multiplexed ion beam imaging,mibi)30和组织质谱成像技术(imaging mass cytometry,imc)31。两种技术均采用偶联了不同金属标签的抗体对组织切片进行免疫染色,之后利用高精度扫描探头对样本进行逐点烧蚀,并将产生的气溶胶送入质谱仪中进行元素分析,最后利用计算机将所得数据重构出不同金属元素对应的蛋白分布图片,通过检测同位素的含量,即可推测该区域中被标记的蛋白含量。二者最大的区别在于样本电离方式(即对应烧蚀源),imc采用紫外激光对样本进行烧蚀,而mibi采用离子束对样本进行烧蚀。由于紫外激光的光斑相较于离子束更大,因此imc的分辨率相对于mibi更低一些,前者分辨率大约为1μm,而后者分辨率可达260nm,近年来发展的高分辨mibi(hd-mibi)更是将mibi的分辨率提升到了30nm32。相比于传统的基于荧光标签的多重免疫成像,组织质谱成像系统具有通道多、无串色、背景低以及数据质量高等技术优势。已有大量的发表在高影响力杂志的文章报道了利用组织质谱成像系统进行肿瘤免疫微环境、干细胞以及肌肉组织等相关领域研究33。目前imc和mibi也已分别被美国fluidigm公司和美国ionpath公司收购并实现了商业化。然而目前质谱成像技术还存在以下不足:1)成像数量的提升空间有限:目前质谱成像最多只能实现40种蛋白的同时成像34,35,虽然仪器配有100种元素的通道,但是有些通道对应的是生物体中已存在的元素、有些金属元素非常稀缺、有些元素难以纯化到足够的纯度。2)使用门槛高:金属同位素标记成本高、质谱成像仪器昂贵、操作难度大,操作人员需经过专门的培训并且具备免疫组化方面的专业知识。3)通道可能受到氢化物、氧化物、氢氧化物和氰化物以及其他同位素杂质的污染,需要识别和补偿。4)金属通过一种螯合物直连于一抗上,缺少类似于二抗的信号放大效果。
6、上述无论是荧光标签或金属标签,其标签数量始终是有限的,因而对应的成像数量也较为有限。不同于此,基于dna标签进行多重蛋白成像的方式将蛋白信息转化成了dna信息,后者本身具有超强的编码能力(一些基于荧光标签进行多重蛋白成像的技术也涉及dna,但此类技术仅将dna作为一个反应载体,并未利用到其特定的核酸序列信息,因而仍归纳为荧光标签)。在技术的实现上,此类技术通常是空间转录组技术的延伸,将对mrna的空间成像转变成对偶联了dna的抗体进行空间成像。10x genomics visium是目前使用最经典的空间转录组技术,该技术将冰冻组织切片放置在10x genomics visium芯片的捕获区域内进行he染色和成像,之后对组织切片进行透化处理以释放细胞内的mrna,释放的mrna被芯片上带有oligo-dt的探针捕获(每个探针都带有特异性的位置标签),然后以mrna为模版进行cdna合成、并提取cdna-mrna复合物用于文库制备和二代测序读数。测序结果除了获得基因表达信息以外,还能获得其对应的位置坐标的信息37。2022年a.regev将该技术与蛋白成像相结合,提出了sm-omics技术38,其蛋白染色步骤与传统免疫染色一致,区别之处在与所用抗体上偶联有包含polya尾的dna序列,这个序列随后同mrna一样经历杂交、逆转录和测序步骤。然而作者最后仅验证了6个蛋白与空间转录组的共成像。2020年樊荣课题组提出了一种与10x genomics visium相反的空间转录组技术dbit-seq(deterministicbarcoding in tissue for spatial omics sequencing),二者最大的区别在于“打位置标签”的方式,前者是将mrna释放到位置标签上,使位置标签主动捕获mrna,可能存在捕获效率不足的情况;而后者是将位置标签通过微流控管道输送的方式“运送”到指定位置,因此不再受限于捕获效率39。dbit-seq技术将带有50个平行微通道的聚二甲基硅氧烷(pdms)微流体芯片放置在孵育了dna-抗体的组织片上,以引入第一组dna条码,x1-x50,其中每个条形码都带有一个连接接头和一个oligo-dt序列,用于结合抗体dna的poly-a尾部;原位进行逆转录产生与条形码x1-x50共价连接的cdna后移除该微流控芯片,再将具有与第一个芯片通道垂直的微流控芯片放置在组织片上,以引入第二组dna条形码,y1-y50,随后连接条形码x和y,生成二维数组的空间条形码xiyj;最后从组织中提取出这些条形码并进行pcr扩增、文库构建和ngs测序,再以计算方式重建空间表达图。dbit-seq在发展之初可以对全转录组和22个蛋白进行同时编码39,后进一步扩充蛋白成像数量至273个40,目前该技术也已实现商业化。然而目前dbit-seq所获图片的分辨率较小(10-50μm),难以分辨单细胞,更难以分辨组织形态。总体而言,基于dna标签编码的空间蛋白成像技术是一个十分出色的技术,理论上成像的蛋白数量无上限。但是目前该技术仍存在以下不足:1)成像分辨率十分有限(10-50μm),难以分辨单细胞,更难以分辨组织形态。2)测序本身存在准确性不足、成本高、复杂性等问题,并且空间成像的测序质量不如悬液,因为标签捕获过程/样本转移过程或多或少都有信息损失。3)推广性差:该技术涉及到众多复杂的技术过程,难以在普通实验室推广使用。例如dna芯片制作需要特殊的芯片打印设备、测序需要专人用专门的仪器操作;4)成本高:目前做一次空间转录测序的市场报价约2-5万不等,加之蛋白成像需要额外消耗的高昂抗体费用,实验过程中使用的各种生物酶(逆转录酶、聚合酶、连接酶等),总费用达10万以上;5)实验周期长:在确保各流程不出错的情况下,全流程的完成仍需花费至少半个月的时间。
7、综上所述,在同一组织片上实现超多重蛋白的共成像仍是一个重要并且亟待解决的关键技术难题。现有的多重蛋白成像技术无论是样本类型的兼容性、捕获区域的大小、还是可检测靶标蛋白的数量上有各有优劣势。整体而言,荧光→金属→dna所能成像的数量越来越多,但随之成本、操作复杂性也进一步提升,难以在普通实验室推广使用。本领域的技术人员致力于开发一种可以在普通实验室推广使用的超多重蛋白成像技术。
技术实现思路
1、有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是如何开发一种可以在普通实验室广泛推广使用的超高维度蛋白成像技术。
2、在现有的多重蛋白成像技术中,荧光成像是最容易推广的技术,然而传统的荧光标签只有颜色单一检测维度,若延续传统荧光检测思路,很难大规模提高成像数量。
3、本发明提供了一种dna链置换反应(dna strand displacement,dsd)介导的时序性荧光编码的高维度成像标签,所述标签为修饰有不同荧光/淬灭团的寡核苷酸片段按照一定顺序排列组合而成的杂交体,可随着链置换反应的进行切换不同的颜色。
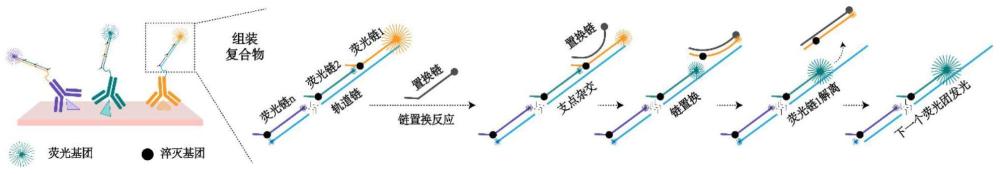
4、本发明的成像标签基于dna链置换反应的编码荧光标签,借助dna链置换反应来切换颜色的新型时序编码荧光标签,在荧光团颜色维度的基础上引入了时间维度,即单个蛋白不再对应单种荧光团,而是对应一串随时间发生颜色改变的“荧光串”(图1)。
5、假设共有f种不同颜色的荧光团参与成像,t次时序变化则可以有ft种不同的编码。例如,5种荧光团按时序变化6次,就可以编码1.56(56)万种蛋白,几乎涵盖了蛋白组库的所有蛋白。优选地,所述荧光基团的个数为2-10个,优选3-6个。
6、在本发明的一种具体实施方式中,所述杂交体包括一条轨道dna链、n条荧光dna链和n条dna置换链,轨道链和n条荧光链互补配对,依次加入的n条置换dna链用于启动dna链置换;所述每个荧光dna链的5’端分别修饰了不同颜色的荧光基团,3’端包含一个用于启动链置换的游离序列及距离末端7-8nt的用于淬灭邻近荧光链的淬灭基团。
7、在本发明的一种具体实施方式中,所述荧光dna链和置换dna链中的n分别为2-10,优选为3-6。
8、在本发明的一种具体实施方式中,所述置换链上设有可将所置换荧光链上的荧光基团淬灭的淬灭基团。
9、本发明的借助dna链置换反应(dna strand displacement,dsd)来切换颜色的新型时序编码荧光标签,简称dsd barcode。其原理如图2所示,dsd barc ode由一条长的轨道链和一系列短的荧光链相互杂交而成,其中,每个荧光链头部(5’端)分别修饰了不同颜色的荧光团,距尾部(3’端)7-8nt处修饰了一个用于淬灭邻近荧光链的淬灭基团,故在初始杂交状态下,只有荧光链1发光。随着与荧光链1完全互补配对的淬灭链的加入,荧光链1被置换,其邻近荧光链2的荧光得以释放、颜色切换得以发生。同时,置换链上设有可将所置换下荧光链淬灭的淬灭基团,无需额外的洗涤去除荧光。反应依次进行,则可以发生一系列的颜色变化,使用者只需更改对应位置上的荧光团,便可得到不同的颜色变化时序。值的注意的是,为了充分利用dsd barcode,其轨道链的5’端也被修饰了荧光基团,在最后一个荧光链被置换之后发光,因此n次颜色切换只需要n-1条荧光链的参与。
10、作为本发明的一种优选实施例,本发明提供了一种三色变化的dsd barcode(图3),包括轨道链、荧光链1、荧光链2、置换链1和置换链2;所述荧光链的5’端分别修饰了不同颜色的荧光基团,3’端包含一个用于启动链置换的游离序列及距离末端7-8nt的用于淬灭邻近荧光链的淬灭基团;所述置换链的3’端连接有淬灭基团。
11、在一种具体的实施例中,轨道链探针序列如seq id no.1所示;荧光链1探针序列如seq id no.2所示;荧光链2探针序列如seq id no.3所示;置换链1探针序列如seq idno.4所示;置换链2探针序列如seq id no.5所示。
12、轨道链探针序列如seq id no.1所示,
13、5’-agtgaacaggctgcaaatagcacgcacgtgaa-3’;
14、荧光链1探针序列如seq id no.2所示,
15、5’-ttcacgtgcgtgctatgtatctg-3’;
16、荧光链2探针序列如seq id no.3所示,
17、5’-ttgcagcctgttcactgtatgac-3’;
18、置换链1探针序列如seq id no.4所示,
19、5’-cagataccatagcacgcacgtgaa-3’;
20、置换链2探针序列如seq id no.5所示,
21、5’-gtcatacagtgaacaggctgcaa-3’。
22、优选地,添加荧光基团和淬灭基团的序列如下:
23、轨道链探针序列,
24、5’-/fluorophore/agtgaacaggctgcaaatagcacgcacgtgaa-3’;
25、荧光链1探针序列,
26、5’-/fluorophore/ttcacgtgcgtgctat/quencher/ggtatctg-3’;
27、荧光链2探针序列,
28、5’-/fluorophore/ttgcagcctgttcact/quencher/gtatgac-3’;
29、置换链1探针序列,
30、5’-cagataccatagcacgcacgtgaa/quencher/-3’;
31、置换链2探针序列,
32、5’-gtcatacagtgaacaggctgcaa/quencher/-3’。
33、本实施例是时序编码的概念验证,在该实施例中,3种荧光团按时序变化3次,可以编码27(33)种蛋白。理论上,进一步增加荧光团和时序变化次数可以进一步提高编码。
34、本发明中,所述荧光基团为fam,tet,joe,hex,tamra,rox,texas red,lc red640,lc red705,5-iaf,6-tet,bis,荧光素-5-马来酰亚胺,5-fitc,磺胺罗丹明g,荧光素及其盐,6-fam,6-tritc,5-tamra,6-tamra,6-cr6g,5-fitc,5-fam,6-fam,罗丹明b,罗丹明6g,amc,af488、cy3或cy5中的任意一种;
35、本发明中,所述淬灭基团为bhq0、bhq1、bhq2、bhq3、tamra、dabcyl中的任意一种。
36、本发明第二方面提供一种用于检测蛋白高维度成像的组合物,所述组合物由待检测蛋白的抗体与权利要求1-6任一项所述的dna链置换反应接到的时序性荧光编码的高维度成像标签偶连而成。
37、在本发明的一种具体实施方式中,所述组合物用于检测待测蛋白质成像时所用检测仪器为荧光显微镜。
38、本发明第三方面提供所述dna链置换反应介导的时序性荧光编码的高维度成像标签以及上述组合物在空间蛋白成像技术中的应用。
39、在本发明的较佳实施例1中,详细说明使用荧光分光光度计验证颜色切换原理可行性的过程;
40、在本发明的另一较佳实施例2中,详细说明dsd barcode与抗体的偶联与组装过程;
41、在本发明的另一较佳实施例3中,详细说明dsd barcode-抗体用于细胞骨架蛋白成像及经历的颜色变化。
42、在本发明的另一较佳实施例4中,详细说明dsd barcode用于细胞爬片中不同靶标的成像。
43、本发明有益的技术效果如下:
44、1.提出了一种可以用于超高维度蛋白成像的时序荧光编码探针概念。对荧光基团进行时序编码,极大提高了成像蛋白的数量。
45、2.相应设计出一种设计简单、合成方便、反应速度快、无需酶催化、无需额外洗涤的dna探针用于概念验证。
46、3.所用检测仪器为荧光显微镜,可以在普通实验室大规模普及。
47、以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
48、以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
- 还没有人留言评论。精彩留言会获得点赞!