基于LAMP检测水稻白叶枯病病原菌的引物组及试剂盒的制作方法
本发明属于植物病原微生物检测,具体涉及基于lamp检测水稻白叶枯病病原菌的引物组及试剂盒。
背景技术:
1、水稻(oryza sativa l.)是世界上最重要的作物之一,同时也是一半以上人口的主食(fahad et al., 2014)。据2019年联合国粮农组织统计的数据,全球水稻年种植面积1.6亿公顷,年产量为7.5亿吨,其中90%以上来自亚洲国家(faostat)。在中国,有着悠久的种植历史,截至2020年统计数据,水稻的种植面积和产量仅次于玉米,是中国第二大粮食作物(中国统计年鉴2020年)。然而,水稻病害(包括细菌性、真菌性和病毒性)是限制水稻产量的重要因素之一,关于水稻病害胁迫在世界各地都有报道,特别是在亚洲,如中国、韩国和日本(sy cho et al., 2013; kim et al., 2011; le et al., 2010; yang et al.,2013),这些病害可导致20-70%的产量损失(fahad et al., 2014)。
2、水稻白叶枯病(bacterial leaf blight,blb)是由一种革兰氏阴性细菌(xanthomonas oryzae pv. oryzae (xoo)病原菌引起(lee, chung, kang, chung, &lee, 2016)。病原体最初通过水孔和伤口进入植物,一旦进入维管系统,白叶枯病菌将产生不规则的黄色波浪边缘病变,浸泡直至堵塞木质部筛管,造成水稻苗期萎蔫,在后期可导致叶茎枯萎,最终导致产量下降(shen & ronald, 2002; zhang et al., 2020)
3、快速有效的水稻病害检测和防治是水稻保产的关键。目前,关于水稻病害检测方法:包括常规pcr诊断法(song et al., 2014),荧光免疫检测法(awaludin et al.,2020)、抗原抗体检测法(ding, liu, wu, zhou, & ni, 2014; wang et al., 2006)、显微观察法(deng, li, jian, ji, & zhou, 2013)、生物接种法((li, li, dong, wang, &zhou, 2011) )、qrt-pcr(cho et al., 2013; xu et al., 2017)。虽然这些方法可以检测水稻病害,但也存在不足。例如,生物接种法费时费力,显微观察法对设备的依赖较高,且需要经过专门培训的人员。免疫学方法通常需要制备特异的抗体,周期往往较长。qrt-pcr虽然具有高灵敏度和高特异性,但检测设备昂贵,需要专业人员操作。
4、近年来,随着等温扩增技术发展,环介导的等温扩增(lamp)以其灵敏度高、特异性强、速度快、设备要求低等优点在核酸诊断中得到广泛应用(becherer, borst, bakheit,frischmann, & methods, 2020)。lamp 在水稻病害检测中也有报道(le et al., 2010;zhou, du, fan, & zhou, 2012)。使用lamp检测水稻白叶枯病原菌,能在1小时内完成,灵敏度为10 am,但还需设计高特异性的lamp检测引物,方能实现在田间现场对水稻病害的快速准确诊断。
技术实现思路
1、有鉴于此,本发明期望提供基于lamp检测水稻白叶枯病病原菌的引物组及试剂盒,能够以水稻白叶枯病病原菌xoo基因为靶基因,设计并筛选获得能够特异性检测白叶枯病的lamp引物组及检测试剂盒,灵敏度高,特异性强,操作简便,耗时短,成本低,可实现在田间现场水稻病害快速诊断。
2、为达到上述目的,本发明的技术方案是这样实现的:
3、基于lamp检测水稻白叶枯病病原菌的引物组,包括xo1321 lamp引物组或xo2967lamp引物组。
4、进一步地,所述xo1321 lamp引物组包括:正向内引物fip、反向内引物bip、正向外引物f3、反向外引物b3、正向环引物lf和反向环引物lb,碱基序列如下:
5、fip:5′-tgatggaccagatgcgaagcaacggaaaaggtggcatcgg-3′;
6、bip:5′-agtcatacgccaggttggtcgttgcagacggcgaatgtg-3′;
7、f3:5′-ggctgcagtcacagtgtt-3′;
8、b3:5′-tcgtcgttctcgcatttgg-3′;
9、lf:5′-gcttccagtctgcctggtata-3′;
10、lb:5′-cctgggtgcggtagttgga-3′。
11、进一步地,所述xo2967 lamp引物组包括:正向内引物fip、反向内引物bip、正向外引物f3、反向外引物b3、正向环引物lf和反向环引物lb,碱基序列如下:
12、fip:5′-agcgcgcagctgatctgccacgaagctgtagcgcaag-3′;
13、bip:5′-atgcgtgtccagctcgcggcgtgccgtactggtcga-3′;
14、f3:5′-cacgccatcggtctgtg-3′;
15、b3:5′-cacggcatgccgttctg-3′;
16、lf:5′-tggggtgttttgtggtattgc-3′;
17、lb:5′-gtgcggcaaacgaaaagcg-3′。
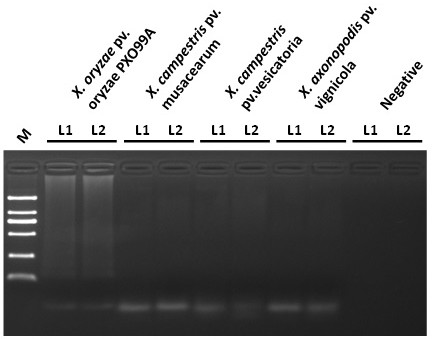
18、这里,本发明以水稻白叶枯病病原菌xanthomonas oryzae pv. oryzae pxo99a(xoo)基因为靶基因,设计并筛选获得能够检测白叶枯病的lamp引物组,通过环介导等温扩
19、增法特异性检测水稻白叶枯病病原菌xanthomonas oryzae pv. oryzae pxo99a。
20、本发明还另外提供了基于lamp检测水稻白叶枯病病原菌的试剂盒,包含所述的xo1321 lamp引物组和/或xo2967 lamp引物组。
21、进一步地,上述试剂盒包括10 µm fip/bip primer,10 µm lf/lb primer,10 µmf3/b3 primer。
22、这里,10 µm指引物浓度规格:10 µm/µl。
23、进一步地,上述试剂盒还包括10 xthermol buffer,100 mm mgso4,1mm dntp,8000 u bst larger fragment polymerase。
24、进一步地,所述试剂盒的反应体系为25µl,包括2.5µl 10 xthermol buffer,1.5µl 100 mm mgso4,3.5µl 1m mdntp,2µl 10 µm fip/bip primer,1µl 10 µm lf/lbprimer,0.5µl 10 µm f3/b3 primer,1µl 8000 u bst larger fragment polymerase,1µldna模板,超纯水定容至25µl。
25、这里,所述dna模板浓度应不小于20ng/µl,即样本起始投入量至少20ng,所需样本量少,灵敏度高。
26、进一步地,所述试剂盒的检测对象为水稻幼苗或水稻种子提取的核酸样本。
27、进一步地,使用所述试剂盒进行lamp反应,反应条件为65℃孵育40min。
28、进一步地,使用所述试剂盒进行lamp反应,根据反应液颜色变化判断检测结果。
29、这里,使用上述试剂盒进行lamp反应,操作简便,设备要求低,而且耗时短,成本低,结果可视化,实现在田间现场水稻病害快速诊断。
30、本发明有益效果如下:1)本发明方法以水稻白叶枯病病原菌xoo基因为靶基因,设计并筛选获得能够特异性检测白叶枯病的lamp引物组,特异性强;2)本发明方法进一步利用该特异性lamp引物组建立检测水稻白叶枯病病原菌的试剂盒,灵敏度高,设备要求低,而且操作简便,耗时短,成本低,结果可视化,可实现在田间现场水稻病害快速诊断。
- 还没有人留言评论。精彩留言会获得点赞!