一种用于高通量筛选鉴定肿瘤特异性抗原的方法
本发明涉及肿瘤特异性抗原筛选,更具体地说是涉及一种用于高通量筛选鉴定肿瘤特异性抗原的方法。
背景技术:
1、目前,癌症患者的标准治疗方法仍然是手术切除结合放化疗。然而,无论是放化疗手段或药物往往会使肿瘤组织和正常组织同时受损,进而导致患者产生严重的副作用。因此,能够特异性杀死肿瘤组织细胞的靶向药并减少毒副作用已成为当今肿瘤治疗面临的新挑战。肿瘤免疫疗法因其应用范围广、毒副作用小、疗效显著等优势而受到人们日趋关注。癌症免疫疗法有效的基本前提是肿瘤内存在功能性的、抗原特异性的t细胞。肿瘤新抗原定向治疗是一种有前途的策略,如癌症疫苗和过继t细胞疗法等,旨在激活宿主的抗肿瘤免疫,形成肿瘤抑制微环境,从而特异性根除癌细胞。肿瘤新抗原免疫应答反应本质上是抗原分子被主要组织相容性复合体mhc-i类分子递呈至肿瘤细胞表面并被t细胞所识别时,会引发抗肿瘤的免疫应答。由此可见,肿瘤新抗原的筛选与鉴定对肿瘤免疫治疗具有重要意义[1]。
2、肿瘤特异性抗原实质上包括两类:一类称为neoantigen,是由于氨基酸突变导致(体细胞基因由于理化、环境等因素诱发或自发突变诱导,经非同义点突变、插入缺失、基因融合和移码突变等方式产生的新抗原);另一类是可以称为癌睾抗原(cancer-testisantigen,cta),是由于原来的组织限制性表达基因在肿瘤中出现异位表达激活。癌睾抗原也称为肿瘤特异性抗原(tumor-specific antigen,tsa),是指仅在某些肿瘤细胞表面表达而不存在于正常细胞上的新抗原(能够有效区分肿瘤细胞和正常细胞),在肿瘤细胞中表达时会诱导免疫反应[2-4]。在正常细胞中,tsa基因的表达因启动子高甲基化而被沉默;而在肿瘤细胞中,tsa基因启动子往往呈低甲基化(dna hypomethylation)特征,导致其表达被重新激活[2-4]。例如,tsa基因mage-a3在正常睾丸中选择性表达,但在癌症中因dna低甲基化而过表达[5]。靶向癌睾抗原magea3的dna适体ap52已被证实能有效抑制多种肿瘤细胞的生长[3]。
3、目前,研究人员已经提出了多种识别肿瘤新抗原的方法,然而这些现有的方法仍有其自身的不足[6]。首先,既往的肿瘤新抗原的高通量筛选方法都是用于鉴定和发现氨基酸突变产生的新抗原,此类肿瘤新抗原往往只有1个或数个氨基酸的改变,所以很难被发现;其次,筛选方法往往步骤繁多、耗时长且成本高[7,8]。传统常用的血清学筛选重组cdna表达文库(serex)和基于hla结合肽的鉴定等筛选方法(因工作量大、耗时长,且效率极其低下);sanger一代测序方法(代价大,耗时长,难以开展深度测序);质谱分析(传统方法,高成本和过度依赖样品纯化质量);其他方法选择使用高通量测序数据与亲和算法工具相结合来预测肿瘤新抗原,如pvac seq和tsafinder(假阳性率很高,导致后期验证成本的巨大浪费)[9]。
4、因此,如何提供一种新的用于高通量筛选鉴定肿瘤特异性抗原的方法是本领域技术人员亟需解决的问题。
技术实现思路
1、有鉴于此,本发明提供了一种用于高通量筛选鉴定肿瘤特异性抗原,特别是癌睾抗原的方法。
2、为了实现上述目的,本发明采用如下技术方案:
3、一种用于高通量筛选鉴定肿瘤特异性抗原,特别是癌睾抗原的方法,过程包括:
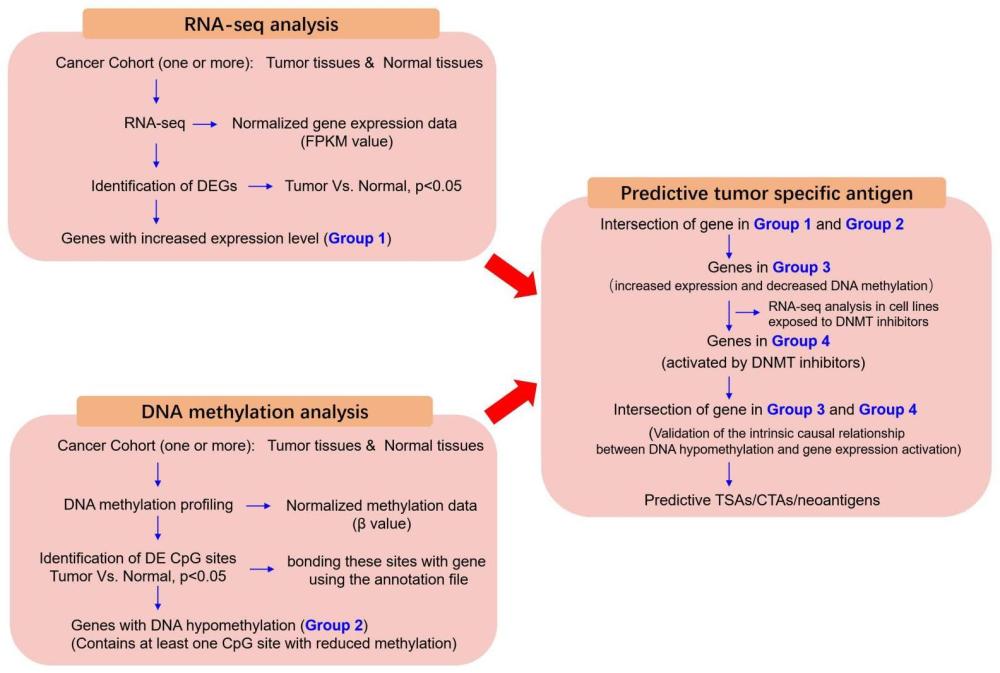
4、1)收集肿瘤组织样本中癌组织和癌旁组织,提取组织样本rna和dna;对rna测序,计算每个基因的表达水平,用标准化后的fpkm值表示;同时,以亚硫酸氢钠bsp修饰处理dna以明确甲基化修饰位点,并进行dna甲基化图谱测定,每个cpg位点的dna甲基化水平使用标准化后的β值;rna-seq数据及步dna甲基化分析数据可以是自测数据,也可以利用网上的开源数据,但必须保证肿瘤类型一致;关于样本:rna-seq数据的样品与dna甲基化芯片数据的样本可以是不同的独立队列也可以是同一个队列,但必须保证肿瘤类型一致;
5、2)比较癌组织和癌旁组织之间fpkm值的差异,筛选癌组织和癌旁组织之间表达变化显著的基因,在癌组织中显著上调的基因列为group 1;
6、3)比较癌组织和癌旁组织之间β值的差异,筛选癌组织和癌旁组织启动子甲基化变化显著的基因cpg位点;根据illumina humanmethylation450k芯片注释文件对所有cpg对应的基因进行注释,将含有至少1个cpg位点甲基化水平在癌组织中显著下调的基因列为group 2;
7、4)取group 1与group 2中基因的交集,记为group 3;
8、group 3中的基因即为候选肿瘤特异性抗原,可直接用于后续的亲和算法分析或后续免疫原性相关的实验验证(通过生物信息学软件预测候选突变位点抗原肽与hla-ⅰ亲和力,筛选出亲和力最高的抗原肽;最后合成抗原肽,在体外验证新抗原免疫原性,将负载了新抗原的apc与患者的t细胞体外共培养);
9、5)为了进一步降低假阳性率,提高效率,节约时间及成本,在细胞水平中进行暴露于dna甲基化转移酶抑制剂联合rna测序实验,根据暴露于dnmt抑制剂的细胞测序分析结果,将能够被dnmt抑制剂显著上调的基因列为group 4;
10、6)取group 3和group 4的交集,即为最终高通量筛选出的肿瘤特异性抗原基因。
11、优选地,步骤1)中,肿瘤组织样本数量n>10。
12、优选地,步骤1)中,癌组织与癌旁组织数据来自于同一患者或不同患者;若来自于同一患者,则使用limmar r包筛选差异表达基因及差异甲基化cpg位点;若来自于不同患者,则需使用deseq2 r包筛选差异表达基因及差异甲基化cpg位点。
13、优选地,group 1中差异表达基因或group 2中差异dna甲基化cpg位点来源于1个队列或者来源于多个独立队列取交集。
14、经由上述的技术方案可知,与现有技术相比,本发明对转录组数据和dna甲基化数据进行联合分析,以dna甲基化芯片数据、dna甲基化转移酶抑制剂联合转录组测序筛选肿瘤特异性抗原筛选到肿瘤特异性抗原,准确度高,大大降低了假阳性率,而且本发明的应用场景并不局限于肿瘤领域,还包括其他非肿瘤领域中与免疫相关疾病抗原的筛选。
15、具体效果如下:
16、独特性:截止目前,关于肿瘤特异性抗原的高通量筛选方法主要集中在筛选氨基酸突变类tsa,而关于如何筛选癌睾抗原类肿瘤特异性抗原的方法尚未见报道。本发明率先提供了一种用于筛选癌睾抗原的新方法,此种方法可在肿瘤组织中高效筛选癌睾抗原。
17、多组学:根据肿瘤特异性抗原的定义(在正常组织中不表达,在肿瘤组织中表达再激活)及相关文献所提出的观点:肿瘤特异性抗原因其启动子dna低甲基化而出现表达再激活,本发明提出将转录组数据与dna甲基化数据进行联合分析用于发现肿瘤特异性抗原。经文献检索,此种多组学筛选肿瘤特异性抗原的方案为首创。
18、高通量:无论是转录组测序技术亦或是dna甲基化芯片数据都属于高通量筛选技术,本发明本质上是以上两项高通量技术的联合应用,因而同样具有高通量的属性。
19、低成本:与外显子测序联合转录组测序的多组学技术相比,本方案假阳性率更低。外显子测序用于筛选氨基酸突变类抗原,但该方案筛出的肿瘤新抗原无法排除同义突变类假抗原。此外,无论是转录组测序还是dna甲基化芯片均为成熟技术,成本较低。
20、高效性:根据抗原的特异性,肿瘤抗原可分为肿瘤相关抗原(taa)和肿瘤特异性抗原(tsa)。大量研究表明,taa的免疫特异性差,且由于多数taa属于胚胎抗原,在个体发育过程中已诱导机体的免疫耐受,不仅免疫原性弱,而且很难诱导出持久特异性免疫应答;本发明专利所筛出的癌睾抗原具有在绝大部分正常组织中几乎不表达,仅在特定肿瘤组织中呈现表达再激活的特点;如前文所述,癌睾抗原又称为肿瘤特异性抗原,本发明所筛选的结果实际上已经是候选tsa。此外,本发明是依赖于多组学数据,经过多轮重重筛选之后,最终的候选tsa的免疫原性验证率较高,假阳性率较低。
21、普遍性:本发明提供的tsa筛选方法的实际应用场景广泛,包括已知的所有肿瘤类型,可以应用于其他具有免疫相关的非肿瘤疾病模型中。
22、高兼容性:本发明提供的tsa筛选流程可与其他抗原表位与配体亲和算法(例如抗原配体组学和质谱联合技术、共享新抗原肽库法等)高度兼容。
- 还没有人留言评论。精彩留言会获得点赞!