一种基于伴侣蛋白GroEL保护的荧光金纳米簇、制备方法及其应用
一种基于伴侣蛋白groel保护的荧光金纳米簇、制备方法及其应用
技术领域
1.本发明属于荧光探针技术领域,具体涉及一种基于伴侣蛋白groel保护的荧光金纳米簇、制备方法及其在groel抑制剂筛选中的应用。
背景技术:
2.groel是一种来源于大肠杆菌的蛋白质,由两个堆叠的七聚环亚基组成桶状结构,每个亚基大小为57kda,它对新合成肽链的折叠和组装具有重要的辅助作用
1.。众所周知,天然正确折叠形成的蛋白质对生物体行使其正常的生理功能具有重要作用;然而,错误折叠的蛋白质(即非天然多肽)容易引起蛋白质聚集而失能,甚至导致危害。groel可与共伴侣分子groes(70kda的同型七聚体)协同作用,以atp依赖的方式将暴露在疏水区域的非天然多肽转移至具有疏水残基的groel空腔内;随后,atp水解导致底物释放能量,辅助新生肽链正确折叠
2.。因此,groel和groes对细菌体内蛋白质的正确折叠、最终保障其行使正常功能具有重要作用。此外,由于所有细菌中都含有至少一种(在所有条件下都必不可少的)groel同源物,所以groel对细菌的生长也至关重要。因此,开发靶向groel的抑制剂则可作为一种重要且具有广谱适用性的抗菌手段,能有效避免抗生素导致的耐药菌的产生。然而,目前对groel抑制剂的相关研究还处于初级阶段,筛选groel有效抑制剂具有重要的研究意义
3.。再则,groel因其特殊的笼状结构以及atp利用机制还可作为疏水性药物的运输机器,据报道groel可作为肿瘤药物的天然靶向载体
4.。因此,开发带有荧光标签的groel对研究其作用机制、发挥其功能,以及进一步拓展其应用均具有重要的科学意义。
3.具有较小尺寸(≤2.2纳米)的金属纳米簇(ncs)在受到适当配体保护时可发出荧光。相比于传统的荧光染料,蛋白质中的部分氨基酸(络氨酸、半胱氨酸等)残基可以作为金属离子的还原剂,允许形成稳定的、蛋白保护的金属纳米簇;而且,由于ncs的尺寸较小,一般不会明显改变蛋白质原有的二级结构和生物功能
5.。作为细菌生长的重要蛋白,groel蛋白序列上含有的络氨酸和半胱氨酸(cys)残基可作为还原剂将氯金酸还原成金原子,并以保护配体的形式将其稳定,因此可用来制备具有荧光效应的金纳米簇。利用生物大分子蛋白质合成的荧光ncs具有安全性高、生物相容性好、以及稳定性高等特点。
4.此外,将groel与病毒衣壳蛋白在大肠杆菌中共表达可以提高目标蛋白的可溶性表达,进而在离心纯化后使其可以大量分布在上清溶液中,有效提高目标蛋白的表达和纯化效率。然而,与目标蛋白分离后的groel蛋白常被视为已完成使命的废弃物而被丢弃,造成浪费。本发明利用这些废弃的groel蛋白来制备荧光金属钠米簇,不但基于废物利用提供了一种新型荧光材料auncs@groel,尤其是可以以此为荧光探针来揭示groel与其它蛋白质相互作用,并可基于所含auncs的荧光变化来筛选groel抑制剂,对深入揭示groel功能和作用机制将具有非常重要的科学意义。
技术实现要素:
5.本发明的目的在于提供一种基于伴侣蛋白groel保护的荧光金纳米簇(auncs@groel)及其在groel抑制剂筛选中的应用。利用groel蛋白制备作为荧光探针材料的荧光金纳米簇此前从未报道过,实验证明该荧光金纳米簇具有良好的荧光稳定性;而且,基于伴侣蛋白groel保护的荧光金纳米簇的groel蛋白基本保留了原有的二级结构,并在类atp酶(atpase-like)的活性测试中表现出未丧失原有的活性。因此,基于保留完好的蛋白结构和功能,利用auncs@groel良好的发光性能可用于groel抑制剂的筛选。
6.本发明首先是制备纯化后的groel溶液。首先取含有groel与rdpv质粒的大肠杆菌1~3ml,加入到含有50μg/ml卡那霉素与20μg/ml氯霉素双抗的100ml lb培养基中,37℃、220r/min过夜,再将其以1:200的体积比例接种于含上述双抗的1l lb培养基中,同时加入2g/l l-阿拉伯糖诱导菌体表达rdpv及groel,37℃、220r/min直到其od600值达到0.6~0.8,再加入100μl、1mol/l iptg,37℃、220r/min诱导表达14~16h;诱导表达后的菌种通过3000~5000r/min、25~30min离心进行收菌,然后加入8~12ml、ph7.4的pbs重悬于50ml离心管中;将得到的菌液按1:10的体积比加入裂菌液进行超声破碎,超声5s,间歇5s,超声有效时间为25~35min,超声破碎后于16000r/min离心20~30min,取上清液,加入饱和硫酸铵溶液,使上清液中硫酸铵的质量终浓度为30%;4℃搅拌1h,10000r/min离心25~35min,分离上清及沉淀,将沉淀用pbs等体积重悬,得到30%硫酸铵沉淀复溶样品;再在蔗糖密度梯度离心管中依次缓慢加入质量分数60%、50%、40%及30%的蔗糖溶液,每梯度2ml;取30%硫酸铵沉淀复溶样品加满离心管,配平后置于超速离心中,4℃、35000~40000r/min离心4h;将离心管上层groel溶液吸出,pbs透析除去蔗糖后利用akta纯化蛋白,得到纯化后的groel溶液。
7.本发明所述的一种基于伴侣蛋白groel保护的荧光金纳米簇(auncs@groel),其是在100μl groel溶液中加入haucl4水溶液,充分混匀,groel与haucl4的用量摩尔比为10~15:6;然后加入20μl、1m的naoh水溶液,充分混匀,groel蛋白解聚变性产生氨基酸将haucl4中的金离子还原成金原子;再在50~70℃下反应1.5~3.0h,反应结束后用10kda的透析袋于1
×
pbs(ph=7.4)中透析24h使蛋白复性,袋内液即为本发明所述的基于伴侣蛋白groel保护的荧光金纳米簇(auncs@groel)溶液,取出并放置于-20℃保存备用,其中groel兼具还原剂和保护配体双功能。
8.经优化得出,当groel与haucl4的摩尔比为11:6时,所制备的auncs@groel的荧光发射峰最强。经透析复性后其在380nm激发波长照射下发出发射中心在675nm处的强红光。进一步,对auncs@groel进行荧光稳定性监测,结果显示(图4):在一周的时间范围内auncs@groel均具有较好的荧光稳定性(4℃),完全可以作为稳定的荧光探针来开展进一步的研究。最后,通过比较groel与auncs@groel的红外光谱证明合成auncs@groel后,groel的二级结构并未被破坏。利用孔雀石绿法测定了auncs@groel的atp酶活性,首先将groel溶液和auncs@groel溶液用折叠缓冲液(配置100ml折叠缓冲水溶液,其中包含50mm tris ph 7.4、50mm kcl、10mm mgcl2、1mm dtt)稀释成原来体积的40%和20%。在96孔板中加入20μl稀释后的groel溶液和auncs@groel溶液、20μl
×
2mm atp溶液、120μl孔雀石绿报告液(0.034%w/v孔雀石绿、1.04%w/v钼酸铵、1%tween-20和溶于h2o的1m hcl),检测其在595nm下的吸光度
7.。结果表明:相较于groel蛋白,auncs@groel仍保留了原有的atp酶活性。
9.伊文思蓝(evans blue)为文献中报道的一种groel的一个小分子抑制剂
8.,在auncs@groel中加入终浓度10um的evans blue溶液,在37℃水浴锅中孵育30min,对混合液进行荧光监测,发现auncs@groel的荧光发生了猝灭,说明auncs@groel可以作为一种groel与其抑制剂作用的荧光探针,因而在groel抑制剂筛选中具有应用。
附图说明
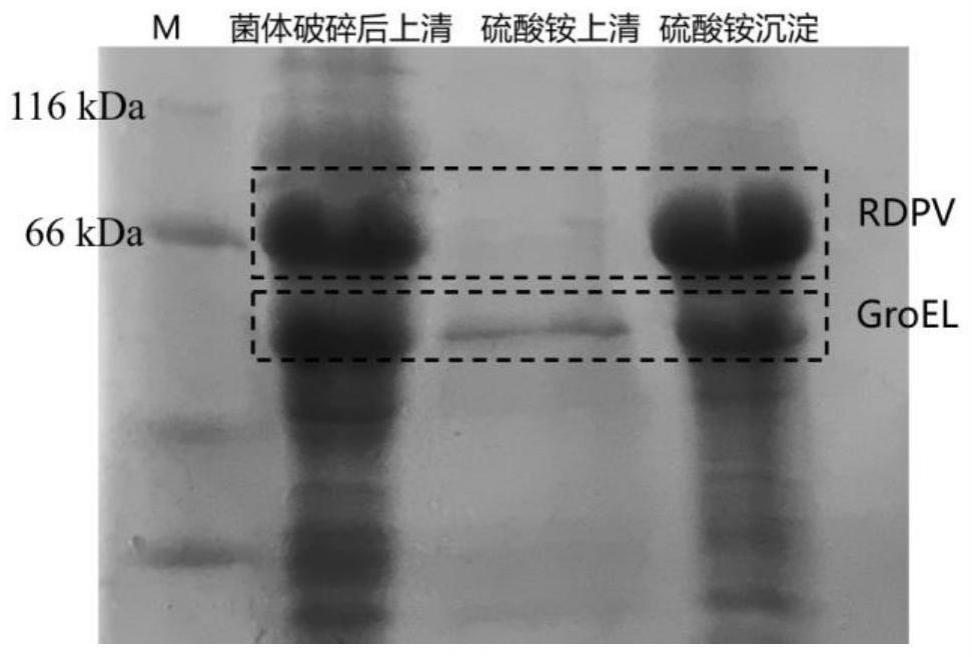
10.图1:诱导大肠杆菌共表达groel与rdpv后破碎菌体提取蛋白的sds-page电泳图,第一泳道为maker,第二泳道为超声破碎后离心的上清液,第三、四泳道分别为采用硫酸铵沉淀上清液后离心的上清液及沉淀。
11.图2:蔗糖梯度离心分离groel蛋白的蛋白分布及其sds-page电泳图,(a)为蔗糖梯度离心后的分层照片,(b)为对应分层的sds-page凝胶电泳图,groel为56kda,可见groel主要分布于第1层。
12.图3:akta纯化后的groel的sds凝胶电泳图。第一泳道为图2离心管中最上层溶液纯化后的洗脱液,第二、三泳道为纯化后的流穿液。
13.图4:在400μl groel溶液(10.4mg/ml)中加入不同浓度haucl4后所制得的auncs@groel的荧光光谱图,激发波长为380nm。
14.图5:(a)auncs@groel的透射电镜(hr-tem)图,(b)auncs@groel的晶粒尺寸分布图。对在优化的条件下制备出的auncs@groel进行形貌表征(图5a)。从图中可以看出纳米颗粒的分散性较高、且粒径较为均一(图5b)。通过对大约200个颗粒进行系统分析后发现晶粒平均尺寸为~2.94nm。
15.图6:auncs@groel在透析前后及放置一个月下的荧光变化曲线;激发波长为380nm。
16.图7:groel与auncs@groel在固态吸光度下的红外谱图。
17.图8:groel与auncs@groel按不同比例用缓冲液稀释、加入atp,在37℃下孵育45min后加入孔雀石绿报告液在595nm处的吸光度对比柱状图。
18.图9a为40%稀释的groel、auncs@groel与不加蛋白的atp折叠缓冲液加入atp溶液后在37℃下分别反应0min、5min、10min、15min、20min(由上至下)后加入孔雀石绿报告液后的照片;图9b为图9a中三种物质在不同反应时间对应的595nm处的吸光度对比曲线,利用graphpad进行非线性回归分析作图。
19.图10:auncs@groel与evans blue反应后的荧光光谱图,激发波长为380nm。
20.本发明所述的auncs@groel荧光探针,是以三水合氯金酸(haucl4·
3h2o)作为au源,groel蛋白作为还原剂和最终的配体稳定剂;其由如下所述方法和步骤制备得到:
21.将含有rdpv及groel质粒的大肠杆菌(菌种制备方法参考长春工业大学雷欢的硕士学位论文
8.),在含50μg/ml的卡那霉素及20μg/ml的氯霉素(双抗)的100ml lb培养基中培养过夜,取2ml过夜培养的菌液转入1l含上述双抗的lb培养基中继续培养,待菌种培养至一定浓度(od值0.6~0.8,约4h)后加入100μl、1m的iptg及终浓度为2g/l的l-阿拉伯糖诱导菌体表达rdpv及分子伴侣蛋白(groel),收集表达蛋白后的菌液进行破碎离心,因groel增加了rdpv蛋白的溶解性,所以groel蛋白大部分存在于破碎后的上清中。上清中再加入30%饱和的硫酸铵溶液进行盐析1h,10000r/min离心30min,通过sds-page电泳图可见groel
(56kda)存在于盐析后的沉淀中。如图1所示。
22.采用硫酸铵沉淀及蔗糖梯度超速离心法纯化蛋白,操作简单,纯化效率高。分别配置60%、50%、40%、30%蔗糖,经蔗糖梯度离心后的groel蛋白主要分布于离心管上层(见图2a中标示处)。将离心管自上而下分层提取出的蛋白进行sds-聚丙烯酰胺凝胶电泳进一步确认(见图2b标示处),电泳结果图证实groel(56kda)主要分布于离心管的第一层。将分离出的groel蛋白进一步利用akta纯化,得到纯化后的groel溶液;ds-聚丙烯酰胺凝胶电泳(见图3标示处)可以看出56kda附近分离出较纯的groel蛋白。
23.探究groel与haucl4的最佳摩尔比,如图4所示,首先在100μl纯化后的groel溶液(10.4mg/ml)分别加入5、8、10、12μl haucl4(10mm)溶液及20μl naoh(1mol/l)。在60℃下恒温反应2h后中止反应,对所得粗产品进行荧光光谱分析(λ
ex
=380nm)。结果显示:加入10μl haucl4所得到的auncs@groel荧光强度最强。从而得出groel与haucl4的摩尔比为11:6时所制得的auncs@groel的荧光强度最强。
24.采用hr-tem对在优化的条件下制备出的auncs@groel进行形貌表征(图5a)。从图中可以看出纳米颗粒的分散性较高、且粒径较为均一(图5b)。通过对大约200个颗粒进行系统分析后发现晶粒平均尺寸为~2.94nm。
25.图6为auncs@groel体系透析前后以及透析后一个月的荧光图谱,可以看出auncs@groel具有较好的荧光稳定性,在放置1个月后仍有较强的荧光强度。
26.图7为groel及auncs@groel在固态光吸收下的红外光谱,采用氟化钙片对groel及auncs@groel进行红外吸收测试,由红外吸收谱图可以看出,auncs@groel相较于groel二级结构未发生明显改变。
27.利用孔雀石绿法、以atp为底物分别对groel及auncs@groel进行酶活性测定。如果auncs@groel依然具有groel活性,它可将atp底物分解成磷酸基团(pi);磷酸根与钼酸根在酸性条件下会形成磷钼杂多酸缔合物,该复合物与孔雀石绿形成弱键复合物为显色复合物,未形成复合物的孔雀石绿在较高酸度下会褪色,而显色复合物则保持稳定,且显色复合物在595nm下具有明显的光吸收
9.。
28.测试auncs@groel稀释倍数对测定灵敏度的影响,图8为40%、20%auncs@groel及groel在37℃、孵育45min后的595nm下吸光值柱状图,可以看出20%稀释的auncs@groel及groel对测试灵敏度显著低于40%的稀释倍数。因此选用40%稀释倍数进行groel及auncs@groel的类atp酶活测试。
29.由样品在595nm下吸光度的时间曲线表明auncs@groel仍然保留了groel的atpase活性(图9)。
30.在auncs@groel中加入终浓度10um的evans blue溶液,在37℃水浴锅中孵育30min,对混合液进行荧光监测,发现auncs@groel的荧光发生了明显的猝灭(图10),说明groel与抑制剂的相互作用会引起auncs@groel的荧光发生猝灭,因此auncs@groel可以作为groel抑制剂筛选的有效荧光探针。图9和图10对应实施例7。
具体实施方案
31.以下实施例进一步说明了本发明的内容,但本发明并不局限于这些实施例。
32.本发明用到的蔗糖、tris、nacl、kcl、nahpo4·
12h2o、kh2po4、硫酸铵、乙酸、甲醇购
于上海阿拉丁试剂公司;整个实验过程中都使用去离子超纯水。
33.实施例1:
34.groel在e.coli中的表达:取含有groel与rdpv质粒的大肠杆菌(按照长春工业大学雷欢的貉细小病毒样颗粒的研究中方法制备
6.)2ml,加入到含有50μg/ml卡那霉素与20μg/ml氯霉素(双抗)的100ml lb培养基中,37℃、220r/min过夜,再将其以1:200的体积比例接种于含上述双抗的1l lb培养基中,同时加入2g/l l-阿拉伯糖诱导菌体表达rdpv及groel,37℃、220r/min直到其od600值达到0.6~0.8,再加入100μl、1mol/l iptg,30℃、220r/min诱导表达16h。
35.诱导表达后的菌种通过4000r/min、30min离心进行收菌,然后加入10ml、ph7.4的pbs重悬于50ml离心管中,标清沉淀质量。
36.实施例2:
37.groel的分离与纯化:将实施例1收好的菌液按1:10的体积比加入裂菌液(50mm tris、150mm nacl溶于1l h2o中,ph调至8)进行超声破碎,超声5s,间歇5s,超声有效时间为30min,超声破碎后于16000r/min离心25min,取上清液,加入饱和硫酸铵溶液,使上清液中硫酸铵的质量终浓度为30%。4℃搅拌1h,10000r/min离心30min,分离上清及沉淀,将沉淀用磷酸盐缓冲盐水(pbs)等体积重悬,得到30%硫酸铵沉淀复溶样品,sds-page检验破碎及粗纯的结果见图1。
38.在蔗糖密度梯度离心管中依次缓慢加入质量分数60%、50%、40%及30%的蔗糖溶液(5个试管是同样的,用于离心配平和提高groel回收量),每梯度2ml,取30%硫酸铵沉淀复溶样品加满离心管(约5~6ml,加至距离管口但不太满即可),配平后置于超速离心中,4℃、35000r/min离心4h,离心后将样品以2ml为一个分级收集样品,sds-page检测结果。
39.梯度离心及电泳图结果(图2a和b)可以看出groel主要分布于离心管的上层。将上层groel溶液吸出,pbs透析除去蔗糖后利用akta纯化蛋白,得到纯化后的groel溶液。sds-page检测纯化蛋白(图3),groel单体为56kd,电泳图显示groel被良好的分离出来。
40.实施例3:
41.auncs@groel的合成与优化:确认groel与haucl4的最佳摩尔比:
42.1、配置10mm haucl4水溶液,再取100μl实施例2纯化后的groel溶液(利用nanodrop测定groel浓度为10.4mg/ml)。
43.2、向100μl纯化后的groel溶液中分别加入5μl、8μl、10μl、12μl haucl4水溶液充分震荡混匀,加入20μl、1m的naoh水溶液振荡混匀,60℃反应2h,制备auncs@groel溶液。
44.3、将auncs@groel溶液用10kda的透析袋于1
×
pbs(ph=7.4)透析24h复性,袋内液取出并放置于-20℃保存备用。
45.4、对制备的auncs@groel进行荧光光谱分析(λ
ex
=380nm)(图4),测试后发现加入10μl haucl4所得到的auncs@groel荧光强度最强,计算得出groel与haucl4制备auncs@groel的最佳摩尔比为11:6。
46.5、将上述体系等比例扩大并按照groel与haucl4的最佳摩尔比加入haucl4,即400μl groel(10.4mg/ml)加入40.5μl haucl4(10mm),反应结束后将制备的auncs@groel用10kda的透析袋于1
×
pbs(ph=7.4)透析24h复性,袋内液取出并放置于-20℃保存备用。
47.采用hr-tem对在优化的条件下制备出的auncs@groel进行形貌表征(图5a)。从图
中可以看出纳米颗粒的分散性较高、且粒径较为均一(图5b)。通过对大约200个颗粒进行系统分析后发现晶粒平均尺寸为~2.94nm。
48.实施例5:
49.auncs@groel的荧光稳定性监测:auncs@groel在365nm的紫外灯光照射下发强红光,分别取透析前后的1ml auncs@groel加入1ml的石英池中进行荧光光谱的测试(λ
ex
=380nm),测试范围395-745nm。测试完成后将样品置于-20℃冰箱保存,1个月后取出再次取出进行荧光光谱的测试,结果表明(图6):经透析处理后的样品由于蛋白质配体复性较完善、其所保护的auncs发光稳定,说明所得到的auncs@groel具有较好的荧光稳定性。
50.实施例6:
51.auncs@groel中的蛋白结构稳定性测量:分别取200μl groel溶液及auncs@groel溶液滴加到氟化钙片上,均匀涂开,在室温下晾置30h蒸干水分,放入仪器中进行红外测试并绘制ft-ir光谱图(图7)。由ft-ir光谱图可以看出groel与auncs@groel的红外吸收光谱一致,表明auncs@groel的二级结构并未发生明显改变。
52.实施例7:
53.groel及auncs@groel的atpase活性测量:利用孔雀石绿测定groel水解atp过程中释放的无机磷酸盐。配置孔雀石绿报告液(含0.034%w/v孔雀石绿、1.04%w/v钼酸铵、1m hcl溶液和体积分数1%的tween20)。分析前将吐温20加入孔雀石绿报告液中使其质量终浓度为0.004%。atp利用折叠缓冲液(50mm trisph7.4、50mm kcl、10mm mgcl2、1mm dtt溶于蒸馏水中)稀释终浓度为2mm,groel与折叠缓冲液按体积比4:6混合配置蛋白样品,取蛋白样品20μl,groel介导的atp酶活性是通过添加20μl atp溶液启动的。groel与auncs@groel分别用折叠缓冲液稀释为原来的40%和20%(即groel和auncs@groel与折叠缓冲液按体积比4:6和2:8混合配置蛋白样品),于37℃孵育45min后加入孔雀石绿报告液,测定595nm下吸光度,结果表明(图8)20%稀释的auncs@groel及groel对测试灵敏度显著低于40%的稀释倍数。由于groel水解atp的反应比较迅速,因此在室温下连续监测不同反应时间595nm下的od值,用graphpadprism对结果进行非线性回归分析(图9)。
54.还需要说明的是,本发明的具体实施例只是用来示例性说明,并不以任何方式限定本发明的保护范围,本领域的相关技术人员可以根据上述一些说明加以改进或变化,但所有这些改进和变化都应属于本发明权利要求的保护范围。
55.参考文献:
56.[1]reddik,meghjis,nairsp,etal.(1998)13(8):1260-1266.
[0057]
[2]aokik,motojimaf,taguchih,etal.(2000)275(18):13755-13758.
[0058]
[3]stevensm,howec,rayam,etal.(2020)28(22):115710.
[0059]
[4]yuan,yi,etal.18.2(2018):921-928.
[0060]
[5]fudy,xueyr,guoy,etal.(2018)23141-23148.
[0061]
[6]雷欢.(2020).doi:10.27805/d.cnki.gccgy.2020.000261.
[0062]
[7]sivinskij,ngod,zeriocj,etal.(2022)36(3):e22198.
[0063]
[8]stevens m,abdeen s,salim n,et al.(2019),29(9):1106-1112.
[0064]
[9]徐幸福,郑日如,王彩云(2013)529-533。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1