基于3D打印技术的微针模具及其制备方法
基于3d打印技术的微针模具及其制备方法
技术领域
1.本发明属生物医学材料技术领域,涉及一种新型微针模具,具体涉及基于3d打印技术的微针模具及其制备方法。
背景技术:
2.微针概念早在20世纪90年代被提出,到目前为止,已有多种类型的微针被报道,如:中空载药微针、可溶性载药微针、包被载药微针以及可溶性双层载药微针等。微针也因其独有的优越性被广泛用于多类药物递送如小分子化药、核酸类药物和小分子蛋白药物等。现有技术常采用光刻制备微针模板,继而通过一系列方法翻制成可以直接用于微针制作的微针模具,虽然这种方法制作的微针模具精确度高,但是对仪器设备的要求也很严格,制作工艺复杂,周期较长,成本较高,且获得的微针模具种类有限,极大地限制了后期微针的发展以及推广使用。
3.3d打印是近年来的一种在二维平面上进行立体堆叠的技术,已广泛应用于建模、珠宝等多个行业,随着其三维打印精度以及速度的提高,已成功进入医学领域,实现了大到骨骼、器官,小到细胞、分子结构等模型的打印。目前3d打印精度已经达到了微米级,提示可以通过3d打印技术实现微针模型的快速获取。现有技术中,3d打印普遍使用的材料是光敏树脂,通过光敏树脂在紫外光下固化获得最终成型的模板。但是,后期研究发现模型翻制常用的材料聚二甲基硅氧烷(poly-dimethylsiloxane,pdms)在与光敏树脂的接触面无法固化成型,使得3d打印在微针模具制作领域的推广应用严重受限。
4.who调查结果显示,心脑血管疾病是导致全球疾病死亡的首要原因。目前,心脑血管疾病的主要防治措施是抗凝,抗凝药物传统给药方式主要为口服和注射,于抗凝药物而言,口服极易导致胃肠道出血,胃肠道降解及肝脏代谢同时又会使药物的利用率大大降低;注射除了会给患者带来疼痛等不适感外,还会产生大量的医疗废弃物,此外还有出血、感染、淤青等风险,而且操作不便,无法维持日常用药,而心血管疾病患者大多需要终生服用抗凝药物,这就亟需一种新的给药方式。现有技术公开了微针是指长度在100-1000μm的微型针,通过将微针有序排列在一定的载体上制成微针阵列,可有效穿过皮肤角质层触及浅表,但又不破坏真皮的血管和神经,能很好地结合注射和贴敷两种给药方式的双重释药优点,为抗凝药物经皮递送提供了一种十分有利的工具;结合3d打印技术,未来或可实现抗凝微针的个性化量身定制,在减少抗凝药物传统给药方式所带来的副作用的同时还可提高患者的依从性,方便日常用药,具有极高的社会效益和经济效益。
5.基于现有技术的现状,本技术的发明人拟提供一种新型微针模具,具体涉及基于3d打印技术的微针模具及其制备方法。本发明将有助于实现微针模具短周期、低成本制作,有效缓解有关3d打印微针发展的瓶颈。
技术实现要素:
6.本发明的目的是基于现有技术的现状,提供一种新型微针模具及其制备方法,具
体涉及基于3d打印技术的微针模具及其制备方法。
7.本发明所采用的技术方案是:应用高精度3d打印机获取微针模型,通过筛选合适的中间过渡材料,建立一种3d打印模型翻制方法并获得新模具,同时对该模具的实用性与可行性进行了验证。
8.本发明通过软件模拟及3d打印技术,通过筛选翻模中间过渡材料,制备获得了一种微针模型,本发明开发了一条全新的微针模具翻制路线,实现微针模具短周期、低成本制作,可有效缓解目前3d打印微针发展的瓶颈。
9.本发明中采用抗凝药物rgd-hirudin进一步验证了由3d打印模具制作的微针给药的可行性,结果显示,所述微针可有效穿过皮肤表层成功实现经皮药物递送而不产生明显创口的效果。本发明有助于根据实际需求实现微针模具的个性化量身定制,丰富微针种类。
10.本发明的微针模具通过下述方法制备获得,其包括步骤:
11.(1)通过软件rhino6.0对目标微针阵列模型进行三维设计,通过反复多次打印确定由打印精度引起的针体长度与针尖损失比例约为4:1;
12.(2)根据针尖损失比例以及打印系统精确度的限制,对最终的微针模型进行参数优化:微针阵列大小1cm
×
1cm,微针阵列微针数目为100个/阵列,微针长度为1000μm,微针基底中心间距为1000μm,微针立体形状为五棱锥,基于以上参数分别设计两种微针,使五棱锥底部边长分别为150μm和100μm;
13.(3)匹配合适的高精度打印系统对微针阵列模型进行打印;
14.(4)获得打印模型后,筛选中间过渡材料并确定明胶为最终的翻模材料;
15.(5)筛选合适的明胶使用浓度并确定最终浓度为12%(w/v);
16.(6)将打印模型针面朝上固定于培养皿底部,将配制的明胶提前于70℃水浴充分溶解后浇铸在打印模型上至明胶完全覆盖模型;
17.(7)将浇铸好的模型放置在70℃水浴中连同水浴一起放入恒温真空干燥箱内,真空快速除泡,使针面与明胶充分接触,之后于常温或4℃凝固,脱模,获得明胶模型;
18.(8)配制翻模试剂:pdms与固化剂按质量比10:1的比例充分混匀,水浴超声除泡后真空进一步除去剩余的气泡;
19.(9)用pdms浇铸明胶上的针孔,反复真空除泡,直至所有的针孔全部被pdms填充,之后于室温放置2-3天直至pdms固化成型;
20.(10)待pdms固化后,将整个模型一同放入55℃风箱加热在进一步固化pdms的同时使得明胶完全溶解脱离,获得pdms微针阵列模型;
21.(11)使用硅烷化试剂处理pdms微针阵列模型约15min后,将模型固定于培养皿底部,浇铸一层新配制的pdms试剂,55℃风箱放置2h以上,待pdms完全固化后即获得可直接用于微针制作的微针模具。
22.经检测结果显示:上述有关模型翻制方法可有效解决翻模材料pdms在以光敏树脂为材料的微针模型的接触面无法固化的问题,有助于成功获得新的微针模具。
23.本发明的实施例中,应用高精度3d打印机获取微针模型,通过筛选合适的中间过渡材料明胶,建立3d打印模型翻制方法,由此获得新微针模具,并应用该模具获得微针,通过将该微针应用于抗凝药物rgd-hirudin的经皮递送进一步验证新模具的实用性与可行性。
24.本发明中,对制得的微针模具进行实用性与可行性分析,其包括步骤:
25.(1)对pdms微针阵列模型和实体微针分别实施电镜扫描以检测模型翻制过程中是否有额外的针尖损失;
26.(2)以rgd-hirudin作为目标载药,体外检测载药微针的抗压强度,载药量,皮肤穿刺能力,以及药物释放情况等;
27.(3)经基于3d打印的微针模具获得的抗凝微针体内药物代谢动力学研究和药效学研究;
28.(4)检测抗凝微针在预防急性肺栓塞中的效用
29.鉴定结果显示:
30.(1)上述微针模具制作过程对最终微针针尖的损失基本可以忽略;
31.(2)由制得的模具翻制的抗凝微针可有效穿刺皮肤表层实现药物递送;
32.(3)由制得的模具翻制的抗凝微针可有效预防小鼠急性肺栓塞。
33.本发明提供了一种新型微针模具及其制备方法,尤其是基于3d打印技术的微针模具及其制备方法。所述的模型翻制方法可成功地将微针阵列从3d打印模具上精确复制,解决了直接使用pdms进行模型翻制时pdms在以光敏树脂为材料的3d打印模型的接触面无法固化的问题,并成功获得了可以直接用于微针制作的新模具,且由该模具制备的微针可行性与实用性均很高。
34.本发明方法的优点还在于,获取微针模具技术设备要求较低,操作简便,周期短,成本低,将其与抗凝药物经皮递送结合,随着3d打印精度的提高,可实现抗凝微针的按需个性化量身定制,具有极高的社会效益和经济效益。
附图说明
35.图1为抗凝药物传统给药方式图1a及微针给药图1b示意图。
36.图2为3d打印模型设计参数和打印模型实体参数以及打印系统参数,其中图2a为微打印设计参数,图2b为打印实体参数,图2c为由打印系统精确度限制导致的针尖损失示意图,图2d为打印系统参数。
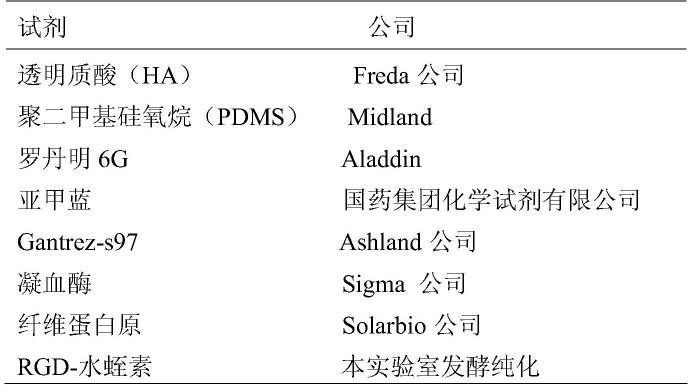
37.图3为由3d打印模型通过中间过渡材料翻制pdms模型的模型流程示意图(图3a)和制得的模具图示以及由模具制备而来的抗凝微针图示(图3b)。
38.图4为微针实体与微针模具的电镜扫描图示,其中图4a为1#mn,图4b为2#mn,图4c为1#微针实体与微针模具针体对比,图4d为2#微针实体与微针模具针体对比。
39.图5显示了由制得的模具制备的微针的sd大鼠皮肤穿透能力(左:1#mn,右:2#mn)。
40.图6显示了由制得的模具制备的抗凝微针体外药物经皮递送能力(左猪皮,右鼠皮)。
41.图7显示了由制得的模具制备的抗凝微针sd大鼠体内药物经皮递送能力。
42.图8显示了由制得的模具制备的抗凝微针在预防急性肺栓塞模型中的应用,其中,图8a/b为小鼠的存活率统计,图8c为肺栓塞小鼠肺部组织切片he染色,图8d为肺栓塞小鼠肺部ct扫描。
具体实施方式
43.实施例1采用基于3d打印的微针模型翻制方法制备获得新型微针模具
44.1.实验材料和仪器
45.1.1.主要试剂
[0046][0047]
1.2.主要仪器
[0048][0049]
2.实验方法
[0050]
2.1微针模型设计
[0051]
基于前期实验研究的基础,由于3d打印技术精度的限制,微针阵列针尖打印会有不可忽略的损失,针尖损失长度与打印实体针体长度的比例接近1:4;此外还观察到当针体过细,打印的损失也越大,微针底边形状为正五边形比为圆形时打印出的针体更具有形状特征,针尖损失更少,因此,本实施例利用软件rhino6分别设计两种微针阵列模型,微针长度(h)=1000μm,底边为正五边形,1#mn底边长度为150μm,2#mn底边长度为100μm。
[0052]
2.2微针模型打印
[0053]
微针模型设计后,选用合适的高精度3d打印系统进行打印,经如,成本、周期以及3d打印限制等多因素评估后,选用nanoarch p140系统进行打印。
[0054]
2.3微针模型翻制
[0055]
光敏树脂,一种经紫外光照射可以固化的材料,是目前普遍使用的高精度3d打印材料,pdms是现在使用较多的模型翻制材料,前期研究发现以光敏树脂作为打印材料获得的微针阵列模型用pdms翻模时,在pdms和打印模型的接触面pdms无法完全有效固化,通过
尝试多种材料,最终选择明胶作为翻模的中间过渡材料,以避免pdms和光敏树脂模型的直接接触;按下述方法:
[0056]
(1)配制10%明胶溶液,70℃水浴溶解保温;
[0057]
(2)将3d打印模型针面朝上固定在直径3cm的培养皿中,浇铸一层12%明胶溶液使完全覆盖模型,快速真空除泡使针面与明胶溶液完全嵌合;
[0058]
(3)室温或4℃放置1-2h,待明胶充分凝固后从容器底部将3d打印模型与明胶剥离,即可获得基于明胶的微针制作模具;
[0059]
(4)配制pdms倒模液:pdms同固化剂按10:1混匀,超声去泡后真空进一步去泡,然后在明胶模型的针孔面浇铸一层pdms,利用真空将pdms填充到针孔中,反复多次,直至每个针孔都被pdms填满且无气泡;
[0060]
(5)室温放置2-3天,待pdms充分固化后从明胶上剥离,即可获得基于pdms的微针阵列;
[0061]
(6)将获得的pdms微针阵列用硅烷化试剂处理15min左右,然后针面朝上固定在24孔板的圆孔中央,浇铸pdms溶液使完全覆盖模型,利用真空除泡并反复多次直至针面与pdms溶液完全嵌合;
[0062]
(7)55℃风箱中放置至少2h,待pdms完全固化后将其从模板剥离制备获得直接用于微针制作的pdms模具。
[0063]
2.4载药微针制作
[0064]
载体溶液配制:25mg rgd
–
hirudin溶于10ml去离子水混匀,使终浓度为2.5mg/ml,加入1g低分子量透明质酸(hyaluronic acid,ha),配制成浓度为10%(w/v)的载体溶液(本发明中,可在ha溶液中加入少量交联剂以增加微针的强度以及载药量,亦可根据需要加入不同染料加以显色以便于观察),玻璃棒搅拌混匀后水浴超声约10min以去除大泡泡,然后放入恒温真空箱真空去除余下的泡泡;将载体溶液倒在微针模具上,覆盖针面,反复真空除泡,使得每个针孔都填满载体溶液,最后在针面上再倒一层载体溶液,以备微针脱模之用,将填充好的模具室温过夜干燥后放入干燥箱,待微针干燥后用眼科镊轻轻将微针与模具脱离即可获得成型的载药微针,可立即使用,也可4℃干燥保存。
[0065]
2.5微针性能鉴定:
[0066]
利用扫描电镜分别对微针和pdms微针模型形貌进行扫描,结果显示翻模过程并未对针尖造成明显的损失,微针形貌特征明显,为五棱锥形,微针长度变化基本可以忽略。应用强度检测器对微针强度进行检测,结果显示微针的抗压强度要高于现有报道的微针刺入皮肤所需的强度,提示微针可以有效刺入皮肤;分别取猪皮、鼠皮,使用脱毛膏褪去皮肤表面的毛发,用自制给药器将微针按压在皮肤或8层折叠厚度约1mm的封口膜上15s后松开,让微针在皮肤上停留约2min,使掺入微针的染料可以溶解在由微针刺入所产生皮肤微孔中,分别统计微针穿膜率和皮肤穿刺率。
[0067]
实施例2.微针给药可行性分析
[0068]
体外实验:
[0069]
根据微针性能鉴定结果,选取1#mn进行后续的实验。分别取猪耳背部皮肤、sd大鼠腹部皮肤,脱毛膏褪去皮肤表面的毛发,眼科剪剔去皮下脂肪、结缔组织等,使用透皮扩散试验仪对载药微针药物透过情况进行检测,分别在0h、0.5h、1h、2h、3h取样,通过检测接收
池样品的抗凝活性检测药物的透过时间以及透过率。
[0070]
体内实验:
[0071]
(1)药效学:选取体重约210
±
10g的sd大鼠,每组6只,分为三组:正常对照组、rgd-hirudin皮下给药组、rgd-hirudin微针给药组;10%水合氯醛按3ml/kg对大鼠进行麻醉,用剃毛器将大鼠腹部毛发剔去后再用脱毛膏褪去剩余毛发,温水洗净后室温晾干;对大鼠实施劲动脉插管,取给药前血液样本;然后用自制给药器对sd大鼠实施腹部皮肤微针给药,微针在大鼠腹部皮肤上按压15s左右后松开,用胶膜封好防止脱落;分别于给药后0.5h,1h,2h,3h取样,每次取样0.9ml,按1:9比例加入3.8%枸橼酸钠0.1ml抗凝;将取好的血样4000rpm离心10-15min,吸取上清至新的1.5ml离心管中,即可获得不同时间点采集的血浆样本,应用全自动血凝仪分别检测血浆的凝血指标:aptt,tt或-80℃保存备用。
[0072]
(2)药物代谢动力学:选取体重210
±
10g的sd大鼠,每组6只,分为三组:rgd-hirudin皮下给药组、rgd-hirudin 3d微针给药组、rgd-hirudin pe微针给药组;10%水合氯醛按3ml/kg对大鼠进行麻醉,用剃毛器将大鼠腹部毛发剔去后再用脱毛膏褪去剩余毛发,温水洗净后室温晾干;对大鼠实施劲动脉插管,取给药前血液样本;然后用自制给药器对sd大鼠实施腹部皮肤微针给药,微针在大鼠腹部皮肤上按压15s左右后松开,用胶膜封好防止脱落,每只大鼠贴4片;分别于给药后0.5h,1h,2h,3h取样,每次取样1ml,无需抗凝;将取好的血样4000rpm离心10-15min,吸取上清至新的1.5ml离心管中,即可获得不同时间点采集的血清样本。对样本进行预处理:配制20%甲酸水溶液,300μl/管分装至新的1.5ml离心管中,加入150血清样本,振荡混匀后转移至ym-50k超滤管,12000rpm室温离心20min,收集滤液,-80℃预冻至少2h,真空冷冻干燥机冻干后-80℃保存备用;液相-质谱(lc-ms)联用检测不同时间点血药浓度,以反映微针释药随时间的变化以及药物经皮吸收入血后在大鼠体内的浓度变化。
[0073]
实施例3动物实验
[0074]
制得的载药微针用于预防小鼠急性肺栓塞实验:
[0075]
配制造模液:ⅰ型胶原和肾上腺素按比例混匀,使得ⅰ型胶原终浓度为3.6mg/ml,肾上腺素的终浓度为0.03mg/ml;分别设置100μl,125μl,150μl和175μl四个造模剂量,选取体重18g左右的c57小鼠,每组6只,分别注射不同剂量的造模剂,以确定造模剂的绝对致死剂量;确定造模剂绝对致死剂量后,将c57分为三组:正常对照组、rgd-hirudin皮下给药组(10μg/只)、rgd-hirudin 3d微针给药组(颈背部给1片微针);对小鼠颈背部实施脱毛,然后分别给药,给药后1h经小鼠尾静脉注射175μl造模剂,统计各组小鼠30min内存活率,利用ct扫描检测给药处理对小鼠肺栓塞的预防情况,同时取各组小鼠肺部组织进行切片染色,观察血栓形成情况;实验结果如图8所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1