活化过硫酸盐、去除污染物的方法、应用与流程
本发明涉及污染物处理领域,具体而言,涉及一种乙酰丙酮联合亚铁离子活化过硫酸盐高级氧化体系及其深度降解污染物的方法、应用。
背景技术
随着我国经济的快速发展和城市化程度的加深,工业废水以及生活废弃物量增多,环境污染也日趋严重。近年来,环境治理倍受关注,其中水体污染问题最为紧迫。水体中cod含量和氮元素过高是当今环境治理的一大难题。水体中cod值越高代表有机物污染越严重。氮元素的严重超标会使水体富营养化,导致藻类大量繁殖,使水中溶解氧含量降低,引起水生动物的大量死亡。此外,硝态氮对人也有潜在的影响,硝酸盐在人体内会被还原成亚硝酸盐,与胺类物质发生反应,生成强致癌物质n-亚硝基胺。硝酸盐还会破坏血红蛋白,生成高铁血红蛋白,使血红蛋白携带氧气的能力丧失,危害人类生命安全。
污水中的含氮化合物主要来自含氮工业废水,城市生活污水以及在农业灌溉中氮肥的淋失,水中氮素多以硝态氮,铵态氮以及少量的亚硝态氮、有机氮形式存在,但有机氮水溶性相对较差且易被生物降解。因此,降低水体氮含量的重点在于对硝态氮和氨态氮的降解。
目前降解含氮化合物的主要方法有:生物脱氮法,利用硝化细菌在有氧条件下将氨态氮转化为硝态氮,再利用反硝化细菌在厌氧条件将硝酸氮、亚硝酸氮还原为n2。生物脱氮法过程绿色,降解效果较好,但条件要求严格,处理成本较高,对高电解质含量或bod值低的体系效果很差;催化还原脱氮法主要有:光催化法,利用二氧化钛作为载体,在紫外光照下对硝态氮进行脱除;电催化法,通过外加电场对水中的硝态氮进行脱除,虽然催化还原法脱氮效果好,但在实际污水处理中无法实现电催化还原法所要求的反应条件,难以达到理想的降解效果;最简便的为化学还原法,常采用活泼金属如fe,mg等为还原剂。铁因为具有来源广泛、价格低廉、反应后生成的三价铁对环境没有毒害作用以及容易被还原剂再次还原利用等优点而备受青睐。但用铁还原硝态氮的体系受ph值影响很大,有报道指出,在ph值>4,fe与硝酸根停止反应,且很容易生成铵根离子,不能实现真正意义上的硝态氮的去除。目前还没有能同步去除污水中的cod和tn的理想方法。
有鉴于此,特提出本发明。
技术实现要素:
本发明目的在于提供一种用于深度降解污染物(包括废水中的有机污染物,含氮污染物)的乙酰丙酮协同亚铁离子活化过硫酸盐的高级氧化反应体系,该体系主要由乙酰丙酮,fe2+以及过硫酸盐组成,以形成复合的激活过硫酸盐体系。该体系可以有效的保护、复活反应体系内的fe2+,同时乙酰丙酮还能辅助活化过硫酸盐,因而能达到持续、稳定、高效活化过硫酸盐并降低或减免过硫酸盐的无谓消耗的目的,从而提升cod以及tn的降解效率和去除效果。
本发明的第二目的在于提供一种上述乙酰丙酮协同亚铁离子活化过硫酸盐体系(还原性配位剂协同亚铁离子活化过硫酸盐)去除污染物的方法,该方法的理论依据如式(1)所示:
其中l为其他还原性配位剂,n为与fe2+共存的杂金属离子。在没有l和n时,体系中fe2+的有效浓度主要受fe2+、aa用量,fe2+:aa比值以及ph控制。
该方法中通过引进还原性配位剂,能够结合游离在溶液中的二价铁离子,从而适当降低反应中铁离子的浓度,并通过ph、配位剂用量以及配位剂:fe2+的配比来调控游离fe2+浓度,从而控制硫酸根自由基的生成速率,使反应向着进攻污染物的方向进行,最大限度发挥药剂的效能,提高物污染物的去除效率。
此外该方法中的配位剂除了具有常规配位剂的作用外,其本身还具有优异的复活fe2+的能力,并具有直接活化过硫酸根生成硫酸根自由基的能力,因此,在优化条件下能够实现能够实现fe2+的长效活性,并保持fe2+浓度恒定,从而保证了硫酸根自由基的持续、稳定形成,为有机污染物和含氮污染物的高效深度降解提供了条件,因此该方法具有良好的应用前景。
为了实现本发明的上述目的,特采用以下技术方案:
本发明提供了一种乙酰丙酮联合亚铁离子活化过硫酸盐的高级氧化体系,主要由乙酰丙酮,fe2+以及过硫酸盐组成,乙酰丙酮作为还原性配位剂可以与亚铁离子形成良好的复合配位体系。乙酰丙酮:fe2+:过硫酸盐之间的摩尔比控制在(1-5):(1-20):(1-8)之间。
一般来说,传统fe(0)单一氧化脱氮体系中,fe(0)易被氧化成fe3+,并且溶液中初始二价铁离子浓度过高,容易在处理污染物中的总氮时生成铵态氮,也是水体的污染物之一,不利于含氮化合物无毒无害降解。在本方案中,采用aa-fe2+高级氧化体系,利用fe2+,引入还原性配位剂乙酰丙酮(aa),有效结合游离在溶液中的二价铁离子,一定程度上降低反应中二价铁离子的有效浓度,使fe2+具有适当的还原能力,控制脱氮过程中不产生铵根离子,直接生成n2。同时,通过ph调控配位剂的配位能力,通过配位剂用量调控游离fe2+浓度,从而控制硫酸根自由基的生成,使反应向着进攻含氮化合物的的方向进行,避免过多的硫酸根自由基与fe2+副反应湮灭及相互碰撞淬灭,减少过硫酸根与fe2+的副反应,造成过硫酸根的无谓消耗,因而可以最大限度的发挥药剂的效能。随着反应的进行,溶液中fe2+浓度减少,配位平衡向着解离方向移动,因而释放出fe2+;反之,当fe3+被还原生成fe2+,配位平衡向着生成配合物的方向移动,fe2+量降低。其结果是配位平衡实现了体系fe2+浓度的一个动态平衡。因而,在体系中有过硫酸根存在的情况下,可以实现持续、平稳激发,为体系硫酸根自由基的持续、平稳生成以及有机污染物的持续氧化降解提供了前提。
aa加入量变化对金属离子fe2+浓度起到有效的调节作用,在乙酰丙酮-fe2+体系存在最优的比例。过高的配位剂量或过高的fe2+浓度都会影响体系中总氮的降解。因此发明人针对aa加入量进行了优化调整。
优选地,乙酰丙酮:fe2+:过硫酸盐之间的摩尔比最好控制在(2-4):(4-15):(2-7)之间,最优地是控制在3:10:4之间,控制在最佳的比例条件下,降解效果可以达到最佳。
在上述摩尔比的控制条件下,无论是对污水中的cod,还是总氮污染物均有非常良好的降解效果,当然根据所处理的污水中所含的污染物的种类不同,可对上述摩尔比进行一定的调整,实际应用过程中尤其是对垃圾渗滤液、纳滤浓缩液等含难降解物质的特种废水处理方面具有非常广泛的应用前景。
本发明除了提供了采用上述过硫酸盐体系进行深度降解污染物的方法,具体包括如下步骤:
(a)将乙酰丙酮联合亚铁离子活化过硫酸盐添加到待处理的含有机污染物及含氮污染物的废水中,反应体系的ph值控制在2-12之间;
(b)15-50℃降解处理5-60min,即可。
在该方法中,ph调控的意义主要包括两个方面:1)影响激化剂fe2+的有效浓度,在ph偏高的情况下,fe2+将以fe(oh)2形式存在,并将较快被氧化为fe(oh)3而失活;2)影响配位剂与金属离子共享电子能力,在ph较小的情况下,较高浓度的h+将与配位剂中o元素核外孤对电子结合,使其失去与金属离子共享电子能力,因而失去配位能力。3)影响总氮化合物的形体分布及反应难易程度,由nh4+形体分布图如图6可知,在ph为9.26时,溶液中铵态氮以铵根离子及氨水形式共存,处理中容易以氨气的形式挥发,对环境造成二次污染;同时依据硝酸根半反应方程式可知,降低ph值利于硝酸根被还原。
12h++2no3-=n2+6n2o
硝酸根半反应方程式
因此,本发明通过实验后得到了当配位剂为乙酰丙酮时其最优的ph值。通过调控ph,可以显著提高降解率,使得污染物能够逐步实现深度降解,尤其是污染物中总氮的降解。
优选地,ph值控制在6-9之间,更优地ph为8,根据所处理的污染物的种类,对具体ph值进行调整,如果只是针对有机污染物,其比较优异的ph值范围为8-12,如果为了降低污染物中的总氮,根据图6的原理分析,应当适当降低ph值,比如可以控制在ph2-5之间。
虽然降解总氮时,ph值不适宜过高,而ph值低是有利于硝酸根被还原的,但是如果ph值太低则因为对aa等还原能力和配位能力的影响,可能又会影响降解的效果,因此最好控制在适宜的ph值范围内。
本发明的过硫酸盐可以为过硫酸钠,过硫酸钾,过硫酸铵中的一种或多种混合,优选为过硫酸钠或过硫酸钾或二者的混合,二价铁离子的亚铁铁源可以为七水合硫酸亚铁、醋酸亚铁、四水合氯化亚铁中的其中任何一种,优选地为七水合硫酸亚铁或四水合氯化亚铁。
此外,需要注意的是本发明的步骤(b)中的降解反应过程中的各个操作参数的控制,本发明降解反应的时间大概为5-60min即可完成降解,提高了降解效率,节省了操作时间,现有技术中其他的降解方法可能需要2-3h,甚至7-8h才能完成降解,相比而言本发明的降解方法不仅降解反应用时短,降解效果也比较优异,优化条件下也可以实现cod和总氮的同步降解。
更优地,降解的处理时间控制在10-30min之间即可。
优选地,降解处理的温度控制在20-35℃之间,更优为30℃。
优选地,降解处理的方式包括静置、搅拌、震荡和超声中的其中一种或几种的结合。最优的处理方式为依次经过静置、搅拌、震荡和超声进行降解处理。
优选地,震荡的速率控制在200-250rpm之间,更优地为210rpm。
优选地,超声功率在40w。
通过采用本发明的搅拌降解的方法,总氮的降解率达85%以上,测定对氯苯酚的降解率达95%以上。
与现有技术相比,本发明的有益效果为:
(1)本发明的于深度降解污染物(包括废水中的有机污染物,含氮污染物)的乙酰丙酮协同亚铁离子活化过硫酸盐的高级氧化反应体系,该体系主要由乙酰丙酮,fe2+以及过硫酸盐组成,以形成复合的激活过硫酸盐体系。该体系可以有效的保护、复活反应体系内的fe2+,同时乙酰丙酮还能辅助活化过硫酸盐,因而能达到持续、稳定、高效活化过硫酸盐并降低或减免过硫酸盐的无谓消耗的目的,从而提升cod以及tn的降解效率和去除效果。
(2)通过采用本发明降解的方法,最终测定总氮的降解率达85%以上,测定对氯苯酚的降解率达95%以上,尤其对于城市污染比较严重的各种污染源中的有机污染物、无机污染物均能实现深度降解,而且降解率非常高,有广泛应用前景。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
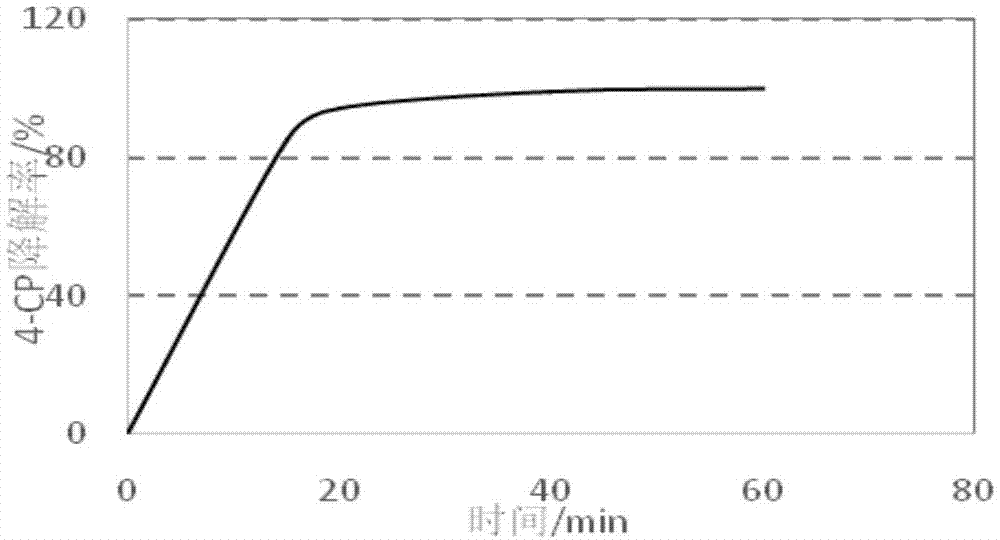
图1为本发明实施例4的乙酰丙酮协同亚铁离子活化过硫酸盐降解对氯苯酚的降解率图;
图2为本发明实施例5的乙酰丙酮协同亚铁离子活化过硫酸盐降解总氮的降解率图;
图3为本发明实验例2的单独fe2+活化过硫酸盐降解总氮的实验结果图;
图4为本发明实验例2中的单独aa活化过硫酸盐降解总氮的实验结果图;
图5为本发明实验例2中的还原性配位剂协同亚铁离子活化过硫酸盐的活化机理图;
图6为本发明在不同ph值下进行含氮化合物的降解处理后nh4+-n的变化情况图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
1)铁离子源的选择:
本实施例选择的亚铁铁源为七水合硫酸亚铁。
2)过硫酸盐的选择:
本实施例选择的过硫酸盐为过硫酸钠。
3)配位剂的选择:乙酰丙酮
4)具体降解过程按照如下步骤实施:
取调节ph值10-12范围内的对氯酚水溶液(浓度为20mg/l),加入乙酰丙酮:fe2+:过硫酸钠摩尔比为1:20:8,总体积50ml,在30℃,200rpm的摇床振荡25min进行反应降解;
取3ml反应降解后的溶液于10ml离心管中,用等体积乙酸乙酯萃取,过0.22um水系滤膜,用高效液相表征20min检测对氯酚(4-cp)降解率为95%。用该反应体系处理垃圾渗滤液浓缩液,垃圾渗滤液纳滤浓缩液cod去除率为93%,总氮去除率85%。
实施例2
1)铁离子源的选择:
本实施例选择的亚铁铁源为醋酸亚铁与七水合硫酸亚铁。
2)过硫酸盐的选择:
本实施例选择的过硫酸盐为过硫酸钠。
3)配位剂的选择:乙酰丙酮
4)具体降解过程按照如下步骤实施:
取调节ph值8-9范围内的对氯酚水溶液(浓度为20mg/l),加入乙酰丙酮:fe2+:过硫酸钠摩尔比为5:1:1,总体积50ml,在35℃,210rpm的摇床振荡30min进行反应降解;
取3ml反应降解后的溶液于10ml离心管中,用等体积乙酸乙酯萃取,过0.22um水系滤膜,用高效液相表征20min检测对氯酚(4-cp)降解率为96%。用该反应体系处理垃圾渗滤液浓缩液,垃圾渗滤液纳滤浓缩液cod去除率为94%,总氮去除率84%。
实施例3
1)铁离子源的选择:
本实施例选择的亚铁铁源为四水合氯化亚铁。
2)过硫酸盐的选择:
本实施例选择的过硫酸盐为过硫酸钾与过硫酸钠。
3)配位剂的选择:乙酰丙酮
4)具体降解过程按照如下步骤实施:
取调节ph值8-9范围内的对氯酚水溶液(浓度为20mg/l),加入乙酰丙酮:fe2+:过硫酸钠摩尔比为2:15:7,总体积50ml,在20℃,250rpm的摇床振荡60min进行反应降解;
取3ml反应降解后的溶液于10ml离心管中,用等体积乙酸乙酯萃取,过0.22um水系滤膜,用高效液相表征20min检测对氯酚(4-cp)降解率为98%。用该反应体系处理垃圾渗滤液浓缩液,垃圾渗滤液纳滤浓缩液cod去除率为95%,总氮去除率86%。
实施例4
本实施例选择的亚铁铁源为七水合硫酸亚铁。
2)过硫酸盐的选择:
本实施例选择的过硫酸盐为过硫酸铵。
3)配位剂的选择:乙酰丙酮
4)具体降解过程按照如下步骤实施:
取调节ph值8-9范围内的对氯酚水溶液(浓度为20mg/l),加入乙酰丙酮:fe2+:过硫酸钠摩尔比为2:2:1,总体积50ml,在26℃,250rpm的摇床振荡60min进行反应降解;
取3ml反应降解后的溶液于10ml离心管中,用等体积乙酸乙酯萃取,过0.22um水系滤膜,用高效液相表征20min检测对氯酚(4-cp)降解率为100%。用该反应体系处理垃圾渗滤液浓缩液,垃圾渗滤液纳滤浓缩液cod去除率为97%,总氮去除率86%,4-cp的具体降解图线见附图1。
实施例5
本实施例选择的亚铁铁源为七水合硫酸亚铁。
2)过硫酸盐的选择:
本实施例选择的过硫酸盐为过硫酸钠。
3)配位剂的选择:乙酰丙酮
4)具体降解过程按照如下步骤实施:
取调节ph值4-5,硝态钾浓度为8g/l,硫酸铵浓度为10g/l的含氮水溶液50ml,加入乙酰丙酮:fe2+:过硫酸钠摩尔比3:10:4,在30℃,震荡210rpm10min,40w超声10min、静置20min进行反应降解;取1ml样液用总氮试剂盒测定,总氮去除率为85%以上,具体总氮降解曲线见附图2。
实施例6
本实施例选择的亚铁铁源为七水合硫酸亚铁。
2)过硫酸盐的选择:
本实施例选择的过硫酸盐为过硫酸钠。
3)配位剂的选择:乙酰丙酮
4)具体降解过程按照如下步骤实施:
取调节ph值2-4,硝态钾浓度为16g/l,硫酸铵浓度为4g/l的含氮水溶液50ml,加入乙酰丙酮:fe2+:过硫酸钠摩尔比3:12:5,在40℃,搅拌5min,震荡220rpm10min,40w超声10min、静置10min,进行反应降解;取1ml样液用总氮试剂盒测定,总氮去除率为92%以上。
比较例1
具体操作步骤与实施例5一致,只是乙酰丙酮:fe2+:过硫酸钠摩尔比20:7:4,体系的ph为1,降解时间为3h,经过总氮试剂盒测定,总氮去除率为70%。
比较例2
具体操作步骤与实施例5一致,只是乙酰丙酮:fe2+:过硫酸钠摩尔比1:70:1,体系的ph为11,降解时间为5h,经过总氮试剂盒测定,总氮去除率为75%。
比较例3
具体操作步骤与实施例5一致,只是乙酰丙酮:fe2+:过硫酸钠摩尔比4:3:0.7,体系的ph为1,降解时间为3h,经过总氮试剂盒测定,总氮去除率为75%。
从附图1-2中可以看出,只有各个参数均控制在本发明的方案范围内,才能达到理想的降解效果,不仅对有机污染物的降解效果优异,总氮的降解效果也非常优异,可见如果某个参数不控制在本发明要求范围内,即使延长了降解反应的时间也达不到理想的降解效果,尤其是ph值,还有体系中各个物质的用量等参数需要相互配合均调配在比较优异的范围内,如果ph值控制在本发明的范围内,用量采用任意配比的条件下,虽然有降解效果,但是降解率不高。
实验例1
将本发明实施例5的亚铁配位体系活化过硫酸盐处理实际污水与现有技术中的其他工艺体系进行降解实验对比,具体实验结果如下表1所示:
表1实验结果
本发明的降解有机污染物的方法成本相对比较低,操作过程也简单,容易进行大规模实施,实现工业化生产,不仅可以有效降低cod,对于含氮污染物的深度降解比如总氮的降解也有非常好的效果,其他实施例经过上述试验后发现能够取得同样的效果。
实验例2
对aa的复活以及辅助激化过硫酸根的功能进行试验,具体实验过程如下:
在高级氧化过程中,活化剂fe2+易被氧化生成fe3+失活,导致氧化降解作用终止。但当体系中有乙酰丙酮(aa)存在时,aa可以将fe3+还原为fe2+,从而实现fe2+的复活。
从图3中的fe2+单独降解体系以及图4的单独乙酰丙酮体系的降解图线可以看出,aa的还原性略高于二价铁,如果后续随着反应进行,aa是可以将fe3+还原为fe2+,从而实现fe2+的复活的,实践证明,乙酰丙酮不但可以与fe2+配位,还可以还原fe3+。
aa的还原作用结果表明,aa具有还原fe2+复活作用,因而有利于高级氧化体系活化剂fe2+活性的保持,有利于更持续高效地进行污染物的氧化降解。
单独fe2+与单独乙酰丙酮对水相中氮的降解效果都不理想,但当二者同时存在时,随着反应进行,溶液中fe2+浓度减少,配位平衡向着解离方向移动,因而释放出fe2+,反之当fe3+被还原生成fe2+,配位平衡向着生成配合物的方向移动,fe2+量降低。其结果是配位平衡实现了体系fe2+浓度的一个动态平衡。因而,在体系中可以实现持续、平稳激发,为体系持续、平稳降解硝态氮和铵态氮提供了前提。
此外,本发明的乙酰丙酮协同亚铁离子活化过硫酸盐的活化机理如下图5所示。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!