利用芽孢杆菌胞外聚合物对金属资源回收与利用的方法与流程
本发明涉及资源利用与回收技术领域,具体的说,是利用微生物对重金属以及稀贵金属进行绿色无污染的处理回收技术领域。
背景技术:
金属对于汽车、电子、医药和工业活动等各种产品的关键部件的可持续生产是必不可少的,在一个日益增长的社会中,对金属的需求正在增加。然而,正面临两方面的挑战,即战略金属的枯竭,因为储量有限,其次是资源开发和人为活动造成的过度环境负担。金属资源的匮乏及其对经济的影响已成为制约可持续发展的主要问题,而金属污染,特别是重金属污染加速了补救的紧迫性。在这样背景下,为了追求循环经济,学者们提出从初级和二级来源回收金属。从废弃物中回收金属对于促进原材料的可持续性和解决环境中的金属干扰是至关重要的。载有金属的废物流对环境构成了威胁,但金属废料也是回收的潜在来源。工业废水和土壤中通常含有用于回收的有价值的金属候选物。例如,废水富含ni、cr、pb、pt和pd,来自电镀、颜料、皮革鞣制、采矿和加工。废水中有害但有价值的重金属的有效和选择性提取有利于回收开发。在过去几十年中,各种方法被用来除去和回收重金属,如电解、溶剂萃取、膜过滤和吸附法。然而,这些方法由于成本高、再生率低、使用或生产大量有毒化学品而受到限制,需要昂贵的设备。微生物吸附法为代表的生物法获得了越来越多的关注,一方面它具有价格低廉、效率高、环境友好的特点,另一方面还可以处理低浓度重金属废水。因此,关于微生物吸附技术处理重金属污染方面的研究越来越广泛。然而,这些方法都不能单独或者不能实现含有重金属、稀贵金属的废水、废弃物以及土壤的资源化处理。
因此,开发具有可再生、可生物降解、廉价和无毒等特性的生态友好的方法,对重金属、稀贵金属进行资源化处理与回收是非常迫切的。
技术实现要素:
本发明的目的在于提供一种芽孢杆菌属微生物胞外聚合物,以实现开发具有可再生、可生物降解、廉价和无毒等特性的生态友好的方法,对重金属、稀贵金属进行资源化处理与回收的目的。
为了达到上述目的,本发明采用以下技术手段:
一种芽孢杆菌属微生物胞外聚合物的制备方法,包括芽孢杆菌属微生物的提取,通过以下步骤提取:
s1:采用固体培养基对芽孢杆菌进行活化培养后,接种至ph值为7-8的液体发酵培养基中,在23-25℃环境下发酵培养,得到微生物发酵液;
s2:将所述微生物发酵液置于5-7℃环境中进行离心,取上层清液过滤,滤液冷冻干燥后制得eps粉末;
所述eps粉末包括s-eps粉末、lb-eps粉末、tb-eps粉末。
进一步的,所述步骤s2制备得所述s-eps粉末;
取所述步骤s2离心后的下层产物利用去离子水再悬浮制得水悬浮液,将所述水悬浮液置于5-7℃环境中进行离心,取上层清液,冷冻干燥后制得lb-eps粉末。
更进一步的,取所述悬浮液离心后的下层产物,与2%-6%edta按照1:1混合制得溶剂悬浮液,在5-7℃条件下振荡混合,随后在5-7℃环境下,将所述溶剂悬浮液进行离心,取上层清液利用微孔滤膜过滤后,冷冻干燥后制得tb-eps粉末。
更进一步的,所述固体培养基采用固体luria-bertani培养基,所述液体发酵培养基通过luria-bertani液体培养基调节ph值后高温灭菌制得。
更进一步的,所述高温灭菌温度为100-121℃,高温灭菌时间为30-40min。
更进一步的,所述步骤s2中采用分子截留量为100-14000kda的透析袋过滤。
更进一步的,所述步骤s1中的活化培养时间为24-48h,发酵培养时间为24-36h。
更进一步的,所述步骤s2中的离心转述为3000-8000r/min,离心时间30min。
更进一步的,所述水悬浮液的离心速度为8000-15000r/min,离心15min;所述溶剂悬浮液的振荡混合条件为180-200r/min,振荡3h,其离心速度为15000-20000r/min,离心20min。
更进一步的,所述芽孢杆菌包括蜡样芽孢杆菌、巨大芽孢杆菌、海水芽孢杆菌、枯草芽孢杆菌中的一种。
一种资源化回收重金属和稀贵金属的方法,利用前述的芽孢杆菌属微生物胞外聚合物对废水和/或土壤中的重金属离子以及稀贵金属进行回收和/或降解和/或转化。
本发明中的eps是指胞外聚合物,s-eps是指可溶性胞外聚合物,lb-eps是指松散结合胞外聚合物,tb-eps是指紧密结合胞外聚合物。
本发明与常见的重金属、稀贵金属回收去除方式相比,具有以下有益效果:
(1)本发明的芽孢杆菌属微生物在自然界中广泛存在且易培养,其eps的提取方法简单,环保,且成本低。
(2)本发明三种类型的eps即s-eps、lb-eps、tb-eps均是可再生的,绿色的,低成本的高分子材料,与目前重金属污染治理和稀贵金属回收方法相比,不存在使用后的环境问题,对环境和生物无毒无害,可用于绿色的金属污染治理和回收。
(3)本发明的三种类型的eps均是通过一个流程制得,即在将芽孢杆菌属微生物进行完全提取的过程中,每个过程均能够得到有效的,能够对重金属污染进行处理以及金属回收的产物,对于最终产物而言,能够大幅增加单位原料即单位芽孢杆菌属微生物的成品产量,大幅增加生产效率,产业化价值高。
(4)本发明金属污染治理和回收的方法,适用于废水和土壤中的重金属污染资源化治理和稀贵金属回收,可有效的减轻上述重金属的污染带来的危害,同时转化重金属离子,实现重金属离子功能化回收与利用。此外,还可以回收稀贵金属。三种类型的eps对重金属离子的降解率均高于为90.00%,对重金属离子功能纳米化回收率可高达80.00%。其中,三种类型的eps对六价铬的降解率均接近为99.00%,实现完全转化,转化的三氧化铬纳米材料表现出良好的半导体性能,在催化、电池等领域具有潜在的应用;三氧化铬纳米材料的回收率高达84.86%。三种类型的eps对贵金属离子功能纳米化回收率可高达85.00%,其中,在含有pt和pd的混合溶液中回收到球形ptpd纳米材料,回收率为90.03%。
附图说明
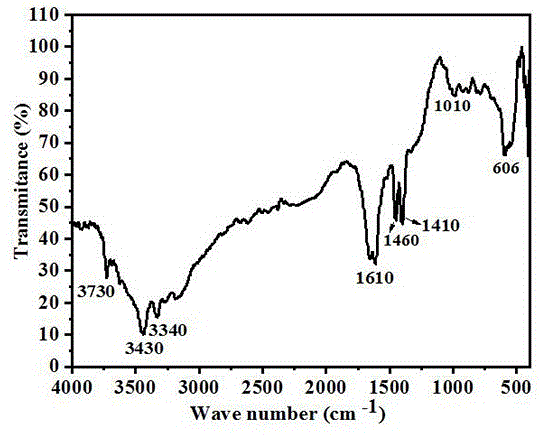
图1为本发巨大芽孢杆菌的s-eps的功能官能团红外光谱图。
图2为本发明巨大芽孢杆菌的s-eps回收cr6+污染回收到的纳米粒子的tem图。
图3为本发明巨大芽孢杆菌的lb-eps回收pdpt纳米粒子的tem图。
图4为本发明枯草芽孢杆菌的s-eps的功能官能团红外光谱图。
图5为本发明不同浓度的枯草芽孢杆菌的lb-eps降解重金属ni2+的效率图。
图6为本发明枯草芽孢杆菌的lb-eps回收pd纳米粒子的dpv图。
图7为本发明蜡样芽孢芽孢杆菌的s-eps的功能官能团红外光谱图。
图8为本发明用蜡样芽孢杆菌的s-eps回收ni2+污染回收到的纳米粒子的tem图。
图9为本发明用蜡样芽孢杆菌的lb-eps回收pd2+污染回收到的纳米粒子的tem图。
图10为本发明海水芽孢芽孢杆菌的lb-eps的功能官能团红外光谱图。
图11为本发明海水芽孢芽孢杆菌的lb-eps回收cr6+污染回收到的纳米粒子的tem图。
图12为本发明海水芽孢杆菌的tb-ep回收贵金属pt纳米的tem图。
图13为本发明巨大芽孢杆菌的tb-eps降解土壤中重金属cd6+的效率图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例以及附图,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
在本发明所有实施例中的eps是指胞外聚合物,s-eps是指可溶性胞外聚合物,lb-eps是指松散结合胞外聚合物,tb-eps是指紧密结合胞外聚合物。
实施例1
在本实施例中的芽孢杆菌采用巨大芽孢杆菌。
巨大芽孢杆菌的eps通过以下步骤进行制备:
(1)调节luria-bertani液体培养基的ph值为7-8,置于温度为100-121℃条件下高温灭菌30-40min后制备为luria-bertani液体发酵培养基,采用固体luria-bertani培养基,对巨大芽孢杆菌进行活化培养24~36h后,接种至luria-bertani液体发酵培养基中,在23-25℃下培养24~36h得到使用巨大芽孢杆菌制成的微生物发酵液;
在前述的步骤中,ph值以及发酵温度的选择,为巨大芽孢杆菌的发酵,产生大量的有益成份提供最佳的环境。
(2)将步骤(1)的微生物发酵液置于5-7℃,3000-8000r/min条件下离心处理,离心后静置,取上层清液,将上层清液通过分子截留量为100-14000kda的透析袋过滤后,过滤产物即为采用巨大芽孢杆菌制成的s-eps溶液;
在低温环境,即5-7℃的环境中进行离心,能够最大限度的保存微生物发酵液中的活性物质的活性及完好性,避免生物发酵液中的大量羟基、酰胺基和氨基功能等具有还原性和氧化性的官能团被破坏,以保证分子结构的稳定性。
(3)将步骤(2)中制成的s-eps溶液进行冷冻干燥,得到s-eps粉末,在使用时,至需要将前述的s-eps粉末溶于蒸馏水中,配置为适当浓度的水溶液即可使用进行金属污染的处理和回收。
(4)将步骤(3)中进行离心后的微生物发酵液的下层产物利用去离子水再悬浮,制备成水悬浮液,将前述的水悬浮液在5-7℃,8000-15000r/min条件下,离心15min,静置后取上层清液,冷冻干燥后,即制得lb-eps粉末,在需要使用时,只需要将前述lb-eps粉末溶于去离子水中,配置成适当浓度的lb-eps水溶液即可使用;
(5)将步骤(4)中离心后的水悬浮液的下层产物用2%-6%的edta按照1:1的比例混合后,在5-7℃,180-200r/min条件下振荡3h,随后在5-7℃,15000-20000r/min条件下,离心20min,取上层清液,利用0.45μm微孔滤膜过滤后,冷冻干燥,即制得tb-eps粉末,在需要使用时,只需要将前述tb-eps粉末溶于去离子水中,配置成适当浓度的tb-eps水溶液即可使用。
在本实施例中,制备过程中的三种类型eps粉末可以混合使用,也可以单独使用。
在制备完成后,将前述制备得到的三种类型eps粉末采用ft-ir进行红外光谱分析,巨大芽孢杆菌的s-eps的功能官能团红外光谱请参考图1所示,巨大芽孢杆菌的s-eps的红外光谱中出现五个主要峰:3000-3400-1为o-h、n-h基团,1610-3400cm-1为酰胺i,1400cm-1为羧基峰,998cm-1为c-o-c拉伸振动峰。其中,3000-3400cm-1范围内的宽拉伸振动带被分配给蛋白质的n-h氨基和碳水化合物的o-h基团。1400cm-1的峰是具有离子基团的羧酸的对称拉伸峰。1620cm-1处的吸收带对应于多肽酰胺i的拉伸振动。998cm-1附近的条带归因于碳水化合物和芳香族化合物的碳-氧-碳拉伸振动。结果表明,巨大芽孢杆菌的s-eps是一种复杂的高分子量聚合物混合物,即蛋白、腐殖酸和核酸。
用巨大芽孢杆菌的三种类型的eps降解重金属粒子(ni2+、pb2+、cd2+、cr6+和cu2+):
(1)用nicl2,pb(no3)2,cdcl2,k2cr2o7和cuso4配制100ml浓度为10mg/l的ni2+,pb2+,cd2+,cr6+,和cu2+溶液作为样液。
(2)配制2mg/l,4mg/l,6mg/l,8mg/l,和10mg/l的nicl2,pb(no3)2,cdcl2,k2cr2o7和cu(no3)2标准溶液。
(3)将2ml的eps的分别置于100ml10mg/l的上述的重金属溶液中,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度均为1mg/l,5mg/l,10mg/l,15mg/l,20mg/l,25mg/l,30mg/l,35mg/l,40mg/l,45mg/l,50mg/l一系列不同的浓度,将样品取出,置于温度为4-8℃条件下8000~10000r/s离心处理,上层清液收集待用,随后下层产物的固体用50%乙醇洗涤3次。
(4)将步骤(3)中的下层产物的固体进行冷冻干燥后,利用tem和xps进行检测;
(5)将步骤(3)中的滤液用icp-ms进行检测。
icp-ms法研究发现巨大芽孢杆菌的三种类型的eps对ni2+,pb2+,cd2+,cr6+,和cu2+的去除率均高达99.00%,当重金属离子的浓度为10mg/l时。通过xps测试发现,回收到的纳米材料均为nio,pbo,cds,cr2o3和cus;电化学法结果发现回收到的这些纳米材料具有很好的导电性,因而能够对重金属进行资源化的处理,即使其形成纳米材料,重金属污水处理效果好。
本实施例巨大芽孢杆菌的s-eps转化cr6+,回收cr2o3纳米材料的tem图请参见图2。
巨大芽孢杆菌的三种类型的eps回收贵金属pt,pd和rh:
(1)用氯化钯配制1ml10mg/l的pd2+溶液作为样液1;用氯铂酸配制1ml10mg/l的pt4+溶液作为样液2,用氯化铑配制1ml10mg/l的pd2+溶液作为样液3。
(2)将0.1mleps的水溶液分别置于1ml10mg/l的pd2+溶液,1ml10mg/l的pt4+溶液,1ml10mg/l的rh3+溶液,以及1ml10mg/l的pd2+和1ml10mg/l的pt4+混合溶液,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度均为0.2mg/l,0.4mg/l,0.6mg/l,0.8mg/l,1.0mg/l一系列不同的浓度,将样品取出,置于温度为4-8℃条件下8000-10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(3)将步骤(2)下层产物的固体进行冷冻干燥后,用tem和xps进行检测;
通过xps测试发现,回收到的纳米材料为pd,pt,rh以及ptpd,电化学测试发现回收到的这些贵金属纳米材料具有很好的导电性和催化性,从而通过巨大芽孢杆菌制备的三种类型eps能够对稀贵金属进行资源化的回收,使其形成纳米材料。
本实施例巨大芽孢杆菌的lb-eps回收ptpd纳米材料的tem图见图3。
实施例2
在本实施例中,芽孢杆菌属微生物采用枯草芽孢杆菌。
枯草芽孢杆菌的eps通过以下步骤进行制备:
(1)调节luria-bertani液体培养基的ph值为7-8,置于温度为100-121℃条件下高温灭菌30-40min后制备为luria-bertani液体发酵培养基,采用固体luria-bertani培养基,对枯草芽孢杆菌进行活化培养26h后,接种至luria-bertani液体发酵培养基中,在23-25℃下培养24~36h得到使用枯草芽孢杆菌制成的微生物发酵液;
在前述的步骤中,ph值以及发酵温度的选择,为枯草芽孢杆菌的发酵,产生大量的有益成份提供最佳的环境。
(2)将步骤(1)的微生物发酵液置于5-7℃,3000-8000r/min条件下离心处理,离心后静置,取上层清液,将上层清液通过分子截留量为100-14000kda的透析袋过滤后,过滤产物即为采用枯草芽孢杆菌制成的s-eps溶液;
在低温环境,即5-7℃的环境中进行离心,能够最大限度的保存微生物发酵液中的活性物质的活性及完好性,避免生物发酵液中的大量羟基、酰胺基和氨基功能等具有还原性和氧化性的官能团被破坏,以保证分子结构的稳定性。
(3)将步骤(2)中制成的s-eps溶液进行冷冻干燥,得到s-eps粉末,在使用时,至需要将前述的s-eps粉末溶于蒸馏水中,配置为适当浓度的水溶液即可使用进行金属污染的处理和回收。
(4)将步骤(3)中进行离心后的微生物发酵液的下层产物利用去离子水再悬浮,制备成水悬浮液,将前述的水悬浮液在5-7℃,8000-15000r/min条件下,离心15min,静置后取上层清液,冷冻干燥后,即制得lb-eps粉末,在需要使用时,只需要将前述lb-eps粉末溶于去离子水中,配置成适当浓度的lb-eps水溶液即可使用;
(5)将步骤(4)中离心后的水悬浮液的下层产物用2%-6%的edta按照1:1的比例混合后,在5-7℃,180-200r/min条件下振荡3h,随后在5-7℃,15000-20000r/min条件下,离心20min,取上层清液,利用0.45μm微孔滤膜过滤后,冷冻干燥,即制得tb-eps粉末,在需要使用时,只需要将前述tb-eps粉末溶于去离子水中,配置成适当浓度的tb-eps水溶液即可使用。
在本实施例中,制备过程中的三种类型eps粉末可以混合使用,也可以单独使用。
在制备完成后,将本实施例中制备得到的三种类型eps粉末采用ft-ir进行红外光谱分析,枯草芽孢杆菌的s-eps的功能官能团红外光谱请参考图4所示,枯草芽孢杆菌的s-eps的红外光谱中,3320cm-1的峰归属于蛋白质的氨基和碳水化合物的o-h基团。1400cm-1的峰是羧酸的对称拉伸峰。1640cm-1,1530cm-1处的吸收带对应于多肽酰胺i和肽酰胺ii。1070cm-1附近的条带归因于碳水化合物和芳香族化合物的c-o-c拉伸振动。结果表明,枯草芽孢杆菌的可溶性胞外聚合物是一种复杂的含有蛋白和有机酸的高分子量聚合物混合物。
枯草芽孢杆菌的三种类型eps降解重金属离子(ni2+,pb2+,cd2+,cr6+,和cu2+):
(1)用nicl2,pb(no3)2,cdcl2,k2cr2o7和cuso4配制100ml10mg/l的ni2+,pb2+,cd2+,cr6+,和cu2+溶液作为样液。
(2)配制2mg/l、4mg/l、6mg/l、8mg/l和10mg/l的nicl2,pb(no3)2,cdcl2,k2cr2o7和cu(no3)2标准溶液。
(3)分别将2ml三种类型的eps,分别添加于100ml10mg/l的重金属离子溶液中,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度为1mg/l、5mg/l、10mg/l、15mg/l、20mg/l、25mg/l、30mg/l、35mg/l、40mg/l、45mg/l、50mg/l一系列不同三种类型的eps的浓度,将样品取出,置于温度为4-8℃条件下8000-10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(4)将步骤(3)中的下层产物固定冷冻干燥,随后用tem和xps进行检测;
(5)将步骤(3)中的滤液用icp-ms进行检测。
icp-ms法研究发现枯草芽孢杆菌的三种类型的eps对ni2+,pb2+,cd2+,cr6+,和cu2+的去除率均高达95.00%。通过xps测试发现,回收到的纳米材料为nio,pbo,cds,cr2o3,和cus,且回收率高达80.00%。电化学法结果发现回收到的这些纳米材料具有很好的导电性。
本实施例中不同浓度的枯草芽孢杆菌的lb-eps降解重金属ni2+的效率见图5。
枯草芽孢杆菌的三种类型eps回收贵金属pt,pd和rh:
(1)用氯化钯配制1ml10mg/l的pd2+溶液作为样液1;用氯铂酸配制1ml10mg/l的pt4+溶液作为样液2,用氯化铑配制1ml10mg/l的pd2+溶液作为样液3。
(2)将0.1mleps的水溶液分别置于1ml10mg/l的pd2+溶液,1ml10mg/l的pt4+溶液,1ml10mg/l的rh3+溶液,以及1ml10mg/l的pd2+和1ml10mg/l的pt4+混合溶液,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度为0.2mg/l、0.4mg/l、0.6mg/l、0.8mg/l、1.0mg/l一系列不同三种类型的eps的浓度,将样品取出,置于温度为4-8℃条件下8000-10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(3)将步骤(2)中下层产物的固体冷冻干燥并用tem和xps进行检测;
通过xps测试发现,回收到的纳米材料为pd,pt,rh以及ptpd,电化学测试发现回收到的这些贵金属纳米材料具有很好的导电性和催化性。
本实施例的枯草芽孢杆菌的tb-eps回收pbo的dpv图可参考图6所示。
实施例3
在本实施例中,芽孢杆菌属微生物采用蜡样芽孢杆菌
蜡样芽孢杆菌的eps通过以下步骤进行制备:
(1)调节luria-bertani液体培养基的ph值为7-8,置于温度为100-121℃条件下高温灭菌30-40min后制备为luria-bertani液体发酵培养基,采用固体luria-bertani培养基,对蜡样芽孢杆菌进行活化培养24-48h后,接种至luria-bertani液体发酵培养基中,在23-25℃下培养24~36h得到使用蜡样芽孢杆菌制成的微生物发酵液;
在前述的步骤中,ph值以及发酵温度的选择,为蜡样芽孢杆菌的发酵,产生大量的有益成份提供最佳的环境。
(2)将步骤(1)的微生物发酵液置于5-7℃,3000-8000r/min条件下离心处理,离心后静置,取上层清液,将上层清液通过分子截留量为100-14000kda的透析袋过滤后,过滤产物即为采用蜡样芽孢杆菌制成的s-eps溶液;
在低温环境,即5-7℃的环境中进行离心,能够最大限度的保存微生物发酵液中的活性物质的活性及完好性,避免生物发酵液中的大量羟基、酰胺基和氨基功能等具有还原性和氧化性的官能团被破坏,以保证分子结构的稳定性。
(3)将步骤(2)中制成的s-eps溶液进行冷冻干燥,得到s-eps粉末,在使用时,至需要将前述的s-eps粉末溶于蒸馏水中,配置为适当浓度的水溶液即可使用进行金属污染的处理和回收。
(4)将步骤(3)中进行离心后的微生物发酵液的下层产物利用去离子水再悬浮,制备成水悬浮液,将前述的水悬浮液在5-7℃,8000-15000r/min条件下,离心15min,静置后取上层清液,冷冻干燥后,即制得lb-eps粉末,在需要使用时,只需要将前述lb-eps粉末溶于去离子水中,配置成适当浓度的lb-eps水溶液即可使用;
(5)将步骤(4)中离心后的水悬浮液的下层产物用2%-6%的edta按照1:1的比例混合后,在5-7℃,180-200r/min条件下振荡3h,随后在5-7℃,15000-20000r/min条件下,离心20min,取上层清液,利用0.45μm微孔滤膜过滤后,冷冻干燥,即制得tb-eps粉末,在需要使用时,只需要将前述tb-eps粉末溶于去离子水中,配置成适当浓度的tb-eps水溶液即可使用。
在本实施例中,制备过程中的三种类型eps粉末可以混合使用,也可以单独使用。
在制备完成后,将本实施例中制备得到的三种类型eps粉末采用ft-ir进行红外光谱分析,蜡样要报杆菌的s-eps的功能官能团红外光谱请参考图7所示,蜡样芽胞杆菌的s-eps的红外光谱中,蜡样芽孢杆菌的tb-eps样品的主要官能团有:3000-3200cm-1(o-h、n-h基团),1610cm-1(酰胺i),1410cm-1(羧基),1010cm-1(c-o-c拉伸振动)。其中3000-3200cm-1范围内的宽拉伸振动带被分配给蛋白质的n-h氨基和碳水化合物的o-h基团。1410cm-1的峰是具有离子基团的羧酸的对称拉伸峰。1610cm-1处的吸收带对应于多肽酰胺i的拉伸振动。998cm-1附近的条带归因于碳水化合物和芳香族化合物的c-o-c拉伸振动。结果表明,蜡样芽孢杆菌的可溶性胞外聚合物是一种复杂的高分子量聚合物混合物,即蛋白和有机酸。
蜡样芽孢杆菌的三种类型的eps降解重金属离子(ni2+,pb2+,cd2+,cr6+,和cu2+):
(1)用nicl2,pb(no3)2,cdcl2,k2cr2o7和cuso4配制100ml10mg/l的ni2+,pb2+,cd2+,cr6+,和cu2+溶液作为样液。
(2)配制2mg/l,4mg/l,6mg/l,8mg/l,和10mg/l的nicl2,pb(no3)2,cdcl2,k2cr2o7和cu(no3)2标准溶液。
(3)将2ml蜡样芽孢杆菌三种类型的eps的分别置于100ml10mg/l的上述的重金属溶液中,放置于24-28℃的恒温箱中反应2-48h,其中实验组中可溶性胞外聚合物的浓度为10mg/l、20mg/l、30mg/l、40mg/l、50mg/l、60mg/l、70mg/l、80mg/l、120mg/l、160mg/l、200mg/l一系列不同蜡样芽孢杆菌三种类型的eps的浓度。随后,将样品取出,置于温度为4~8℃条件下8000~10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(4)将步骤(3)的固体产物冷冻干燥后用tem和xps进行检测;
(5)将步骤(3)的滤液用icp-ms进行检测;
icp-ms法研究发现蜡样芽孢杆菌三种类型的eps对ni2+,pb2+,cd2+,cr6+,和cu2+的去除率均高达99.00%。通过xps测试发现,回收到的纳米材料为nio,pbo,cds,cr2o3,和cus电化学法结果发现回收到的这些纳米材料具有很好的导电性。
本实施例蜡样芽孢杆菌的s-eps转化ni2+,回收nio纳米材料的tem图请参见见图8所示。
蜡样芽孢杆菌的三种类型的eps回收贵金属pt,pd和rh:
(1)用氯化钯配制1ml10mg/l的pd2+溶液作为样液1;用氯铂酸配制1ml10mg/l的pt4+溶液作为样液2,用氯化铑配制1ml10mg/l的pd2+溶液作为样液3。
(2)将0.1mleps的水溶液分别置于1ml10mg/l的pd2+溶液,1ml10mg/l的pt4+溶液,1ml10mg/l的rh3+溶液,以及1ml10mg/l的pd2+和1ml10mg/l的pt4+混合溶液,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度为0.2mg/l、0.4mg/l、0.6mg/l、0.8mg/l、1.0mg/l一系列不同三种类型的eps的浓度,将样品取出,置于温度为4-8℃条件下8000-10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(3)将步骤(2)中的下层产物固体冷冻干燥后用tem和xps进行检测。
通过xps测试发现,回收到的纳米材料为pd,pt,rh以及ptpd,电化学测试发现回收到的这些贵金属纳米材料具有很好的导电性和催化性。
本实施例蜡样芽孢杆菌的lb-eps转化pd2+,回收pd纳米材料的tem图请参见图9所示。
实施例4
在本实施例中,芽孢杆菌属微生物采用海水芽孢杆菌。
海水芽孢杆菌的eps通过以下步骤进行制备:
(1)调节luria-bertani液体培养基的ph值为7-8,置于温度为100-121℃条件下高温灭菌30-40min后制备为luria-bertani液体发酵培养基,采用固体luria-bertani培养基,对海水芽孢杆菌进行活化培养26h后,接种至luria-bertani液体发酵培养基中,在23-25℃下培养24-36h得到使用海水芽孢杆菌制成的微生物发酵液;
在前述的步骤中,ph值以及发酵温度的选择,为海水芽孢杆菌的发酵,产生大量的有益成份提供最佳的环境。
(2)将步骤(1)的微生物发酵液置于5-7℃,3000-8000r/min条件下离心处理,离心后静置,取上层清液,将上层清液通过分子截留量为100-14000kda的透析袋过滤后,过滤产物即为采用海水芽孢杆菌制成的s-eps溶液;
在低温环境,即5-7℃的环境中进行离心,能够最大限度的保存微生物发酵液中的活性物质的活性及完好性,避免生物发酵液中的大量羟基、酰胺基和氨基功能等具有还原性和氧化性的官能团被破坏,以保证分子结构的稳定性。
(3)将步骤(2)中制成的s-eps溶液进行冷冻干燥,得到s-eps粉末,在使用时,至需要将前述的s-eps粉末溶于蒸馏水中,配置为适当浓度的水溶液即可使用进行金属污染的处理和回收。
(4)将步骤(3)中进行离心后的微生物发酵液的下层产物利用去离子水再悬浮,制备成水悬浮液,将前述的水悬浮液在5-7℃,8000-15000r/min条件下,离心15min,静置后取上层清液,冷冻干燥后,即制得lb-eps粉末,在需要使用时,只需要将前述lb-eps粉末溶于去离子水中,配置成适当浓度的lb-eps水溶液即可使用;
(5)将步骤(4)中离心后的水悬浮液的下层产物用2%-6%的edta按照1:1的比例混合后,在5-7℃,180-200r/min条件下振荡3h,随后在5-7℃,15000-20000r/min条件下,离心20min,取上层清液,利用0.45μm微孔滤膜过滤后,冷冻干燥,即制得tb-eps粉末,在需要使用时,只需要将前述tb-eps粉末溶于去离子水中,配置成适当浓度的tb-eps水溶液即可使用。
在本实施例中,制备过程中的三种类型eps粉末可以混合使用,也可以单独使用。
在制备完成后,将本实施例中制备得到的三种类型eps粉末采用ft-ir进行红外光谱分析,海水芽孢杆菌的lb-eps的功能官能团红外光谱请参考图10所示,海水芽胞杆菌的lb-eps的红外光谱中,海水芽孢杆菌的lb-eps样品的主要官能团有:3420cm-1的峰归属于蛋白质的氨基和碳水化合物的o-h基团,1400cm-1的峰是羧酸的对称拉伸峰。1620cm-1,1540cm-1处的吸收带对应于多肽酰胺i和肽酰胺ii。980cm-1附近的条带归因于碳水化合物和芳香族化合物的碳-氧-碳拉伸振动。结果表明,海水芽孢杆菌的可溶性胞外聚合物是一种复杂的含有蛋白、有机酸的高分子量聚合物混合物。
海水芽孢杆菌的三种类型eps降解重金属离子(ni2+,pb2+,cd2+,cr6+,和cu2+):
(1)用nicl2、pb(no3)2、cdcl2、k2cr2o7和cuso4配制100ml10mg/l的ni2+、pb2+、cd2+、cr6+和cu2+溶液作为样液。
(2)配制2mg/l、4mg/l、6mg/l、8mg/l和10mg/l的nicl2,pb(no3)2,cdcl2,k2cr2o7和cu(no3)2标准溶液。
(3)分别将2ml三种类型的eps水溶液添加于100ml10mg/l的重金属离子溶液中,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度为1mg/l、5mg/l、10mg/l、15mg/l、20mg/l、25mg/l、30mg/l、35mg/l、40mg/l、45mg/l、50mg/l一系列不同三种类型的eps的浓度,将样品取出,置于温度为4-8℃条件下8000-10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(4)将步骤(3)中的下层产物固体进行冷冻干燥后,用tem和xps进行检测;
(5)将步骤(3)中的滤液用icp-ms进行检测。
icp-ms法研究发现海水芽孢杆菌的三种类型的eps对ni2+,pb2+,cd2+,cr6+和cu2+的去除率均高达90.00%。通过xps测试发现,回收到的纳米材料为nio,pbo,cds,cr2o3和cus,且回收率高达80.00%。电化学法结果发现回收到的这些纳米材料具有很好的导电性。
本实施例不同浓度的海水芽孢杆菌的lb-eps降解重金属cr6+的效率请参见图11所示。
海水芽孢杆菌的三种类型eps回收贵金属pt,pd和rh:
(1)用氯化钯配制1ml10mg/l的pd2+溶液作为样液1;用氯铂酸配制1ml10mg/l的pt4+溶液作为样液2,用氯化铑配制1ml10mg/l的rh3+溶液作为样液3。
(2)将0.1mleps的水溶液分别置于1ml10mg/l的pd2+溶液、1ml10mg/l的pt4+溶液、1ml10mg/l的rh3+溶液以及1ml10mg/l的pd2+和1ml10mg/l的pt4+混合溶液,放置于24-28℃的恒温箱中反应2-48h,其中实验组中三种类型的eps的浓度为0.2mg/l、0.4mg/l、0.6mg/l、0.8mg/l、1.0mg/l一系列不同三种类型的eps的浓度,将样品取出,置于温度为4-8℃条件下8000-10000r/s离心处理,上清液收集待用,随后下层产物的固体用乙醇洗涤3次。
(4)将步骤(3)中的下层产物固体进行冷冻干燥后用tem和xps进行检测;
通过xps测试发现,回收到的纳米材料为pd、pt、rh以及ptpd,电化学测试发现回收到的这些贵金属纳米材料具有很好的导电性和催化性。
本实施例海水芽孢杆菌的tb-ep回收贵金属pt纳米的tem图见图12所示的。
实施例5
在本实施例中,利用蜡样芽孢杆菌的eps回收土壤中的重金属及其稀贵金属
蜡样芽孢杆菌的三种类型的eps降解土壤中的重金属离子(ni2+、pb2+、cd2+、cr6+和cu2+):
(1)用nicl2、pb(no3)2、cdcl2、k2cr2o7和cuso4配制100ml10mg/l的ni2+、pb2+、cd2+、cr6+和cu2+溶液作为样液。
(2)配制2mg/l、4mg/l、6mg/l、8mg/l、和10mg/l的nicl2、pb(no3)2、cdcl2、k2cr2o7和cu(no3)2标准溶液。
(3)将(1)中的重金属离子溶液加入土壤中,记为空白组,将(1)中的重金属离子溶液和蜡样芽孢杆菌的eps水溶液分别加入土壤中,记为实验组,放置于10-30℃的恒温箱中反应2-48h,随后,将样品取出,加入蒸馏水溶解,过滤,去除土壤和杂质,固体用蒸馏水和乙醇混合溶液洗三次,上清液用0.45μm的滤膜过滤。实验组中可溶性胞外聚合物的浓度为1mg/l、5mg/l、10mg/l、15mg/l、20mg/l、25mg/l、30mg/l、35mg/l、40mg/l、45mg/l、50mg/l一系列不同蜡样芽孢杆菌三种类型的eps的浓度。
(4)将步骤(3)中的过滤清洗后的固体进行冻干燥后,用tem和xps进行检测;
(5)将步骤(3)中的上层清液用icp-ms进行检测。
icp-ms法研究发现蜡样芽孢杆菌三种类型的eps对土壤中ni2+、pb2+、cd2+、cr6+和cu2+的去除率均高达90.00%。通过xps测试发现,从土壤回收到的纳米材料nio、pbo、cds、cr2o3和cus。电化学法结果发现回收到的这些纳米材料具有很好的导电性。
本实施例不同浓度蜡样芽孢杆菌的tb-eps降解土壤中cd2+的降解率图请参考图13所示。
蜡样芽孢杆菌的三种类型的eps回收土壤中的贵金属pt,pd和rh:
(1)用氯化钯配制1ml10mg/l的pd2+溶液作为样液1;用氯铂酸配制1ml10mg/l的pt4+溶液作为样液2,用氯化铑配制1ml10mg/l的rh3+溶液作为样液3。
(2)将(1)中的贵金属离子溶液加入土壤中,记为空白组,将(1)中的贵金属离子溶液和蜡样芽孢杆菌的eps水溶液分别加入土壤中,记为实验组,放置于10-30℃的恒温箱中反应2-48h,随后,将样品取出,加入蒸馏水溶解,过滤,去除土壤和杂质,剩余固体用蒸馏水和乙醇混合溶液洗三次,上清液用0.45μm的滤膜过滤。其中,实验组中三种类型的eps的浓度为0.2mg/l、0.4mg/l、0.6mg/l、0.8mg/l、1.0mg/l一系列不同三种类型的eps的浓度。
(3)将步骤(2)洗涤后的固体进行冷冻干燥,利用tem和xps进行检测。
通过xps测试发现,从土壤中回收到纳米材料pd,pt,rh以及ptpd,电化学测试发现回收到的这些贵金属纳米材料具有很好的导电性和催化性。并且通过tem对回收材料的形貌观察能够看到完好的纳米粒子。从土壤中进行测试的结果与从水中回收到的纳米材料相同。
通过本发明所公开的方法制备芽孢杆菌属微生物的eps,用于对重金属以及稀贵金属进行处理和回收,其主要的原理在于:三种eps的基团种类相似,只是各元素所占比例不尽相同。芽孢杆菌属微生物的eps含有蛋白质、核酸、多糖、酯类等高分子化合物,这些化合物分子内含有氨基、羧基、羟基、酰胺基等带负电的功能官能团,能有效地吸附金属离子,与金属离子发生矿化,形成生物矿化物,从而起到降低金属污染的作用。此外,通过本发明所公开的制备方法,能够最大程度的保留芽孢杆菌属中三种类型的eps中所含有的大量羟基、酰胺基和氨基功能等具有还原性和氧化性的官能团,将高价的重金属离子以及低价金属离子还原和转化,形成纳米颗粒。这不仅降低了金属的毒性,更重要的是形成了具有新的功能的纳米粒子,这些纳米材料收集后可用于催化、电池等领域,实现有毒转化为有价值金属材料,实现其二次利用。
通过本发明,能够带来如下的若干有益效果:
(1)本发明的芽孢杆菌属微生物在自然界中广泛存在且易培养,其eps的提取方法简单,环保,且成本低。
(2)本发明三种类型的eps即s-eps、lb-eps、tb-eps均是可再生的,绿色的,低成本的高分子材料,与目前重金属污染治理和稀贵金属回收方法相比,不存在使用后的环境问题,对环境和生物无毒无害,可用于绿色的金属污染治理和回收。
(3)本发明的三种类型的eps均是通过一个流程制得,即在将芽孢杆菌属微生物进行完全提取的过程中,每个过程均能够得到有效的,能够对重金属污染进行处理以及金属回收的产物,对于最终产物而言,能够大幅增加单位原料即单位芽孢杆菌属微生物的成品产量,大幅增加生产效率,产业化价值高。
(4)本发明金属污染治理和回收的方法,适用于废水和土壤中的重金属污染资源化治理和稀贵金属回收,可有效的减轻上述重金属的污染带来的危害,同时转化重金属离子,实现重金属离子功能化回收与利用。此外,还可以回收稀贵金属。三种类型的eps对重金属离子的降解率均高于为90.00%,对重金属离子功能纳米化回收率可高达80.00%。其中,三种类型的eps对六价铬的降解率均接近为99.00%,实现完全转化,转化的三氧化铬纳米材料表现出良好的半导体性能,在催化、电池等领域具有潜在的应用;三氧化铬纳米材料的回收率高达84.86%。三种类型的eps对贵金属离子功能纳米化回收率可高达85.00%,其中,在含有pt和pd的混合溶液中回收到球形ptpd纳米材料,回收率为90.03%。
尽管这里参照本发明的多个解释性实施例对本发明进行了描述,但是,应该理解,本领域技术人员可以设计出很多其他的修改和实施方式,这些修改和实施方式将落在本申请公开的原则范围和精神之内。更具体地说,在本申请公开和权利要求的范围内,可以对主题组合布局的组成部件和/或布局进行多种变型和改进。除了对组成部件和/或布局进行的变形和改进外,对于本领域技术人员来说,其他的用途也将是明显的。
- 还没有人留言评论。精彩留言会获得点赞!