一种杀菌活性水及其制备方法和应用与流程
本发明属于食品微生物领域,涉及一种杀菌活性水及其制备方法和应用。
背景技术:
果蔬,即水果和蔬菜的简称,是指可食用的水果和蔬菜。果蔬中富含人体生命健康所必需的维生素、无机盐、生物酶及植物纤维等活性功能成分,对人体健康十分有利。但是食品和农产品在生长、加工等环节容易受到微生物的污染,最终导致食品的腐败、变质等。随着人们生活水平的提高,人们对食品安全和食品的品质越来越关注。
现阶段,食品加工中设备的清洗情况并不乐观,导致这种情况的原因主要有2个,一个是食品工艺设备的清洗过程比较繁琐,另一个关键因素是食品生产厂商的缺乏足够的重视。清洗食品加工设备需要注意的方面有很多,其中,清洗水的选择和使用最为重要。水的作用不仅仅是去除设备表面的残留物,还需要用洗涤剂等对设备进行清洗,目的是清洗掉油脂污物和蛋白质污物,从而达到防止微生物繁殖的目的,那么选择一种能够有效清洗设备达到抑制微生物的生长并且成本低、环境友好的杀菌溶液就显得尤为重要。
现代果蔬的贮藏保鲜,多采用冷冻、气调、化学防腐药剂等方法。冷冻、气调保鲜方法投资大,配套动力设备和检测设备多,存在难以抑制霉菌生长和消除残留药剂等缺点,同时造成蔬果的失水而达不到保鲜的目的。化学防腐剂均以甲醛、亚硫酸盐、次氯酸钠等化学药剂喷洒、熏蒸为主,存在较严重的药物残留和环境污染问题。辐射保鲜法,投资较大,辐射技术不易严格掌控,不易推广,剂量一旦过量,即会造成一定程度的放射性污染,对人体造成危害,所以其应用受到限制。
等离子体活性水(plasmaactivatedwater,paw)是指由低温等离子体在水下或水面放电得到的液体,具有制备成本低、活性物质丰富、安全无残留等优点,并且其流动性强,在处理固态样品时具有比低温等离子体作用更均匀的处理效果。
ε-聚赖氨酸(ε-polylysine,简称ε-pl)是一种由赖氨酸单体分子在α-羧基和ε-氨基形成酰胺键而连接成的均聚氨基酸。这类直链多聚体约由20~30个赖氨酸残基组成,由一类白色链霉菌(streptomycesalbulus)代谢产生。由于ε-pl在体内可以分解为人体必需的l-赖氨酸,因此ε-pl也被认为是一种高安全性的天然食品防腐剂,具有抗菌广谱,水溶性好的特点,具有潜在的商业利用价值,已于2003年10月被美国食品药品监督管理局(foodanddrugadministration,fda)批准为安全食品保鲜剂。目前我国已批准ε-pl作为食品防腐剂应用于焙烤制品、熟肉制品以及果蔬汁等产品。
技术实现要素:
本发明的目的是解决现有的技术缺陷,提出一种杀菌活性水及其制备方法和应用,制备了一种杀菌活性水,并将该杀菌活性水与ɛ-聚赖氨酸、温度协同用于果蔬清洗与保鲜。
本发明的技术方案通过如下步骤实现:
一种杀菌活性水的制备方法,所述杀菌活性水为无菌去离子水经低温等离子体表面处理机处理后,即得杀菌活性水(paw)。
所述低温等离子体表面处理机的处理条件为:频率为18khz-60khz,功率为750w,工作气压为0.15mpa-0.4mpa,处理时间是60-100s,温度为室温。
所述杀菌活性水中氧化还原电位为478.21-587.67mv、过氧化氢含量为27.54-42.73μmol/l、no2-含量为38.65-1120.58μmol/l、no3-含量为120.98-1077.79μmol/l,ph为2.75-3.56。
一种ɛ-聚赖氨酸水溶液,利用杀菌活性水配制ɛ-聚赖氨酸水溶液。
所述ɛ-聚赖氨酸水溶液的质量浓度为0.1-5%(w/v)。
一种灭活酿酒酵母的溶液,所述溶液为杀菌活性水或ɛ-聚赖氨酸水溶液。
所述溶液在与温热协同处理灭活酿酒酵母中的应用。
所述温热协同处理的温度为25-80℃,处理时间为15-30min。
所述杀菌活性水在清洗果蔬、食品接触面以及果蔬保鲜方面的应用。
清洗果蔬时处理温度25-55℃,处理时间15min;清洗食品接触面时处理温度为70-80℃,处理时间为30min;保鲜果蔬时处理温度为50-55℃,处理时间为30min。
本发明具有以下有益效果:
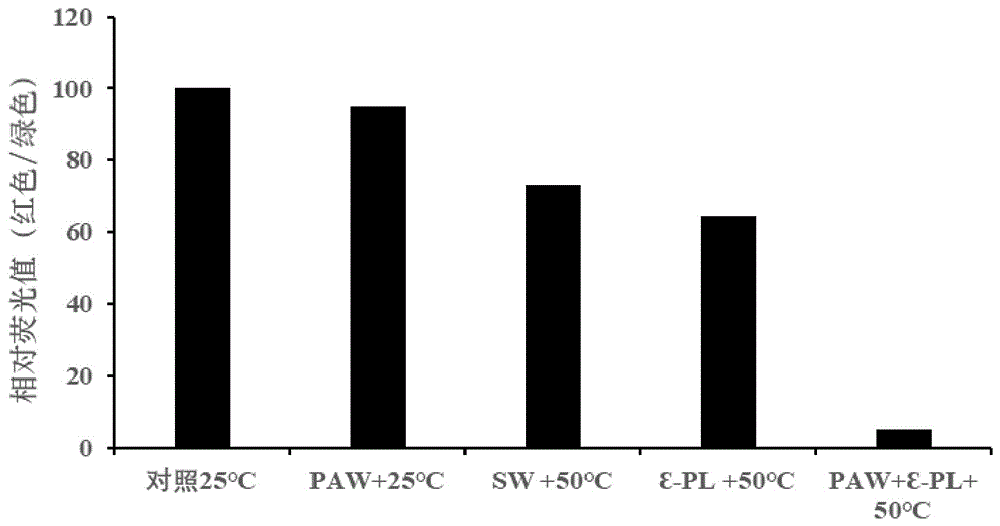
1、本申请的paw、ɛ-pl水溶液及50℃处理三者协同组酿酒酵母胞内jc-1探针红绿荧光的相对比值与未处理组细胞相比显著降低了95%,表明上述协同处理使得酿酒酵母细胞的线粒体膜电位下降。协同处理后胞外核酸的泄露如图3所示:与对照组相比,25℃+paw处理组胞外核酸浓度仅增加了0.57µg/ml,50℃+无菌水sw及50℃+ɛ-pl水溶液处理组核酸浓度分别增加了5.33µg/ml和6.18µg/ml,然而,50℃+paw+ɛ-pl处理组核酸浓度升高至25.76µg/ml;胞外蛋白浓度变化与胞外核酸变化结果一致,如图4所示,50℃+paw+ɛ-pl处理组蛋白浓度为89µg/ml,分别是25℃+paw处理组、50℃+sw处理组及50℃+ɛ-pl处理组的蛋白浓度的3.17、3.56和2.97倍。
2、本申请中paw、ɛ-pl以及温热协同能够有效杀灭葡萄表面酿酒酵母,尤其是在52.5℃条件下,与对照组相比,四个处理组都表现出有效的杀菌作用,无菌水处理组降低了1.29log10cfu/g,失活率为94.87%,单独的paw处理组降低了2.64log10cfu/g,失活率为99.77%,单独的ɛ-pl处理组降低了2.39log10cfu/g,失活率为99.59%,然而,paw+ɛ-pl协同处理组表现出显著的杀菌效果,降低了4.92log10cfu/g,失活率高达99.9983%,表明该协同技术对葡萄表面的酿酒酵母有明显的杀菌效果。
3、从机理研究来看,paw、ɛ-pl以及温热协同能够使细胞膜的通透性发生改变并且破坏细胞的结构,随着不同处理组合强度的增大,胞内核酸和蛋白的泄露也随之增加,破坏细胞的正常生理功能,从而导致细胞死亡。
4、本发明提出该协同处理方法能够灭活酿酒酵母细胞是基于杀菌活性水的特性,因活性水本身低ph以及大量含氧自由基等,能够有效灭活微生物,避免果蔬在贮藏过程中受到腐败菌污染而腐烂变质。
5、本申请采用低温等离子体活性水处理葡萄,绿色无污染,与低温等离子体直接处理相比,单位时间内葡萄处理量更大,处理效率更高;低温等离子体直接处理需关注葡萄与低温等离子体之间的距离、低温等离子体处理强度等,对低温等离子体处理技术的工艺要求高,若放电电压、距离、气体流速等工艺参数控制不当,则不但不能达到杀菌保鲜的目的,还将破坏葡萄的营养成分及色泽、硬度等品质指标,这使得低温等离子体直接预处理过程效率较低;而本发明可以减少低温等离子体直接处理前期的工艺参数的探索,大大提高了效率。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为不同协同处理后酿酒酵母细胞jc-1染色后红/绿色荧光强度比值图。
图2为不同协同处理后酿酒酵母细胞碘化丙啶(pi)染色后荧光强度比较图。
图3为不同协同处理后酿酒酵母胞外核酸浓度的变化图。
图4为不同协同处理后酿酒酵母胞外蛋白浓度变化图。
图5为不同协同处理前后酿酒酵母的扫描电镜图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例
一、菌悬液的制备
将酿酒酵母标准菌株(atcc9763)用新鲜ypd固体培养基培养传代。用无菌接种环挑取活力旺盛的单菌落接种于ypd液体培养基中,于30℃、120r/min摇床震荡培养12h至对数生长期,离心收集菌体并重悬于无菌生理盐水至108cfu/ml,备用。
二、葡萄准备及接菌
1.样品准备:挑选表面完整无破损、颜色相似、大小相似的葡萄,称重,保证重量在7g左右。
2.接菌:经准备好的葡萄样品放入装有200ml菌悬液的烧杯中,浸泡30min。经实验得到此时接在葡萄表面菌的浓度为106cfu/g。
三、杀菌活性水协同ɛ-聚赖氨酸及温热处理葡萄
1.paw的制备:采用自制的大气压射流等离子体设备处理无菌水制备paw,放电时间为90s,输入功率为750w;所制备paw的氧化还原电位为478.21-587.67mv、过氧化氢含量为27.54-42.73μmol/l、no2-含量为38.65-1120.58μmol/l、no3-含量为120.98-1077.79μmol/l,ph为2.75-3.56。
2.ɛ-聚赖氨酸及温热协同洗涤处理:将接菌后晾干的葡萄分别放入装有无菌水(sw)、paw、sw+聚赖氨酸(1%)和paw+聚赖氨酸(1%)的容器中,同时分别进行不同温度的协同处理,温度分别为25℃、50℃、52.5℃和55℃,处理时间为15min。
四、检测
1.均质拍打:将处理好的葡萄样品和洗涤液一同倒入无菌袋中拍打,得到匀浆。
2.平板计数:用0.85%无菌生理盐水将所得匀浆稀释一定的倍数,取0.1ml加入到ypd固体培养基涂板,评价杀菌效果。
结果如表1所示:
表1不同处理方式对葡萄表面酿酒酵母活菌数的影响(log10cfu/g)
以上结果显示:在25℃条件下,四个处理组都没有表现出很强的杀菌效果,但是与对照组(5.97log10cfu/g)相比,paw+ɛ-pl处理组降低了0.92log10cfu/g,失活率为87.98%;在50℃条件下,与对照组相比,paw单独处理组降低了1.11log10cfu/g,失活率为92.24%,而ɛ-pl单独处理组仅降低了0.94log10cfu/g,失活率为88.52%,但是paw+ɛ-pl处理组降低了2.09log10cfu/g,失活率为99.19%;在52.5℃条件下,与对照组相比,四个处理组都表现出有效的杀菌作用,无菌水处理组降低了1.29log10cfu/g,失活率为94.87%,单独的paw处理组降低了2.64log10cfu/g,失活率为99.77%,单独的ɛ-pl处理组降低了2.39log10cfu/g,失活率为99.59%,然而,paw+ɛ-pl协同处理组表现出显著的杀菌效果,降低了4.92log10cfu/g,失活率高达99.9983%。以上结果表明,paw+ɛ-pl+温热处理组具有显著的杀菌效果,优于各个单独处理组,并且随着协同温度的升高,协同效果也逐渐加强,杀菌效果更为明显。
五、葡萄样品的品质变化
将不同洗涤处理后的葡萄样品榨汁,测定其理化指标,包括可滴定酸、ph、可溶性固形物、还原糖、多酚含量和维生素c的测定。
上述不同处理对葡萄理化性质的影响见表2:
表2协同处理对葡萄理化性质的影响表
以上结果显示:单独的温热处理组、单独的paw处理组、单独的ɛ-pl处理组以及温热+paw+ɛ-pl处理组均未对葡萄的ph值、可滴定酸含量、可溶性固形物含量、还原糖含量、多酚含量以及维生素c含量造成显著性影响。
协同处理对葡萄色泽的影响:
表3不同协同处理对葡萄表面色泽的影响表
以上结果显示:与处理前的葡萄样品相比,单独的温热处理组、单独的paw处理组、单独的ɛ-pl处理组以及温热+paw+ɛ-pl处理组均未对葡萄的色泽造成显著性影响。
综上所述,处理前葡萄表面酿酒酵母菌活菌数为5.97log10cfu/g,在paw及ɛ-聚赖氨酸协同52.5℃处理15min条件下,达到最高的失活率(99.9983%),降低了4.92log10cfu/g,此结果优于52.5℃条件下paw单独处理组(降低了2.64log10cfu/g)和在52.5℃条件下的无菌水及ɛ-聚赖氨酸处理组(分别降低了1.29和2.39log10cfu/g)。同时,在paw及ɛ-聚赖氨酸协同25℃、50℃、和52.5℃处理15min后,葡萄的可滴定酸、ph、可溶性固形物、还原糖、多酚含量、vc含量等指标和色泽参数(l*、a*和b*)均无显著性变化。由此可见,本发明在杀菌活性水及ɛ-聚赖氨酸协同25℃、50℃和52.5℃15min处理葡萄后,有效降低了葡萄表面酿酒酵母的活菌数,并未对葡萄的理化性质及色泽等造成不良影响。
六、协同处理对酿酒酵母的影响
1.对协同处理后jc-1荧光强度比值结果如图1所示:各处理组jc-1红色/绿色荧光强度相对比值呈下降趋势,与对照组相比,25℃+paw处理组红色/绿色荧光强度相对比值仅仅下降了5%;50℃+sw处理组下降了28%;50℃+ɛ-pl处理组下降了36%;而paw、ɛ-pl及50℃三者协同时红色/绿色相对比值大幅度降低(降低95%),表明协同处理使得酿酒酵母细胞的线粒体膜电位下降。
2.协同处理后pi染色荧光强度结果如图2所示:pi是一种疏水性dna嵌入荧光染料,不能穿过活细胞的细胞质膜。当细胞膜破损后,pi会穿过细胞膜与胞内dna结合,在一定的激发波长下产生红色荧光,荧光强度随之增强。以上结果显示:与对照组相比,25℃+paw处理组酿酒酵母细胞pi荧光强度略微升高;50℃+sw、50℃+ɛ-pl处理组酿酒酵母pi荧光强度无显著变化;但是,50℃+paw+ɛ-pl处理组导致pi吸收相对荧光强度显著增强较对照组升高了154倍。结果表明paw、ɛ-pl结合温热处理后,荧光强度显著高于ɛ-pl、paw或温热单独处理,这表明该结合处理导致酿酒酵母细胞质膜通透性增强。
3.协同处理后核酸蛋白泄露结果,如图3胞外核酸浓度的变化和图4胞外蛋白浓度的变化,结果显示:与对照组相比,25℃+paw处理组核酸水平仅仅增加了0.57µg/ml,50℃+sw及50℃+ɛ-pl处理组核酸水平分别增加了5.33µg/ml、6.18µg/ml,然而,50℃paw+ɛ-pl处理组核酸水平升高至25.76µg/ml;胞外蛋白浓度变化与核酸一致,其中,50℃+paw+ɛ-pl处理组蛋白水平为89µg/ml,分别是25℃+paw处理组、50℃+sw处理组及50℃+ɛ-pl处理组的蛋白水平的3.17、3.56和2.97倍。
以上结果表明,paw、ɛ-pl及温热协同处理会使酿酒酵母细胞膜的通透性发生改变,并随着不同处理组合强度增大,酿酒酵母胞内核酸和蛋白的泄露也随之增加,破坏了细胞的正常生理功能,从而导致细胞死亡,且其效果比单独热处理、单独paw处理及单独ɛ-pl处理更明显。因此,细胞膜通透性的变化可能是paw、ɛ-pl及温热协同灭活酿酒酵母的可能原因之一。
4.协同处理前后酿酒酵母扫描电镜结果如图5所示:对照组的酿酒酵母细胞表面光滑完整,呈正常的球形或椭圆形,饱满无破损现象;paw处理组酿酒酵母细胞形态较对照组出现轻微粗糙,但是大多数仍为光滑状态;50℃处理组部分酿酒酵母细胞表面出现褶皱和凹陷;经paw、ɛ-pl协同50℃处理后,酿酒酵母细胞表面凹凸不平更为明显,大部分细胞表面都出现大面积褶皱和凹陷,与对照组细胞相比,细胞皱缩,且细胞体积减小。结果表明,经paw、ɛ-pl协同50℃处理能够导致酿酒酵母的细胞结构发生严重的损伤,且这种作用是不可逆的,从而破坏细胞的正常生理功能,最终导致细胞死亡,这可能是paw温热协同处理导致酿酒酵母死亡的主要原因。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!