一种以卞胺为配基的高效疏水相互作用色谱介质、制备方法及其在蛋白质复性与纯化的应用与流程
本发明属于高效液相色谱技术领域,具体涉及一种以卞胺为配基的高效疏水相互作用色谱介质及其制备方法,和其用于高效液相色谱中对蛋白质重组链霉亲和素的复性与纯化的应用。
背景技术
链霉亲和素(stv)是放线菌培养过程中产生的一种外分泌蛋白质,能高度特异性结合水溶性维生素(d-生物素),从而形成生物素-链霉亲和素系统(biotin-streptavidinbindingsystem,bsa)。该系统不影响生物大分子的活性,在实际应用中具有显著的优越性,表现为亲和力强、灵敏度高、特异性强、稳定性好等,且有信号逐级放大的功能,在免疫学、分子生物学及组织化学中具有广泛的应用。
目前对stv的分离纯化方法主要包括硫酸铵沉淀、离子交换层析以及偶联有亚氨基生物素的琼脂糖凝胶亲和纯化等方法。经典法纯化stv的过程中,需要使用硫酸铵对其沉淀,但硫酸铵不仅会使培养液中的stv沉淀,同时还会使内源性蛋白质酶被浓缩、沉淀,导致蛋白质酶作用加强,结果使stv分子降解,这种方法的缺点是过程长,耗时大。hofmann[pnas,1980,77(8):4666-4668]等首次采用偶联有亚氨基生物素的sepharose4b亲和纯化链霉亲和素,纯化产物纯度高,但价格昂贵且色谱柱体积有限,难以应用于产业化制备链霉亲和素;之后bayer[jbiochembiophmeth,1986,13(2):103-112]使用亲和色谱法分离纯化stv,将发酵获得的培养液离心得到的滤液溶解在ph11.0的氢氧化钠溶液中,然后将该溶液与合成的凝胶树脂直接混合,搅拌过滤,用平衡缓冲液洗脱基线平衡,洗涤后的树脂装柱并用缓冲液洗脱,重复该过程直到stv被洗脱完全,收集馏分,最后冻干得到纯化的stv。使用这种方法步骤繁琐,且过程中的损失较大。
技术实现要素:
针对现有技术的缺陷,本发明提供一种以卞胺为配基的高效疏水相互作用色谱介质、制备方法及其在蛋白质重组链霉亲和素的复性与纯化的应用,复性效率高,活性回收率高,复性后重组链霉亲和素的纯度高。
一种以卞胺为配基的高效疏水相互作用色谱介质,所述高效疏水相互作用色谱介质的结构式如下:
上述以卞胺为配基的高效疏水相互作用色谱介质的制备方法,包括以下步骤:
(1)硅胶活化;
(2)制备环氧化硅胶:按照1g:50ml将步骤(1)得到的活化硅胶加入无水甲苯中,超声处理3-5min,然后在搅拌条件下向其中缓慢加入硅烷偶联剂,所述活化硅胶和硅烷偶联剂的质量体积比为1g:1ml~1g:2ml,升温至90-120℃,回流并搅拌9-12h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即得到环氧硅胶;
(3)环氧开环制备高效疏水相互作用色谱介质:按照体积比1:200,将苄胺加入干燥的1,4-二氧六环溶液中,超声处理3-5min,向其中加入环氧硅胶,所述环氧化硅胶和卞胺的质量比为1:2~1:4,超声处理3-5min,然后在80℃下回流并搅拌7h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即可。
优选地,步骤(1)所述硅胶活化的步骤具体如下:按照质量体积比1g:10ml~1g:20ml将未活化的硅胶加入质量浓度为20%的盐酸溶液中,在120℃下回流并搅拌2-6h,用蒸馏水洗涤抽滤至中性,在100~150℃真空干燥箱中干燥12~24h,即得到活化硅胶。
优选地,所述未活化的硅胶孔径为80~200å、粒径为5~10μm的球状硅胶。
优选地,步骤(2)所述硅烷偶联剂为γ-缩水甘油醚氧丙基三甲氧基硅烷。
上述以卞胺为配基的高效疏水相互作用色谱介质的应用,所述应用为将所述高效疏水相互作用色谱介质应用于重组链霉亲和素的复性和纯化。
优选地,所述重组链霉亲和素的复性和纯化具体如下:
(1)将链霉亲和素末端的疏水氨基酸去掉,合成重组链霉亲和素氨基酸片段,含有126个氨基酸;
(2)将步骤(1)得到的重组链霉亲和素氨基酸片段在大肠杆菌中表达,然后离心、离心得到的沉淀经过超声处理3-5min、用tris-hcl缓冲液分别洗涤3次、再次离心,离心得到的包涵体按照1g:10ml的比例溶解于变性剂缓冲液中,得到含有重组链霉亲和素的变性抽提液;所述变性剂缓冲液为8.0mol/lurea或6.0-7.0mol/l盐酸胍,与10.0-20.0mmol/ltris-hcl缓冲液、0.5-1mmol/ledta的混合液,且ph为7.5-8.5;
(3)将所述高效疏水相互作用色谱介质装填在高效液相色谱仪的色谱柱中,然后将步骤(2)得到的变性抽提液直接进样100μl,进入色谱柱,用流动相a冲洗色谱柱至基线平稳,然后采用流动相b从0-100%线性梯度洗脱20-30min,在达到100%时延长洗脱10-20min,流动相a和流动相b的流速均为1.0-2.0ml/min,检测波长为280nm,收集色谱馏分,透析、冷冻干燥,即得到重组链霉亲和素;
所述流动相a为2.0-3.0mol/l(nh4)2so4、2.0-3.0mol/lurea、10-20.0mmol/lkh2po4的混合液,且ph为7.0-7.5;
所述流动相b为2.0-3.0mol/lurea(脲)和10-20.0mmol/lkh2po4的混合液,且ph为7.0-7.5。
优选地,步骤(2)中所述重组链霉亲和素氨基酸片段在大肠杆菌中表达具体如下:在37℃下,培养基为添加50%体积浓度的葡萄糖、0.2-2.0mmol/l的iptg的2yt培养基中诱导表达2-6h。
优选地,步骤(2)中所述用tris-hcl缓冲液分别洗涤3次中,3次洗涤采用的tris-hcl缓冲液分别记为:一次洗涤缓冲液ⅰ、二次洗涤缓冲液ⅱ、三次洗涤缓冲液ⅲ,分别如下:
一次洗涤缓冲液ⅰ为10.0-20.0mmol/l的tris-hcl缓冲液,且ph为8.0;
二次洗涤缓冲液ⅱ为10.0-20.0mmol/ltris-hcl缓冲液,且ph为7.5-8.5,其中还添加1%体积浓度的triton(聚乙二醇辛基苯基醚);
三次洗涤缓冲液ⅲ为10.0-20.0mmol/ltris-hcl缓冲液,且ph为7.5-8.5,其中还添加0.5%体积浓度的doc(脱氧胆酸钠)。
优选地,步骤(1)中所述重组链霉亲和素氨基酸片段的氨基酸序列如seqidno.1所示。
本发明所述2yt培养基为现有技术中的2yt培养基,具体配方如下:每1l超纯水中,溶解胰蛋白胨16g、酵母粉10g、氯化钠5g。
本发明所述透析采用现有技术,透析袋的截留分子量为6000,透析液为超纯水,每个4小时换一次透析液。
本发明中iptg为异丙基-β-d-硫代吡喃半乳糖苷;urea为脲。
本发明的优点:
本发明以苄胺作为配基,制备的高效疏水相互作用色谱介质,该介质的分子结构中既含有较强的疏水作用基团(苯基),又含有弱的静电作用基团,能装填于色谱柱,用于高效液相色谱中重组链霉亲和素复性与纯化,流动相中添加了低浓度的小分子脲,复性效率高,活性回收率高,复性后重组链霉亲和素的纯度高。
附图说明
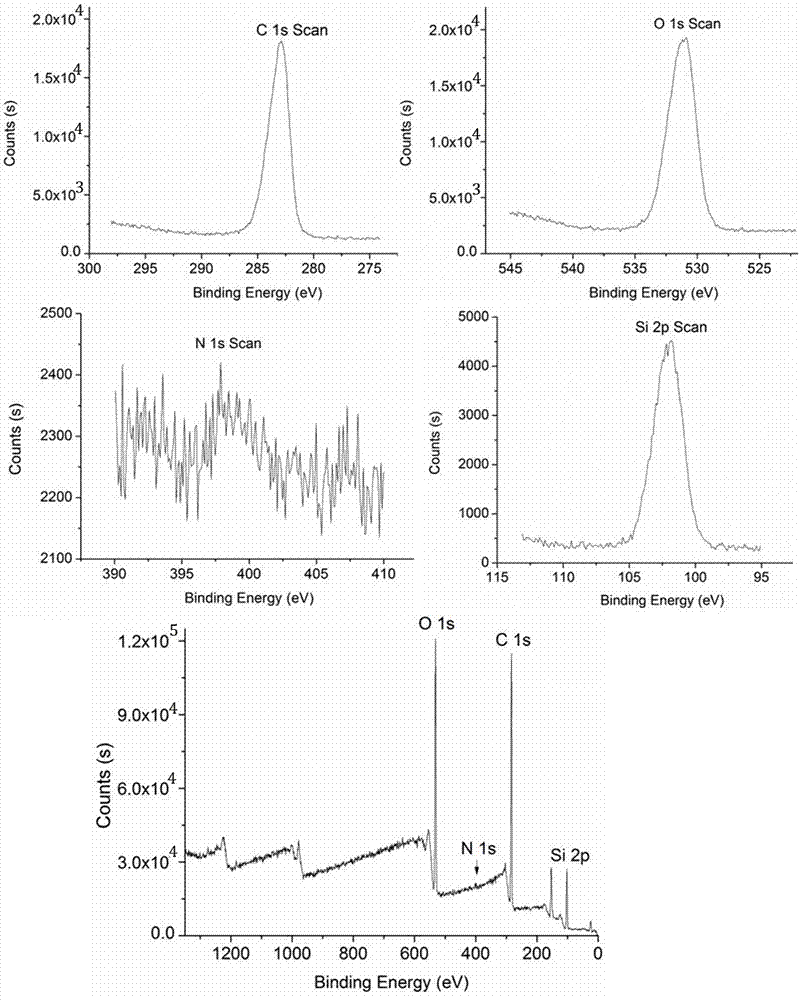
图1实施例3制备的高效疏水相互作用色谱介质的x射线光电子能谱图(xps图);其中,横坐标为结合能(bindingenergy),纵坐标为相对强度(counts)。
图2重组链霉亲和素复性与同时纯化的色谱图,其中,横坐标为保留时间(time),纵坐标为波长280nm处的紫外吸收值(mau);其中,1为馏分。
图3复性与纯化前后rhstv的sds-page分析,其中,条带1:蛋白质分子量标准;条带2:未诱导表达的重组链霉亲和素;条带3:诱导表达后的重组链霉亲和素;条带4:经过色谱柱复性纯化后的馏分1。
图4复性与纯化前后rhstv的圆二色光谱分析;其中,横坐标为波长值(nm),纵坐标为蛋白在圆二色光谱仪下的信号响应值(mdeg);曲线1:溶解于8mol/l脲的rhstv;曲线2:经色谱柱分离纯化后的rhstv色谱馏分。
具体实施方式
实施例1
一种以卞胺为配基的高效疏水相互作用色谱介质的制备方法,包括以下步骤:
(1)硅胶活化:按照质量体积比1g:15ml将未活化的硅胶加入质量浓度为20%的盐酸溶液中,在120℃下回流并搅拌2h,用蒸馏水洗涤抽滤至中性,在100℃真空干燥箱中干燥24h,即得到活化硅胶;其中,所述未活化的硅胶孔径为80~200å、粒径为5~10μm的球状硅胶;
(2)制备环氧化硅胶:按照1g:50ml,将步骤(1)得到的活化硅胶加入无水甲苯中,超声处理3min,使活化硅胶分散均匀,然后在搅拌条件下向其中缓慢加入硅烷偶联剂,所述活化硅胶和硅烷偶联剂的质量体积比为1g:1ml,升温至90℃,回流并搅拌10h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即得到环氧硅胶;所述硅烷偶联剂为γ-缩水甘油醚氧丙基三甲氧基硅烷;
(3)环氧开环制备高效疏水相互作用色谱介质:按照体积比1:200,将苄胺加入干燥的1,4-二氧六环溶液中,超声处理3min,使分散均匀,向其中加入环氧硅胶,所述环氧化硅胶和卞胺的质量比为1:3,超声处理3min使分散均匀,然后在80℃下回流并搅拌7h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即可,得到以卞胺为配基的高效疏水相互作用色谱介质。
实施例2
一种以卞胺为配基的高效疏水相互作用色谱介质的制备方法,包括以下步骤:
(1)硅胶活化:按照质量体积比1g:20ml将未活化的硅胶加入质量浓度为20%的盐酸溶液中,在120℃下回流并搅拌6h,用蒸馏水洗涤抽滤至中性,在150℃真空干燥箱中干燥12h,即得到活化硅胶;其中,所述未活化的硅胶孔径为80~200å、粒径为5~10μm的球状硅胶;
(2)制备环氧化硅胶:按照1g:50ml,将步骤(1)得到的活化硅胶加入无水甲苯中,超声处理5min,使活化硅胶分散均匀,然后在搅拌条件下向其中缓慢加入硅烷偶联剂,所述活化硅胶和硅烷偶联剂的质量体积比为1g:2ml,升温至120℃,回流并搅拌9h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即得到环氧硅胶;所述硅烷偶联剂为γ-缩水甘油醚氧丙基三甲氧基硅烷;
(3)环氧开环制备高效疏水相互作用色谱介质:按照体积比1:200,将苄胺加入干燥的1,4-二氧六环溶液中,超声处理5min使分散均匀,向其中加入环氧硅胶,所述环氧化硅胶和卞胺的质量比为1:4,超声处理5min使分散均匀,然后在80℃下回流并搅拌7h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即可,得到以卞胺为配基的高效疏水相互作用色谱介质。
实施例3
一种以卞胺为配基的高效疏水相互作用色谱介质的制备方法,包括以下步骤:
(1)硅胶活化:按照质量体积比1g:10ml将未活化的硅胶加入质量浓度为20%的盐酸溶液中,在120℃下回流并搅拌5h,用蒸馏水洗涤抽滤至中性,在120℃真空干燥箱中干燥18h,即得到活化硅胶;其中,所述未活化的硅胶孔径为80~200å、粒径为5~10μm的球状硅胶;
(2)制备环氧化硅胶:按照1g:50ml,将步骤(1)得到的活化硅胶加入无水甲苯中,超声处理4min,使活化硅胶分散均匀,然后在搅拌条件下向其中缓慢加入硅烷偶联剂,所述活化硅胶和硅烷偶联剂的质量体积比为1g:1ml,升温至110℃,回流并搅拌12h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即得到环氧硅胶;所述硅烷偶联剂为γ-缩水甘油醚氧丙基三甲氧基硅烷;
(3)环氧开环制备高效疏水相互作用色谱介质:按照体积比1:200,将苄胺加入干燥的1,4-二氧六环溶液中,超声处理4min使分散均匀,向其中加入环氧硅胶,所述环氧化硅胶和卞胺的质量比为1:2,超声处理4min使分散均匀,然后在80℃下回流并搅拌7h,然后用甲醇、水、甲醇洗涤抽滤,重复洗涤抽滤5次,在60℃下真空干燥12h,即可,得到以卞胺为配基的高效疏水相互作用色谱介质。
一.xps
将实施例3制备的高效疏水相互作用色谱介质做xps检测,结果见图1。通过图1可以看出:在309.8ev附近出现了氮元素1s的谱峰,对应为卞胺中的氮元素;在531.1ev、282.9ev、102.0ev附近分别出现了氧元素ls谱峰、碳元素1s谱峰、硅元素的2p谱峰,证明卞胺基团成功键合于硅胶基质上。
对实施例1、2制备得到物质做xps检测,结果与实施例3的相同,说明实施例1、2、3制备得到物质结构式为:
实施例4
将实施例3制备得到的以卞胺为配基的高效疏水相互作用色谱介质用于重组链霉亲和素的复性和纯化,具体方法如下:
(1)将链霉亲和素末端的疏水氨基酸去掉,合成重组链霉亲和素氨基酸片段,氨基酸序列如seqidno.1所示,含有126个氨基酸;
(2)将步骤(1)得到的重组链霉亲和素氨基酸片段在大肠杆菌中表达,具体为:在37℃下,培养基为添加50%体积浓度的葡萄糖、0.2-2.0mmol/l的iptg的2yt培养基中诱导表达2-6h;将表达得到的产物离心、离心得到的沉淀经过超声处理4min、用tris-hcl缓冲液分别洗涤3次、再次离心,离心得到的包涵体按照1g:10ml的比例溶解于变性剂缓冲液中,得到含有重组链霉亲和素的变性抽提液;
所述变性剂缓冲液为8.0mol/lurea,与10.0mmol/ltris-hcl缓冲液、1mmol/ledta的混合液,且ph为8.5;
3次洗涤采用的tris-hcl缓冲液分别记为:一次洗涤缓冲液ⅰ、二次洗涤缓冲液ⅱ、三次洗涤缓冲液ⅲ,分别如下:
一次洗涤缓冲液ⅰ为20.0mmol/l的tris-hcl缓冲液,且ph为8.0;
二次洗涤缓冲液ⅱ为20.0mmol/ltris-hcl缓冲液,且ph为8.0,其中还添加1%triton;
三次洗涤缓冲液ⅲ为20.0mmol/ltris-hcl缓冲液,且ph为8.0,其中还添加0.5%doc;
(3)采用lc-20a高效液相色谱仪,将所述高效疏水相互作用色谱介质装填在高效液相色谱仪的色谱柱(150×4.6mmi.d.)中,然后将步骤(2)得到的变性抽提液直接进样100μl,进入色谱柱,用流动相a冲洗色谱柱至基线平稳,然后采用流动相b从0-100%线性梯度洗脱20min,在达到100%时延长洗脱20min,流动相a和流动相b的流速均为1.0ml/min,检测波长为280nm,收集色谱馏分,分离的色谱图见图2;采用截留分子量为6000的透析袋、透析液为超纯水,将收集的馏分装入透析袋中,放入透析液中进行透析,每隔4小时换一次透析液,然后冷冻干燥,即得到重组链霉亲和素;
所述流动相a为3.0mol/l(nh4)2so4、3.0mol/lurea、20.0mmol/lkh2po4的混合液,且ph为7.0;
所述流动相b为3.0mol/lurea和20.0mmol/lkh2po4的混合液,且ph为7.0-7.5。
二.重组链霉亲和素的理化性能检测
首先,配制缓冲液,简称缓冲液a,具体为200mmol/l的(nh4)2co3,且ph为8.9;用缓冲液a配制0.1mg/ml生物素标准品;然后将实施例4最终得到的重组链霉亲和素(rhstv)透析称重,并用缓冲液a溶解,浓度为0.1mg/ml。在紫外波长233nm下,通过其结合生物素的量测定rhstv中加入生物素前后的吸光值的变化计算rhstv的活性,即以1毫克rhstv结合生物素微克数的多少来表示rhstv的活性。当rhstv与生物素结合量越大时,说明两者的结合能力越强,其活性越大,测的经固定相纯化后的rhstv的活性回收率为94.3%。
利用sds-15%page法分析目标蛋白的纯度,结果见图3,得到其纯度为93.3%。
对复性与纯化前后rhstv的圆二色光谱分析,结果见图4,从中可以看出在远紫外区(185-260nm)时,溶解于8mol/l脲的包涵体为变性状态,在200nm处呈正峰,而纯化后的rhstv在200nm附近处呈现负峰,为α-螺旋的特征峰,说明纯化后的rhstv二级结构发生变化,呈天然状态。
sequencelisting
<110>西北大学
<120>一种以卞胺为配基的高效疏水相互作用色谱介质及其制备方法与应用
<130>2018.08.20
<160>1
<170>patentinversion3.3
<210>1
<211>126
<212>prt
<213>人工合成
<400>1
alaglualaglyilethrglythrtrptyrasnglnleuglyserthr
151015
pheilevalthralaglyalaaspglyalaleuthrglythrtyrglu
202530
seralavalglyasnalagluserargtyrvalleuthrglyargtyr
354045
aspseralaproalathraspglyserglythralaleuglytrpthr
505560
valalatrplysasnasntyrargasnalahisseralathrthrtrp
65707580
serglyglntyrvalglyglyalaglualaargileasnthrglntrp
859095
leuleuthrserglythrthrglualaasnalatrplysserthrleu
100105110
valglyhisaspthrphethrlysvallysproseralaala
115120125
- 还没有人留言评论。精彩留言会获得点赞!