PDMS基底的表面修饰方法和微流控装置与流程
本发明属于微流控技术领域,具体涉及一种pdms基底的表面修饰方法和微流控装置。
背景技术:
近年来,微流控技术的发展迅速,在许多传统学科,如分子生物学,药物开发,医学诊断学和材料科学中的到了应用,革新了传统技术。但是目前,微流体通道的特异性吸附问题,即流体成分不可逆地粘附在通道表面,仍然是基于pdms材料的微流控芯片尚未解决的问题。正是由于基于pdms的微流控装置材料的非特异性吸附问题,限制了其在血浆和全血样品中的应用。通道表面的吸附问题会引起一系列血液凝固和血栓形成,阻塞通道并破坏芯片正常功能,增加污染的风险,增加清洁和操作的成本。因此,大多数基于pdms的微流控装置应用在血液分析中需要稀释全血样本。诸如氟橡胶弹性体、注入液体的多孔材料和聚四氟乙烯已被用作以pdms为基质的微流控装置的替代物,以便减少有限应用的污染。物理的和化学的改性方法也进行了研究,以改进防污性能的短期稳定性和复杂的制造工艺。
聚二甲基硅氧烷(pdms)由于其成本较低,生物兼容性强,透明透气而成为在学术实验室中使用的最普遍的微流体基材。pdms材料在正常情况下是疏水性的,因此可以通过疏水性相互作用发生非特异性吸附。pdms芯片的应用受到该特性的严重限制:(i)分子(特别是大生物分子)在其表面上的吸附效果明显;(ii)将非极性和弱极性分子吸收到pdms本体中;(iii)将大分子pdms中的小分子浸出到溶液中;(iv)与有机溶剂不相容。因此,当需要定量分析(试剂粘附到通道壁上和扩散到pdms空隙中)或者涉及有机溶剂时,需要特别注意。
teflon(特氟龙)微流控显示出对各种化学品的良好惰性和对所有溶剂的耐腐蚀性。但是,非特异性吸附问题依然存在,尤其是生物分子。另外teflon材料的微流控芯片的制备成本较高,工艺繁琐,不利于该技术的推广。通过甲基丙烯酸甲酯的聚合形成的聚甲基丙烯酸甲酯(pmma)以其商品名plexiglas和lucite广为人知。pmma模型可以通过热压成型或注塑成型而形成,并已经证明了几种不同的结合形成微流控通道的方法。然而pmma的表面电荷是负的,溶液中的带电分子会有静电吸附。
由于聚乙二醇(peg)的掺入可能有助于减少蛋白质和细胞的非特异性吸附,我们可以使用具有抗小分子渗透性和非特异性蛋白质吸附超时的聚乙二醇二丙烯酸酯(pegda)材料来构建微流体。然而尽管peg涂层通常能成功地抑制蛋白质的非特异性吸附,但是它们可能会引起不良的二次反应。
因此,现有技术有待改进。
技术实现要素:
本发明的目的在于克服现有技术的上述不足,提供一种快捷方便的pdms基底的表面修饰方法和微流控装置,旨在解决现有以pdms为基底的微流控装置具有一定程度的非特异性吸附,从而限制了其在处理血浆和全血样品中应用的技术问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明一方面提供一种pdms基底的表面修饰方法,包括如下步骤:
提供pdms基底;
将所述pdms基底置于硅油中,进行静置浸润处理。
本发明提供一种对pdms基底的表面修饰方法,该表面修饰方法直接将pdms基底置于硅油中静置浸泡。由于硅油和pdms基底中的pdms材料具有相似的化学结构,使得硅油可以更好地浸润在pdms基底内,并对表面的pdms材料进行修饰。修饰后得到的pdms基底具有很好的疏水性,而且材料结构性能稳定、表面光滑,特别是对血液具有很好的抗污染能力,因此在血液分析领域中具有很好的应用。
本发明另一方面提供一种微流控装置,包括pdms基底,所述pdms基底由本发明的上述表面修饰方法进行修饰处理。
本发明提供的微流控装置中的pdms基底经过本发明特有的修饰方法进行了表面修饰处理,修饰后的pdms基底支持具有很好的疏水性,而且材料结构性能稳定、表面光滑,特别是对血液具有很好的抗污染能力,因此该微流控装置在血液分析领域中具有很好的应用。
附图说明
图1为本发明实施例1中pdms芯片的浸润修饰的示意图;
图2为本发明实施例1中pdms基底的原材料与硅油材料的示意图;
图3为本发明实施例2中硅油修饰的浸润型pdms的溶胀比率测试结果图;
图4为本发明实施例2中去离子水和未稀释血滴在浸润型pdms膜和常规pdms膜上的接触角对比图;
图5为本发明实施例2中未稀释血液滴在浸润型pdms膜上的滑动程度图;
图6(a)为本发明实施例2中未稀释血液滴在常规pdms膜上室温孵育10min后的切面角度测量图(45°倾角的板上);
图6(b)为本发明实施例2中未稀释血液分别滴在常规的pdms膜上和浸润型pdms膜上室温下孵育10min后结果图(90°左右倾角的板上);
图7为本发明实施例2中未稀释血液滴在浸润型pdms膜上滚动而保留在常规pdms膜上的时间序列图像(板的倾斜角是45°);
图8为本发明实施例3中含荧光染料的全血滴在浸润型pdms膜和常规pdms膜上,清洗前后的血液残留物对比图;
图9为本发明实施例3中在不同的培养时间内浸润型pdms膜和常规pdms膜上的血液残留物的荧光图像;
图10为本发明实施例3中在浸润型pdms膜和常规pdms膜上的血液残留物的荧光强度数据图(以两个pdms膜表面上的染料液滴作对照);
图11为本发明实施例3中浸润型pdms膜和常规pdms膜上上的血红素和血红蛋白进行质谱分析检测图;
图12为本本发明实施例4中荧光溶液处理浸润型pdms通道和常规pdms通道,全血样品中加入玫瑰红染料,再用pbs洗涤的前后对比图(比例尺:50μm);
图13为本发明实施例4中荧光溶液处理浸润型pdms通道和常规pdms通道,在pbs洗涤前后血液样品的荧光强度图测试防污性能图;
图14为本发明实施例4中荧光溶液处理浸润型pdms通道和常规pdms通道,在pbs洗涤前后血液样品的荧光强度数据图;
图15为本发明实施例5中不同尺寸的浸润型pdms微流控阀进行血流控制的效果图:图中水平方向为宽度尺寸分别为40μm,60μm和100μm的控制层,垂直方向是宽度为100μm的流道;
图16为本发明实施例5中100μm,60μm和40μm三种不同控制层尺寸下,微流控阀逐渐关闭的未稀释血液的流动数据图;
图17为本发明实施例5中100μm,60μm和40μm三种不同控制层尺寸下,微流控阀逐渐打开的未稀释血液的流动数据图。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
一方面,本发明实施例提供了一种快捷简便的pdms基底的表面修饰方法,包括如下步骤:
s01:提供pdms基底;
s02:将所述pdms基底置于硅油中,进行静置处理。
本发明实施例提供一种对pdms基底的表面修饰方法,该表面修饰方法直接将pdms基底置于硅油中静置浸泡,由于硅油和pdms基底中的pdms材料具有相似的化学结构,使得硅油可以更好地浸润在pdms基底内,并对表面的pdms材料进行修饰。修饰后得到的pdms基底具有很好的疏水性,而且材料结构性能稳定、表面光滑,特别是对血液具有很好的抗污染能力,因此在血液分析领域中具有很好的应用。
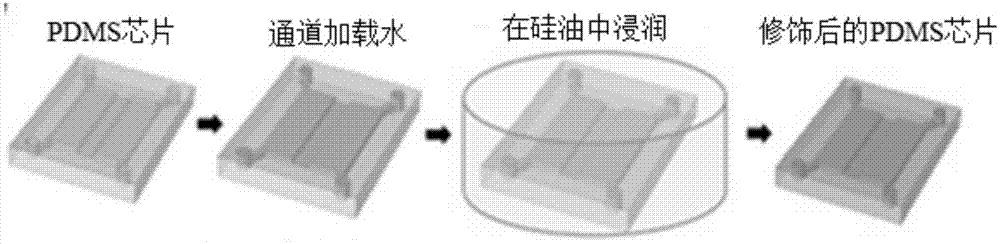
进一步地,在上述步骤s01中,本发明实施例的所述pdms基底包括pdms薄膜和/或pdms微流控芯片。该表面修饰是对基底材料的表面修饰,既可以是pdms薄膜的膜表面修饰,也可是pdms微流控芯片内部的微流控通道表面修饰,即该表面修饰的位置在pdms基底的内表面和外表面均可,只有将pdms基底完全浸没于硅油中均可以实现修饰。如图1所示,即为本发明一实施例的pdms芯片的浸润修饰的示意图。
本发明实施例所述的修饰后的pdms、浸润后的pdms、浸润型pdms、或硅油修饰的浸润型pdms,即指本发明实施例的pdms基底的表面修饰方法得到的pdms,既可以是pdms膜、也可以是pdms芯片中的微通道或微流控阀膜。而本发明实施例所述的常规的pdms或未修饰的pdms,即指未经本发明实施例的表面修饰方法浸润处理的pdms。
进一步地,在上述步骤s02中,所述硅油为液态的、三甲基甲硅烷氧基封端的聚二甲基硅氧烷。以三甲基甲硅烷氧基封端的聚二甲基硅氧烷的分子结构式为:(ch3)3sio(si(ch3)2o)nsi(ch3)3)。该硅油的对分子量取值范围可以为3500-4500,本发明实施例中优选4000。更优选地,所述pdms基底以三甲基甲硅烷氧基封端的聚二甲基硅氧烷和固化剂为原料制成;其中,三甲基甲硅烷氧基封端的聚二甲基硅氧烷和固化剂的质量比为(9-11):1,优选10:1。固化剂选自
更进一步地,所述静置处理的时间为12-18h。该时间范围内,硅油可以对pdms的表面达到很好的修饰效果。本发明一实施例中,将所述pdms基底置于硅油中16h后达到平衡,其溶胀比(sr)约为1.3,浸泡后的pdms基底体积保持稳定超过3天,表明浸润的pdms材料具有良好的稳定性。
为了改善pdms表面的抗污性能,特别是对于血液接触,现有技术与工作已经做了大量努力,但效果始终不理想。本发明实施例首次将液态的硅油对固态pdms基底进行浸润的表面修饰方法应用于微流控通道和功能装置中,并成功地应用于非稀释的血液操作。结合微流控技术的优点,这种简单的液体浸润修饰方法可以方便地应用于目前基于pdms的微流控技术,并为进一步的应用提供了一个方便的抗污微环境。
另一方面,本发明实施例提供一种微流控装置,包括pdms基底,所述pdms基底由本发明实施例的上述表面修饰方法进行修饰处理。
本发明实施例提供的微流控装置中的pdms基底经过本发明实施例特有的修饰方法进行了表面修饰处理,修饰后的pdms基底具有很好的疏水性,而且材料结构性能稳定、表面光滑,特别是对血液具有很好的抗污染能力,因此该微流控装置在血液(血浆或全血样品)分析领域中具有很好的应用。
本发明实施例中,通过将上述修饰后的pdms基底应用到微流控装置中,这样可以产生光滑和抗污染的通道和阀门。并且在人类心血管循环系统的启发下,我们设计并制作了一个封闭的基于微流体的网络通道,以模拟非稀释的全血循环分析的微循环系统,经硅油浸润修饰的微循环系统为全血血液动力学分析提供了一个闭合环流平台,具有光滑和抗污的特性,能够稳定、准确地控制全血循环。
由于血液凝固和表面上的血液成分的非特异性吸附,现有基于pdms的微流控系统在血液分析中的应用受到限制。同时,由于全血样本具有高粘度,因此也需要稀释。而本实施例通过试验验证,硅油修饰的pdms结构化表面,表现出异常的抗生物污损性能,因此得到具有超级光滑和抗污性表面的浸润型pdms微流控系统。
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
实施例1
1.1抗污pdms薄膜和pdms微流控芯片制造:
(1)对于pdms薄膜,使用固化剂与液态的三甲基甲硅烷氧基封端的聚二甲基硅氧烷(分子量为4000,cas号:9016006,alfa
(2)pdms微流控芯片:对于pdms通道,根据我们先前使用的软光刻技术通过将聚二甲基硅氧烷(pdms)(10:1有机硅弹性体与固化剂,sylgard184,sylgard184,dow
如图1所示,将pdms薄膜和pdms微流控芯片完全浸没在硅油(三甲基甲硅烷氧基封端的聚二甲基硅氧烷,分子量4000)液体中过夜。由于具有pdms基底(即pdms薄膜和pdms微流控芯片)使用与硅油具有相同的材料,化学性质相似,硅油即液态pdms能够快速且容易地浸入到固体pdms基底中。将浸润修饰后的pdms基底取出,除去残留的pdms液体,并用去离子水洗涤,最后置于室温下干燥;即得到硅油表面修饰后的pdms薄膜和pdms微流控芯片。
1.2硅油修饰的浸润型pdms芯片的阀门制作:
为了制作包含弧边截面单片阀(amvs)的微流控芯片,制造了流体层的pdms主模具和控制层的pcb主模具。将pdms预聚物(5基料:1固化剂)倒在pdms母模上在65℃下固化30min以制备流体层。在控制层主模(kw-4a,中国科学院微电子研究所)上旋涂pdms预聚物(20基料:1固化剂),并在65℃烘箱中固化40min,对齐后,将流体层和控制层pdms在65℃烘箱中固化50min。微流控芯片在65℃烘箱中过夜使完全固化。然后,将pdms微流控芯片装载去离子水并浸入液态的三甲基甲硅烷氧基封端的聚二甲基硅氧烷(分子量为4000)中过夜,表面上的液态pdms用棉纸去除。将样品加载到流动通道中,通过数字注射器泵控制流速,同时用去离子水填充控制通道,并通过注射泵手动或数字控制。将注射器从刻度标记1.0推至0.6,给出1.6×105pa的正压,同时将另一个腔室的注射器从0.6升至1.0。当血液从腔内流出后,我们将注射器拉回到刻度线1.0处,再将注射器从1.0推到0.6,并重复上述步骤。使用红细胞作为示踪物进行分布预测,并用leicalasaf软件进行分析。
1.3全血样本制备:
在大鼠深度麻醉下,我们通过心脏穿刺从大鼠心脏处收集500μl全血。全血采用市售的抗凝剂处理试管((
实施例2
2.1首先测试了硅油修饰的浸润型pdms的溶胀比率,其定义为硅油浸润型pdms的体积与常规pdms的体积之比。如图3所示,常规pdms在不同的硅油浸泡时间内体积有所增加,并在16h后达到平衡,其溶胀比(sr)约为1.3。硅油浸泡后体积保持稳定超过3天,表明硅油修饰的浸润型pdms材料具有良好的稳定性。
2.2然后测量了硅油修饰的浸润型pdms与常规pdms的接触角,如图4所示,浸润型pdms与常规pdms保持有相同的表面疏水性质:去离子水在浸润型pdms表面上的接触角为107.3±1.1°(常规pdms:~115.9°),全血滴在浸润型pdms表面上的接触角为92.2±1.6°(常规pdms:~99.6°)。即浸润型pdms具有良好的稳定性和疏水性表面。
接触角表征方法:使用接触角测量仪(dropshapeanalyzer,dsa100,
2.3接下来在硅油修饰的浸润型pdms的表面上,在室温下不同的孵育时间后测量全血滴的滑动角度。由于血液凝固,在室温下孵育的时间越长,它变得越粘稠,越难在表面上移动。通常,在常规pdms表面上,即使在90°的板角度下,全血滴在10分钟后也粘附在表面上。然而,在浸润型pdms表面上,如图5和图6所示,在室温下,即使在45°的板角度孵育30分钟后,全血样品仍然可以移动,表明硅油修饰的浸润型pdms具有比常规pdms更小的表面摩擦力。此外,我们观察到在相同的倾斜角度下,如图7所示,硅油修饰的浸润型pdms表面上的血滴比常规pdms表面上的血滴移动速度快得多。结果表明,硅油修饰的浸润型pdms表面比常规pdms表面更光滑。
滑动角度表征方法:使用带有数字量角器的滑动台来测量在浸润型pdms和常规pdms表面上的5μl水滴和未稀释的血液样品的滑动角度。对于每次测量,缓慢增加角度,直到液滴开始沿着表面滑动,记录此时滑动角度;同样的方法在pdms膜的不同区域重复10次。
实施例3
硅油修饰的浸润型pdms膜表面的功能验证。
由于玫瑰红染料与强烈稳定的荧光具有生物相容性,因此我们制备了加入玫瑰红染料(5μl)的非稀释全血样品(1ml)进行跟踪和鉴定。将10μl含荧光染料的全血滴置于硅油修饰的浸润型pdms膜和常规pdms膜上,并在避光条件下分别保持10min,30min和3h。如图8和图9所示,在清洗血滴后,可以通过眼睛容易地观察到,仅在10min的孵育期,血迹留在常规pdms表面上,然而浸润型pdms表面上没有可见的血液残留和荧光。分析浸润型pdms和常规pdms上血液残留物的荧光强度,以常规和浸润型pdms表面上的玫瑰红染料作为对照,结果如图10所示,硅油修饰的浸润型pdms具有最低的荧光强度。此外,在血液样品孵育10min,30min和3h后,在清洁的pdms表面上通过maldftof质谱分析法分析血液样本中的两种主要成分血红素(~mw616)和血红蛋白(~mw16000)。如图11所示,1g血红素和血红蛋白均在常规pdms的显著水平上检测到,而硅油修饰的浸润型pdms上没有检测到信号。结果表明,与常规的pdms相比,浸润型的pdms表面对全血接触具有显著的抗污性能。
表面血液残留物的质谱测量方法:将1μl的血液残留物样品直接点在抛光钢maldi靶板上,干斑用maldi模型覆盖。在基质干燥之后,使用配有60hz氮激光器的microflexlt台式质谱仪(brukerdaltonicsgmbh,germany)进行飞行时间质谱测量。模型由结晶分子组成:2,5-二羟基苯甲酸(dhb)用于检测分子大小在5000da以下的小蛋白质,3,5-二甲氧基-4-羟基肉桂酸(芥子酸)用于检测分子大于5000da的蛋白质。通过质谱检测血液样品中的两种主要蛋白—血红蛋白复合物和血红素,常规pdms膜用于对照组,使用origin8.5进行数据分析。
实施例4
以硅油修饰的浸润型pdms为基础的微流控系统的通道功能验证。
体内循环系统由主动脉(内径5mm~1cm),小动脉(内径0.3mm~1mm)和毛细血管(内径10μm)组成。在全血分析和操作中,由于其高粘度,非稀释血液在以常规pdms为基础的微流体通道中流动性差,特别是在宽度小于100μm的窄通道中。我们采用不同尺寸的浸润型pdms制作了微流体通道,并加载了未稀释的全血样品。即使在10μm宽的通道中,血流也可以快速平稳地流通,这在常规pdms通道中是不能实现的(如图12所示)。结果表明,浸润型pdms通道为全血样本流动提供了一个光滑的条件,特别是在狭窄的pdms通道中。
我们研究了浸润型pdms表面在微流体环境下的抗污染性能。两个微流体通道分别填充藻红蛋白(pe)染料溶液,cd133抗体(pe-缀合)溶液和分别用玫瑰红(bengal)标记的未稀释的全血。荧光图像显示,在室温下孵育30min后,用pbs溶液洗涤,浸润型pdms表面对pe染料、cd133抗体和血液的均无吸附(图13a),而在常规pdms表面上有明显的吸附(图13b);具体的荧光强度数据分析如图14所示,结果进一步证实了在全血样品存在下,硅油修饰的浸润型pdms的抗污染性。
表面血液残留物的荧光强度测量方法:将未稀释的血液样品与玫瑰红染料混合后分别置于浸润型pdms膜和常规pdms膜上10min,20min,3min,1h,3h和24h。然后用透镜纸和3m胶带清洁血液样本,通过荧光显微镜(mei3000b,leica,us)检测膜表面上的荧光强度。类似地,将未稀释的血液样品滴在浸润型pdms膜上,于室温下分别孵育10min、30min和3h。
实施例5
硅油修饰后的浸润型pdms的微流控阀的功能验证。
微流控阀是微流控应用中的重要功能单元,微流控阀结构通常由三层组成:顶层为压力控制通道,中间层为阀膜结构,底层为样品流道。灌注后,通过控制层施加不同的压力,可以控制微流控阀分别打开、半关闭和关闭通道,从而分别实现流量运行、衰减和停止。一般来说,在集成微流控系统中,针对不同的控制用途,存在不同的阀门尺寸。本实施例,我们使用了三种宽度分别为40μm,60μm和100μm的不同尺寸的微流控阀进行血流控制,如图15所示,从图中可以清楚地看到微流控阀通过膜的形状变化过程来阻断通道。首先通过流体动力学压力将全血样品加载到通道中,再通过数字泵将通道中的初始血流保持在500μm/s:当阀门从0.9×105pa(阀门半关闭)逐渐到1.5×105pa(阀门完全关闭)时,流量逐渐减少;如图16所示:与大尺寸阀门相比,小尺寸阀门控制的血流速度下降更为缓慢,且成线性变化,对于三种不同的阀门,在相同的正压下,硅油修饰的浸润型pdms的阀门比常规pdms的阀门关闭得更快。同样,在相同的负压下,如图17所示:当阀门逐渐打开时,硅油修饰的浸润型pdms阀内的血流恢复到初始流量的速度比常规pdms阀门更快。上述结果表明,在全血操作中,浸润型pdms的微流控阀能够比常规pdms的微流控阀具有更快速、更准确地控制血流的优点。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!