制备多孔框架材料为基质的色谱固定相用于手性分离的制作方法
本发明属于色谱手性分离的领域,具体涉及多种适用于高效液相色谱(hplc)、气相色谱(gc)、毛细管电泳(ce)等色谱分离方法的以多孔框架材料为载体,以具有天然手性单元的生物分子为手性拆分剂的复合新型手性固定相的制备。该专利要求引用了如下中国发明专利的优先权,申请号201810027487.0,申请日2018年01月11日。
背景技术:
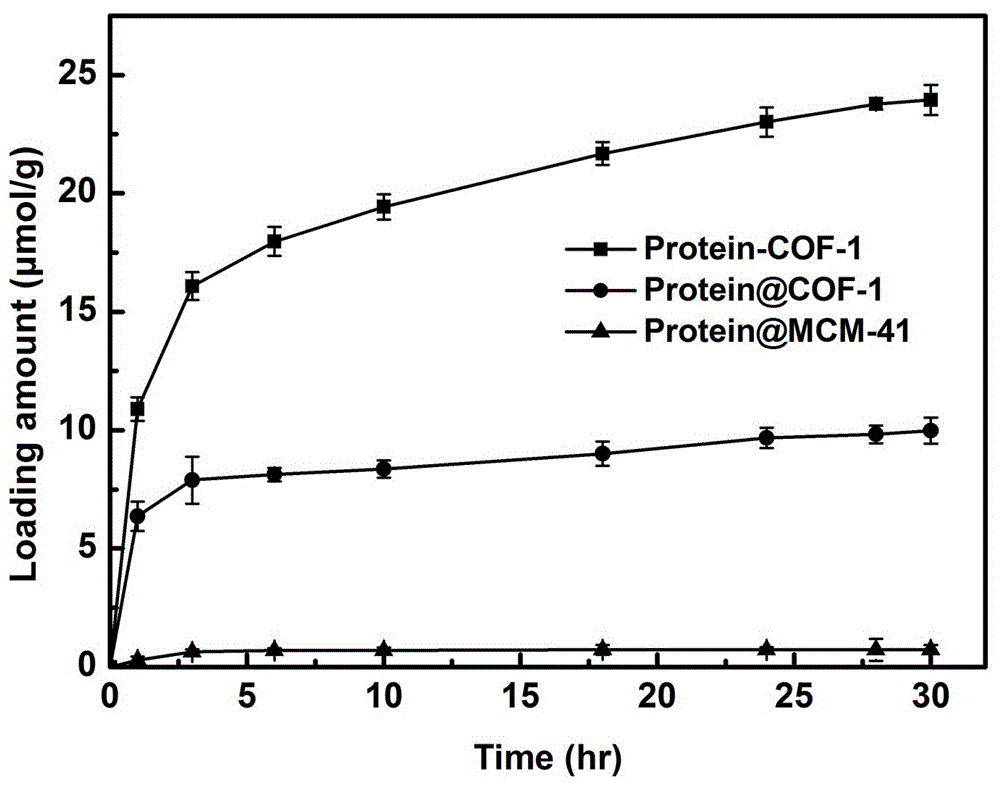
:在自然界中手性普遍存在,如构成生命体的生物大分子,包括蛋白质、核酸、酶等,以及许多药物、食品等都具有单一手性结构。手性化合物一般有两种对应异构体,在物理和化学性质方面几乎完全相同,但不同旋光活性的对映体所表现出的生物学活性、代谢过程及毒性存在着显著的差异。因此,如何获取单一构型的、有高生物活性的异构体是目前的色谱手性分离的研究重点。目前,色谱法是对映体分离最为常用的一类方法,包括气相色谱法(gc)、高效液相色谱法(hplc)、毛细管电泳(ce)等。对于各种色谱方法,色谱柱是色谱仪的心脏,而色谱柱内填充的分离材料(固定相)是实现分离的关键。因此,高性能的色谱柱填料是色谱研究中最丰富、最富有创造性的部分之一。手性色谱柱内填充手性固定相(chiralstationaryphases,csp),通常由具有手性识别分离能力的物质(手性拆分剂)经化学键合或物理涂覆等方法负载到载体上制备而成,主要包括:多糖衍生物类csp、大环抗生素类csp、蛋白质类csp、环糊精类csp、配体交换型csp、刷型csp等。前四种手性固定相法在各种色谱法分离中较为常用,可根据分析物的种类和性质选择合适的手性固定相,达到不同的分离效果。用于负载手性拆分剂的载体的性能对于csp的分离效果影响很大,理想的载体应具有高负载能力,不易泄露所负载的手性拆分剂,高稳定性,高适用性(可用于负载不同类型的手性拆分剂)等性能。作为近年来新兴的功能性多孔材料,多孔框架材料(如金属-有机框架材料,mofs;共价有机框架材料,cofs;氢键有机框架材料,hofs),凭借高比表面积、孔道大小可调、结构多样、易于修饰、优良的热稳定性及化学稳定性等优点,其在气体吸附与分离、传感器及催化等领域的应用发展迅猛。但目前尚无关于其在手性固定相载体方面的应用报道。本申请针对传统手性固定相的载体材料存在稳定性差、手性拆分剂负载率低、手性拆分剂容易泄露等问题,创造性地筛选和设计多孔框架材料作为手性固定相载体,利用其易于修饰,高稳定性,高比表面积和多孔性等优良特性,通过化学键合、吸附、包埋等多种手段来负载手性拆分剂(如蛋白质、酶、大环抗生素等),制备高效手性固定相(csp),以克服传统材料在手性色谱柱方面的应用限制。通过对框架材料及其孔道进行设计、调控和修饰可以使框架材料与所负载的客体分子产生较强的相互作用,提高多孔框架材料对手性拆分剂的负载能力、效率,有效降低和防止手性拆分剂的泄露,从而提高手性柱的分离效果及重复利用性。另一方面,区别于传统载体材料(如二氧化硅、琼脂糖等),多孔框架材料具有很好的结晶性、确定的结构和孔道环境,便于研究和分析此类材料与其所负载的手性拆分剂之间的相互作用和相关机理,以不断提升和优化此类csp的性能。此外,多孔框架材料的组分和结构灵活,可设计性强,可根据所选的手性拆分剂的结构、性质,在材料中方便的引入特定功能的基团或结构,以实现对某些特定手性拆分剂的高效负载。因而此方法可用于设计制备不同类型的手性固定相(csp)作为高性能手性色谱柱填料,满足不同的分离需要,因而具有广泛的应用价值。技术实现要素:本申请针对传统手性固定相载体材料所存在的问题,创造性地利用多孔框架材料(如金属-有机框架材料,mofs;共价有机框架材料,cofs;氢键有机框架材料,hofs)为载体通过化学键合、吸附、包埋、交联等手段负载各类手性拆分剂(如蛋白质、酶、大环抗生素),制备新型高效耐用的手性色谱固定相作为高性能手性色谱柱填料。一种新型手性固定相,包括多孔框架材料和生物分子,多孔框架材料为固体载体,生物分子为生物手性拆分剂,生物分子负载到多孔框架材料中。进一步,所述多孔框架材料可以是金属-有机框架材料(mofs)、共价有机框架材料(cofs)及氢键有机框架材料(hofs)中的任意一种或几种的结合。进一步,所述生物分子手性拆分剂可以是蛋白质类或大环抗生素类;其中,蛋白质类可以是溶菌酶、牛血清蛋白(bsa)、细胞色素c、胰蛋白酶(trpsin)、木瓜蛋白酶(papain)、胃蛋白酶(pepsin)、亲和素(avidin)中的任意一种或几种的结合;大环抗生素类可以是万古霉素、去甲万古霉素、阿伏帕星、瑞斯托菌素a、利福霉素b、替考拉宁、卡那霉素、弗氏霉素、链霉素中的任意一种或几种的结合。进一步,多孔框架材料上修饰有羧基、羟基、氨基、醛基、双键、巯基基团中的任意一种或几种的结合,多孔框架材料的孔道尺寸为0.2-15nm,生物分子手性拆分剂本身具有羧基、羟基、氨基、巯基基团中的任意一种或几种的结合。进一步,生物分子负载到多孔框架材料中的方式可以是共价键和法、吸附法、包埋法、交联法中的任意一种或几种的结合。进一步,其可以通过原位生长法或直接填充法制备高效液相色谱气相色谱和毛细管色谱的整体柱或填充柱。进一步,新型手性固定相可在反相色谱、极性有机相色谱、正相色谱条件下,应用于氨基酸、药物、有机小分子的拆分。进一步,金属-有机框架材料(mofs)可以是pcn-777、pcn-600、pcn-333、pcn-222、mil-101、mil-100、zif-8、zif-90、zpf-1、zpf-2、tb-mof;共价有机框架材料(cofs)可以是picof-1、picof-2、picof-3、cof-1、coftta-dhta、cof-nh2、ptdb-nh2、ptpa-nh2、cof-oh、[hooc]x-cofs;氢键有机框架材料(hofs)可以是hof-1、hof-2、hof-3、hof-4、hof-5、hof-6、hof-7、mpm-1-br。进一步,用共价键和法、交联法负载生物分子的多孔框架材料可以是picof-1、picof-2、picof-3、cof-1、coftta-dhta、cof-nh2、ptdb-nh2、ptpa-nh2、cof-oh、[hooc]x-cofs中的一种或几种的结合;用包埋法、吸附法负载生物分子的多孔框架材料可以是tta-cof、pcn-777、pcn-600、pcn-333、pcn-222、mil-101、mil-100、zif-8、zif-90、zpf-1、zpf-2、tb-mof、hof-1、hof-2、hof-3、hof-4、hof-5、hof-6、hof-7、mpm-1-br中的一种或几种的结合。共价有机框架材料(covalentorganicframeworks,cofs)是由有机构建单元通过共价键连接形成的结构有序的有机多孔材料,具有高比表面积、较高孔道率、孔径规则并容易调控、结构灵活、易于功能化等特性,并具有优异的热稳定和化学稳定性。氢键有机框架材料(hydrogen-bondingorganicframeworks,hofs)是由有机构建单元(配体)通过氢键连接形成的结构有序的有机多孔材料。hofs具有高比表面积、孔径规则易于调控、结构灵活多变等特点。cofs和hofs都可以根据需要来设计合成孔道尺寸和形状合适的、高比表面积的、具有良好热和溶剂稳定性的载体材料。金属-有机框架材料(metal-organicframeworks,mofs)由金属离子(或金属簇)以及具有特定官能团和形状的有机配体来合成,因此可以根据需要来设计合成孔道尺寸和形状合适的、高比表面积和高孔道率的、具有良好热和溶剂稳定性的mofs材料。优选地,选择多孔框架材料为基质来负载手性拆分剂,可根据所选择的拆分剂的尺寸,设计合成合适的有机配体以制备孔道尺寸与拆分剂尺寸相匹配的多孔材料,既能保证材料对拆分剂的负载效率,又能保证手性拆分剂可以进入材料孔道内而不是附着在材料表面(传统手性固定相一般是拆分剂固载在基质材料表面)。从而显著提高手性拆分剂的稳定性,减低和避免手性拆分剂的泄露,进而提高手性色谱柱的耐用性。优选地,基于多孔框架材料具有多种拓扑结构,我们可设计合适的孔道大小和形状(如多面体笼构筑的结构,其具有大的空腔和较小的窗口,被封装在材料中的手性拆分剂不易泄露和流失)进行手性拆分剂的固载。例如,通过对具有不同孔道特征的材料进行性能优化比较,我们筛选出多种不同孔道类型的金属-有机框架材料来吸附、包埋手性拆分剂,如pcn-777、pcn-600、pcn-333、pcn-222、mil-101、mil-100、zif-8、tb-mof等,进而实现多模式的手性固定相的高效制备。优选地,由于多孔框架材料(如cofs、mofs等)具有极高的比表面积和高孔道率,因而具有很高的负载能力,单位质量的多孔框架材料可以负载的手性拆分剂的量大大高于一般传统载体,因而可用于手性拆分剂的高效负载,制备高效率的手性固定相(csp)。优选地,由于多孔框架材料合成方法的多样性(如溶剂热合成法、研磨法、微波合成法、室温静置法等),多孔框架材料可以通过多种方式对客体手性选择剂进行负载。对于具有不同结构特征的手性拆分剂,我们分别选择合适的固载方法(如化学键合法、吸附法、包埋法、交联法等)来实现高效负载,降低和避免负载过程中手性选择剂的结构变性和活性流失,同时提高手性选择剂的负载率,进而提升了手性拆分效率。优选地,通过分析手性拆分剂的结构特征,设计合成具有不同功能的构筑基元,得到对拆分剂具有特异性作用的多孔框架材料(即“bottom-up”构建策略),或对材料进行后修饰与官能团进行反应,进而实现手性拆分剂与框架材料的共价结合。可实现对多种手性拆分剂的化学键合负载,进而拓宽手性拆分柱的应用范围,极大程度降低和避免拆分剂的泄露。优选地,由于某些框架材料可在温和的条件下合成,我们可通过“一锅法”(如金属盐、配体及手性拆分剂同时加入溶剂中反应)反应,实现手性拆分剂的高效率包埋的同时保证其分离活性,进而提升手性拆分效率。优选地,基于多孔框架材料是由有机配体作为构筑单元,当构成材料的有机配体含有较多-oh、-nh2、-och3等功能基团或含有能与客体分子进行π-π相互作用、静电相互作用等的功能基团如苯环、氮杂环等时,多孔框架材料可以通过与客体分子间的相互作用,增加了对手性拆分剂的负载效率,减缓其泄露流失。此外,由于多孔框架材料具有密度低和材料粒径均匀等特点,所以填充得到的手性柱具有通透性好、柱压均匀稳定、柱效重复性好、批次间稳定性高等特点。优选地,基于多孔框架材料结构的可知性,我们可实现其可控合成,经过长期实验摸索我们对部分多孔框架材料(如picof-1、picof-2、picof-3、cof-1、pcn-333、pcn-777、mil-100等)进行了基团修饰或金属交换处理,并得到了热及溶剂(甲醇、乙醇、四氢呋喃、乙腈、丙酮、二氯甲烷等有机溶剂,各种酸性、碱性缓冲溶液,热水等溶液)稳定性显著提高的新结构。因此,最终制备的手性固定相既适用于正相模式又适用于反相模式,极大拓宽了可拆分底物的范围和此类技术的适用性。优选地,我们以蛋白质为手性拆分剂,蛋白质是由多种l-氨基酸组成的复杂的生物大分子,其三维结构和其具有的手性基团位点均可以参与对映体的选择性作用,因此蛋白csps是分离对映体用途最广的固定相之一。其中牛血清白蛋白(bsa)、人血清白蛋白(hsa)、α-酸性糖蛋白(agp)、卵黏蛋白(ovm)、胃蛋白酶和纤维素水解酶等六种蛋白质csps已经商品化。但这些蛋白类手性柱仍存在样品容量较小、稳定性较差等问题。我们创造性地使用多孔框架材料为载体通过多种方法来固载溶菌酶、bsa、细胞色素c、胰蛋白酶(trpsin)、木瓜蛋白酶(papain)、胃蛋白酶(pepsin)、亲和素(avidin)等具有手性拆分效果的蛋白制备手性柱,极大地提高了其色谱分离效能、延长了其使用寿命(例如,连续使用超过3个月,柱效没有明显下降),并且极大地降低了批次间的差异性。优选地,由于大环抗生素类具有多种官能团和不对称中心,及空穴结构(糖肽型),其可与被拆分物质发生多种作用,如π-π作用、氢键作用、疏水作用、立体排阻、范德华力等,因此大环抗生素类手性固定相(尤其是糖肽类抗生素)具有应用范围广,分离效率高,色谱柱载样量大等优点。本发明中我们选用了大环糖肽类抗生素如万古霉素、去甲万古霉素、阿伏帕星、瑞斯托菌素a、利福霉素b、替考拉宁、卡那霉素、弗氏霉素、链霉素等作为手性拆分剂,利用框架材料负载,制备其手性柱,极大地提高了其色谱分离效能、延长了其使用寿命。优选地,蛋白质及大环抗生素类分子中,除了疏水部位,通常都还具有亲水基和可离子化的基团,因而为双亲分子。因此蛋白质csp及大环抗生素类csp既适用于水相(即反相色谱),又适用于有机相(即正相色谱)。并且都对对映体具有较高的选择性,显示出了广泛的手性识别能力。以溶菌酶csp为例,其既可以拆分酸性的手性物质(如色氨酸、亮氨酸、苏氨酸等),也可拆分碱性的手性物质(如扑尔敏),同时可以拆分中性的手性物质(如安息香)。并且针对各种对映体都具有高的选择因子α和分离度rs,即说明其对各种手性物质均可完全分离。目前尚没有一种类似十八烷基硅烷键合硅胶柱(ods)的普遍适用的手性色谱柱,且市售的手性色谱柱通常价格昂贵且寿命有限。本发明开发了利用多孔框架材料为载体的手性固定相作为高性能手性色谱柱填料的制备方法,该方法制备的手性固定相具有耐用性强、稳定性好、ph及溶剂(缓冲溶液、乙醇、甲醇、异丙醇、丙酮、二氯甲烷、正己烷等)适用范围广、适用于多种色谱分离模式等优点。同时多孔框架材料的结构及孔道具有设计调节性,可应用于负载各种类型的手性拆分剂;并且多孔框架材料合成方法简单,反应条件温和,重现性好;由于多孔框架材料极高的比表面积和高孔道率,因此手性拆分剂的负载量高,且可以通过调节材料结构而控制负载量;材料合成成本低,选用的手性拆分剂也是常见易得的蛋白类、大环抗生素类,所以总体色谱柱的制备成本低。目前市售的纤维素衍生物型手性柱cellu-d和直链淀粉衍生物型amy-d仅适用于正相色谱条件;cellu-dr和amy-dr适用于极性有机相和反相色谱,但由于涂覆的手性拆分剂容易流失,不适于反复更换流动相。但是,本申请制备的手性固定相,由于其手性拆分剂本身的双亲性、双离子性,多孔框架材料的可设计性,其广泛适用于各种色谱条件,并且手性拆分剂固定牢固,其可在反复更换流动相的条件下保持其分离效果。另外,市售的手性柱固体基质一般为硅球,由于硅球对强酸强碱敏感,其使用ph受限,范围为4-9。本申请的方法制备的手性固定相,由于多孔框架材料的稳定性,其可适用于ph范围为2-12的条件。附图说明图1:多孔框架材料对手性拆分剂进行负载制备的手性固定相用于手性拆分的示意图。图2、图3:共价有机框架材料及传统材料对手性拆分剂的负载数据,误差线代表了三次独立实验的标准偏差。图2是共价有机框架材料cof-1对酶类手性拆分剂的共价固定、吸附固定,及传统材料mcm-41对酶类手性拆分剂的吸附曲线。图3是24小时后,各种材料对酶类手性拆分剂的最终负载量的数据图。图2、图3中protein-cof-1指酶共价固定到cof-1中;protein@cof-1指酶吸附固定到cof-1中;protein@mcm-41指酶吸附固定到mcm-41中。图4:共价有机框架材料cof-1对万古霉素的化学键合曲线。图5:共价有机框架材料coftta-dhta对去甲万古霉素的交联固定曲线。图6:金属-有机框架材料对酶类手性拆分剂的吸附曲线图。图7、图8:通过共价法负载酶的手性固定相的稳定性测试。图7:固定后酶的热稳定性、溶剂稳定性、机械稳定性,(以游离酶的活性为100%),图中freeprotein指游离的酶,protein-cof-1指酶共价固定到cof-1中;图8显示了固定后酶的5次重复利用数据。图9:以负载酶的cof材料为手性固定相制备的手性柱对dl-苏基酸的拆分图及重复进样。色谱柱的规格:100×4.6mm(i.d.),流动相:ph6.5的磷酸缓冲溶液98%/异丙醇2%,流速:0.5ml/min,检测波长:214nm,温度:25℃。图10:以负载酶的cof材料为手性固定相制备的手性柱对扑尔敏药物的拆分图。色谱柱的规格:100×4.6mm(i.d.),流动相:ph6.5的磷酸缓冲溶液98%/异丙醇2%,流速:0.5ml/min,检测波长:214nm,温度:25℃。图11:以负载酶的cof材料为手性固定相制备的手性柱对中性安息香药物的拆分图。色谱柱的规格:100×4.6mm(i.d.),流动相:甲醇80%/乙腈20%,流速:0.5ml/min,检测波长:214nm,温度:25℃。具体实施方式:除非本申请上下文中另有其他说明,否则本申请中所用技术术语及缩写均具有本领域技术人员所知的常规含义;除非另有说明,否则下述实施例中所用原料化合物均为商购获得。按照本发明所提到的,多孔框架材料的合成、各种性能的表征测试及其对手性拆分剂的负载方法,其具体实施方式如下。相反,下列实施例仅用于对本发明进一步解释和发明,而不应视为限制本发明的范围,本发明将仅由权利要求来限制。实施例1~8为多孔框架材料对生物分子的负载。实施例1:用于化学键合手性拆分剂的共价有机框架材料cof-1的合成,具体实施步骤如下:分别称取配体1,3,5-三-(4-氨基苯)三嗪(tapt0.10mmol)和均苯四甲酸二酐(pmda0.15mmol)加入厚壁耐热玻璃管中(o.d.×i.d=10×8mm2),再加入0.5ml均三甲苯、0.5mln-甲基吡咯烷酮和0.05ml异喹啉,然后在液氮中快速冰冻,再抽真空,然后用氢氧机火焰封管。将封好的玻璃管放入200℃的烘箱中反应5天,得到黄色固体产物cof-1。多孔框架材料cof-1的溶剂活化将得到的固体用无水四氢呋喃清洗数次,至上清液无色,再用100ml无水四氢呋喃索氏萃取24小时,得到的黄色固体在真空条件下80℃活化8小时,然后将产物保存于手套箱中,待用于下一步实验操作。实施例2:以共价有机框架材料cof-1为载体对酶的化学键合对共价有机框架材料cof-1中羧酸的活化称取10mgcof-1到20ml的玻璃反应瓶中,再添加含有等量1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺的2-吗啉乙磺酸缓冲溶液(mes)5ml,室温下摇床震荡2小时后,将cof-1过滤出来,然后用5ml0.1mph6.0的mes缓冲溶液清洗3-5次,然后室温干燥。活化后的cof-1化学键合酶称取10mg活化后的cof-1,加入20ml的玻璃反应瓶中,再往小瓶中添加2ml含有3mg/ml的酶的mes缓冲溶液,37℃下摇床震荡。如附图1所示每隔一段时间,测试上清液的紫外吸收,以计算材料负载的酶量,并绘制cof-1对酶的化学键合固载曲线。附图2是材料在24小时后,对酶的最终负载量。附图1和附图2中多孔框架材料cof-1和传统材料mcm-41对酶的吸附过程操作如下:分别称取cof-1和mcm-4110mg,直接加2ml含有3mg/ml的酶的0.1mph7.0的mes缓冲溶液,37℃下摇床震荡,如附图1所示,与cof-1化学键合酶一样,每隔一段时间,测试上清液的紫外吸收,以计算每种材料吸附酶的量。实施例3:以共价有机框架材料cof-1为载体对万古霉素的化学键合活化后的cof-1化学键合万古霉素称取5mg活化后的cof-1,加入10ml的离心管中,再往离心管中添加2ml含有5mg/ml的万古霉素水溶液,37℃下摇床震荡。如附图3所示每如隔一段时间,测试上清液的紫外吸收,以计算材料负载的万古霉素量,并绘制cof-1对万古霉素的化学键合固载曲线。实施例4:共价有机框架材料coftta-dhta的合成分别称取配体1,3,5-三-(4-氨基苯)三嗪(0.05mmol)和2,5-二羟基对苯二甲醛(dhta0.075mmol)加入厚壁耐热玻璃管中(o.d.×i.d=10×8mm2),再加入0.5ml均三甲苯、1ml1,4-二氧六环和0.1ml6m的乙酸,然后在液氮中快速冰冻,再抽真空,然后用氢氧机火焰封管。将封好的玻璃管放入120℃的烘箱中反应3天,得到红色固体产物coftta-dhta。实施例5:共价有机框架材料coftta-dhta对去甲万古霉素的交联固定共价有机框架材料coftta-dhta的活化称取共价有机框架材料coftta-dhta40mg,分散在2ml的四氢呋喃溶液中,加入40mg的三聚氰氯,室温下反应3小时,反应结束后,活化好的材料依次用四氢呋喃、乙醇和水清洗数次,干燥。去甲万古霉素的交联固定称取5mg活化后的coftta-dhta,加入10ml的离心管中,再往离心管中添加2ml含有5mg/ml的去甲万古霉素水溶液,37℃下摇床震荡。如附图4所示每如隔一段时间,测试上清液的紫外吸收,以计算材料负载的去甲万古霉素量,并绘制coftta-dhta对去甲万古霉素的交联固定曲线。实施例6:金属-有机框架材料对酶的吸附负载金属-有机框架材料的合成方法4,4’,4’’-s-三嗪-2,4,6-三苯甲酸(h3tatb)50mg和alcl3·6h2o200mg溶解到10ml的n,n-二甲基甲酰胺中,然后加入1ml三氟甲磺酸。将以上混合液放入烘箱135℃加热2天,得到白色固体。离心收集白色沉淀,并且用新鲜的n,n-二甲基甲酰胺冲洗数次,至上清液无色,收集得到白色产物,pcn-333。产率:80%。金属-有机框架材料吸附固载酶过程称取框架材料pcn-33310mg,直接加2ml含有3mg/ml的酶的mes缓冲溶液,37℃下摇床震荡,如附图5所示,每隔一段时间,测试上清液的紫外吸收,以计算吸附固载酶的量。实施例7:金属-有机框架材料对酶的包埋称取牛血清蛋白bsa5mg,2-甲基咪唑1.552g溶于5.4ml去离子水中,六水合硝酸锌80mg溶于0.6ml的去离子水中,两种溶液混合后,30℃下反应10min。得到bsa@zif-8,对bsa的包裹率达到90%以上。实施例8:氢键有机框架材料对万古霉素的吸附固载氢键有机框架材料的合成称取腺嘌呤11mg溶于12ml甲醇中,8.8mg溴化铜溶于12ml异丙醇中,将腺嘌呤的甲醇溶液加入试管中,缓慢滴加溴化铜的异丙醇溶液,使其覆盖在甲醇溶液上方,室温条件下静置反应一周。得到的材料用甲醇洗涤数次,得到mpm-1-br。氢键有机框架材料吸附固定万古霉素称取氢键有机框架材料mpm-1-br5mg,直接加2ml含有5mg/ml的万古霉素的水缓冲溶液,37℃下摇床震荡,如附图6所示,每隔一段时间,测试上清液的紫外吸收,以计算吸附固载万古霉素的量实施例9~11为新型手性固定相的稳定性测试。实施例9:新型手性固定相的稳定性测试实验:化学键合后酶的热稳定性测试化学键合后的酶与等量的游离酶同时在80℃的烘箱里放置1小时,冷却后,分别加入150μg/ml的壳聚糖底物,在50℃下孵育30分钟后,过滤,取上清液与显色剂铁氰化钾在100℃下反应15分钟,然后将反应液在420nm处,检测其紫外吸光值。通过与未加热处理的固定酶与游离酶的活性对比发现,固定后酶的热稳定性显著提高,仍为80%左右,而游离酶在热处理后,已经没有活性。化学键合后酶的溶剂稳定性测试化学键合后的酶与等量的游离酶同时在甲醇溶液中处理一小时,然后按照热稳定性测试时酶活测试方法,进行酶活测试,结果发现,固定后酶在甲醇处理后,酶活仍在85%以上,而自由酶的活性已降至40%以下。化学键合后酶的机械稳定性测试化学键合后的酶与等量的游离酶同时在超声40khz的条件下处理30min,然后按照热稳定性测试时酶活测试方法,进行酶活测试,结果发现,固定后酶在甲醇处理后,酶活仍在90%以上,而自由酶的活性已降至30%以下。化学键合后酶的重复利用性测试化学键合后的酶按以上酶活测定方法,连续测试五次,结果显示,五次循环后,酶活没有明显下降。以上稳定性测试实验,均说明化学键合后,酶的稳定性显著提高,因此以此制作的手性固定相稳定性好,重复利用性也显著提高。实施例10:以多孔框架材料cof-1为载体的酶化学键合的hplc手性固定相的制备:按实施例2中化学键合酶的方法将1gcof-1负载上酶,然后冻干处理。将准备好的材料加入50ml乙醇中,超声分散10min,所得均匀的手性固定相填料装入匀浆管中,以乙醇为顶替液,通过气动泵压入卡套式色谱空管柱中。色谱柱规格为100×4.6mm(i.d.)。填充压力为5000psi。原位法制备毛细管手性整体柱:5m×0.32mm的毛细管柱经过1m氢氧化钠,水,0.1m盐酸,水,甲醇反复冲洗活化后,灌入50%的3-氨丙基三乙氧基硅烷,在40℃下反应10小时,得到氨基活化的毛细管柱。将1,3,5-三-(4-氨基苯)三嗪(0.1mmol)和对苯二甲醛(0.15mmol)溶于0.4ml均三甲苯和1.6ml1,4-二氧六环中,加入bsa5mg,将混合溶液灌入毛细管内,再加入0.4ml3.75mg/ml的三氟甲磺酸钪溶液,超声混匀,静置反应30min,反应结束用甲醇溶液反复冲洗,最终得到包埋bsa的毛细管手性整体柱。实施例11:流动相和样品的制备:分别选用酸性、碱性和中性样品进行测试,样品首先由水或乙醇配置成2mg/ml,测试前使用流动相稀释为20μg/ml,进样量为10μl。流动相:ph6.5,20mm的磷酸缓冲溶液由磷酸氢二钠和磷酸二氢钠制备,然后添加2%的异丙醇为有机调节剂,使用前过滤膜;有机流动相:甲醇、乙腈在使用前超声30min。流速为0.5ml/min。表1反相条件下手性样品的分离结果样品保留时间t1/min保留时间t2/minrsαdl-亮氨酸4.325.611.421.15dl-色氨酸4.355.651.411.29dl-苏氨酸4.305.631.431.31扑尔敏3.974.691.641.18结论:从上述表中的分离结果可以看出,该手性固定相对表1中几种酸性、碱性样品具有较好的分离效果,可与现有市售手性柱相媲美。表2极性有机相条件下手性样品的分离结果样品保留时间t1/min保留时间t2/minrsα安息香14.006.512.411.34安息香24.7010.863.711.57安息香1条件:乙腈100%,流速0.5ml/min;安息香2条件:甲醇/乙腈,80/20(v/v),流速0.5ml/min。结论:由上述表中的分离结果可以看出,该手性固定相在极性有机相条件下对安息香有良好的分离效果。表3正相条件下手性样品的分离结果样品保留时间t1/min保留时间t2/minrsα1-苯基-2异丙醇24.532.11.781.291-苯基-1-正戊醇23.229.61.581.21色谱柱的规格:150×4.6mm(i.d.),流动相:正己烷99%/异丙醇1%,流速:0.2ml/min,检测波长:214nm,温度:25℃。结论:由上述表中的分离结果可以看出,该手性固定相在正相条件下对有机小分子有良好的分离效果。表4手性色谱柱的重复性能重复进样8次连续10天3根手性柱相对标准偏差%0.0680.140.12结论:从表4的数据可以得出,手性色谱柱的稳定性及重复利用性都很好,并且不同批次间的差异性小。实施例12:以酶、大环抗生素为手性拆分剂,以共价有机框架材料为载体的手性柱市场化成本:生产一根4.6×100mm的酶固载手性柱需要共价固定了手性拆分剂的材料(cof-1)0.8g,其成本为:目前市售的同规格的进口大赛璐(daicel)酶固载手性柱价格为14,000~16,000元;市售国产的同规格手性柱价格为12,000元。利用本申请方法制备一根酶固载的手性柱成本仅为814元。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1