蛋白A包覆磁性纳米团簇以及制备方法及其在捕获抗体方面的应用与流程
本发明属于纳米磁性材料和生物技术领域,具体涉及一种蛋白a包覆磁性纳米团簇的制备及其在捕获抗体方面的应用。
背景技术:
设计和构建一种成功的靶向生物杂化磁性纳米探针是发展生物医学的主要目标,它位于纳米技术和分子生物学之间的接口。最终的挑战是开发可靠的策略,将靶向生物分子,特别是单克隆抗体igg与磁性纳米颗粒结合。但是在结合时普遍会面临一个问题,即磁性材料会与igg的非特异性位点结合,影响抗体的靶向效率。
蛋白a是金黄色葡萄球菌表面的一种细胞壁相关蛋白,它可以通过与igg的fc片段(fragmentcrystallization结晶片段)可逆地结合多种igg,特别对人类、兔子和鼠类的igg表现出很高的亲和力。由于蛋白a能够识别igg的fc端,它有望介导一个有序的fc位点特异性抗体固定在磁性纳米颗粒上,从而产生靶向fab(fragmentantigen-binding抗原结合片段)表达。
作为由磁性纳米晶粒组装得到的三维簇状材料,磁性纳米团簇与纳米粒子相比,拥有更强的磁饱和强度、独特的介孔框架结构、更好的结构稳定性以及更高的表面活性。然而在磁性纳米团簇表面直接连接蛋白a,不仅作用效果弱,而且包覆效率低,很快出现解吸附行为。蛋白a在负载到磁性纳米团簇之前通常要对其表面进行修饰,修饰的目的不仅在于可以改善其稳定性及单分散性,更为下一步的连接提供了所需的作用位点。
现有方法利用溶剂热法在高压反应釜中制备四氧化三铁纳米团簇,但是得到的团簇粒径较大,大约为200nm,不利于后续的生物应用。而一种水溶性蛋白包覆的磁性纳米颗粒及其制备方法,包括:将蛋白与磁性金属盐混合,制得蛋白-磁性金属的中间分散产物,然后加入碱使其反应后制得所述水溶性蛋白包覆的磁性纳米颗粒。但是这种方法制得的磁性纳米颗粒只有5nm,磁响应性低,较难实现在外磁场操控下的快速吸附,从而受到一定限制。
技术实现要素:
本发明的目的是提供一种蛋白a包覆磁性纳米团簇。
本发明的另一个目的是提供一种高性能的蛋白a包覆磁性纳米团簇的制备方法。
本发明的再一个目的是提供一种蛋白a包覆磁性纳米团簇在捕获抗体方面的应用。
本发明采用以下技术方案:一种蛋白a包覆磁性纳米团簇,它的磁性单元是30-80nm小尺寸的四氧化三铁纳米团簇,该纳米复合材料具有粒径小、分散性好、磁响应强的特点。
一种蛋白a包覆磁性纳米团簇的制备方法,将水合三氯化铁,乙酸胺,乙二醇,聚丙烯酸和柠檬酸钠混合超声,利用微波辅助多元醇法制备富含羧基的小尺寸四氧化三铁纳米团簇,然后在磁性团簇表面通过活化负载蛋白a,制得所述蛋白a包覆磁性纳米团簇。
进一步的,具体步骤如下:
蛋白a包覆磁性纳米团簇的制备:
①称取水合三氯化铁,乙酸胺溶于乙二醇中,超声后加入聚丙烯酸和柠檬酸钠,继续超声,直到混合液变为亮红色;
②将①得到的溶液倒入微波反应管中,设定加热温度和反应时间,进行微波反应,反应完毕后,得到黑色液体;用乙醇与去离子水交替离心洗涤三次,低压冷冻干燥后得到羧基化的fe3o4纳米团簇;
③利用1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和n-羟基琥珀酰亚胺活化fe3o4纳米团簇的羧基;
④使用磷酸缓冲盐溶液洗涤活化后的磁性物质,磁分离,弃上清液;再加入蛋白a,在样品混合仪上室温震荡反应过夜,得到蛋白a包覆磁性纳米团簇。
进一步的,所述的水合三氯化铁与乙酸胺的摩尔比为1:3-1:5,聚丙烯酸和柠檬酸钠分别固定为1.39mmol和0.3mmol。
进一步的,所述的微波反应前驱液须最终呈现亮红色,反应完全后方可进行后续的微波反应。
进一步的,所述的微波反应加热温度为220-260°c,反应时间为30-60min。
进一步的,所述蛋白a的浓度为1mg/ml,加入量的体积范围为50μl-100μl。
用上述的蛋白a包覆磁性纳米团簇进行捕获抗体的检测方法,包括如下步骤:
①将两份荧光素标记的人免疫球蛋白g分别与pbs分散的磁性纳米团簇和蛋白a包覆磁性纳米团簇混合,室温下孵育,磁分离后进行荧光测试;
②利用荧光光谱仪对蛋白a包覆磁性纳米团簇捕获抗体的能力进行检测,对比磁性纳米团簇连接荧光素标记的人免疫球蛋白g与蛋白a包覆磁性纳米团簇连接荧光素标记的人免疫球蛋白g的荧光强度;
③利用荧光电子显微镜对蛋白a包覆磁性纳米团簇捕获抗体的能力进行表观分析,对比磁性纳米团簇连接荧光素标记的人免疫球蛋白g与蛋白a包覆磁性纳米团簇连接荧光素标记的人免疫球蛋白g的荧光强度。
一种蛋白a包覆磁性纳米团簇在捕获抗体方面的应用。
本发明使用一种对igg具有高亲和力的天然肽链—蛋白a,来解决磁性材料会与igg的非特异性位点结合,影响抗体的靶向效率的问题。
本发明使用的聚丙烯酸(paa)中的羧基可与蛋白a的氨基连接,相当于在蛋白a与磁性团簇界面之间架起一座“分子桥”,提高了连接效率和强度。
此外,在制备高性能的羧基化四氧化三铁纳米团簇时,本发明采用了微波辅助加热一步合成法。微波辐射的加热方式可以实现快速并且均匀的加热,样品的粒径分布均匀与否主要决定于样品的成核和生长过程是否同步,微波加热可以使样品受热均匀,因此制备得到的四氧化三铁纳米团簇粒径分布均一,且微波加热升温迅速,在反应初期易形成大量晶核,有利于形成粒径较小的纳米颗粒。
本发明提出了一种学科交叉的方法来设计和合成磁性纳米复合探针,该材料由高性能的羧基化四氧化三铁纳米团簇和强亲和力的蛋白a结合而成,通过微波辅助多元醇法制备得到的蛋白a包覆磁性纳米团簇磁响应强、水溶性好、生物活性高,易于分离并进一步修饰靶向分子,尺寸小,易进入组织细胞内部。将这种复合材料用于抗体的智能固定化,使所有抗体在纳米团簇上以相同的方向呈现,活性fab部分定向于抗原结合的最佳构型。并利用荧光素标记的人igg成功地检测了本发明所制备的蛋白a包覆磁性纳米团簇的抗体捕获能力。由于蛋白a能与多种哺乳动物血清中的免疫球蛋白g(igg)的fc片段相结合,将其偶联在磁性纳米团簇上,在生物分离、活体成像、体内信号实时追踪以及癌症特异性靶向治疗等领域有潜在应用价值。
本发明的显著优点是:
(1)本发明通过微波辅助多元醇法一步制备出了水相分散均一稳定、结晶程度高、超顺磁性、饱和磁化强度高、富含羧基官能团且粒径可控的小尺寸磁性纳米颗粒。使用简单方法即可实现多种优异性能集于一体的fe3o4磁性纳米材料的制备,克服了现有制备方法不能对fe3o4磁性纳米材料多种性能同时进行调控的缺点,而且微波辐射加热的方式也大大提高了制备效率;
(2)设计了一种简单的荧光检测方法成功地检测了本发明所制备的蛋白a包覆磁性纳米团簇的抗体捕获能力;
(3)本发明所制备的蛋白a包覆fe3o4纳米团簇可以定向连接抗体,提高抗体连接效率,并使其抗原结合位点向外暴露,保持其活性。
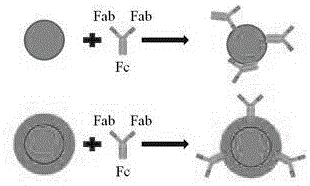
本发明涉及的抗体定向连接原理如图1所示,抗体在空间构型中的随机取向与优化取向对比图(将抗体的初级氨基与磁性纳米团簇表面羧基直接进行共价偶联使其随机固定;通过蛋白a优化固定:蛋白a首先共价连接在磁性纳米团簇表面,然后抗体的fc结构域与蛋白a偶联)。
磁性纳米团簇表面羧基被活化后,采用两种方法用靶向抗体对颗粒表面进行功能化:直接将抗体共价偶联到羧基化团簇表面,导致它们在表面上的随机取向;或通过优化抗体定位的支持层蛋白a进行fc端定向固定。当抗体随机附着在磁性纳米团簇表面时,其抗原结合位点(fab)可能会被颗粒表面的羧基残基修饰,从而被阻断,破坏抗体活性,影响后续使用。因此需要将抗体定向结合,使其抗原结合位点尽可能向外暴露,保持其活性。
本发明不仅提供了一种高效的蛋白a包覆磁性纳米团簇材料,同时还建立了一种简单检测其捕获抗体的新方法。蛋白a包覆磁性纳米团簇能够定向连接抗体,提高抗体的捕获效率。蛋白a作为衔接蛋白定向连接抗体和磁性纳米团簇,这种特异性结合的技术在生物医学领域有重要价值。
附图说明
图1为抗体在空间构型中的随机取向与优化取向对比图;
图2为制备的fe3o4纳米团簇的透射电镜图(a图)、x射线衍射图(b图)和红外光谱图(c图);
图3为制备的fe3o4纳米团簇与蛋白a包覆fe3o4纳米团簇的zeta电位对比图(a图)和室温下的磁滞回线对比图(b图);
图4为fe3o4纳米团簇连接荧光素标记抗体与蛋白a包覆fe3o4纳米团簇连接荧光素标记抗体的荧光光谱对比图;
图5为fe3o4纳米团簇连接荧光素标记抗体与蛋白a包覆fe3o4纳米团簇连接荧光素标记抗体的荧光显微镜对比图。
具体实施方式
下面的实施例可以进一步说明本发明,但不以任何方式限制本发明。
实施例1-蛋白a包覆磁性纳米团簇的制备:
①称取0.5mmol水合三氯化铁(fecl3·6h2o),2.5mmol乙酸胺(nh4oac)溶于5ml乙二醇中,超声30min后加入1.39mmol聚丙烯酸(paa)和0.3mmol柠檬酸钠,继续超声,直到混合液变为亮红色。
②将①得到的溶液倒入10ml微波反应管中,设定加热温度为240°c、反应时间为45min,进行微波反应。反应完毕后,得到黑色液体。用乙醇与去离子水交替离心洗涤三次,低压冷冻干燥后得到羧基化的四氧化三铁纳米团簇(fe3o4ncs),将其分散于水中形成储备液a(10mg/ml)。
对所得到的fe3o4纳米团簇的形貌、结构和官能团表征如图2所示:
从图2a透射电镜中观察到的纳米团簇是由许多很小的fe3o4纳米颗粒组装而成的,其平均粒径在30nm左右,背景干净清晰,团簇分布均一,结晶性好。
从图2bx射线衍射图可看出其与反尖晶石型fe3o4(jcpds.19-0629)标准衍射谱吻合。另外,在衍射角为20.00°左右的位置出现了无定形的聚合物包峰,说明在fe3o4纳米团簇表面有聚合物的包覆。
从图2c红外光谱图中得到3400cm-1处的宽峰为(-oh)的伸缩振动峰,1663cm-1处的峰为(c=o)的伸缩振动峰,这两个峰的出现说明了样品中存在羧基,且羧基上的两个氧原子与fe结合后波峰进行了红移。在2948cm-1处的峰为聚丙烯酸主链上(-ch2-)的反对称伸缩振动峰,进一步证实了聚丙烯酸(paa)的存在,说明fe3o4纳米团簇表面成功修饰上了paa,它们极易与蛋白之间发生化学偶联、静电吸附、氢键的相互作用。
③利用100μl(10mg/ml)的edc(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和100μl(10mg/ml)nhs(n-羟基琥珀酰亚胺)活化fe3o4纳米团簇的羧基。
④使用0.01mol/l磷酸缓冲盐溶液(pbs)洗涤活化后的磁性物质,磁分离,弃上清液。再加入50μl(1mg/ml)蛋白a,在样品混合仪上室温震荡反应过夜,得到蛋白a包覆磁性纳米团簇。
对所得到的蛋白a包覆磁性纳米团簇的表征如图3所示:
图3a是fe3o4纳米团簇与蛋白a包覆fe3o4纳米团簇的zeta电位对比图,从图中可以看到fe3o4纳米团簇表面由于带了羧基,zeta电位呈负性(a曲线);而包覆蛋白a后zeta电位像更负方向移动(b曲线),这是由于蛋白a分子中含有很多活性基团。
图3b是fe3o4纳米团簇与蛋白a包覆fe3o4纳米团簇的磁滞回线对比图,从图中可以看到fe3o4纳米团簇包覆蛋白a后饱和磁化强度减弱(b曲线),这是由于随着蛋白a的引入,导致fe3o4磁性粒子的含量降低,从而造成饱和磁化强度下降,从侧面证明蛋白a已成功包覆。但包覆后的饱和磁化强度仍然达到了40emu/g,相比于磁性纳米颗粒,磁性纳米团簇因其内部磁性纳米粒子不进行包覆,在复合结构中磁含量较高,磁饱和强度下降程度小,有利于磁分离,从而进行后续实验。
实施例2-5,蛋白a包覆磁性纳米团簇的制备:步骤同实施例1,原料具体用量及反应条件见表1。
实施例3条件下得到的团簇平均粒径在80nm左右,其他实施例条件下得到的团簇平均粒径在30-80nm之间。
实施例8-蛋白a包覆磁性纳米团簇捕获抗体的检测:
①将两份80μg荧光素标记的人免疫球蛋白g(fam-igg)分别与2mlpbs分散的磁性纳米颗粒(10mg/ml)和蛋白a包覆磁性纳米颗粒(10mg/ml)混合,室温下孵育2天,磁分离后进行荧光测试;
②利用荧光光谱对蛋白a包覆磁性纳米颗粒捕获抗体人免疫球蛋白g的能力进行检测,对比2mlpbs分散的磁性纳米颗粒连接荧光素标记的人免疫球蛋白g(fe3o4ncs-fam-igg)与2mlpbs分散的蛋白a包覆磁性纳米颗粒连接荧光素标记的人免疫球蛋白g(fe3o4ncs-proteina-fam-igg)的荧光强度(荧光强度对比图如图4所示);
③利用荧光电子显微镜对蛋白a包覆磁性纳米颗粒捕获抗体的能力进行表观分析,对比2mlpbs分散的磁性纳米颗粒连接荧光素标记的人免疫球蛋白g(fe3o4ncs-fam-igg)与2mlpbs分散的蛋白a包覆磁性纳米颗粒连接荧光素标记的人免疫球蛋白g(fe3o4ncs-proteina-fam-igg)的荧光强度(荧光强度对比图如图5所示),图5中a图为四氧化三铁纳米团簇(fe3o4ncs)的荧光显微镜图,b图为fam-igg的荧光显微镜图,c图为fe3o4ncs-fam-igg的荧光显微镜图,d图为fe3o4ncs-proteina-fam-igg的荧光显微镜图。
由图4得出fe3o4ncs-proteina-fam-igg的荧光强度(a曲线)比fe3o4ncs-fam-igg的荧光强度(b曲线)强,由于蛋白a能定向连接抗体,因此能提高荧光标记抗体的负载量。
由图5看到fe3o4ncs-proteina-fam-igg的荧光强度(图5d)比fe3o4ncs-fam-igg的荧光强度(图5c)强,从表观分析角度进一步证实了蛋白a能够提高抗体负载量。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改,等同替换,改进等,均应包含在本发明保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!