一种用于定量联合检测的微流控芯片卡的制作方法
本实用新型属于体外诊断与免疫检测技术领域,尤其是涉及一种用于定量联合检测的微流控芯片卡。
背景技术:
心肌肌钙蛋白(ctn)是由三种不同基因的亚基组成:心肌肌钙蛋白t(ctnt)、心肌肌钙蛋白i(ctni)和肌钙蛋白c(tnc),其中心肌肌钙蛋白i的分子量为22.5kd。心肌肌钙蛋白(ctn)和原肌球蛋白一起通过调节钙离子对横纹肌动蛋白atp酶的活性来调节肌动蛋白和肌球蛋白相互作用。当心肌损伤后,心肌肌钙蛋白复合物释放到血液中,4-6小时后,开始在血液中升高,升高的肌钙蛋白能在血液中保持很长时间6-10天。近年来关于心肌肌钙蛋白的研究初步表明,心肌肌钙蛋白i(ctni)是心脏的特异性抗原,其释放入血循环是心肌细胞损伤的敏感和高度特异性标志,对某些心血管病的诊断、预告及疗效判断等具有重要意义。对心肌损伤的诊断在诸多诊断急性心肌梗死(ami)的临床生化指标中,随着对心肌肌钙蛋白(ctni)深入研究,无论是对心肌的特异性还是诊断敏感性,ctni都被认为是目前最好的确定标志物,成为ami的诊断"金标准"。在心肌细胞受刺激后,产生初始基因产物前bnp前体(pre-probnp),该肽的一个26氨基信号肽被立即去除,形成含108个氨基酸的的bnp前体(probnp),后者在内切酶的作用下裂解为含有76个氨基酸、无生物活性的nt-probnp和含有32个氨基酸、有活性的bnp。nt-probnp是一个诊断心衰比较可靠的指标,临床若考虑心衰,因nt-probnt检测可快速获取检验结果和结果的可靠性,第一个必做的检验项目,且nt-probnt升高程度和心衰严重程度正相关,而nt-probnt阴性者即可以排除心衰可能。nt-probnp是bnp激素原分裂后没有活性的n-末端片段,与bnp相比,半衰期更长,更稳定,其浓度可反映短暂时间内新合成的而不是贮存的bnp释放,因此更能反映bnp通路的激活。血浆nt-probnp水平随心衰程度加重而升高。
d-dimer水平的上升,代表血块在血管循环系统中形成,是急性血栓形成的一个敏感的标记物,但不具特异性。d-dimer的升高反映了体内存在着凝血及纤溶活性增强的重要分子标志物。患者急性发病时血浆d—二聚体水平明显增高,d—二聚体检测不仅可作为观察心肌梗死病情的一项指标,而且也是观察溶栓治疗的一种理想检测方法。
目前临床快速诊断以胶体金和荧光免疫层析为主。胶体金技术只能用于定性或半定量的检测,难以满足临床定量化检测要求联合也经常存在漏检现象。荧光免疫层析虽然依据光电信号放大系统提高了检测灵敏度,但依旧是基于层析技术,检测结果的变异系数(cv值)约15%左右并且检测时间至少需要10-15min。因此,越来越不能满足临床快速诊断的需要,检测准确度和时间有待进一步提高。
微流控技术(microfluidics)是一种精确控制和操控微尺度流体,以在微纳米尺度空间中对流体进行操控为主要特征的科学技术,具有将生物、化学等实验室的基本功能诸如样品制备、反应、分离和检测等缩微到一个几平方厘米芯片上的能力,其基本特征和最大优势是多种单元技术在整体可控的微小平台上灵活组合、规模集成。是一个涉及了工程学、物理学、化学、微加工和生物工程等领域的交叉学科。2003年被福布斯(forbes)杂志评为影响人类未来15件最重要的发明之一。
微流控芯片(microfluidicchip),又称为芯片实验室(lab-on-a-chip)或生物芯片。是利用mems技术将一个大型实验室系统缩微在一个玻璃或塑料基板上,从而复制复杂的生物学和化学反应全过程,快速自动地完成实验。其特征是在微米级尺度构造出容纳流体的通道、反应室和其它功能部件,操控微米体积的流体在微小空间中的运动过程,从而构建完整的化学或生物实验室。基于微流控技术的微流控芯片最大的应用场景在体外诊断领域。由于微流控检测芯片一般具有样品消耗少、检测速度快、操作简便、多功能集成、体小和便于携带等优点,因此特别适合发展床边(poct)诊断,具有简化诊断流程、提高医疗结果的巨大潜力。联合,这一技术将给基因、免疫、微生物和临床化学等诊断领域带来颠覆性突破,使威胁人类健康的诸多疾病如癌症、心脑血管疾病的早期诊断和预防成为可能。生物芯片与生物靶向药物的结合,推动临床医学全面走向个性化医疗诊疗。
荧光微球是指直径在纳米级至微米级范围内,通过物理和化学等方法负载荧光物质,受激发光源刺激后激发出荧光的固体微粒。荧光微球具有很好的热稳定性,分散性,生物相容性,高的荧光稳定性和表面可修饰性。可广泛应用与生物检测、疾病诊断、免疫检测、液相芯片技术、高通量药物筛选(hts)等生物医学领域。相比胶体金等传统标记物须大量聚集肉眼辨别,它的发光强度可以随激发光的强度增强而增强。因此荧光微球作为标记物的免疫诊断有较高的研究价值与前景。
生物素-亲和素系统是上世纪70年代末发展起来的一种非常有效的生物反应放大系统。生物素-亲合素系统几乎可与目前研究成功的各种标记物结合。生物素-亲和素与标记试剂之间高亲和力的牢固结合及多级放大效应,使bas免疫标记和有关示踪分析更加灵敏。它已成为目前广泛用于微量抗原、抗体定性、定量检测及定位观察研究的新技术。
目前急性心梗心衰的发病率呈逐年增高趋势,是遍及全球的常见病和多发病。ctni用于急性心梗发生程度的判断;nt-probnt升高程度和心衰严重程度正相关,而nt-probnt阴性者即可以排除心衰可能;d-dimer是急性血栓形成的一个敏感的标记物。三者联合在一起进行检测,不仅可以节省时间和试剂耗材,而且可以帮助医生对重症患者进行危险评价或危险分层,疾病的诊断和鉴别诊断,高危患者筛查,各种情况下心脏评估等作用,更利于精准性治疗。
而且现有技术中,通常是单项检测,也有部分是多项心肌心梗联合检测,但都是基于免疫层析技术,无论是在检测灵敏度、准确度还是检测时间方面都存在不足。目前并没有出现关于基于微流控技术快速联合检测ctni、nt-probnp和d-dimer诊断试剂的报道。
另外,现有的微流控芯片卡因检测区的检测位点点样问题造成废品率较高,且检测灵敏度较低,主要原因为:微流控通道位置固定,荧光信号采集的激光扫描仪采样位置固定,因此对检测区各位点的点样量、圆度、直径、点中心位置有较高要求。现有基片卡是整个卡片为光洁平面,在点样泵、点样机台和基片制具误差范围内情况下,可能出现部分点样后的位点圆度和直径误差大,中心位置偏移的情况。另外,现有基片卡是整个卡片为光洁平面,基片个位点包被面积固定,包被量受限,因此灵敏度也受限。
本实用新型即是在上述技术问题的基础上进行改进。
技术实现要素:
有鉴于此,本实用新型的目的提供一种定量联合检测ctni、nt-probnp和d-dimer的微流控芯片卡。它是基于微流控技术的侧向层流、荧光免疫检测原理和生物素-亲和素的放大系统,用于快速联合定量检测血浆中的ctni、nt-probnp和d-dimer。使用本新型的芯片卡不但可以降低芯片卡的废品率,还可以实现快速联合定量检测ctni、nt-probnp和d-dimer,而且检测结果具有高度的灵敏度和稳定性,为临床快速准确鉴别诊断心梗、心衰发生情况提供了极大的便利。
为达到上述目的,本实用新型的技术方案是这样实现的:
一种用于定量联合检测的微流控芯片卡,该芯片卡的检测区上间隔设置有互为独立的至少两个检测位点,该检测位点由若干紧邻设置的上凸微颗粒组成。
进一步,包括紧密叠合的基片和盖片,基片的上表面沿样本流动方向依次间隔设有样本缓冲区、荧光标记区和检测区,盖片的下表面开设有微通道,微通道的端部设有加样孔,加样孔与微通道相连通,基片和盖片紧密叠合时,样本加样孔和样本缓冲区重合,荧光标记区和检测区均位于微通道内。
进一步,所述检测位点为圆形,该圆形检测位点的直径为2~3mm,相邻两个检测位点之间的间距为3-5mm。
进一步,所述检测位点为方形,该方形检测位点的边长为2~3mm,相邻两个检测位点之间的间距为3-5mm。
进一步,所述上凸微颗粒为半球形微颗粒,该半球形微颗粒的直径为0.01~0.2mm,相邻两个半球形微颗粒之间的间距为0.01~0.2mm。
进一步,所述上凸微颗粒为圆柱形微颗粒,该圆柱形微颗粒高度为0.4~0.5mm,底面直径为0.01~0.2mm,相邻两个圆柱形微颗粒之间的间距为0.01~0.1mm。
进一步,所述检测区包括沿样本流动方向依次包被在基片上的第一检测位点、第二检测位点、第三检测位点和质控位点。
进一步,第一检测位点为nt-probnp检测位点,第二检测位点为ctni检测位点,第三检测位点为d-dimer检测位点。
进一步,荧光标记区固定干燥有nt-probnp荧光标记抗体、ctni荧光标记抗体和d-dimer荧光标记抗体的混合物,第一检测位点包被干燥有生物素化nt-probnp抗体,第二检测位点包被干燥有生物素化ctni抗体,第三检测位点包被干燥有生物素化d-dimer抗体。
进一步,nt-probnp荧光标记抗体、ctni荧光标记抗体和d-dimer荧光标记抗体之间的摩尔比为1:1:1。
相对于现有技术,本实用新型所述的一种用于定量联合检测的微流控芯片卡具有以下优势:
(1)本实用新型基于微流控技术进行ctni、nt-probnp和d-dimer的联合检测,检测时间为3-5min,仅需一次检测即可进行心梗和心衰的快速鉴别诊断,提高了检测效率;
(2)本实用新型通过在检测区表面活化预处理,增加了亲和素的结合效率,进一步提高了检测的灵敏度;
(3)本实用新型检测区各检测位点由半球形微颗粒或圆柱形微颗粒组成,在有限的区域增加了检测区的整体有效面积,进一步提高了检测的灵敏度;
(4)本实用新型检测区各检测位点由半球形微颗粒或圆柱形微颗粒组成,避免首次亲和素点样时液滴的不规则形状的形成,从而降低废品率;
(5)本实用新型检测区各检测位点由半球形微颗粒或圆柱形微颗粒组成,避免点样时位置的偏差导致液滴部分位置不在通道内,从而降低废品率;
(6)本实用新型利用“生物素-亲和素放大系统”,进一步提高了检测的灵敏度;
(7)本实用新型将荧光微球作为标记物,稳定性好,提高了检测稳定性,荧光信号强度作为检测信号,极大的提高了检测灵敏度;
(8)本实用新型可通过自动化的荧光免疫分析仪对结果进行判读,实现准确、快速、简便的诊断检测;
(9)本实用新型基片与盖片键合方便,体积小,便于携带;
(10)本实用新型可批量生产,可常温保存与运输,适用于各种类型医院的临床和现场的快速诊断和基层的诊所推广和使用;
(11)本实用新型采用联合检测,基片检测区可以联合检测3项,降低了检测成本。
附图说明
构成本实用新型的一部分的附图用来提供对本实用新型的进一步理解,本实用新型的示意性实施例及其说明用于解释本实用新型,并不构成对本实用新型的不当限定。在附图中:
图1为本实用新型芯片卡基片平面结构示意图;
图2为本实用新型芯片卡盖片结构示意图;
图3为本实用新型芯片卡基片侧面结构示意图;
图4为本实用新型实施例中带有方形检测位点的芯片卡结构示意图;
图5为本实用新型实施例中带有圆形检测位点的芯片卡结构示意图。
附图标记说明:
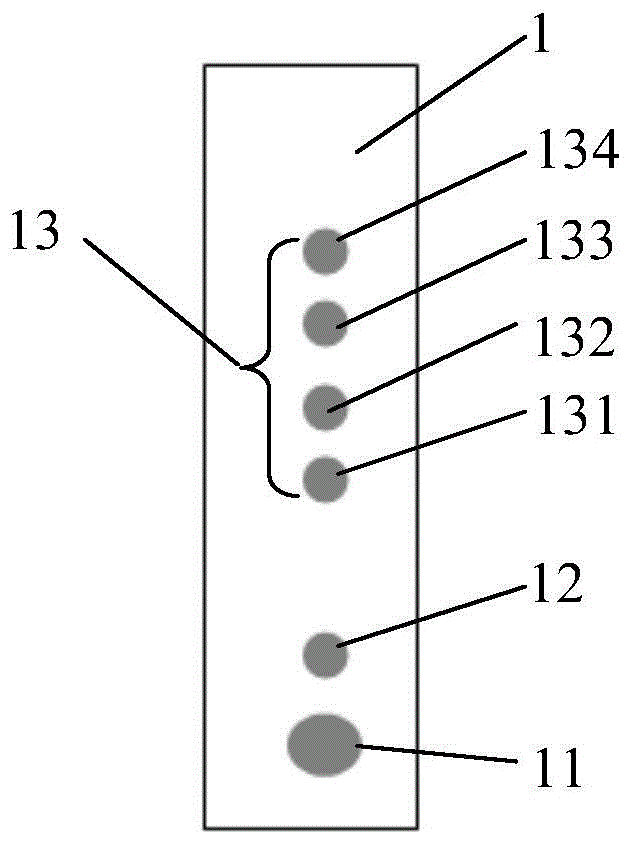
1-基片,11-样本缓冲区,12-荧光标记区,13-检测区,131-第一检测位点,132-第二检测位点,133-第三检测位点,134-第四检测位点,2-盖片,21-加样孔,22-微通道,23-条码区。
具体实施方式
需要说明的是,在不冲突的情况下,本实用新型中的实施例及实施例中的特征可以相互组合。
在本实用新型的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。此外,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”等的特征可以明示或者隐含地包括一个或者更多个该特征。在本实用新型的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本实用新型的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以通过具体情况理解上述术语在本实用新型中的具体含义。
下面结合实施例及附图来详细说明本实用新型。
在一些实施例中,一种用于定量联合检测ctni、nt-probnp和d-dimer的微流控芯片卡包括基片1和盖片2,基片1和盖片2通过丙酮键合组成芯片卡。
延基片1长度方向依次设置样本缓冲区11、荧光标记区12、检测区13,检测区分别有独立的四个检测位点,各检测位点相对独立,是直径为2.4mm的圆形,各位点间距4mm,位点由多个间距0.1mm的半球形微颗粒状组成,每一个半球形微颗粒的直径为0.1mm,如图4。且,检测区进行等离子表面预处理。
检测区第四检测位点134设置为质控位点,由生物素化ctni抗体和ctni重组抗原组成;第一检测位点131包被为生物素化nt-probnp抗体,第二检测位点132包被生物素化ctni抗体,第三检测位点133包被生物素化d-dimer抗体。
在芯片卡制备过程中,检测区各检测位点第一次点样包被亲和素,清洗,晾干,第二次点样包被各位点对应的溶液。
样本缓冲区11包被有样本缓冲液干燥的圆斑。
荧光标记区12包被有ctni荧光标记抗体、nt-probnp荧光标记抗体和d-dimer荧光标记抗体按1:1:1摩尔比混合后干燥的圆斑。
盖片2由微通道22和加样孔21组成,加样孔21在基片1的样本缓冲区11上方,与微通道22联通。
优选地,将检测区第四检测位点设置为质控位点,可由生物素化ctni抗体和ctni重组抗原组成质控位点,或者生物素化nt-probnp抗体和nt-probnp重组抗原组成质控位点,或者生物素化d-dimer抗体和d-dimer重组抗原组成质控位点,或者其中的任意两组组成质控位点,或者三组一起组成质控位点。检测区第一检测位点、第二检测位点、第三检测位点分别包被有生物素化nt-probnp抗体、生物素化ctni抗体、物素化d-dimer抗体中的任意一种,位置可互换。
本实施例中芯片卡在废品率及灵敏度的检测如下:
(1)芯片卡废品率检测
本实施例芯片卡检测区第一检测位点、第二检测位点、第三检测位点分别包被有生物素化nt-probnp抗体、生物素化ctni抗体、物素化d-dimer抗体和第四检测位点包生物素化ctni抗体和ctni重组抗原组成质控位点。在芯片卡制备过程中,第一次点样包被亲和素废品率和第二次点样包被各位点对应溶液废品率,通过成像系统判断各点圆度、直径、点中心位置偏移三个指标,判断是否符合设置标准,任何一项不合格即确定为不合格品,计算2000人份基片在这两步点样过程中产生的废品率。普通基片与本实施例基片其他步骤处理方式一致,数量一样。结果发现本实施例基片对第二步降低圆度和直径的不合格率有很大提高,两步总废品率接近1%,远低于普通基片的5%,见表1。
表1两种基片两步点样包被不合格率比较
(2)芯片卡灵敏度检测
本实施例基片和普通基片点样包被等处理过程一致,选择相同浓度和体积的亲和素以及包被液体,最终各组随机选择10人份进行样本检测。样本为企业内控品,浓度值分别为:nt-probnp107.17pg/ml,ctni0.41ng/ml,d-dimer0.52mg/l。
检测过程:
在加样孔位置,加入血浆或血清样本,进入样本缓冲区,样本缓冲区干燥的样本缓冲液被样本溶解混合,样本在微通道毛细作用下依次流经微通道内的荧光标记区、检测区、最终到达废液区。样本流经荧光标记区时,溶解包被在荧光标记区的荧光标记混合物,包括荧光标记nt-probnp抗体、荧光标记ctni抗体和荧光标记d-dimer抗体,样本中的抗原与部分荧光混合标记抗体反应结合形成荧光抗原抗体复合物,流经检测区时,荧光复合物分别与第一检测位点包被的生物素化nt-probnp抗体、第二检测位点包被生物素化ctni抗体以及第三检测位点包被生物素化d-dimer抗体进行特异性的免疫反应;在荧光标记区未被样本中抗原结合的荧光标记ctni抗体,在质控区与生物素化ctni抗体和ctni重组抗原复合物发生特异性免疫反应。
通过配套仪器检测分别检测第一检测位点、第二检测位点、第三检测位点以及质控位点的荧光信号强度,分别计算第一检测位点的荧光信号强度/质控位点的荧光信号强度、第二检测位点的荧光信号强度/质控位点的荧光信号强度、第三检测位点的荧光信号强度/质控位点的荧光信号强度,以荧光信号比值为纵坐标、以配制的系列质控品浓度为横坐标绘制的标准曲线,最终得到全血样本中各检测指标的浓度。
结果显示,本实施例基片各nt-probnp,ctni和d-dimer浓度检测平均值更接近内控品浓度值,且降低产品cv值,详见表2。因此,本实施例芯片卡灵敏度提高。
表2两组基片各位点检测结果平均值及cv值比较
在一些实施例中,一种用于定量联合检测ctni、nt-probnp和d-dimer的微流控芯片卡包括基片1和盖片2,基片1和盖片2通过丙酮键合组成芯片卡。
延基片1长度方向依次设置样本缓冲区11、荧光标记区12、检测区13,检测区13分别有独立的四个检测位点,边长为2.4mm正方形各检测位点相对独立,间距3mm,检测位点由间距0.05mm的竖置圆柱形微颗粒状组成,微颗粒高0.5mm,底面直径0.1mm,如图5。且,检测区进行等离子表面预处理。
优选地,将检测区13第四检测位点134设置为质控位点,由生物素化nt-probnp抗体和nt-probnp重组抗原组成质控位点。检测区第一检测位点131、第二检测位点132、第三检测位点133分别包被为生物素化生物素化d-dimer抗体、nt-probnp抗体、生物素化ctni抗体。
样本缓冲区11包被有样本缓冲液干燥的圆斑。
荧光标记区12包被有ctni荧光标记抗体、nt-probnp荧光标记抗体和d-dimer荧光标记抗体按1:1:1摩尔比混合后干燥的圆斑。
盖片2由微通道22和加样孔21组成,加样孔21在基片1的样本缓冲区11上方,与微通道22联通。
优选地,将检测区13第四检测位点134设置为质控位点,可由生物素化nt-probnp抗体和重组nt-probnp抗原组成质控位点,或者生物素化ctni抗体和ctni重组抗原组成质控位点,或者生物素化d-dimer抗体和d-dimer重组抗原组成质控位点,或者其中的任意两组组成质控位点,或者三组一起组成质控位点。检测区第一检测位点131、第二检测位点132、第三检测位点133分别包被有生物素化nt-probnp抗体、生物素化ctni抗体、物素化d-dimer抗体中的任意一种,位置可互换。
本实施例中芯片卡在废品率及灵敏度的检测如下:
(1)芯片卡废品率检测
本实施例芯片卡检测区第一检测位点、第二检测位点、第三检测位点分别包被有生物素化物素化d-dimer抗体、nt-probnp抗体、生物素化ctni抗体、和第四检测位点包生物素化nt-probnp抗体和nt-probnp重组抗原组成质控位点。在芯片卡制备过程中,第一次点样包被亲和素废品率和第二次点样包被各位点对应溶液废品率,通过成像系统判断各点圆度、直径、点中心位置偏移三个指标,判断是否符合设置标准,任何一项不合格即确定为不合格品,计算2000人份基片在这两步点样过程中产生的废品率。普通基片与本实施例基片其他步骤处理方式一致,数量一样。结果发现本实施例基片对第二步降低圆度和直径的不合格率有很大提高,两步总废品率接近1%,远低于普通基片的5%,见表3。
表3两种基片两步点样包被不合格率比较
(2)芯片卡灵敏度检测
本实施例基片和普通基片点样包被等处理过程一致,选择相同浓度和体积的亲和素以及包被液体,最终各组随机选择10人份进行样本检测。样本为企业内控品,浓度值分别为:nt-probnp107.17pg/ml,ctni0.41ng/ml,d-dimer0.52mg/l。
检测过程:
在加样孔位置,加入血浆或血清样本,进入样本缓冲区,样本缓冲区干燥的样本缓冲液被样本溶解混合,样本在微通道毛细作用下依次流经微通道内的荧光标记区、检测区、最终到达废液区。样本流经荧光标记区时,溶解包被在荧光标记区的荧光标记混合物,包括荧光标记nt-probnp抗体、荧光标记ctni抗体和荧光标记d-dimer抗体,样本中的抗原与部分荧光混合标记抗体反应结合形成荧光抗原抗体复合物,流经检测区时,荧光复合物分别与第一检测位点包被的生物素化nt-probnp抗体、第二检测位点包被生物素化ctni抗体以及第三检测位点包被生物素化d-dimer抗体进行特异性的免疫反应;在荧光标记区未被样本中抗原结合的荧光标记ctni抗体,在质控区与生物素化ctni抗体和ctni重组抗原复合物发生特异性免疫反应。
通过配套仪器检测分别检测第一检测位点、第二检测位点、第三检测位点以及质控位点的荧光信号强度,分别计算第一检测位点的荧光信号强度/质控位点的荧光信号强度、第二检测位点的荧光信号强度/质控位点的荧光信号强度、第三检测位点的荧光信号强度/质控位点的荧光信号强度,以荧光信号比值为纵坐标、以配制的系列质控品浓度为横坐标绘制的标准曲线,最终得到全血样本中各检测指标的浓度。
结果显示,本实施例基片各nt-probnp,ctni和d-dimer浓度检测平均值更接近内控品浓度值,且降低产品cv值,详见表4。因此,本实施例芯片卡灵敏度提高。
表4两组基片各位点检测结果平均值及cv值比较
以上所述仅为本实用新型的较佳实施例而已,并不用以限制本实用新型,凡在本实用新型的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本实用新型的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!