收集水蒸气的材料和装置的制作方法
相关申请的交叉引用本申请要求2018年5月17日提交的标题为“用于生产淡水的太阳能辅助收集大气水的材料”的美国临时专利申请第62/672865号和2019年1月23日提交的标题为“基于吸收的连续大气水产生器(awg)装置”的美国临时专利申请第62/795691号的优先权,其公开内容通过引用整体并入本文。
背景技术:
:本文公开的主题的实施方案总体上涉及用于使用包含易潮解的盐和光热剂的聚合物水凝胶来收集大气水蒸气的装置、材料和方法。
背景技术:
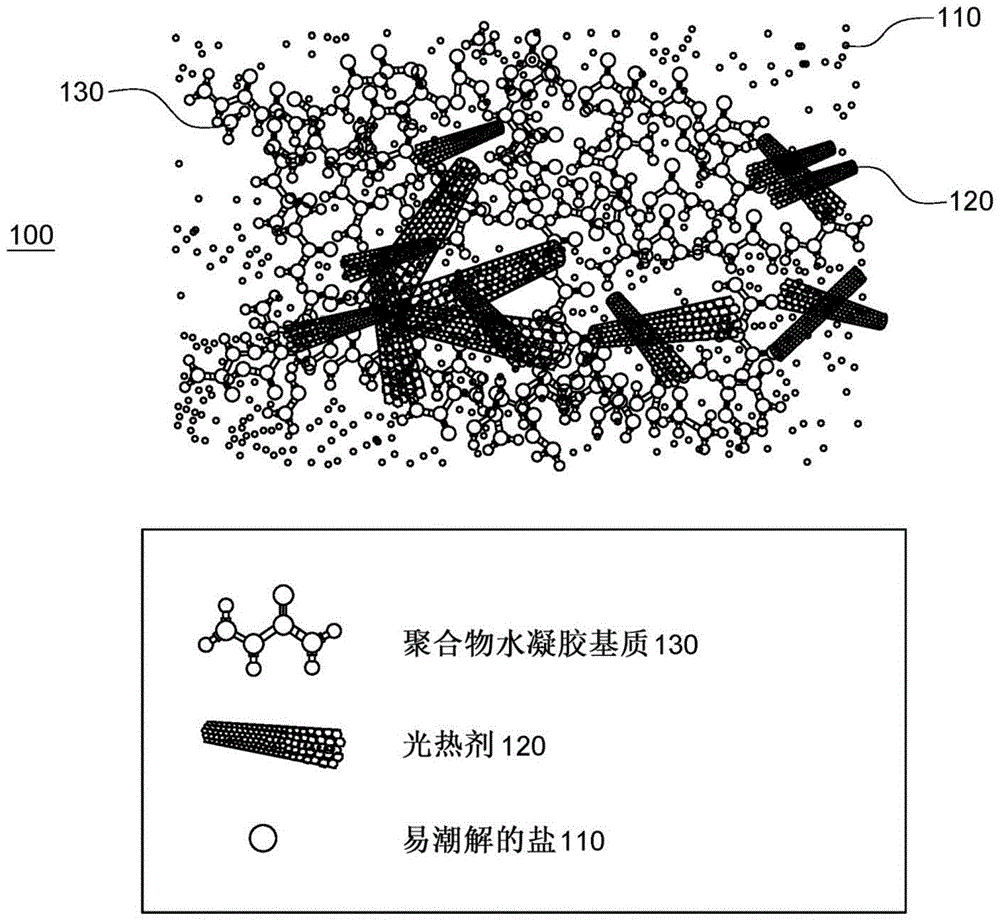
的讨论水对于这个星球上的生命是必需的。但是,世界上许多地区没有随时取用的水。此外,即使是可以使用水的区域,可用的水也可能不适合人类饮用。例如,可用的水可能是来自海洋的盐水,其中所含的钠太多,无法以维持人类生命所需的量用于饮用。地球大气是一种随时可获得的水源,几乎可以在地球上的任何地方使用地球大气,并且地球大气含有大约129000亿吨淡水。因此,已经在获取大气水蒸气来为干旱地区、内陆地区和偏远社区提供清洁水方面进行了大量研究。最有希望的常规收集大气水的装置使用水吸附剂来捕集大气水蒸气以及使用太阳能来释放捕集的用于饮用的大气水蒸气。使用太阳能释放捕集的大气水是有利的,因为该装置不需要外部电源从水吸附剂中解吸捕集的大气水。为了节省成本并鼓励广泛采用,收集大气水的装置应包括水吸附剂,使得即使在相对低的湿度条件下也能够从空气中吸收大量的水,并且能够在相对较低的温度下释放经吸收的水。例如硅胶、沸石、活性氧化铝的常规干燥剂通常具有宽的水蒸气吸收窗口,但要有效释放捕集的水,则它们需要高温(>160℃),这通常超出了简单的基于太阳能光热的加热装置所能够提供的温度。文献[1]公开了由聚丙烯酸钠粉末与氯化锂溶液形成的固体超级干燥剂。该干燥剂可以在低于80℃的温度下再生,即可以释放吸收的水。尽管文献[1]没有公开可以在低于80℃多少的温度下再生干燥剂,但是使用太阳辐射将超级干燥剂加热至大约80℃需要非常强的太阳光线。因此,文献[1]中公开的解决方案只能在有限的环境条件下产生水。文献[2]公开了一种水凝胶复合干燥剂,其组成为由氯化钙(cacl2)形式的吸湿性盐浸渍的多孔聚(n-异丙基丙烯酰胺)。具体而言,将氯化钙浸渍在热响应性聚合物基质-双网络al-褐藻酸盐/pnippam水凝胶中。水凝胶复合干燥剂是热响应性聚合物,其是温度诱导的相转移材料。当温度低时,聚合物表现出亲水润湿行为,其中水可以被吸收到交联结构中。当温度高于特定值(称为最低临界共溶温度,lcst)时,聚合物转化为疏水润湿行为,其中聚合物链将收缩并挤出水。因为pnipaam是静电交联的水凝胶,所以浸润溶液的离子强度(即盐溶液的浓度)将显著影响其相变性能,这似乎是文献[2]公开可以将非常有限的盐加载到水凝胶中的原因。文献[2]中公开的水凝胶的一个问题是其需要足以提高水凝胶温度以使其转化为疏水相的热源。这通常涉及燃烧化石燃料的热源,因此需要额外的化石燃料能量输入才能将水蒸气转化为水。文献[2]中公开的水凝胶的另一个问题涉及其水释放过程。当温度高于lcst时,由于亲水性向疏水性的转化,聚合物链/交联将收缩。因此,水在其原始位置被“留下”。此过程将导致严重的盐洗去,并且从水凝胶中沉淀出来的吸湿性物质以及其他杂质将污染收集的水。此外,盐洗去会导致吸收剂的水吸收性能下降,因此,需要偶尔向水凝胶中添加盐以保持其水吸收性能。因此,需要一种收集大气水的材料,其能够吸收大量的大气水蒸气并且能够在相对较低的温度下安全地解吸大气水蒸气而无需化石燃料加热源、和/或其可以产生纯净水而不是盐污染的水。技术实现要素:根据一个实施方案,存在一种收集大气水的材料,其包含易潮解的盐、光热剂以及含有易潮解的盐和光热剂的聚合物水凝胶基质。根据另一个实施方案,存在一种用于形成收集大气水的材料的方法。形成了包含光热剂的聚合物水凝胶基质。然后将包含光热剂的聚合物水凝胶基质冷冻干燥。将包含光热剂的冷冻干燥的聚合物水凝胶基质浸入含有易潮解的盐的溶液中,以形成包含光热剂和易潮解的盐的聚合物水凝胶基质。然后将包含光热剂和易潮解的盐的聚合物水凝胶基质干燥。根据另一个实施方案,存在一种收集大气水的装置,其包括具有透光上表面和出水口的冷凝室。装置还包括布置在冷凝室下方的收集大气水的室,该收集大气水的室容纳有收集大气水的材料并具有底表面和顶表面,所述底表面具有接收环境空气的开口,所述顶表面具有开口以允许通过收集大气水的材料由于太阳能辐射到冷凝室的透光上表面上所产生的热量而使从环境空气捕集的大气水进入冷凝室。根据另一个实施方案,存在一种用于从水蒸气产生水的方法。通过布置在圆筒的外表面上的收集大气水的材料吸收水蒸气。收集大气水的材料包含易潮解的盐、光热剂和含有易潮解的盐和光热剂的聚合物水凝胶基质。旋转圆筒,使得吸收了水蒸气的收集大气水的材料的一部分朝向冷凝室,冷凝室布置在圆筒上方并具有透光上表面。使朝向冷凝室的收集大气水的材料的一部分暴露于穿过透光上表面的太阳能。来自朝向冷凝室的收集大气水的材料的一部分的水蒸气由于太阳能而被释放到冷凝室中。将释放的水蒸气在冷凝室中冷凝为水。经冷凝的水是纯水,或者水蒸气仅由于太阳能被释放。附图说明结合在说明书中并构成说明书一部分的附图示出了一个或多于一个实施方案,并且与说明书一起解释了这些实施方案。在附图中:图1是根据实施方案的收集大气水的材料的图;图2是根据实施方案的用于制造收集大气水的材料的方法的流程图;图3a至图3e是根据实施方案的制造收集大气水的材料的图;图4是根据实施方案的收集大气水的装置的图;和图5是根据实施方案的由水蒸气产生水的方法的流程图。发明详述示例性实施方案的以下描述参考附图。不同附图中的相同附图标记表示相同或相似的元件。以下详细描述不限制本发明。相反,本发明的范围由所附权利要求书限定。为了简单起见,关于用于生产水的收集大气水的术语和结构讨论了以下实施方案。然而,应当认识到,实施方案也可以结合收集大气水的其他用途来使用,包括除湿、干燥剂辅助冷却等。贯穿说明书引用的“一个实施方案”、“实施方案”的意思是结合实施方案描述的特定特征、结构或特性包括在公开主题的至少一个实施方案中。因此,贯穿本说明书在各个地方出现的短语“在一个实施方案中”或“在实施方案中”不一定是指同一个实施方案。此外,在一个或多于一个实施方案中,可以以任何合适的方式组合特定特征、结构或特性。图1是示出收集大气水的材料100的图;收集大气水的材料包含易潮解的盐110、光热剂120和含有易潮解的盐110和光热剂120的聚合物水凝胶基质130。易潮解的盐110是液相的,但在聚合物水凝胶基质130中保持固态形式。聚合物水凝胶基质130包含交联的柔性水凝胶网络。本领域技术人员应理解,光热剂是一种由于光激发试剂而以热的形式产生热能的光热剂。所公开的收集大气水的材料是特别有利的,因为它对浸润溶液的离子强度不敏感,这使其可以容纳更多的吸湿性盐,因此与常规材料,例如文献[2]中公开的常规材料相比,其具有更高的水容量。具体地,所公开的收集大气水的材料在表现为亲水相时释放水,并且不需要转化为可以表现为盐洗去的疏水相。因此,与文献[2]中公开的材料相比,公开的收集大气水的材料显示出更好的耐久性,以及产生纯水的能力,而不产生需要进一步处理的被盐污染的水。因此,所公开的收集大气水的材料可以从大气水蒸气中产生饮用水(即蒸馏水),而无需另外的、复杂的后处理。在收集大气水的材料中包含光热剂使收集大气水的材料在自然日光下产生热量,这使得收集大气水的材料被加热并被蒸发掉吸收的水蒸气。因此,所公开的收集大气水的材料可以仅由于太阳能而释放水(即,它是自热的),并且不需要电力或可能需要消耗化石燃料的其他热源。在所示的实施方案中,易潮解的盐110是氯化钙(cacl2)。但是,易潮解的盐110可以是以下物质中的一种或多于一种:在所示的实施方案中,光热剂120包括碳纳米管(cnt)。但是,光热剂120可以是以下物质中的一种或多于一种:在所示的实施方案中,聚合物水凝胶基质130是聚丙烯酰胺(pam)水凝胶。但是,聚合物水凝胶基质130可以包含以下聚合物中的一种或多于一种:聚合物缩写聚(丙烯酸)paa聚(乙烯吡咯烷酮)pvp聚(丙烯酰胺)pam聚(环氧乙烷)peo聚(乙烯基甲基醚)pvme聚(乙烯醇)pva羟丙基纤维素hpc羟乙基纤维素hec聚(2-羟乙基乙烯基醚)pheve聚(n-异丙基丙烯酰胺)pnipam现在将结合图2的流程图和图3a至图3e的图来描述制造收集大气水的材料的方法。尽管描述了以氯化钙作为易潮解的盐,碳纳米管作为光热剂以及聚(丙烯酰胺)(pam)水凝胶作为水凝胶基质的方法,但该方法可以使用如上所述的任何易潮解的盐、光热剂和水凝胶基质。首先,形成包含光热剂的聚合物水凝胶基质(步骤210)。具体地,首先通过将例如6.0g大小为例如6nm至9nm×5μm的碳纳米管分散在例如70%硝酸(60ml)和97%硫酸(180ml)的混合物中。然后将分散液在70℃下回流4小时,然后超声处理2小时。然后可以过滤经处理的分散液,并且在将其加入水凝胶基质之前用去离子水彻底洗涤。通过将例如1.0克丙烯酰胺(am)溶解在添加了指定量的碳纳米管(例如2.5mg、1.25mg、0.5mg、0.375mg、0.25mg、0.125mg、0.05mg、0.025mg)的例如5ml的碳纳米管分散液中来形成水凝胶基质。然后用氮气吹扫丙烯酰胺碳纳米管分散液以清除溶解的氧气。其结果在图3a中示出,其中示出了悬浮在去离子水305中的丙烯酰胺310和碳纳米管320。将引发剂例如5.00mg过二硫酸钾(kps)和水凝胶化剂例如0.38mg的n,n'-亚甲基双(丙烯酰胺)(mbaa)添加到丙烯酰胺-碳纳米管分散液中。然后添加水凝胶促进剂例如25μl四甲基乙二胺(temed),并使混合物在例如22℃的温度下沉降过夜。所得的聚(丙烯酰胺)(pam)-碳纳米管水凝胶基质322在图3b中示出,其中水凝胶被标记为元素325,而聚(丙烯酰胺)被标记为元素330。然后将包含光热剂的聚合物水凝胶基质冷冻干燥以将水凝胶制成微孔水凝胶(步骤220)。可以在例如-80℃下冷冻干燥聚合物水凝胶基质。所得的微孔水凝胶在图3c中示出。然后将包含光热剂的经冷冻干燥的聚合物水凝胶基质浸入含有易潮解的盐的溶液中,以形成包含光热剂和易潮解的盐的聚合物水凝胶基质(步骤230)。例如,可以将经冷冻干燥的水凝胶浸入例如10ml的氯化钙溶液中持续例如24小时。干燥可以在环境条件下进行,例如60%的相对湿度和22℃。在例如60%的相对湿度和22℃的环境条件下,使用浓度为0.1g/ml、0.2g/ml、0.3g/ml、0.4g/ml、0.5g/ml和0.6g/ml的氯化钙进行24小时的实验。根据实验,氯化钙的浓度为0.4g/ml时,氯化钙的负载量最高,并且水蒸气的吸收能力最高。所得的水凝胶如图3d所示,其中氯化钙悬浮在溶液中,因此看不到氯化钙。最后,干燥包含光热剂和易潮解的盐的聚合物水凝胶基质(步骤240)。例如,可以将聚(丙烯酰胺)-碳纳米管-氯化钙水凝胶在鼓风炉中在80℃下干燥三天。所得的水凝胶在本文中称为收集大气水的材料,如图3e所示,其中氯化钙标记为元素335。所公开的收集大气水的材料可用于任何类型的收集水的装置中,图4示出了其中一个实例。收集大气水的装置400包括冷凝室405,该冷凝室405具有透光上表面410和出水口415。收集大气水的装置400还包括布置在冷凝室405下方的收集大气水的室420,该收集大气水的室420包括收集大气水的材料425并具有底表面430和顶表面445,该底表面430具有接收环境空气的开口435,该顶表面445具有开口450以允许通过收集大气水的材料425由于太阳能460辐射到冷凝室405的透光上表面410所产生的热量而使从环境空气440捕集的大气水455进入冷凝室405。如图所示,冷凝室405包括用于将收集的水移动到出水口415的倾斜的集水器465。此外,冷凝室405的透光表面410应该由对进入的太阳能460影响最小的材料,例如石英制成。收集大气水的室420包括圆筒470,收集大气水的材料425布置在该圆筒的外表面上。收集大气的水室420还包括围绕圆筒470的框架475。圆筒470包括轴480,电动机(未示出)连接至轴480。应当认识到,收集大气水的装置400还可以包括除了所示的元件外的元件,例如轴上的轴承、垫圈、螺栓、螺母等。圆筒470可以由例如丙烯酸的材料构成。圆筒470的内部可以是空的或可以被填充。圆筒的侧表面(即图4中可见的表面)可以包括孔。因此,当有太阳能460到达圆筒470时,圆筒470的上部将比下部温暖。由于借助于光热剂加热收集大气水的材料425,水蒸气从圆筒470释放到冷凝室405中。水蒸气将附着至冷凝室的上表面410和/或侧壁,并且水滴将落到倾斜的集水器465上,并通过出水口415离开冷凝室405。同时,圆筒470下部中的收集大气水的材料425将不会被加热到足以释放水蒸气的程度,因此继续从大气中吸收水蒸气。为了辅助水蒸气的冷凝,冷凝室405的侧壁可以由例如铜的金属制成。因此,应理解的是,电动机使圆筒470旋转,使得上部的已经释放了水蒸气的收集大气水的材料425旋转以朝向收集大气水的室420的底表面430,从而使它可以从环境空气440中吸收水蒸气,并且使得下部的已经从环境空气440中吸收了水蒸气的收集大气水的材料425旋转以朝向收集大气水的室420中的开口450,从而使它可以暴露于太阳能460并被加热以将所吸收的水蒸气释放到冷凝室405中。通过将电动机附接到圆筒470,可以连续操作收集大气水的装置400,从而可以连续地从环境空气440中吸收水蒸气并将水蒸气排放到冷凝室405中。圆筒470可以以例如每小时00.5转、0.75转、1.5转或4转的速度旋转。这是特别有利的,因为水蒸气可以被连续地吸收和解吸而无需其他人工干预,因此使得对于纯工业实施之外的例如在住宅中使用的多种实施是可行的。现在将结合图5的流程图描述使用图4所示的收集大气水分的装置400由水蒸气产生水的方法。最初,通过布置在圆筒470的外表面上的收集大气水的材料425吸收水蒸气(步骤510)。收集大气水的材料425包含易潮解的盐110、光热剂120和含有易潮解的盐110和光热剂120的聚合物水凝胶基质130。旋转圆筒470,使得吸收了水蒸气的收集大气水的材料425的一部分朝向冷凝室405,冷凝室405布置在圆筒470上方并具有透光上表面410(步骤520)。使朝向冷凝室405的收集大气水的材料425的一部分暴露于穿过透光上表面410的太阳能(步骤530)。太阳能使水蒸气从朝向冷凝室405的收集大气水的材料425的一部分释放到冷凝室405中(步骤540)。释放的水蒸气在冷凝室405中冷凝为水(步骤550)。冷凝水是纯水,或者水蒸气仅由于太阳能被释放。当收集大气水的材料425的一部分朝向冷凝室405时,收集大气水的材料425的第二部分不直接暴露于太阳能,并且收集大气水的材料的第二部分吸收水蒸气。因此,可以连续操作收集大气水的装置400,从而可以连续从环境空气440中吸收水蒸气并将水蒸气排放到冷凝室405中。此外,收集大气水的材料在释放水蒸气时不从亲水相变为疏水相。针对收集大气水的材料进行了许多实验,该收集大气水的材料包括聚(丙烯酰胺)-碳纳米管-氯化钙水凝胶(以下称为“pam-cnt-cacl2水凝胶”)、以及聚(丙烯酰胺)-碳纳米管水凝胶(以下称为“pam-cnt水凝胶”)、聚(丙烯酰胺)-氯化钙水凝胶(以下称为“pam-cacl2水凝胶”)和聚(丙烯酰胺)水凝胶(以下称为“pam水凝胶”)。关于收集大气水的材料的组成,使用不同浓度的碳纳米管(即2.5mg、1.25mg、0.5mg、0.375mg、0.25mg、0.125mg、0.05mg和0.025mg)和不同浓度的氯化钙(即0.1g/ml、0.2g/ml、0.3g/ml、0.4g/ml、0.5g/ml和0.6g/ml)进行试验。实验表明,水凝胶的结构刚性在很大程度上取决于水凝胶中聚合物的量,可以通过在合成过程中改变丙烯酰胺单体的量来调节水凝胶中聚合物的量。基于以下事实和成本考虑,将丙烯酰胺单体前体的量优化为20重量%。首先,20重量%的丙烯酰胺单体是pam水凝胶表现出独立的固体形式并具有足够的结构稳定性的阈值。如果丙烯酰胺单体浓度低于20%,则产物为黏稠的液体状。其次,将丙烯酰胺单体的浓度增加到20重量%以上不会带来明显的提高水吸收和释放的益处。因为收集大气水的材料被设计成通过被暴露于太阳能来释放水,所以评估了没有碳纳米管和带有碳纳米管的pam水凝胶的吸光度。没有碳纳米管的pam水凝胶强烈吸收1400nm以上波长的近红外光,这是由于水凝胶内部的水分子产生的吸光度。添加碳纳米管增加了从240nm至1400nm的吸光度。实验表明,水凝胶中少量的碳纳米管(即,ppm级)导致吸光度大大提高。实验表明,当碳纳米管的负载量仅为0.083重量‰时,吸收了99%的入射光。在一个实施方案中,pam水凝胶中碳纳米管的负载量可设定为0.42‰,其中几乎100%的入射光将被吸收。氯化钙的水蒸气吸收行为既可以单独进行评估,也可以掺入pam-cnt水凝胶中进行评估。实验表明,将氯化钙盐暴露在60%的相对湿度条件下后,白色固体盐完全液化为无色透明溶液,并且在吸水后,pam-cnt-cacl2水凝胶显著膨胀,但仍呈如软橡胶的固体形式。研究并比较了在动态和静态湿度情况下的pam-cnt-cacl2水凝胶的吸水性能。设定25℃的恒定温度,并在所有样品的整个吸水过程中保持该温度。选择25℃的温度是因为在干旱地区的夜间发生水蒸气吸收时通常为该温度。在测试前,首先将所有用于吸水评估的样品进行干燥。在动态情况下,将水凝胶在一定的时间内保持在湿度逐步增加的流中,而在静态情况下,在整个吸水过程中相对湿度保持不变。首先对pam水凝胶和pam-cnt水凝胶进行动态相对湿度测试。两者均表现出相似的吸水特性,在低湿度范围(<40%)下,干燥的pam水凝胶的水蒸气吸收略高于干燥的pam-cnt水凝胶,并且在高相对湿度范围内无明显差异。但是,在高湿度范围内没有显著差异。静态相对湿度测试表明,pam水凝胶和pam-cnt水凝胶均在400min内逐渐达到其饱和容量附近的吸水值,并且在80重量%的相对湿度下由于吸水而产生的最终重量变化分别为32重量%和38重量%。使用pam-cacl2水凝胶和pam-cnt-cacl2水凝胶进行了其他相对湿度实验。在动态吸水率测量中,这两者均表现出相似的与相对湿度相关的水蒸气吸收趋势。具体地说,在5%的非常低的湿度下这两者均开始水吸收,并且之后随着湿度的增加而逐渐增加,在其他条件相同的情况下,吸水量要比没有氯化钙负载的水凝胶高得多。在相对湿度为10%、35%、60%和80%的情况下,pam-cacl2水凝胶在实验结束时的吸水量分别为6%、72%、116%、203%,pam-cnt-cacl2水凝胶的吸水量分别为5%、69%、110%、173%。在80%的湿度下,pam-cacl2水凝胶和pam-cnt-cacl2水凝胶吸水量是各个水凝胶在负载氯化钙之前的重量的6.3倍和4.5倍,这清楚地证明了氯化钙在水吸收中的有效性。负载了氯化钙的水凝胶的吸水特性与纯氯化钙晶体的吸水特性非常相似,具体吸收量仅有微小差异,这表明氯化钙是pam-cnt-cacl2水凝胶吸水的主要原因。因为已经对水-氯化钙的相图进行了深入研究,并且可以在文献中轻松找到,所以认为这可以用来解释所公开的pam-cnt-cacl2水凝胶的吸水行为。氯化钙包括与水吸收过程有关的两个主要阶段。在第一阶段,无水氯化钙晶体通过水合反应捕获水分子并形成水合物。氯化钙吸收足够的水并形成cacl2.6h2o后,随着更多的水被吸收,它溶解在吸收的水中。25℃时,饱和氯化钙水溶液的蒸气压为0.9kpa,等同于26%的湿度。换句话说,氯化钙在相对湿度小于26%时的吸水是由于其水合水的增加,而在相对湿度大于26%的情况下会导致氯化钙水溶液的稀释,即潮解。应当注意,作为临界点的26%相对湿度值可以随环境温度而变化。从理论上讲,第一阶段中纯无水氯化钙的吸水量为97%,成为cacl2.6h2o时结束。但是,在低于160℃的温度下很难去除最后两个水晶体。在实验中,将样品在80℃下预干燥,因为这是通过在常规和非集中日光下进行光热加热可以实现的合理温度。因此,在80℃下干燥过程之后,公开的pam-cnt-cacl2水凝胶中的氯化钙主要是cacl2·4h2o和cacl2·2h2o的混合物,这通过x-射线衍射分析和相图进行了证实。因为在实验中,将4克氯化钙负载到1克pam-cnt水凝胶中(总重量的4/5),所以氯化钙的负载率为80%。在吸水过程中,由水合反应引起的总重量变化应不明显,即小于30%,这是最终吸水量的一小部分。该分析表明,水凝胶材料的大部分水吸收是由氯化钙水溶液的潮解引起的。在潮解阶段的吸水量高度依赖于周围的湿度。因此,吸收随湿度的增加而连续增加,这使氯化钙具有宽的吸收窗口。将基于由静态相对湿度测试获得的结果得出的衍生重量变化用于研究氯化钙、pam-cacl2水凝胶和pam-cnt-cacl2水凝胶的吸水动力学。在开始的200分钟内,所有三个样品在相对湿度为10%时都表现出较小的吸收率,并且在200分钟后吸收率迅速降低至接近零,这意味着在相对湿度为10%时具有快速但少量的水吸收。当相对湿度小于10%时,pam-cacl2水凝胶和pam-cnt-cacl2水凝胶具有与氯化钙相似的吸收趋势,但吸收速率更高,这可能是由于水凝胶具有多孔结构。在静态相对湿度测试(即1000分钟)期间,pam-cacl2水凝胶和pam-cnt-cacl2水凝胶在10%、35%和60%的确定相对湿度下达到饱和状态,这通过它们在测试结束时的吸收率非常接近于零来指示。然而,在35%、60%和80%的相对湿度下,原始氯化钙盐未能在1000min内达到饱和状态,这可能是由于它在潮解后具有液体特性。据推测,仅在氯化钙溶液界面上的空气中发生吸水并受边界层控制。通过比较三批样品的结果,可以得出以下结论:(1)pam-cacl2水凝胶和pam-cnt-cacl2水凝胶的吸水性能主要是由氯化钙贡献的;(2)水凝胶基质不抑制整体的吸水性能;和(3)水凝胶平台不仅提供了收集大气水的装置的物理稳定性,而且还提高了吸水动力学,使得其比原始的氯化钙盐具有更快的蒸气吸收速率。在收集大气水的装置中,水在日光的帮助下通过光热作用释放出来,从而提高了吸收剂的温度。因此,在实验室中使用模拟日光源研究了水凝胶的水释放性能。首先将pam-cacl2水凝胶和pam-cnt-cacl2水凝胶样品在室温下于相对湿度为60%的空气中存储36小时,以确保完全吸水。对于这两种水饱和的水凝胶,pam/cacl2水凝胶的水含量为53.7%,pam-cnt-cacl2水凝胶的水含量为54.5%。将5.0g的水饱和的水凝胶暴露在强度为1kw/m2的模拟日光下以释放水。光照50分钟,pam-cacl2水凝胶的表面温度仅升高到35℃,然后在275分钟后缓慢升高到大约42℃。如上所述,在这种情况下,温度升高主要归因于水的光吸收。水凝胶的表面温度取决于其能量平衡。在光照50分钟的初始阶段,水释放速度相对较快,这会带走大量的热量,从而导致水凝胶的温度降低。然后,水蒸发速率逐渐降低,因为在此过程中,由于水的流失,水凝胶内部残留水中的盐浓度持续增加。因此,水蒸发所消耗的热量减少,使平衡移至更高的平衡温度。实验结束时,pam-cacl2水凝胶的温度达到42℃,水凝胶由于释放水损失了总重量的25%。这表明,pam-cacl2水凝胶内部只有不到一半的水能够被释放。关于公开的pam-cnt-cacl2水凝胶,其表面温度最初在25分钟时跃升至50℃,比pam-cacl2水凝胶的表面温度高15℃。该比较令人信服地证明了水凝胶中碳纳米管的巨大光热效应。应该注意,由于pam-cnt-cacl2水凝胶具有较高的温度,因此它的蒸发速率比pam-cacl2水凝胶高得多。然后,随着表面温度的升高,水的蒸发速率逐渐降低。最终记录的温度为75℃,在270分钟结束时,pam-cnt-cacl2水凝胶的重量变化%为约53%,表明pam-cnt-cacl2水凝胶中几乎所有(>97%)的经吸收的水均被释放。在从水凝胶中释放出大部分可用水的情况下,通过对流、辐射和传导而产生的热量损失是平衡恒定太阳能输入的主要能量消耗,因此,水凝胶温度分布在180分钟至270分钟的最后阶段呈现平稳状态。还评估了被模拟日光以不同的光强度照射的pam-cnt-cacl2水凝胶的温度和重量随时间变化的过程。在0.6kw/m2、0.8kw/m2和1.0kw/m2日光照射下的270分钟时观察到的温度分别为55℃、66℃和75℃。样品的相应重量变化分别为44%、49%和53%,对应于释放了80%、89%和97%的经吸收的水。这表明在弱化的日光下,大部分的经吸收的水仍然可以被有效释放。这些光热辅助的水释放实验表明,所公开的pam-cnt-cacl2水凝胶作为在宽范围的相对湿度和日光条件下工作的有效收集大气水的装置具有巨大潜力。进行循环测试以评估所公开的pam-cnt-cacl2水凝胶的稳定性。通过将2.5g干燥的水凝胶在黑暗中在22℃下在相对湿度为60%的露天环境中放置36小时,然后进行5小时的单次阳光辐照,来吸收水。整个循环重复10次。该实验表明,pam-cnt-cacl2水凝胶的水吸收和释放性能在10个循环后未发生恶化,表明其具有长期运行稳定性。总之,所公开的pam-cnt-cacl2水凝胶具有类似于氯化钙的优越的吸水能力,并且其灵活的固体形式使其成为一种有效的收集大气水的装置。由于所公开的pam-cnt-cacl2水凝胶的有效相对湿度范围覆盖了大多数干旱沙漠、几乎所有岛屿和内陆偏远地区,基于水凝胶的收集大气水的装置成本低廉、通用、可有效地利用的事实,因此适用于在这些地方提供非常需要的淡水。另外,所公开的pam-cnt-cacl2水凝胶仅需要太阳能来释放所获取的水蒸气,并且所释放的水是不含吸湿性物质或其他杂质的纯水。公开的实施方案提供一种收集大气水的材料,生产收集大气水的材料的方法以及一种收集大气水的装置。应当理解,该描述并非旨在限制本发明。相反,示例性实施方案旨在覆盖包括在由所附权利要求书限定的本发明的精神和范围内的替代、修改和等同形式。此外,在示例性实施方案的详细描述中,阐述了许多具体细节以便对所要求保护的发明进行全面理解。然而,本领域技术人员应理解,在没有这样的具体细节的情况下可以实施各种实施方案。尽管在实施方案中以特定组合描述了本发明示例性实施方案的特征和要素,但是每个特征或要素可以在没有实施方案的其他特征和要素的情况下单独使用,或者以具有或不具有本文所公开的其他特征和要素的各种组合来使用。本书面描述使用了所公开主题的实施例以使本领域任何技术人员能够实践该主题,包括制造和使用任何装置或系统以及进行任何合并的方法。主题的可专利范围由权利要求限定,并且可以包括本领域技术人员想到的其他实施例。这样的其他实施例旨在权利要求的范围内。引用文献[1]yang等人,developmentofsolidsuperdesiccantsbasedonapolymericsuperabsorbenthydrogelcomposite,rscadv.,2015,5,59583-59590。[2]cui等人,fastsuperabsorbentthermo-responsivehydrogelcompositedesiccantwithlowregenerationtemperature(2018)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1