光子晶体编码的检测芯片及其制备方法和应用以及药物筛选系统和药物筛选方法
1.本发明涉及一种光子晶体编码的检测芯片及其制备方法和应用,本发明还涉及一种采用该检测芯片的光子晶体编码的药物筛选系统,本发明进一步涉及一种采用该检测芯片的药物筛选方法。
背景技术:
2.药物筛选是药物研发的重要和关键过程,据统计,一种新药的上市平均需要15年和80亿美元,与此同时,人类面临着各种各样疾病的困扰,迫切要求能更快速且更低成本地研发新药。上个世纪90年代以来,基因组学和组合化学的发展对药物研究产生了深远的影响,高通量药物筛选技术是在此基础上出现的新型药物筛选方法,由于其简便,高效的特点,如今高通量药物筛选已经成为新药研发过程中的重要领域,广泛应用于候选化合物或生物的研究,成为药物筛选的主要技术手段之一。
3.cn101983724a公开了一种快速高通量抗病毒药物筛选模型,将在动物体内提取的含药血清加入到细胞培养液中,检测细胞活性,评价药物效果; cn102432973a公开了一种高通量药物筛选用微球,并用于高通量筛选中的闪烁分析法;cn104789634a公开了一种具有高精确性和高重复性的药物筛选方法,实现细胞在较小腔体内生长,同时用于筛选药物;cn107325964a 公开了一种即用型高通量三维药物筛选模型,用三维模型进行药物的筛选,但每次只能筛选一种浓度的一种药物。
4.尽管研究人员已经开发出多种筛选药物的方法,但是目前所采用的方法仍存在很多缺陷,例如:在筛选药物过程中所需药品和耗材使用量大,筛选过程中需要复杂的细胞液移液步骤,操作繁琐;实验时体系不易编码,从而难以实现同时对多种药物同时进行筛选。
技术实现要素:
5.本发明的目的在于克服现有药物筛选方法存在的筛选过程中需要复杂的细胞液移液步骤,且实验时体系不易编码,从而难以实现同时对多种药物进行筛选的不足,提供一种光子晶体编码的检测芯片及其制备方法和采用该检测芯片的药物筛选系统和药物筛选方法,本发明采用光子晶体进行编码,可以实现对多种药物同时进行筛选,并且在检测芯片表面构建超疏水
‑
亲水表面图案,从而能省略对于复杂的细胞移液步骤的依赖性。
6.根据本发明的第一个方面,本发明提供了一种光子晶体编码的检测芯片,该芯片含有基底,所述基底的至少一个表面具有超疏水区域和亲水检测点阵列,所述亲水检测点阵列中的亲水检测点具有亲水层、附着力增强层和光子晶体层,所述亲水检测点阵列的表层为光子晶体层,所述附着力增强层位于所述亲水层和光子晶体层之间。
7.根据本发明的第二个方面,本发明提供了一种光子晶体编码的检测芯片的制备方法,该方法包括以下步骤:
8.(1)提供基底;
9.(2)在基底的至少一个表面形成超疏水层;
10.(3)在所述超疏水层的部分表面形成亲水层;以及
11.(4)在至少部分亲水层的表面依次形成附着力增强层和光子晶体层。
12.根据本发明的第三个方面,本发明提供了由本发明第二个方面所述的方法制备的光子晶体编码的检测芯片。
13.根据本发明的第四个方面,本发明提供了根据本发明第一个方面或者第三个方面所述的检测芯片在药物筛选或者微生物筛选中的应用。
14.根据本发明的第五个方面,本发明提供了一种光子晶体编码的药物筛选系统,该系统包括本发明第一个方面或者第三个方面所述的检测芯片、以及附着在所述检测芯片的亲水检测点表面的一系列药物混合物,所述一系列药物混合物包括两种以上药物混合物,附着在具有相同颜色的光子晶体的亲水检测点表面的药物混合物为同一种药物混合物。
15.根据本发明的第六个方面,本发明提供了一种药物筛选方法,该方法包括以下步骤:
16.(a)提供一系列药物溶液,所述一系列药物溶液包括两种以上药物溶液;
17.(b)使所述药物溶液附着在本发明第一个方面或者第三个方面所述的检测芯片的亲水检测点表面,附着在具有相同颜色的光子晶体的亲水检测点表面的药物溶液为同一种药物溶液,将所述药物溶液干燥;以及
18.(c)使药物检测液附着在亲水检测点表面。
19.根据本发明的检测芯片含有光子晶体,光子晶体具有不同的结构色,易于编码,能方便快捷地同时对不同种类和/或不同浓度的药物和/或微生物进行筛选。
20.根据本发明的检测芯片的表面具有超疏水区域,在用于药物筛选或者微生物筛选时,与药物和/或微生物溶液结合,能够在检测芯片表面构建亲水
‑ꢀ
超疏水图案,使得检测芯片表面具有不同的浸润性能,对细胞培养液或者微生物培养液显示出不同的粘附性,从而借助于亲水
‑
超疏水图案,对细胞培养液或者微生物培养液进行切割,使得细胞培养液或者微生物培养液被切割成小液滴分布在检测芯片的亲水位置,消除了对于繁琐的移液操作的依赖,试剂用量少,实现了药物和/或微生物筛选的高效率和低成本。
21.根据本发明的光子晶体编码的检测芯片,对于光子晶体材料和超疏水区及基底材料没有严格的要求。根据本发明的光子晶体编码的检测芯片,制备工艺简单、成本低且制备周期短。因而,根据本发明的光子晶体编码的检测芯片便于实现批量生产。
附图说明
22.附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。
23.图1为本发明的实施例1制备的超疏水区域的静态水接触角测试图;
24.图2为本发明的实施例1制备的光子晶体编码的检测芯片中的光子晶体的颜色示意图;
25.图3为利用宏观角分辨光谱仪测定的本发明的实施例1制备的光子晶体的反射光谱。
26.图4为采用实施例1制备的药物筛选系统在不同盐酸阿霉素浓度下hela 细胞的存
活率测试结果。
27.图5为采用实施例2制备的药物筛选系统在不同5
‑
氟尿嘧啶浓度下hela 细胞的存活率测试结果。
28.图6为采用实施例3制备的药物筛选系统在不同的药物下hela细胞的存活率测试结果。
29.图7为采用实施例4制备的药物筛选系统在不同盐酸阿霉素浓度下 a549癌细胞的存活率测试结果。
30.附图标记说明
31.1:红色
ꢀꢀꢀꢀꢀꢀ
2:橙色
ꢀꢀꢀꢀꢀꢀ
3:黄色
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4:绿色
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5:青色
32.6:蓝色
ꢀꢀꢀꢀꢀꢀ
7:紫色
ꢀꢀꢀꢀꢀꢀ
8:超疏水区域
ꢀꢀꢀꢀ
9:亲水点
ꢀꢀꢀꢀꢀꢀꢀ
10:红色
33.11:橙色
ꢀꢀꢀꢀꢀ
12:黄色
ꢀꢀꢀꢀꢀ
13:绿色
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
14:青色
ꢀꢀꢀꢀꢀꢀꢀꢀ
15:蓝色
34.16:紫色
具体实施方式
35.以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
36.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
37.本发明中,“光子晶体编码”是指以光子晶体的不同结构色进行编码。
38.根据本发明的第一个方面,本发明提供了一种光子晶体编码的检测芯片,该芯片含有基底,所述基底的至少一个表面具有超疏水区域和亲水检测点阵列,所述亲水检测点阵列中的亲水检测点具有亲水层、附着力增强层和光子晶体层,所述亲水检测点阵列的表层为光子晶体层,所述附着力增强层位于所述亲水层和光子晶体层之间。
39.根据本发明的检测芯片,所述亲水层优选为对基底表面进行亲水化而形成的层。在一种优选的实施方式中,所述基底表面为超疏水表面,所述亲水层为对需要形成光子晶体的超疏水表面进行亲水化而形成的层。所述亲水化的方法可以包括但不限于:采用紫外光照射、等离子体处理、刻蚀、涂覆、表面化学修饰、电纺和电化学腐蚀中的一种或两种以上对超疏水层进行处理。所述刻蚀可以为离子束刻蚀和/或化学刻蚀。所述化学刻蚀采用的刻蚀液可以为食人鱼洗液、贝克刻蚀液和浓硫酸中的一种或两种以上。所述涂覆可以为喷涂、打印和旋涂中的一种或两种以上。
40.根据本发明的检测芯片,所述亲水层的表面的静态水接触角为不高于 5
°
。
41.本发明中,静态水接触角采用外形图像分析法测定,在温度为25℃、相对湿度为40%且压力为1标准大气压的条件下测定。
42.根据本发明的检测芯片,所述附着力增强层用于提高光子晶体层对亲水层的附着力。在一种优选的实施方式中,所述附着力增强层含有含硅化合物。所述含硅化合物优选为聚硅氧烷,更优选为聚二甲基硅氧烷,进一步优选为交联的聚二甲基硅氧烷,例如:所述含硅化合物可以为乙烯基封端的聚二甲基硅氧烷与含有硅氢键的聚硅氧烷(例如聚二甲基氢
硅氧烷)的反应产物,所述含有硅氢键的聚硅氧烷作为交联剂,与乙烯基封端的聚二甲基硅氧烷发生硅氢加成反应进行交联,所述乙烯基封端的聚二甲基硅氧烷与含有硅氢键的聚硅氧烷的质量比可以为8
‑
12:1,例如可以为8:1、8.5:1、9:1、9.5: 1、10:1、10.5:1、11:1、11.5:1或者12:1。根据该优选的实施方式,所述附着力增强层的表面静态水接触角优选为110
°
至120
°
,例如:110
°
、 111
°
、112
°
、113
°
、114
°
、115
°
、116
°
、117
°
、118
°
、119
°
或者 120
°
。根据该优选的实施方式,能进一步提高点状的光子晶体在亲水层表面的附着稳定性,即便在细胞培养液中浸泡一周以上,点状的光子晶体也不会从基底表面脱落。
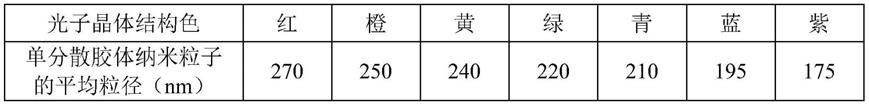
43.根据本发明的检测芯片,所述光子晶体含有单分散颗粒,将对空气具有不同光折射率的两种以上单分散颗粒组合使用,能使得光子晶体显示出不同的颜色,实现编码,即所述光子晶体使得所述亲水检测点阵列中每一列内的亲水检测点或每一行内的亲水检测点显示出与其它列内的亲水检测点或其它行内的亲水检测点不同的颜色。作为一个实例,亲水检测点阵列的同一行或同一列内的光子晶体采用相同的单分散颗粒,不同行或不同列采用对空气具有不同光折射率的单分散颗粒,能使得同一行或同一列显示出相同的颜色,不同行或不同列显示出不同的颜色,通过颜色的不同对亲水检测点阵列进行编码。
44.本发明中,所述单分散颗粒可以为有机颗粒、无机颗粒、有机
‑
无机复合颗粒和量子点中的一种或两种以上的组合。所述单分散颗粒的具体实例可以包括但不限于:具有核壳结构的聚合物颗粒、氧化硅颗粒、聚苯乙烯颗粒、聚丙烯酸颗粒、金颗粒、银颗粒、铂颗粒、铜颗粒、氧化锌颗粒、氧化铁颗粒、四氧化三铁颗粒、氧化钛颗粒、碳颗粒、多巴胺颗粒、硅颗粒和量子点中的一种或两种以上,更优选为具有核壳结构的聚合物颗粒、聚苯乙烯颗粒、二氧化硅颗粒和聚(苯乙烯
‑
甲基丙烯酸甲酯
‑
丙烯酸)颗粒中的一种或两种以上。
45.在本发明的一种优选的实施方式中,所述单分散颗粒为具有核壳结构的聚合物颗粒、二氧化硅颗粒、氧化钛颗粒、聚苯乙烯颗粒和聚(苯乙烯
‑
甲基丙烯酸甲酯
‑
丙烯酸)颗粒中的一种或两种以上。更优选地,所述单分散颗粒为二氧化硅颗粒、聚苯乙烯颗粒和聚(苯乙烯
‑
甲基丙烯酸甲酯
‑
丙烯酸)颗粒中的一种或两种以上。根据该优选的实施方式,能进一步提高光子晶体的生物相容性。
46.所述单分散颗粒的平均粒径可以为100nm至800nm,优选为100nm至 400nm,更优选为150nm至280nm。所述单分散颗粒中的“单分散”是指颗粒的颗粒尺寸分布窄。一般地,所述单分散颗粒的粒径波动在5%以内(即,粒径分布的标准偏差在5%以内)。本发明实施例中使用的单分散颗粒的粒径分布的标准偏差均在5%以内。本发明中,平均颗粒尺寸以及粒径分布的标准偏差均由体积平均粒径确定,采用激光粒度仪测定。
47.所述单分散颗粒可以商购得到,也可以采用常规方法制备,本文不再详述。
48.根据本发明的检测芯片,所述光子晶体层的直径可以为0.1
‑
10mm,例如:0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、 1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、 3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、6.1、 6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、7.4、7.5、7.6、 7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9、9.1、9.2、 9.3、9.4、9.5、9.6、9.7、9.8、9.9或者10mm。所述光子晶体层的直径优选为2
‑
5mm。
49.根据本发明的检测芯片,所述光子晶体层的表面静态水接触角优选为 0
°
至90
°
,
例如:0
°
、1
°
、2
°
、3
°
、4
°
、5
°
、6
°
、7
°
、8
°
、9
°
、 10
°
、11
°
、12
°
、13
°
、14
°
、15
°
、16
°
、17
°
、18
°
、19
°
、20
°
、 21
°
、22
°
、23
°
、24
°
、25
°
、26
°
、27
°
、28
°
、29
°
、30
°
、31
°
、 32
°
、33
°
、34
°
、35
°
、36
°
、37
°
、38
°
、39
°
、40
°
、41
°
、42
°
、 43
°
、44
°
、45
°
、46
°
、47
°
、48
°
、49
°
、50
°
、51
°
、52
°
、53
°
、 54
°
、55
°
、56
°
、57
°
、58
°
、59
°
、60
°
、61
°
、62
°
、63
°
、64
°
、 65
°
、66
°
、67
°
、68
°
、69
°
、70
°
、71
°
、72
°
、73
°
、74
°
、75
°
、 76
°
、77
°
、78
°
、79
°
、80
°
、81
°
、82
°
、83
°
、84
°
、85
°
、86
°
、 87
°
、88
°
、89
°
或者90
°
。更优选地,所述亲水检测点的光子晶体层的表面静态水接触角为10
°
至60
°
。进一步优选地,所述亲水检测点的光子晶体层的表面静态水接触角为30
°
至50
°
。
50.根据本发明的检测芯片,多个亲水检测点以行列排列,在基底表面形成亲水检测点阵列。所述亲水检测点阵列的行和列的数量可以根据检测芯片的检测通量进行选择,例如可以为3
×
3以上阵列,例如7
×
7阵列。
51.根据本发明的检测芯片,所述基底具有亲水检测点阵列的表面中,与亲水检测点阵列形成互补的区域为超疏水区域。所述超疏水区域的表面的静态水接触角一般为150
°
至180
°
,例如:150
°
、151
°
、152
°
、153
°
、154
°
、 155
°
、156
°
、157
°
、158
°
、159
°
、160
°
、161
°
、162
°
、163
°
、164
°
、 165
°
、166
°
、167
°
、168
°
、169
°
、170
°
、171
°
、172
°
、173
°
、174
°
、175
°
、176
°
、177
°
、178
°
、179
°
或者180
°
。优选地,所述超疏水区域的表面的静态水接触角为155
°
至180
°
。更优选地,所述超疏水区域的表面的静态水接触角为160
°
至170
°
。
52.所述超疏水区域可以为粗糙化表面,例如:具有微纳结构的表面。优选地,所述超疏水区域为粗糙化表面并含有疏水性物质。所述疏水性物质可以为选自含硅的疏水性物质、含氟的疏水性物质、含氟和硅的疏水性物质以及聚苯乙烯中的一种或两种以上。更优选地,所述疏水性物质为选自聚硅氧烷、聚苯乙烯、聚四氟乙烯和聚全氟丙烯中的一种或两种以上。
53.本发明中,所述基底的材质可以根据检测芯片的具体使用场合进行选择。所述基底的具体实例可以包括但不限于硅基底、玻璃基底、石英基底、金属基底或聚合物基底。所述基底优选选自铝基底、硅基底、玻璃基底、石英基底、铁基底、铜基底、塑料基底和橡胶基底。所述基底更优选选自铝基底和硅基底。
54.根据本发明的第二个方面,本发明提供了一种光子晶体编码的检测芯片的制备方法,该方法包括以下步骤:
55.(1)提供基底;
56.(2)在基底的至少一个表面形成超疏水层;
57.(3)在所述超疏水层的部分表面形成亲水层;以及
58.(4)在至少部分亲水层的表面依次形成附着力增强层和光子晶体层。
59.所述基底的材质在前文已经进行了详细的描述,此处不再赘述。
60.步骤(1)中,根据基底的来源,可以采用常规方法对基底进行裁减和/ 或清洗。清洗采用的洗液可以为能清除基底表面不洁物的洗涤液,例如可以为水和/或丙酮。从进一步提高清洗的效果的角度出发,所述清洗可以在超声波的存在下进行。
61.步骤(2)中,将基底用于形成光子晶体阵列的表面进行超疏水化处理,形成超疏水层。所述超疏水层的表面的静态水接触角可以为150
°
至180
°
,例如:150
°
、151
°
、152
°
、153
°
、154
°
、155
°
、156
°
、157
°
、158
°
、 159
°
、160
°
、161
°
、162
°
、163
°
、164
°
、165
°
、166
°
、167
°
、168
°
、169
°
、170
°
、171
°
、172
°
、173
°
、174
°
、175
°
、176
°
、177
°
、178
°
、 179
°
或者180
°
。优选地,所述超
疏水区域的表面的静态水接触角为155
°
至180
°
。更优选地,所述超疏水区域的表面的静态水接触角为160
°
至 170
°
。可以采用常规方法将基底表面进行超疏水化处理。
62.在一种优选的实施方式中,可以将基底表面进行粗糙化,可选在经粗糙化的基底表面引入疏水性物质,从而在基底表面形成超疏水层。
63.可以采用常规方法将基底表面粗糙化,例如:化学蚀刻和/或能量束照射,所述能量束照射可以为采用激光对基底表面进行照射,从而在基底表面形成粗糙结构。所述化学蚀刻可以通过将化学蚀刻液施用于基底表面,从而对基底表面进行蚀刻,使得基底表面粗糙化。所述化学蚀刻液可以根据基底的材质进行选择,没有特别限定。在一个实例中,所述化学蚀刻液可以为含有氢氟酸的化学蚀刻液,例如:氢氟酸和盐酸的混合液,所述混合液中,氢氟酸:盐酸:水的体积比可以为1:16:5,所述氢氟酸的浓度为40重量%,所述盐酸的浓度为37重量%。所述化学蚀刻可以在15℃至30℃的温度下进行,优选在20℃至25℃的温度下进行。所述化学蚀刻的持续时间可以为5
‑
20 秒,优选为8
‑
12秒。
64.所述疏水性物质可以为选自含硅的疏水性物质、含氟的疏水性物质、含氟和硅的疏水性物质以及聚苯乙烯中的一种或两种以上。所述疏水性物质的具体实例可以包括但不限于聚硅氧烷、聚苯乙烯、聚四氟乙烯和聚全氟丙烯中的一种或两种以上。
65.可以采用常规方法将疏水性物质引入经粗糙化的基底表面,例如:化学气相沉积法。例如:可以将含有两个以上烷氧基基团的硅烷进行化学气相沉积,从而在经粗糙化的基底表面引入疏水性物质。在一种优选的实施方式中,可以将经粗糙化的基底置于干燥箱中,在含有两个以上烷氧基基团的硅烷的存在下进行干燥,从而在经粗糙化的基底表面引入疏水性物质聚硅氧烷。所述含有两个以上烷氧基基团的硅烷优选为1h,1h,2h,2h
‑
全氟癸基三甲氧基硅烷。所述干燥优选在50
‑
125℃、更优选60
‑
110℃、进一步优选70
‑
100℃的温度下进行,所述干燥的持续时间可以为0.5
‑
6小时,优选为1
‑
5小时,更优选为2
‑
4小时。所述干燥箱优选为真空干燥箱。
66.步骤(3)中,所述亲水层的表面的静态水接触角可以为不高于5
°
。
67.可以采用常规方法将超疏水层的需要形成亲水层的表面进行亲水化处理。具体地,形成亲水层的方法可以包括但不限于:采用紫外光照射、等离子体处理、刻蚀、涂覆、电纺和电化学腐蚀中的一种或两种以上对超疏水层进行处理。所述刻蚀可以为离子束刻蚀和/或化学刻蚀。所述化学刻蚀采用的刻蚀液可以为食人鱼洗液、贝克刻蚀液和浓硫酸中的一种或两种以上。所述涂覆可以为喷涂、打印和旋涂中的一种或两种以上。
68.在一种优选的实施方式中,可以在超疏水层表面形成掩膜,所述掩膜覆盖无需形成亲水层的区域,在超疏水层的暴露表面形成亲水层。该优选的实施方式中,优选采用紫外光照射未被掩膜覆盖的超疏水层表面,形成亲水层。所述紫外光照射的时间可以为6
‑
10小时。
69.步骤(3)中,多个亲水层以行列排列,在基底表面形成亲水点阵列。所述亲水点阵列的行和列的数量可以根据检测芯片的检测通量进行选择,例如可以为3
×
3以上阵列,例如7
×
7阵列。
70.步骤(4)中,在亲水层表面形成附着力增强层的方法可以根据采用的附着力增强性物质的性质进行选择。在一种优选的实施方式中,在亲水层的表面形成附着力增强层的方法包括:在亲水层的表面施用含硅化合物,这样能进一步提高光子晶体在基底表面的附
着稳定性。所述含硅化合物优选为聚硅氧烷,更优选为聚二甲基硅氧烷,进一步优选为交联的聚二甲基硅氧烷,例如:所述含硅化合物可以为乙烯基封端的聚二甲基硅氧烷与含有硅氢键的聚硅氧烷(例如聚二甲基氢硅氧烷)的反应产物,所述含有硅氢键的聚硅氧烷作为交联剂,与乙烯基封端的聚二甲基硅氧烷发生硅氢加成反应进行交联,所述乙烯基封端的聚二甲基硅氧烷与含有硅氢键的聚硅氧烷的质量比可以为8
‑
12:1,例如可以为8:1、8.5:1、9:1、9.5:1、10:1、10.5:1、 11:1、11.5:1或者12:1。根据该优选的实施方式,所述附着力增强层的表面的静态水接触角优选为110
°
至120
°
,例如:110
°
、111
°
、112
°
、 113
°
、114
°
、115
°
、116
°
、117
°
、118
°
、119
°
或者120
°
。
71.可以将含有含硅化合物的溶液涂覆在亲水层的表面,将所述溶液干燥,从而在亲水层的表面形成附着力增强层。优选地,所述含硅化合物的用量为 0.1
‑
1毫克/平方厘米。所述干燥的温度可以为50
‑
100℃,优选为60
‑
80℃。所述干燥的持续时间可以为10分钟至120分钟,优选为10分钟至60分钟,更优选为15分钟至30分钟。
72.步骤(4)中,所述光子晶体层的横截面为圆形,所述圆形的直径可以为0.1
‑
10mm,例如:0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、 1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、 2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、 4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、 5.8、5.9、6、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、 7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、 8.9、9、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9或者10mm。所述光子晶体层的直径优选为2
‑
5mm。
73.步骤(4)中,可以采用常规方法在亲水层表面形成光子晶体。在一种实施方式中。将一种乳液施用于需要形成光子晶体的亲水层的表面,将乳液干燥,形成光子晶体。所述乳液含有至少一种单分散颗粒和至少一种溶剂。
74.所述单分散颗粒在前文已经进行了详细的描述,此处不再赘述。以所述乳液的总量为基准,所述单分散颗粒的含量可以为0.5
‑
5重量%,优选为 1.5
‑
2.5重量%。
75.所述溶剂可以为水、醇、烷烃和芳烃中的一种或两种以上。所述醇是指在环境温度(一般为25℃)下为液体的醇,如链烷醇、环烷醇和芳基烷基醇。所述醇可以为一元醇、二元醇和三元醇中的一种或两种以上的组合。所述醇的具体实例可以包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇、叔丁醇、正戊醇、异戊醇、新戊醇、环戊醇、环己醇、苯甲醇、乙二醇、1,3
‑
丙二醇和丙三醇。所述烷烃是指在环境温度(一般为25℃)下为液体的烷烃,其具体实例可以包括但不限于戊烷、己烷、庚烷和辛烷。所述芳烃是指在环境温度(一般为25℃)下为液体的芳烃,其具体实例可以包括但不限于苯、甲苯、二甲苯、三甲苯和乙苯。
76.步骤(4)中,可以通过将所述单分散颗粒和所述溶剂混合并进行乳化,从而得到所述乳液。所述乳化的方法可以为常规方法,没有特别限定。具体地,可以通过对单分散颗粒和溶剂的混合液施加剪切作用,从而实现乳化;还可以在乳化机中进行乳化。为了强化混合和乳化效果,可以通过超声的方法将所述单分散颗粒和所述溶剂混合并进行乳化,从而得到所述乳液。所述单分散颗粒可以以固体颗粒的形式存在,也可以以胶体(如溶胶)的形式提供。在制备所述乳液时,可以额外添加表面活性剂,也可以不额外添加表面活性剂。所述表面活性剂可以为选自阳离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂和非离子表面活性剂中的一种或两种以上,优选为选自十二烷基苯磺酸钠、十二烷基硫酸钠、硬
脂酸钠、季铵盐型阳离子表面活性剂、氨基酸型两性离子表面活性剂、甜菜碱型两性离子表面活性剂、卵磷脂型两性离子表面活性剂、聚氧乙烯型非离子表面活性剂和多元醇型非离子表面活性剂中的一种或两种以上。
77.根据本发明的第三个方面,本发明提供了一种由本发明第二个方面所述的制备方法制备的光子晶体编码的检测芯片。
78.根据本发明的第四个方面,本发明提供了本发明第一个方面或者第三个方面所述的检测芯片在药物筛选或者微生物筛选中的应用。
79.所述药物可以为常见的各种具有治疗功能的药物,优选为抗癌药物,例如:阿霉素、盐酸阿霉素、顺铂、5
‑
氟尿嘧啶、博莱霉素、长春花碱、长春新碱、环磷酰胺、吉西他滨、甲氨蝶呤、盐酸阿糖胞苷、卡铂、顺铂、洛莫司汀、羟基脲、丝裂霉素、依托泊苷、嘌呤巯醇、柔红霉素、盐酸阿糖胞苷、喜树碱和紫杉醇中的一种或两种以上。更优选地,所述药物为缓释药物。
80.所述微生物可以为细胞、细菌、病毒和真菌中的一种或两种以上。
81.根据本发明的第五个方面,本发明提供了一种光子晶体编码的药物筛选系统,该系统包括本发明第一个方面或者第三个方面所述的检测芯片、以及附着在所述检测芯片的亲水检测点表面的一系列药物混合物,所述一系列药物混合物包括两种以上药物混合物,附着在具有相同颜色的光子晶体的亲水检测点表面的药物混合物为同一种药物混合物。
82.所述药物混合物含有载体和药物。所述载体优选为选自明胶、淀粉、海藻酸钠和纤维素中的一种或两种以上。在一种优选的实施方式中,所述药物为抗癌药物中的一种或两种以上,优选为阿霉素、盐酸阿霉素、顺铂、5
‑
氟尿嘧啶、博莱霉素、长春花碱、长春新碱、环磷酰胺、吉西他滨、甲氨蝶呤、盐酸阿糖胞苷、卡铂、顺铂、洛莫司汀、羟基脲、丝裂霉素、依托泊苷、嘌呤巯醇、柔红霉素、盐酸阿糖胞苷、喜树碱和紫杉醇中的一种或两种以上。进一步优选地,所述药物为缓释药物。所述载体与所述药物的重量比可以为 1
‑
200:1。
83.根据本发明的光子晶体编码的药物筛选系统,不同种药物混合物之间的区别可以根据药物筛选的目标进行选择,可以为至少一种物质的含量不同和 /或至少一种物质的种类不同。在一个实例中,同种药物混合物之间的区别在于药物(有效成分)的含量不同,这样可以筛选同一种药物在不同浓度下的作用效果。在另一个实例中,不同种药物混合物之间的区别在于药物(有效成分)的种类不同,这样可以对不同药物的药效进行筛选。
84.根据本发明的第六个方面,本发明提供了一种药物筛选方法,该方法包括以下步骤:
85.(a)提供一系列药物溶液,所述一系列药物溶液含有两种以上药物溶液;
86.(b)使所述药物溶液附着在本发明第一个方面或者第三个方面所述的检测芯片的亲水检测点表面,附着在具有相同颜色的光子晶体的亲水检测点表面的药物溶液为同一种药物溶液,将所述药物溶液干燥;以及
87.(c)使药物检测液附着在亲水检测点表面。
88.步骤(a)中,所述药物溶液含有载体、药物和分散剂。所述药物溶液可以为均相溶液,也可以为悬浮液或悬浊液。所述载体优选为选自明胶、淀粉、海藻酸钠和纤维素中的一种或两种以上。在一种优选的实施方式中,所述药物为抗癌药物中的一种或两种以上,优选为阿霉素、盐酸阿霉素、顺铂、5
‑
氟尿嘧啶、博莱霉素、长春花碱、长春新碱、环磷酰胺、吉西
他滨、甲氨蝶呤、盐酸阿糖胞苷、卡铂、顺铂、洛莫司汀、羟基脲、丝裂霉素、依托泊苷、嘌呤巯醇、柔红霉素、盐酸阿糖胞苷、喜树碱和紫杉醇中的一种或两种以上。所述药物优选为缓释药物。所述载体与所述药物的重量比可以为 1
‑
200:1。所述分散剂可以根据药物的种类进行选择,优选为水。
89.根据本发明的药物筛选方法,不同种药物溶液之间的区别可以根据药物筛选的目标进行选择,可以为至少一种物质的含量不同和/或至少一种物质的种类不同。在一个实例中,同种药物溶液之间的区别在于药物的含量不同,这样可以筛选同一种药物在不同浓度下的作用效果。在另一个实例中,不同种药物溶液之间的区别在于药物的种类不同,这样可以对不同药物的药效进行筛选。
90.步骤(b)中,可以采用常规方法将药物溶液滴加在亲水检测点表面。
91.步骤(b)中,将药物溶液进行干燥,使得药物和载体附着在亲水检测点表面,通过光子晶体的颜色对亲水检测点以及相应的被测药物进行编码。所述干燥可以根据药物溶液的溶剂进行选择。一般地,所述干燥可以在 30
‑
50℃的温度下进行,所述干燥的持续时间可以为2
‑
4小时。
92.步骤(c)中,所述药物检测液用于对药物的药效进行检测,可以含有细胞和/或微生物,例如:为含有细胞、细菌、病毒、真菌和微生物中的一种或两种以上的检测液。在一种优选的实施方式中,所述药物混合物为对癌细胞具有抑制作用的药物,所述药物检测液为含有能衡量药物对癌细胞的抑制作用的检测液,例如:含有癌细胞的检测液。
93.根据本发明的药物筛选方法,检测芯片中与亲水检测点阵列形成互补的区域为超疏水区域,因而可以通过超疏水区域和亲水检测点区域不同的浸润性,对药物检测液进行切割,使得药物检测液均匀分布在附着有药物的亲水检测点的表面,每一个亲水检测点形成相对独立的药物微检测器,对药物的药效进行检测,实现药物筛选。通过超疏水区域和亲水检测点区域浸润性的不同对药物检测液进行切割分配,避免了重复繁杂的移液操作,降低了药物筛选的操作复杂性,缩短了操作时间,提高了药物筛选效率。
94.具体地,步骤(c)中,使药物检测液附着在亲水检测点表面的方法可以包括:
95.(c1)用检测芯片具有亲水检测点阵列的表面切割固定于该表面上方的药物检测液;
96.(c2)将检测芯片从药物检测液中拉出。
97.方式(c1)中,可以在检测芯片上方固定药物检测液液滴,并使得药物检测液液滴沿检测芯片表面滑动,从而借助于检测芯片表面的亲水和超疏水作用,将药物检测液液滴进行切割,使得药物检测液附着在检测芯片的亲水检测点区域表面。具体地,可以采用移液装置,使得移液装置沿检测芯片表面滑动,或者使得检测芯片相对于移液装置发生移动,从而借助于检测芯片表面的亲水和超疏水作用,将药物检测液液滴进行切割,使得药物检测液附着在检测芯片的亲水检测点区域表面。可以沿检测芯片表面拖动滴液管,从而将药物检测液附着在检测芯片的亲水检测点区域表面。
98.方式(c2)中,可以将检测芯片浸入药物检测液中,并将检测芯片从药物检测液中竖直拉出(检测芯片具有亲水检测点阵列的表面为竖直),从而在检测芯片的亲水检测点表面附着药物检测液。
99.根据本发明的筛选方法,在亲水检测点区域引入药物检测液后,可以将检测芯片
在筛选条件下放置,检测药物检测液随时间的变化,从而衡量药物的药效。
100.以下结合实施例详细说明本发明,但并不因此限制本发明的范围。
101.以下实施例和对比例中,采用购自岛津的型号为ig
‑
1000的粒度仪测定单分散颗粒的粒径以及粒径分布,其中,粒径为体积平均粒径。
102.以下实施例和对比例中,采用购自dataphysics的型号为oca20的接触角仪测定静态水接触角,测试在25℃的温度下进行,测试时的压力为1标准大气压,湿度为40%。
103.以下实施例和对比例中,宏观角分辨光谱仪购自上海复享科学仪器有限公司,用于检测光子晶体的反射光谱,反射光谱的反射率可以表征光子晶体的质量高低,其中,反射率越高则光子晶体的质量越高。
104.实施例1
‑
4用于说明本发明。
105.实施例1
106.(1)裁取6cm
×
6cm的铝片,依次用丙酮、乙醇和超纯水进行清洗。
107.将经清洗的铝片浸入蚀刻液中,蚀刻液的温度为25℃,浸渍时间为10 秒,浸渍液为盐酸、氢氟酸和超纯水的混合液,其中,盐酸(浓度为37重量%):超纯水:氢氟酸(浓度为40重量%)的体积比为16:5:1。
108.将经蚀刻的铝片用氮气吹干后置于真空干燥器中,然后向真空干燥器的中部位置滴加2滴(约0.1ml)1h,1h,2h,2h
‑
全氟癸基三甲氧基硅烷,密封真空干燥器并抽真空10分钟。然后,将干燥器在80℃的烘箱中放置2小时,得到具有超疏水层的铝片。如图1所示,经超疏水化处理的铝片的表面为超疏水表面,其静态水接触角为165
°
。
109.在具有超疏水层的铝片的超疏水层表面覆盖上带有7
×
7点状阵列的掩膜版,并将铝片整体置于hw
‑
uvx400型紫外灯下,其中,具有掩膜版的超疏水层表面朝向紫外灯,照射6小时。在没有被掩膜版覆盖的区域产生亲水点,从而制备出7
×
7阵列的点状亲水
‑
超疏水图案。经检测,亲水点区域的静态水接触角为≤5
°
。
110.(2)在具有亲水
‑
超疏水图案铝片的亲水点处用点胶机滴加0.3μl的乙烯基封端的聚二甲基硅氧烷(pdms)和交联剂(pdms:交联剂的质量比=10:1,所述交联剂为聚二甲基氢硅氧烷,pdms和交联剂为购自道康宁,牌号为dc 184),待pdms在亲水点处均匀分布后,将铝片置于60℃烘箱中加热25min。经检测,经处理的pdms区域的静态水接触角为110
°
。
111.取7种分散有不同粒径的单分散聚(苯乙烯
‑
甲基丙烯酸甲酯
‑
丙烯酸)胶体纳米粒子的乳液(浓度为2重量%,溶剂为水,乳化剂为十二烷基硫酸钠) 各8μl(胶体纳米粒子的平均粒径以及相应的光子晶体结构色如表1所示),用移液枪分别将其点在亲水点处。将滴有不同种胶体纳米粒子乳液的铝片放置于80℃的烘箱中加热5min,在亲水点处形成形貌均匀的胶体光子晶体,从而得到光子晶体编码的检测芯片,亲水检测点阵列中不同列的光子晶体具有不同的颜色(如图2所示)。经检测光子晶体表面的静态水接触角为50
°
,光子晶体的直径为3mm。将制备的检测芯片利用宏观角分辨光谱仪进行测试,由其反射光谱可知,亲水检测点阵列中每一列内的光子晶体均具有高反射率的结构色(如图3所示)。
112.表1
113.114.(3)取7个相同的烧杯,各称量100ml超纯水,向其中各加入0.02g 明胶(购自阿拉丁试剂有限公司),然后加热至明胶完全溶解,冷却至室温 (为25℃)后,在各个烧杯中分别加入5mg、2.5mg、1mg、0.75mg、0.5mg、 0.25mg和0.1mg的盐酸阿霉素(购自阿拉丁试剂有限公司),混合均匀,得到一系列具有不同盐酸阿霉素浓度的药物溶液。
115.(4)将药物溶液按照表2所示的对应关系与光子晶体匹配,将药物溶液滴加到与之匹配的光子晶体对应的亲水检测点区域,其中,每一列的第一个点不滴加任何溶液,作为空白对照组,每一列的第二个点滴加仅含明胶的溶液,作为明胶对照组,每一列的第三个点至第七个点滴加相同浓度的药物溶液。滴加完成后,将铝片置于50℃环境中干燥,直至药物混合物液滴中的水挥发凝固,得到光子晶体编码的药物筛选系统。
116.表2
[0117][0118]
(5)用滴管固定一大滴hela细胞培养液,筛选系统的检测芯片表面滑动,借助于芯片表面的亲水检测点区域和超疏水区域对于细胞培养液的不同浸润性,将细胞培养液切割成相应于亲水检测点区域的小液滴,并附着在亲水检测点区域,每一个亲水检测点形成一个独立的细胞培养室。
[0119]
将具有hela癌细胞培养液的光子晶体编码的药物筛选系统放置于温度为37℃、5体积%co2浓度、压力为常压(即,1标准大气压)的恒温箱中,放置24小时后,再向药物筛选系统中加入10微升质量浓度为5%的mtt/ pbs溶液,继续将细胞置于37℃,5体积%co2浓度下培养4小时后,吸出药物筛选系统中的液体,并加入100微升二甲基亚砜,使细胞中生成的甲臜充分溶解,再用酶标仪测试其吸光值。按照如下公式计算细胞归一化存活率:细胞存活率(%)=(样品吸光值
‑
背景吸光值)/(参比吸光值
‑
背景吸光值)
×ꢀ
100%。
[0120]
结果如图4所示。从图4可以看出,随着盐酸阿霉素浓度的增加,hela 癌细胞的存活数目也在降低,表明采用本发明的药物筛选系统能有效地确定药物的最佳用量。
[0121]
对比例1
[0122]
采用与实施例1相同的方法制备检测芯片,不同的是,步骤(2)中,不在亲水点处用点胶机滴加0.3μl的聚二甲基硅氧烷,而是直接在亲水点处滴加乳液,以形成光子晶体。
[0123]
将实施例1步骤(2)和对比例1步骤(2)制备的检测芯片分别浸泡于 hela细胞培养液中,细胞培养液的温度为25℃。结果,对比例1制备的检测芯片在加入细胞培养液后几分钟内发生光子晶体脱落现象,而实施例1制备的检测芯片在浸泡一周后并未发生光子晶体脱落现象,表明在施加乳液制备光子晶体之前,在亲水点先滴加聚二甲基硅氧烷,能大大提高光子晶体在亲水区域的附着稳定性。
[0124]
实施例2
[0125]
采用与实施例1相同的方法制备检测芯片和药物筛选系统,不同的是:
[0126]
步骤(2)中,胶体纳米粒子用氧化硅纳米粒子代替;
[0127]
步骤(4)中,用5
‑
氟尿嘧啶代替盐酸阿霉素,从而得到一系列具有不同5
‑
氟尿嘧啶浓度的药物溶液。
[0128]
将步骤(2)制备的检测芯片利用宏观角分辨光谱仪进行测试,由其反射光谱可知,亲水检测点阵列中每一列内的光子晶体均具有高反射率的结构色。
[0129]
采用与实施例1相同的方法测定具有hela癌细胞培养液的光子晶体编码的药物筛选系统中的细胞存活率,结果如图5所示。从图5可以看出,随着5
‑
氟尿嘧啶浓度的增加,hela癌细胞的存活数目也在降低,表明采用本发明的药物筛选系统能有效地确定药物的最佳用量。
[0130]
实施例3
[0131]
(1)裁取6cm
×
6cm的铝片,依次用丙酮、乙醇和超纯水进行清洗,将经清洗的铝片浸入蚀刻液中,蚀刻液的温度为20℃,浸渍时间为12秒,浸渍液为盐酸、氢氟酸和超纯水的混合液,其中,盐酸(浓度为37重量%):超纯水:氢氟酸(浓度为40重量%)的体积比为16:5:1。
[0132]
将经蚀刻的铝片用氮气吹干后置于真空干燥器中,然后向真空干燥器中部位置滴加2滴(约0.1ml)1h,1h,2h,2h
‑
全氟癸基三甲氧基硅烷,密封真空干燥器并抽真空15分钟。然后,将干燥器在100℃的烘箱中放置3小时,得到具有超疏水层的铝片。经检测,经超疏水化处理的铝片的表面为超疏水表面,其静态水接触角为160
°
。
[0133]
在具有超疏水层的铝片的超疏水层表面覆盖上带有7
×
7点状阵列的掩膜版,并将铝片整体置于hw
‑
uvx400型紫外灯下,其中,具有掩膜版的超疏水层表面朝向紫外灯,照射10小时。在没有被掩膜版覆盖的区域产生亲水点,从而制备出7
×
7阵列的点状亲水
‑
超疏水图案。经检测,亲水点区域的静态水接触角为≤5
°
。
[0134]
(2)在具有亲水
‑
超疏水图案的铝片的亲水点处用点胶机滴加0.5ul的乙烯基封端的聚二甲基硅氧烷(pdms)和交联剂(pdms:交联剂的质量比=10:1,所述交联剂为聚二甲基氢硅氧烷,pdms和交联剂均购自道康宁,牌号为dc 184),待pdms在亲水点处均匀分布后,将铝片置于80℃烘箱中加热15min。经检测,经处理的含有pdms的区域的静态水接触角为114
°
。
[0135]
取7种分散有不同粒径的单分散二氧化硅胶体纳米粒子的乳液(浓度为 1.8重量%,溶剂为水,乳化剂为十二烷基硫酸钠)各8μl(胶体纳米粒子的平均粒径以及相应的光子晶体结构色如表3所示),用移液枪分别将其点在亲水点处。将滴有不同种胶体纳米粒子乳液的铝片再放置于80℃的烘箱中加热10min,在亲水点处形成形貌均匀的胶体光子晶体,从而得到光子晶体编码的检测芯片,亲水检测点阵列中不同列的光子晶体具有不同的颜色。经检测光子晶体表面的静态水接触角为30
°
,光子晶体的直径为2mm。将制备的检测芯片利用宏观角分辨光谱仪进行测试,由其反射光谱可知,亲水检测点阵列中每一列内的光子晶体均具有高反射率的结构色。
[0136]
表3
[0137][0138]
(3)取7个相同的烧杯,各称量100ml超纯水,向其中各加入0.02g 明胶(购自阿拉丁试剂有限公司),然后加热至明胶完全溶解,冷却至室温(为25℃)后,在各个烧杯中分别加入1mg的盐酸阿霉素、阿霉素、6
‑
嘌呤巯醇、5
‑
氟尿嘧啶、柔红霉素、博来霉素和盐酸阿糖
胞苷得到一系列具有相同药物浓度的不同种类药物溶液。
[0139]
(4)将药物溶液按照表4所示的对应关系与光子晶体匹配,将不同种类药物溶液滴加到与之匹配的光子晶体对应的亲水检测点区域,其中,每一列的第一个点不滴加任何溶液,作为空白对照组,每一列的第二个点滴加仅含明胶的溶液,作为明胶对照组,每一列的第三个点至第七个点滴加相同浓度的药物溶液。滴加完成后,将铝片置于50℃环境中进行干燥,直至药物溶液中的水挥发凝固,得到光子晶体编码的药物筛选系统。
[0140]
表4
[0141][0142]
(5)用滴管固定一大滴hela癌细胞培养液,筛选系统的检测芯片表面滑动,借助于芯片表面的亲水检测点区域和超疏水区域对于细胞培养液的不同浸润性,将细胞培养液切割成相应于亲水检测点区域的小液滴,并附着在亲水检测点区域,每一个亲水检测点形成一个独立的细胞培养室。
[0143]
采用与实施例1相同的方法测定具有hela癌细胞培养液的光子晶体编码的药物筛选系统中的细胞存活率,结果如图6所示。从图6可以看出,不同的药物对hela癌细胞显示不同的抑制效率,表明采用本发明的药物筛选系统能同时对多种药物进行筛选。
[0144]
实施例4
[0145]
(1)裁取6cm
×
6cm的铝片,依次用丙酮、乙醇和超纯水进行清洗。
[0146]
将经清洗的铝片浸入蚀刻液中,蚀刻液的温度为20℃,浸渍时间为8 秒,浸渍液为盐酸、氢氟酸和超纯水的混合液,其中,盐酸(浓度为37重量%):超纯水:氢氟酸(浓度为40重量%)的体积比为16:5:1。
[0147]
将经蚀刻的铝片用氮气吹干后置于真空干燥器中,然后向真空干燥器中部位置滴加2滴(约0.1ml)1h,1h,2h,2h
‑
全氟癸基三甲氧基硅烷,密封真空干燥器并抽真空20分钟。然后,将干燥器在90℃的烘箱中放置4小时,得到具有超疏水层的铝片。经检测,经超疏水化处理的铝片的表面为超疏水表面,其静态水接触角为170
°
。
[0148]
在具有超疏水层的铝片的超疏水层表面覆盖上带有7
×
7点状阵列的掩膜版,并将铝片整体置于hw
‑
uvx400型紫外灯下,其中,具有掩膜版的超疏水层表面朝向紫外灯,照射10小时。在没有被掩膜版覆盖的区域产生亲水点,从而制备出7
×
7阵列的点状亲水
‑
超疏水图案。经检测,亲水点区域的静态水接触角为≤5
°
。
[0149]
(2)在具有亲水
‑
超疏水图案铝片的亲水点处用点胶机滴加0.5μl的乙烯基封端的聚二甲基硅氧烷(pdms)和交联剂(pdms:交联剂的质量比=10:1,所述交联剂为聚二甲基氢硅氧烷,pdms和交联剂均购自道康宁,牌号为dc 184),待pdms在亲水点处均匀分布后,将铝片置于75℃烘箱中加热15min。经检测,经处理的含有pdms的区域的静态水接触角为120
°
。
[0150]
取7种分散有不同粒径的单分散聚苯乙烯胶体纳米粒子的乳液(浓度为 2重量%,溶剂为水,乳化剂为十二烷基苯磺酸钠)各8μl(胶体纳米粒子的平均粒径以及相应的光子晶体结构色如表5所示),用移液枪分别将其点在亲水点处。将滴有不同种胶体纳米粒子乳液的铝片再放置于80℃的烘箱中加热5min,在亲水点处形成形貌均匀的胶体光子晶体,从
而得到光子晶体编码的检测芯片,亲水检测点阵列中不同列的光子晶体具有不同的颜色。经检测光子晶体表面的静态水接触角为40
°
,光子晶体的直径为5mm。将制备的检测芯片利用宏观角分辨光谱仪进行测试,由其反射光谱可知,亲水检测点阵列中每一列内的光子晶体均具有高反射率的结构色。
[0151]
表5
[0152][0153]
(3)取7个相同的烧杯,各称量100ml超纯水,向其中各加入0.02g 明胶(购自阿拉丁试剂有限公司),然后加热至明胶完全溶解,冷却至室温 (为25℃)后,在各个烧杯中分别加入5mg、2.5mg、1mg、0.75mg、0.5mg、 0.25mg和0.1mg的盐酸阿霉素(购自阿拉丁试剂有限公司),混合均匀,得到一系列具有不同药物浓度的药物溶液。
[0154]
(4)将药物溶液按照表6所示的对应关系与光子晶体匹配,将药物溶液滴加到与之匹配的光子晶体对应的亲水检测点区域,其中,每一列的第一个点不滴加任何溶液,作为空白对照组,每一列的第二个点滴加仅含明胶的溶液,作为明胶对照组,每一列的第三个点至第七个点滴加相同浓度的药物溶液。滴加完成后,将铝片置于50℃环境中进行干燥,直至药物混合物液滴中的水挥发凝固,得到光子晶体编码的药物筛选系统。
[0155]
表6
[0156][0157]
(5)用滴管固定一大滴a549癌细胞培养液,筛选系统的检测芯片表面滑动,借助于芯片表面的亲水检测点区域和超疏水区域对于细胞培养液的不同浸润性,将细胞培养液切割成相应于亲水检测点区域的小液滴,并附着在亲水检测点区域,每一个亲水检测点形成一个独立的细胞培养室。
[0158]
采用与实施例1相同的方法测定具有a549癌细胞培养液的光子晶体编码的药物筛选系统中的细胞存活率,结果如图7所示。从图7可以看出,随着盐酸阿霉素浓度的增加,a549癌细胞的存活数目也在降低,表明采用本发明的药物筛选系统能有效地确定药物的最佳用量。
[0159]
实施例1
‑
4的结果表明,采用本发明的检测芯片易于实现编码,减少复杂的移液操作,提高药物筛选的效率。
[0160]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0161]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0162]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本
发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1