一种含氧缺陷Ru/W
一种含氧缺陷ru/w
18o49
光催化剂的制备方法及其在储氢领域的应用
技术领域
1.本发明涉及一种含氧缺陷ru/w
18o49
光催化剂及其制备方法和应用,属于环境化工光催化新能源技术领域。
背景技术:
2.在众多的新能源中,氢能是宇宙中分布最广泛的物质,它构成了宇宙质量的75%,其具有能量密度高、环境友好、零碳排放的优点,成为最具发展潜力的清洁能源之一,被称为人类的终极能源,是20世纪70年代提出的一个最“完美”的可持续能源方案。然而传统的制氢方式,需要消耗巨大的常规能源,使氢能身价太高,大大限制了氢能的推广应用。于是科学家们很快想到利用取之不尽、廉价的太阳能作为氢能形成过程中的一次能源,使氢能开发展现出更加广阔的前景。1972年日本科学家fujishima和honda(nature, 1972, 238(5358): 37-38.)在以tio2作为光阳极进行光电催化分解水研究时发现以光催化材料为“媒介”,能利用太阳能把水裂解为氢和氧,自此,科学家称这种仅用阳光和水生产出氢和氧的技术为“人类的理想技术之一”,受到了人们的广泛关注。
[0003][0004]
然而,长久以来光解水制氢的发展停滞不前,其原因是氢气的收集和存储上的技术瓶颈抑制了光解水制氢的实际应用。氢气的产生依赖于光生电子和空穴分别迁移到氧化和还原位点,使得二者间距必须小于电子的平均自由程(约为10~50 nm)。如此短的间距不仅导致逆反应的发生无法避免,也增加了分离和收集氢气的困难。另一方面,氢气的安全存储是一项长期的挑战。氢气(h2)与氧气(o2)混合极易发生反应,产生爆炸,十分危险。而常用的高压液化后金属储氢成本高,使用不便。因此,在开发出低成本收集氢气和安全储氢的解决方案之前,太阳能光解水制氢无法得以有效地大规模应用。
[0005]
2014年,江苏科技大学袁爱华教授通过原位合成pt-go/hkust-1在常温常压下实现了基于氢溢流效应的储氢技术的应用,在室温常压下储氢量达到1.6wt% (international journal of hydrogen energy, 2014, 39(5): 2160-2167.)。2021年,陕西科技大学王传义教授更是首次将金属氢化物储氢技术应用于电催化二氧化碳还原中,提出在光照射下bi-h
x
可以作为电子-质子传输介质实现对co2的还原,同时bi-h
x
恢复为bi (nature communications, 2021, 12:123.)。2021年香港城市大学张华教授氢化处理pd@pt合金纳米颗粒后,发现氢原子会通过pdh
0.4
的形式插嵌在pd的晶格间隙中(journal of the american chemical society, 2021, 143(29):11262-11270.)。上述一系列的创新为光催化分解水-原位储氢耦合成“串联反应系统”带来了曙光:将储氢金属构筑在光催化剂内,通过储氢技术与光解水技术的结合,在光解水的同时利用氢溢流现象实现储氢金属对氢的原位捕获,从而不仅解决了太阳能光解水制氢过程中的氢氧产物分离,同时所储存的氢可以直接转化利用,避免了h2的运输和生成,减少了安全隐患。但是该研究尚未在光催化领域引起关注。
技术实现要素:
[0006]
本发明旨在提供一种含氧缺陷ru/w
18o49
光催化剂的合成及其在光催化分解水-原位储氢中的应用,其目的是提供一种简单经济环保的合成方法,以制备出一种性能较强、组成单一的新型光催化剂,将储氢技术与光解水技术的结合,在光解水的同时利用氢溢流现象实现对氢的原位捕获,从而不仅解决太阳能光解水制氢过程中的氢氧产物分离,同时所储存的氢可以直接转化利用,避免h2的运输和生成,减少安全隐患。
[0007]
本发明提供了一种含氧缺陷ru/w
18o49
光催化剂的制备方法,包括以下步骤:以氯化钨和无水乙醇为原料,调节反应时间,利用经济环保的一步水热法制得含氧缺陷的w
18o49
材料,接着以三氯化钌为原料,硼氢化钠为还原剂,将ru负载于w
18o49
上,制备出含氧缺陷的ru/w
18o49
光催化剂。
[0008]
进一步地,上述制备方法包括以下步骤:1)称取1.60~3.20 g氯化钨,将其放置于80~200 ml的无水乙醇中,在室温下搅拌0.2~2 h,直至完全溶解,之后置于反应釜中在140~160 o
c下反应5~12 h,得到沉淀;2)用抽滤机将步骤1)中所得沉淀分别进行分离,并用蒸馏水和无水乙醇分别洗涤2~3次后,在50~70 o
c下烘干,即得到含氧缺陷的w
18o49
纳米材料;3)称取0.3~0.8 gw
18o49
,将其放置于10~40 ml蒸馏水中,在室温下搅拌10~20 min,之后将100~500
ꢀµ
l三氯化钌溶液(溶液浓度为0.0001g
·
l-1
~0.01 g
·
l-1
)加入其中,控制反应温度为20~30 oc
,持续搅拌反应2~5 h,记为溶液a;4)称取0.03~0.10 g硼氢化钠溶于10~40 ml蒸馏水中,记为溶液b,将溶液b缓慢滴入溶液a中,继续搅拌反应2~5 h,之后抽滤、并用蒸馏水和无水乙醇分别洗涤2~3次后,在50~70 o
c下真空烘干,得到含氧缺陷ru/w
18o49
纳米材料光催化剂。
[0009]
本发明提供了上述含氧缺陷ru/w
18o49
光催化剂在光催化分解水-原位储氢反应中的应用。
[0010]
上述应用中,所述的光催化分解水-原位储氢,反应条件为:常温常压,催化剂用量为0.01~0.1 g,蒸馏水用量为20~100 ml,所用光源为氙灯,功率为300 w,照度为120 klx,距离反应界面10~30 cm,所用光源为波长为200~800 nm的模拟太阳光。
[0011]
进一步地,光催化分解水-原位储氢反应的储氢性能评价方式为:称取上述反应后回收的ru/w
18o49
光催化剂5 mg置于20 ml石英反应器中,首先通入氩气以除去催化剂表面吸附的杂质,之后将石英反应器加热至400 o
c,同时利用气相色谱收集催化产物进行定量分析。
[0012]
本发明的有益效果:(1)本发明所采用的催化剂制备方法简单易行、经济环保,不产生有毒有害副产物,通用性强,成本低,所用条件简单安全,且原材料廉价易得,易于实现工业化生产;(2)本发明所设计的体系以较低的成本,巧妙地抑制了光解水制氢的逆反应发生,实现了氢气的有效提纯和储存,从而有效解决了太阳能光解水制氢过程中的氢氧产物分离问题;(3)本发明所储存的氢是以原子氢的形式储存,所储存的氢可以直接转化利用,避免了h2的运输和生成,减少了安全隐患;解决了太阳能光解水制氢过程中的安全存储运输的问题。
附图说明
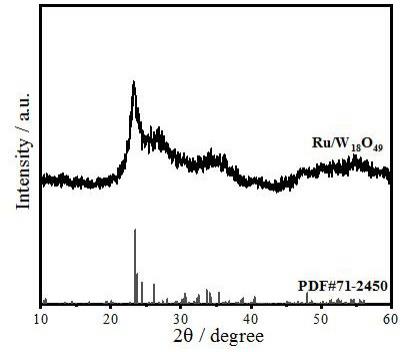
[0013]
图1为本发明实施例1所制含氧缺陷ru/w
18o49
纳米材料的xrd图谱;图2为本发明实施例1所制含氧缺陷ru/w
18o49
纳米材料的drs图谱;图3为本发明实施例1所制含氧缺陷ru/w
18o49
材料的光解水性能图;图4为本发明实施例1所制含氧缺陷ru/w
18o49
材料的储氢性能测试图;图5为本发明实施例1所制含氧缺陷ru/w
18o49
反应前的放氢性能图;图6为本发明实施例1所制含氧缺陷ru/w
18o49
避光条件下的放氢性能图。
具体实施方式
[0014]
为了使本发明的技术方案更加清楚明白,下面将用实施例具体给予详细说明,但本发明的内容不只局限于所列举的实施方式的范围。
[0015]
实施例1将1.60 g wcl6加入到80 ml无水乙醇中在室温下搅拌0.5 h,之后将完全溶解的溶液转移至100 ml反应釜中在140 o
c下反应6 h,将所得沉淀抽滤用蒸馏水及无水乙醇分别洗涤三次并进行真空干燥,即可得到含氧缺陷的w
18o49
。
[0016]
取0.5 g上述制备的w
18o49
置于20 ml蒸馏水中搅拌15 min后,将 200
ꢀµ
l三氯化钌水溶液(0.001 g
·
l-1
)滴入,继续搅拌3h后,再加入0.1 g硼氢化钠水溶液(5 g
·
l-1
),持续搅拌3 h,最后将所得产物经抽滤用蒸馏水及无水乙醇分别洗涤三次并进行真空干燥,即可得到含氧缺陷的ru/w
18o49
纳米材料,记为ru/w
18o49-a。
[0017]
所得含氧缺陷的ru/w
18o49-a纳米材料用于光催化分解水-原位储氢反应。其反应条件为:常温常压,催化剂用量为0.02 g,水的用量为100 ml,所用光源为氙灯,功率为300 w,照度为120 klx,距离反应界面20 cm, 所发光为波长为200-800 nm的模拟太阳光。具体操作步骤:首先将光催化剂溶解于水中,超声使其充分溶解,之后在避光条件下通入氩气0.5 h,以期完全排除空气;然后打开光源,进行光催化分解水-原位储氢实验,光照1 h后测得其光解水性能如图3所示:随时间的增加,o2的量逐渐增加而h2的产量为0,表明成功将h2储存在含氧缺陷的ru/w
18o49-a中。
[0018]
之后回收样品,通过氢气释放实验测试其储氢性能,所述的氢气释放实验测试过程如下:称取回收的ru/w
18o49
光催化剂置于20 ml的石英反应器中,首先通入氩气以除去催化剂表面吸附的杂质,之后将石英反应器加热至400 o
c,同时利用气相色谱收集催化产物进行定量分析。结果如图4和表1所示:随着时间的进行,氢气的释放量线性增加,证明h2成功储存在样品中。
[0019]
所述的氢气释放实验测试过程如下:称取回收的ru/w
18o49
光催化剂置于20 ml的石英反应器中,首先通入氩气以除去催化剂表面吸附的杂质,之后将石英反应器加热至400 o
c,同时利用气相色谱收集催化产物进行定量分析。
[0020]
对比例1-1按照实施例1制备光催化剂,将所得光催化剂直接进行氢气释放实验测试,反应条件及操作同上述实施例1,不同的是不做任何处理测试所制备ru/w
18o49-a的放氢性能,结果如图5所示:h2释放量为0,说明实施例1所储的氢为分解水产生的,排除了材料本身含氢放氢的可能。oc,同时利用气相色谱收集催化产物进行定量分析。结果如表1所示:随着时间的进行,氢气的释放量线性增加,证明h2成功储存在样品中。
[0030]
表1 不同ru/w
18o49
催化剂在模拟太阳光下放氢量/
ꢀµ
mol
·
g-1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1