粒子的分离方法、分离装置以及分离系统与流程
本公开涉及一种粒子的分离方法、分离装置以及分离系统。本公开尤其涉及分离悬浮液中含有的标记粒子和未标记粒子的方法、其中使用的分离装置以及分离系统。
背景技术:
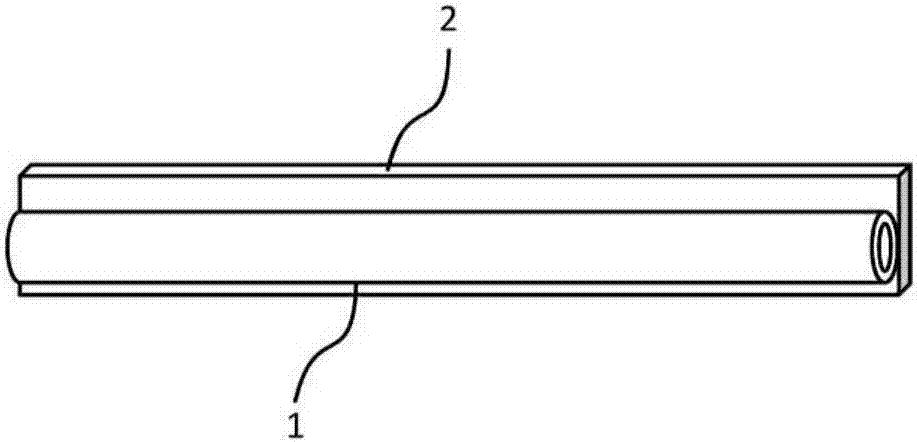
:作为从含有多种粒子的悬浮液中分离目标粒子的方法,例如有如下方法:预先通过磁等来标记目标粒子,在通过磁铁等吸引标记的目标粒子的状态下去除悬浮液,由此分离目标粒子和其他粒子(例如,日本专利特表第2013-517763号公报)。日本专利特表第2013-517763号公报中公开了如下方法:将含有磁标记的细胞的试样导入到产生了磁通量的管内,通过所述磁通量来将磁标记的细胞吸引到管壁的同时,抑制磁标记的细胞以外的细胞(未磁标记的细胞)对管壁的粘附,将管内的试样排出到外部,以及结束磁通量并从管壁分离磁标记的细胞,并且以液体洗去并进行回收,由此分离和回收目标细胞。技术实现要素:如上述的日本专利特表第2013-517763号公报所述,一般通过标记目标粒子来进行分离(正选择)。在该方法中,通过磁等来捕获标记的目标粒子,在该状态下,通过去除除此之外的未标记粒子而进行分离,此后通过解除磁等的捕获来回收目标粒子。但是,在试样中所含的目标粒子的数量少于除此之外的粒子的情况下,上述方法存在分离精度的问题、以及不能以充分的精度回收分离后的目标粒子的情况。在一个或多个实施方式中,本公开提供高效地分离标记粒子和未标记粒子、并且能够以高精度回收未标记粒子的方法、分离装置以及分离系统。一个方式中,本公开涉及一种分离方法,其分离标记粒子和未标记粒子,所述分离方法包括:从流路的一端供应含有标记粒子和未标记粒子的悬浮液;在所述流路内,使所述标记粒子向与重力方向不同的方向偏转;将所述标记粒子固定在流路内壁面;以及在所述标记粒子被固定在流路内壁面的状态下,从所述流路的一端向流路内导入气相并从所述流路的另一端排出所述流路内的悬浮液,并且回收所述未标记粒子。一个方式中,本公开涉及一种分离装置,其用于分离标记粒子和未标记粒子,所述分离装置包括:流路,所述流路能够供应含有标记粒子和未标记粒子的悬浮液;使所述标记粒子向与重力方向不同的方向偏转、并固定在流路内壁面的单元;以及导入单元,所述导入单元用于导入用于排出所述流路内的悬浮液的气相。一个方式中,本公开涉及一种分离系统,其用于分离标记粒子和未标记粒子,所述分离系统包括:分离部,所述分离部具有能够供应含有标记粒子和未标记粒子的悬浮液的流路,以及使所述标记粒子向与重力方向不同的方向偏转、并固定在流路内壁面的单元;以及导入单元,所述导入单元用于导入用于排出所述流路内的悬浮液的气相。根据本公开,在一个方式中,能够高效地分离标记粒子和未标记粒子,并且能够以高精度回收未标记粒子。附图说明图1是示出本公开的分离方法中能够利用的分离装置的一个例子的简略图;图2是示出图1的分离装置中的流路和磁场照射体的配置的一个例子的示意图。具体实施方式如日本专利特表第2013-517763号公报所示,通过管内磁分离而分离和回收目标细胞。关于管内磁分离的方法,由于具有流路结构因此具有容易系统化和装置化的优点、以及具有通过缩小管内径来拉近标记粒子悬浮液和磁之间的距离的优点。尤其在使用磁的情况下,磁力与距离的平方成反比,因此通过拉近距离来提高磁分离的性能是极其重要的。但是,在该方法中还存在几个问题。第一个是难以有效地从管内回收想要回收的细胞。不管是正选择也好,还是负选择也好,想要回收的粒子通过磁力以及重力等而被收集到管的壁。为了回收被收集到壁的粒子,一般向管内输送液体,但在管的壁面难以产生液体流动,因此在管的中央液体以快的速度流动,然而壁面的速度则极其迟缓。因此,难以通过输送来有效地移动壁面的细胞,其结果为,降低了目标粒子的回收率。第二个是相对于管内处理(分离)之前的液量,难以维持或减少管内处理(分离)之后的回收液量,即由于分离处理后的回收液的液量与处理前的液量相比有增加的倾向,因此不适合用于稀有粒子的处理。作为用于补偿作为第一个问题的、想要回收的粒子的回收效率不好的手段,例如,存在通过进行追加输送来回收未被回收的粒子的手段。但是,在该情况下,处理后的回收液量增加。在回收对象的粒子为稀有粒子的情况下,当回收液量增加时,粒子的浓度极其低,难以处理。在处理稀有粒子的情况下,反而希望减少回收液量而以少量进行处理,因此不适合用于稀有粒子的处理。一个方式中,本公开基于如下本发明人发现的新发现:在进行分离的悬浮液中含有的目标粒子(检测对象粒子)的数量少的情况下,通过标记并分离检测对象外的粒子,能够提高检测对象粒子的分离和回收精度。另外,一个方式中,本公开基于如下本发明人发现的新发现:在将检测对象粒子移动到流路的底面侧、且将检测对象外的粒子捕获(固定)到流路的底面以外的部分的状态下,通过向流路内导入气相并回收流路内的悬浮液,能够提高检测对象粒子的分离和回收精度。通过本公开,虽然不明确能够以高精度分离检测对象粒子并回收的原理,但推测为如下。当向存在含有检测对象粒子的悬浮液的流路导入气相时,在流路内形成气液界面。通过进一步导入气相,对气液界面施加挤压力,气液界面在流路内从流入口侧向流出口侧移动。通过该气液界面的移动,流路内的检测对象粒子与悬浮液一同被挤出,但检测对象外的粒子被捕获(固定)到流路内从而被保持而不是被挤出。另外,如果检测对象外的粒子被捕获到与检测对象粒子不同的流路的壁面,则能够顺利地挤出检测对象粒子而不会成为在检测对象粒子被挤出时的障碍。其结果为,能够以高精度分离检测对象粒子并对此进行回收。但是,对本公开的解释不局限于这些原理。血中循环肿瘤细胞/circulatingtumorcell(ctc)等稀有细胞通常在10ml的血液中通常只含有0~10个左右。根据本公开的方法,在一个或多个实施方式中,从含有比稀有细胞多量的白细胞的试样中分离稀有细胞和白细胞,并能够以高回收率回收稀有细胞。对于血液中的ctc数,作为转移性癌症的治疗效果的判定以及预后预测的因素的用处受到认可,从而要求进行更准确的分析。因此,在一个或多个实施方式中,本公开的方法可以说是这些领域中的治疗效果的判定以及预后预测中极其重要的技术。[分离方法]一个方式中,本公开涉及分离标记粒子和未标记粒子的方法(本公开的分离方法)。本公开的分离方法包括:从流路的一端供应含有标记粒子和未标记粒子的悬浮液;在所述流路内,使所述标记粒子向与重力方向不同的方向偏转;将所述标记粒子固定在流路内壁面;以及在所述标记粒子被固定在流路内壁面的状态下,从所述流路的一端向流路内导入气相并从所述流路的另一端排出所述流路内的悬浮液,并且回收所述未标记粒子。根据本公开的分离方法,在一个或多个实施方式中,能够以高精度分离标记粒子和未标记粒子,并且能够以高精度回收未标记粒子。本公开的分离方法包括从流路的一端供应含有标记粒子和未标记粒子的悬浮液。由此,将悬浮液填充到流路内。在一个或多个实施方式中,流路具有流入口和流出口。在一个或多个实施方式中,从减少流路中的未标记粒子(目标粒子)的损失的观点出发,流路的长边方向的长度为80cm以下、60cm以下或40cm以下,或者2cm以上、5cm以上或10cm以上。在一个或多个实施方式中,从能够形成稳定的气液界面、且能够进一步提高未标记粒子的观点出发,流路的内径为50mm以下、20mm以下或10mm以下,或者0.5mm以上、1mm以上或2mm以上。在一个或多个实施方式中,从能够进一步提高未标记粒子的回收精度的观点出发,流路的体积为10000μl以下、5000μl以下或2000μl以下,或者10μl以上、50μl以上或100μl以上。在一个或多个实施方式中,作为流路的与流入口和流出口的直线方向(流路的长边方向)正交的截面形状,可以举出圆形、椭圆形矩形、以及三角形、四边形、五边形、六边形、七边形和八边形等多边形等。从防止流路中的未标记粒子(目标粒子)的损失的观点出发,优选圆形或者椭圆形。作为流路的形状,在一个或多个实施方式中,可以举出中空形状的圆柱形状、大致长方体形状或者多边柱形状等。在一个或多个实施方式中,流路优选配置于与垂直方向(重力方向)正交的方向(大致水平方向)。在本公开的分离方法的一个或多个实施方式中,未标记粒子是检测对象粒子(目标粒子),标记粒子是检测对象外的粒子。在一个或多个实施方式中,悬浮液含有比未标记粒子多的标记粒子。在一个或多个实施方式中,未标记粒子相对于悬浮液中的标记粒子的比例([未标记粒子]/[标记粒子])为1%以下、0.5%以下、0.4%以下、0.3%以下、0.2%以下、0.1%以下或者0.09%以下。在一个或多个实施方式中,本公开的分离方法是从含有比未标记粒子多的标记粒子的悬浮液中分离和回收未标记粒子时有用的技术。作为粒子的标记,在一个或多个实施方式中,可以举出磁标记或者金属标记等。在磁标记的情况下,在一个或多个实施方式中,粒子的结合分子、以及被固定在磁性珠(磁珠)的表面的物质(与结合分子特异性反应的物质)结合,并且磁珠被固定到粒子,由此能够进行粒子的标记。关于被固定到磁性珠的物质,在一个或多个实施方式中,能够根据标记粒子的结合分子来适当决定。作为磁性珠,在一个或多个实施方式中,可以举出在表面固定了亲和素的磁性珠、在表面固定了链霉亲和素的磁性珠、在表面固定了中性亲和素的磁性珠、在表面固定了生物素的磁性珠、在表面固定了生物素衍生物的磁性珠、在表面固定了抗体的磁性珠、在表面固定了抗原的磁性珠等。关于磁性珠的大小,没有特别的限制,能够根据成为标记对象的粒子的大小来适当决定。在成为标记对象的粒子的大小如白细胞以及ctc、直径为5~20μm的情况下,在一个或多个实施方式中,从提高标记效率的观点出发,为1μm以下、800μm以下、又は500μm以下。另外,从磁响应性的观点出发,为50μm以上、或者100μm以上。关于悬浮液的供应,在一个或多个实施方式中,优选在流路的另一端(悬浮液的供应侧的相反侧的流路的一端)闭合的状态下进行。在一个或多个实施方式中,被供应到流路内的悬浮液优选大致全量填充到流路内。从顺利进行向流路填充悬浮液的观点出发,悬浮液的供应优选在没有在流路内产生磁场或者电场的状态下进行。在一个或多个实施方式中,从能够进一步提高未标记粒子的回收精度的观点出发,供应到流路的悬浮液的量为10000μl以下、5000μl以下或2000μl以下,或者10μl以上、50μl以上或100μl以上。在一个或多个实施方式中,本公开的分离方法可以包括静置被填充的悬浮液。由此,关于未标记粒子,通过利用作用到该粒子的重量等,能够向流路的底面侧移动未标记粒子。从细胞的沉降速度和有效的磁分离的观点出发,在一个或多个实施方式中,静置时间为1分钟以上、5分钟以上或10分钟以上,或者60分钟以下或30分钟以下。本公开的分离方法包括在流路内使标记粒子向与重力方向不同的方向偏转。在一个或多个实施方式中,偏转能够通过在流路内产生磁场或者电场来进行。关于磁场或者电场,在一个或多个实施方式中,可以在流路的长边方向整体内产生,也可以在流路的一部分产生。作为将标记粒子向与未标记粒子不同的方向、即向与重力方向不同的方向偏转,在一个或多个实施方式中,能够通过使未标记粒子移动到流路的底面侧、且将标记粒子移动到流路的底面以外的部分来进行。在一个或多个实施方式中,磁场能够通过配置流路的磁场照射体等来进行。关于配置位置,能够根据使标记粒子偏转的方向而适当决定,在朝向除了流路的底面以外的部分移动的情况下,在一个或多个实施方式中,只要配置在流路的上部以及侧面的至少一侧即可,与配置在流路上面的情况相比,能够以弱的磁场来偏转标记粒子,因此优选在流路的侧面的一侧或两侧配置。关于磁场照射体,在一个或多个实施方式中,可以配置在流路的长边方向整体上,也可以配置在流路的长边方向的至少一部分。关于磁场照射体的数量,在一个或多个实施方式中,可以是一个,也可以是两个以上的多个。作为磁场照射体,在一个或多个实施方式中,可以举出磁铁或者电磁铁等。在一个或多个实施方式中,本公开的分离方法包括:通过在流路内静置含有标记粒子和未标记粒子的悬浮液,利用作用于未标记粒子的重力,使未标记粒子向流路的底面侧移动;以及通过在流路内产生磁场或者电场,使标记粒子向流路的底面以外的部分移动。本公开的分离方法包括将被偏转的标记粒子固定在流路内壁面。固定能够通过标记粒子的标记方法而适当决定。在标记粒子为磁标记粒子的情况下,固定能够通过在流路内产生磁场而进行。本公开的分离方法中的一个或多个实施方式中,可以同时进行悬浮液的静置、以及标记粒子的偏转和固定,也可以在不同时间进行。在一个或多个实施方式中,本公开的分离方法包括:在标记粒子被固定在流路内壁面的状态下,将气相从流路的一端向流路内导入并从流路的另一端排出流路内的悬浮液,并且回收未标记粒子。导入气相,通过气液界面的移动来排出悬浮液并挤出流路内的未标记粒子,由此能够高效地回收粒子。另外,通过导入气相,能够使粒子回收时的液量成为与分离前的悬浮液的液量相同的量或者更少的量。本公开中的“气相”是指,由气体构成的相。关于气相的导入,在一个或多个实施方式中,能够以通过被导入的气相的压力来将流路内的悬浮液与未标记粒子一同从流路的另一端侧排出的方式进行。关于气相的导入,在一个或多个实施方式中,能够以在流路内的悬浮液与导入的气相之间形成气液界面的方式进行,进一步能够以该气液界面从流路的一端(流入口)向另一端(流出口)移动的方式进行。关于本公开中被导入的气相,在一个或多个实施方式中,优选在流路的内壁面占据不是点也不是线的一定的区域,当气相采用这样的方式的情况下,与泡不同。另外,在一个或多个实施方式中,通过导入气相而形成的气液界面与流路的内壁面之间的接触点形成连续的线。作为气体,在一个或多个实施方式中,能够使用空气、氧气、氮气、氩气或二氧化碳气体等。关于气相,在一个或多个实施方式中,能够通过被配置在流路的一端的压力产生机构等来导入。作为压力产生机构,在一个或多个实施方式中,可以举出注射泵、管式泵或真空泵等。从能够形成稳定的气液界面、能够进一步提高未标记粒子的回收精度、以及维持固定在流路内壁面的标记粒子的固定的观点出发,在一个或多个实施方式中,气相的流量为25μl/分以上、50μl/分以上或75μl/分以上,或者500μl/分以下或250μl/分以下。关于悬浮液的排出,在一个或多个实施方式中,可以排出流路内的全量,也可以排出至少一部分的量。通过将排出量作为流路内的悬浮液的一部分,在一个或多个实施方式中,能够以浓缩的状态回收未标记粒子。在一个或多个实施方式中,本公开的分离方法可以包括通过解除标记粒子的固定、且向流路内导入液体,来回收标记粒子。作为本公开中的悬浮液,在一个或多个实施方式中,可举出标记粒子和未标记粒子和从人、患者或动物等得到的试样。试样在一个或多个实施方式中,可以制备血液、血浆或血清等而得。作为本公开中的粒子,没有特别限制,可以举出人或人以外的动物的细胞。作为没有特别限制的细胞的示例,可以举出稀有细胞、白细胞、红细胞、血小板以及它们的未分化细胞等。稀有细胞是指,人或人以外的动物的血液中可能含有的血球成分(红细胞、白细胞、以及血小板)以外的细胞。作为稀有细胞,在一个或多个实施方式中,可以举出选自由癌细胞、循环肿瘤细胞、血管内皮细胞、血管内皮前体细胞、癌症干细胞、上皮细胞、造血干细胞、间充质干细胞、胎儿细胞、干细胞、未分化白细胞、未分化红细胞以及它们的组合构成的组的细胞等。本公开中,标记粒子为检测对象粒子,所述未标记粒子为检测对象外的粒子。作为检测对象粒子在一个或多个实施方式中,可举出稀有细胞,作为检测对象外的粒子在一个或多个实施方式中,可举出白细胞。[分离装置]一个方式中,本公开涉及用于分离标记粒子和未标记粒子的装置(本公开的分离装置)。本公开的分离装置具有能够供应含有标记粒子和未标记粒子的悬浮液的流路、使标记粒子向与重力方向不同的方向偏转并固定到流路内壁面的单元、以及用于导入用于排出流路内的悬浮液的气相的导入单元。根据本公开的分离装置,在一个或多个实施方式中,能够以高精度分离标记粒子和未标记粒子,并且能够以高精度回收未标记粒子。流路为如上所述。作为导入单元,可以举出上述的压力产生机构等。作为使标记粒子向与未标记粒子不同的方向、即与重力方向不同的方向偏转、并固定到流路内壁面的单元,在一个或多个实施方式中,可以是进行偏转和固定两者的单元,偏转单元和固定单元可以是彼此不同的单元。作为能够进行偏转和固定两者的单元,在一个或多个实施方式中,可以举出磁场照射体等。[分离系统]一个方式中,本公开涉及用于分离标记粒子和未标记粒子的系统(本公开的分离系统)。本公开的分离系统包括:具有能够供应含有标记粒子和未标记粒子的悬浮液的流路、以及将标记粒子向与未标记粒子不同的方向、即与重力方向不同的方向偏转、并固定到流路内壁面的单元的分离部;以及用于导入用于排出流路内的悬浮液的气相的导入单元。根据本公开的分离系统,在一个或多个实施方式中,能够以高精度分离标记粒子和未标记粒子,并且能够以高精度回收未标记粒子。[其他方式]本公开在其他方式中,涉及对含有检测对象粒子和与所述检测对象粒子相比占多数的非检测对象粒子的待测体中的所述非检测对象粒子进行标记,捕获所述待测体中的标记了的所述非检测对象粒子,对所述待测体中的检测对象粒子进行分离的方法。作为待测体,在一个或多个实施方式中,可举出从人、患者或动物等得到的试样。试样在一个或多个实施方式中,可以制备血液、血浆或血清等而得。以下,对于本公开的分离方法,对没有限定的一个实施方式进行说明。以使用图1所示的分离装置、未标记粒子(目标粒子)为ctc、标记粒子为磁标记的白细胞的情况为例子进行说明。悬浮液中,含有比未磁标记粒子(ctc)多的磁标记的白细胞。此外,本公开不局限于该实施方式。图1示出能够在本公开的分离方法中利用的分离装置的一个例子。图1所示的分离装置具有流路1、磁场照射体2、气相导入单元(压力产生机构)3、以及连通流路1和气相导入单元3的管4。流路1具备流入口11和流出口12,可以在流出口12配置回收容器5。流路1被配置成长边方向的中心轴成为大致水平。图2示出图1的分离装置中的流路1和磁场照射体2的配置的一个例子。如图2所示,磁场照射体2在被配置成大致水平方向的流路1的一侧侧面沿着长边方向配置。在管4上配置三通阀41,能够通过三通阀41来向流路1内导入悬浮液。接着,对使用图1的分离装置的、分离未标记粒子和标记粒子的方法的一个例子,进行说明。首先,将含有ctc和磁标记的白细胞的悬浮液从三通阀41通过流入口11而向流路1内供应从而填充。从顺利进行对流路1的悬浮液的填充的观点出发,悬浮液的填充优选在没有产生磁场的状态下进行。关于白细胞的磁标记,能够通过由结合了结合分子的抗体等对白细胞抗体染色之后、与固定了与该结合分子特异性反应的物质的磁性珠反应来进行。作为结合分子,在一个或多个实施方式中,可以举出生物素等。作为特异性反应的物质,在一个或多个实施方式中,可以举出链霉亲和素以及中性亲和素等蛋白质。在填充结束之后,在流路1内静置悬浮液,并且通过被配置在流路1的一侧侧面的磁场照射体2而在流路1内产生磁场。由此,磁标记的白细胞偏转并向配置了流路1的磁场照射体2的一侧的内壁面移动,并且在其内壁面(流路1的底面以外的内壁)被捕获(固定)。另一方面,未标记粒子(ctc)不受磁场的影响,因此通过重力而向流路1的底面侧移动。在ctc位于流路1的底面、且磁标记的白细胞被捕获到流路1的底面以外的内壁的状态下,从气相导入单元3通过管4和流入口11而向流路1内导入气相。气相只要以如下方式导入即可:流路内1的悬浮液和未标记粒子(ctc)能够向流路1的外部排出,并且维持流路1上捕获的底面以外的内壁的白细胞在流路1的内部位置被捕获的状态。含有被排出到流路1的外部的ctc的悬浮液通过流出口12而被回收到管等回收容器5。由此,能够分离未标记粒子(ctc)和磁标记的白细胞,并且能够回收未标记粒子(ctc)。通过导入气相,由气液界面的移动排出悬浮液并挤出流路内的未标记粒子,由此能够高效地回收粒子。另外,通过导入气相,能够在白细胞的分离前后无需增加液量而回收。另外,通过调整排出到流路1的外部的悬浮液的量,能够以浓缩的状态回收ctc。在上述实施方式中,以均从流入口11导入悬浮液和气相的方式为例子进行了说明,但本公开不限于此,悬浮液的导入方向与气相的导入方向可以不相同。例如,也可以从流入口11导入悬浮液,从流出口12导入气相。另外,在上述实施方式中,以在向流路1内填充悬浮液之后、在流路1内产生磁场的方式为例子进行了说明,但本公开不限于此。也可以在流路1内产生磁场的状态下填充悬浮液,并且同时进行悬浮液的填充和标记粒子的移动方向的偏转。在上述实施方式中,以将磁场照射体2配置在流路1的一侧侧面的方式为例子进行了说明,但本发明不限于此。未标记粒子通过重力而向流路1的底面侧移动,因此避免未磁标记粒子被卷入到磁标记的粒子中从而被捕获的情况,并且从提高未磁标记粒子的回收率的观点出发,磁场照射体2优选配置于流路1的底面侧以外的位置。另外,与配置于流路1上面的情况相比,能够以弱的磁场偏转标记粒子,因此磁场照射体2优选配置于流路1的侧面。本公开可以涉及以下的一个或多个实施方式。〔1〕一种分离方法,其分离标记粒子和未标记粒子,所述分离方法包括:从流路的一端供应含有标记粒子和未标记粒子的悬浮液;在所述流路内,使所述标记粒子向与重力方向不同的方向偏转;将所述标记粒子固定在流路内壁面;以及在所述标记粒子被固定在流路内壁面的状态下,从所述流路的一端向流路内导入气相并从所述流路的另一端排出所述流路内的悬浮液,并回收所述未标记粒子。〔2〕根据〔1〕所述的分离方法,其中,所述标记粒子是磁标记粒子。〔3〕根据〔1〕或〔2〕所述的分离方法,其中,所述偏转通过在所述流路内产生磁场或电场来进行。〔4〕根据〔1〕至〔3〕中任一项所述的分离方法,其中,所述固定通过在所述流路内产生磁场来进行。〔5〕根据〔1〕至〔4〕中任一项所述的分离方法,其中,所述悬浮液含有比所述未标记粒子多的所述标记粒子。〔6〕一种分离装置,其用于分离标记粒子和未标记粒子,所述分离装置包括:流路,所述流路能够供应含有标记粒子和未标记粒子的悬浮液;使所述标记粒子向与重力方向不同的方向偏转,并固定在流路内壁面的单元;以及导入单元,所述导入单元用于导入用于排出所述流路内的悬浮液的气相。〔7〕一种分离系统,其用于分离标记粒子和未标记粒子,所述分离系统包括:分离部,所述分离部具有能够供应含有标记粒子和未标记粒子的悬浮液的流路,以及使所述标记粒子向与重力方向不同的方向偏转,并固定在流路内壁面的单元;以及导入单元,所述导入单元用于导入用于排出所述流路内的悬浮液的气相。示例以下,使用实施例,进一步说明本公开。在以下的实施例中,通过磁场来偏转标记的粒子,但可以使用施加了电压的电线等,并通过电场来偏转。但是,本公开不被解释为限于以下的实施例。(实施例1)使用含有由磁粒子标记的白细胞和人结肠腺癌细胞的悬浮液,进行图1所示的磁分离装置的分离和回收。[磁分离装置]准备图1所示的磁分离装置。在safido(商标)管(内径3.1mm、管长度26cm、容积2cm3)的一端,经由三通阀和注射器(10ml)而与注射泵连接,并且在另一端配置用于回收从safido(商标)管排出的液体的容器。在safido(商标)管的侧面配置磁铁(钕磁铁(n40、方形、200x15x5(mm)、5mm方向、表面磁通量密度229mt))。[细胞悬浮液的制备]细胞悬浮液通过如下的方式准备:在分别单独地对从全血中采集的白细胞(wbc)和人结肠腺癌细胞染色之后、调整细胞数,此后混合磁粒子和两者的细胞(白细胞以及人结肠腺癌细胞),并由磁粒子标记。通过生物素标记白细胞并使用涂覆了链霉亲和素的磁粒子,通过上述的混合,磁粒子与白细胞特异性结合,仅仅白细胞被磁标记。<白细胞的制备>使用真空采血管(含有edta·2k)而从人采血。按照hetasep(stemcell社)的附加文件,从采血的全血中进行白细胞的分离。<癌细胞的制备>按照通常的方法,使用胰蛋白酶(invitrogen社)对培养的人结肠腺癌细胞株(sw620americantypeculturecollection(atcc)社)进行回收。对回收的癌细胞的细胞悬浮液进行离心,并除去上清液。用dulbeccopbs(-)(nissui社)pbs(-)来再次悬浮,进行离心,再次除去上清液,由此得到癌细胞(sw620)。<白细胞的biotin(生物素)标记以及染色>按照通常的方法,使用血细胞计数板,对细胞数进行计数,通过hetasep来获取分离的白细胞,制备含有105个~106个白细胞的试样(细胞悬浮液)。在离心且除去上清液之后,通过将10%山羊血清、0.000001%avidin、0.2%bsa溶解在dulbeccopbs(-)中的封闭液在23℃下反应10分钟。离心并除去上清液,用dulbeccopbs(-)而再次悬浮。再次离心,除去上清液。在第一抗体反应液中悬浮细胞,在23℃下反应15分钟,其中,所述第一抗体反应液是分别按照附加文件而向溶解了10%山羊血清、0.01%biotin、0.2%bsa的dulbeccopbs(-)中添加抗cd45抗体、以及抗cd50抗体而得到的。离心并除去上清液,并使用dulbeccopbs(-)而进行悬浮。共计进行三次离心、再次除去上清液的步骤,充分清洗细胞。在第二抗体反应液中悬浮细胞,在23℃下反应15分钟,所述第二抗体反应液是在分别按照附加文件而向溶解2μg/mlhoechst33342、10%山羊血清、0.2%bsa的dulbeccopbs(-)中添加alexa594标记抗小鼠igg(fab)以及biotin标记抗小鼠igg(fc)而得到的。离心并除去上清液,并使用dulbeccopbs(-)而进行悬浮。共计进行三次离心、再次除去上清液的步骤,充分清洗细胞。<癌细胞的追加染色>在按照附加文件添加neurodio(绿色标记)的反应液中悬浮sw620,在23℃下反应10分钟。离心并除去上清液,并使用dulbeccopbs(-)而进行悬浮。共计进行三次离心、再次除去上清液的步骤,充分清洗细胞。<磁标记>按照附加文件而制备在溶解了0.2%bsa的dulbeccopbs(-)中悬浮的磁粒子(bio-adembeadsstreptadivin,粒径300nm:ademtech社),混合由neurodio染色的sw620和biotin标记的白细胞,反应30分钟。使悬浮液通过具有短轴径5μm、长轴直径88μm的孔的过滤器,并除去未反应的剩余磁粒子。输送溶解了0.2%bsa的dulbeccopbs(-),回收过滤器上的细胞并获取细胞悬浮液。[分离方法]朝向没有液相而被空气充满的气相状态的safido(商标)管通过三通阀(三通旋塞阀)而导入细胞悬浮液1000μl,在safido(商标)管内构建由细胞悬浮液构成的液相。通过三通阀而闭合导入细胞悬浮液的导入口,由此将使从注射泵内至细胞悬浮液的末端界面形成一个连续的气相。此后,将钕磁铁(n40、方形、200x15x5(mm)、5mm方向)移动到与safido(商标)管的侧面相邻的位置,在室温下静置15分钟。从注射泵以100μl/min流量向safido(商标)管导入空气,从safido(商标)管排出safido(商标)管内的全部液体,将排出的液体回收到管内。荧光检测回收到管的液体中含有的白细胞和sw620。表1示出其结果。此外,如上所述,通过进行气相的形成和空气的导入,能够在流路内的悬浮液和导入的气相之间形成气液界面,并且能够使该气液界面从流路的导入口向流出口移动。如上所述,该气相从注射泵向悬浮液的末端界面成为连续的状态,该气相在流路的内壁占据不是点也不是线的一定区域。另外,气液界面与流路的内壁面之间的接触点形成连续的线。(比较例1)将实施例1中使用的细胞悬浮液1000μl添加到1.5ml管中。在靠近magicaltrapper(toyobo制)磁铁架的状态下,在室温下静置15分钟。然后,通过移液器来回收全量的上清液,并计测回收的上清液中含有的白细胞和sw620。表1表示其结果。(比较例2)除了没有靠近钕磁铁以外,与实施例1同样地进行磁分离。表1表示其结果。(比较例3)除了替代空气而以100μl/min流量输送溶解了0.2%bsa的dulbeccopbs(-)以外,与实施例1同样地进行磁分离。表1表示其结果。(比较例4)除了替代空气而以1000μl/min流量输送溶解了0.2%bsa的dulbeccopbs(-)以外,与实施例1同样地进行磁分离。表1表示其结果。表1如表1所示,根据实施例1,能够确认如下情况:能够有效地分离标记粒子(wbc)和未标记粒子(sw620),并且能够以高的回收率回收目标细胞(sw620)。如表1所示,在没有靠近钕磁铁的比较例2中,从safido(商标)管中排出的wbc的量多,不能充分进行分离。在替代空气(气相)而以与实施例1相同的流量通过液体(液相)回收的比较例3中,根本无法回收sw620和wbc。作为该理由,可以考虑到如下情况:虽然以与空气(气相)相同的流量进行输送,但在液体的情况下,只在流路的中央产生高的流速,在壁面难以产生流速,从而对该流量而言,挤出由于自身重量而沉降到流路的细胞的效果不充分。另外,比较例4中输送了日本专利特表第2013-517763号公报的实施例中公开的流量(1000μl/分)的液体并对其进行回收,其结果为根本无法回收wbc,sw620的回收率为12%,极其低,不能充分回收sw620(未标记粒子)。(实施例2)除了每次100μl分10次回收从safido(商标)管排出的液体以外,与实施例1同样地进行磁分离。按照回收的顺序每100μl附以级分(fraction)编号,并计测各级分中包含的sw620的数量。表2表示其结果。表2级分编号12345678910合计回收数sw6201972238178281112333全部级分(级分1~10的合计)中的sw620的回收率为88%,白细胞的回收率(残存率)为0.097%。由此,确认了如下情况:在以磁铁保持回收目标以外的细胞(白细胞)的状态下,导入气相(空气),由此能够有效地回收目标细胞(稀有细胞)。另外,如表2所示,本实施例中回收的稀有细胞中的80%以上包含于最后的三个级分中。因此,通过分离获取被排出的液体或者仅仅回收后半部分,能够进行回收目标细胞(稀有细胞)和回收目标以外的细胞(白细胞)之间的分离,同时还能够进行浓缩。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1