基于盐酸催化水解-酯化反应利用湿微藻直接制备生物柴油的方法与流程
本发明涉及生物柴油制备领域,具体涉及一种基于水解-酯交换催化反应的湿微藻直接制备生物柴油方法。
背景技术:
在众多的生物质中,微藻由于其生长速度快、脂质含量高、光合效率高等优点,是生物燃料生产的重要来源之一[1-5]。然而,高昂的生产成本与藻类生物质生产相关的技术瓶颈限制了微藻类衍生生物燃料的商业开发[6]。微藻类生物柴油的生产通常包括四个步骤:(i)种植、(ii)收获、(iii)干燥、(iv)提取和生物柴油转换[7-11]。其中,微藻的干燥环节被认为是能耗最大的阶段,这提高了生物柴油的生产成本[12-14]。有关小球藻柴油生产的生命周期评估(lca)表明,干燥和油脂提取占总生产成本的90%[15]。因此如何降低干燥和油脂提取的成本是藻类生物柴油成本降低的关键所在。
与传统的生物柴油制备过程(通常包括干燥、脂质提取、酯化或酯交换反应)相比,以湿微藻为原料,采用直接水解酯化法生产生物柴油具有显著的节能潜力,因为该法避免了干燥的步骤,以及相对减少了溶剂的使用。目前,硫酸是湿微藻水解酯化制备生物柴油产品中唯一使用的催化剂。但硫酸在作为催化剂时,面临着反应结束后存在于生物柴油相难以分离回收利用、并产生大量废水等问题[16]。因此,使用盐酸作为催化剂进行水解酯化反应湿微藻直接制备生物柴油,不仅能够节省传统工艺中干燥环节的大量成本,而且能够解决硫酸催化剂面临的一系列问题,对降低湿微藻直接制备生物柴油成本具有巨大潜力和经济价值。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种基于盐酸催化水解-酯化反应的湿微藻直接制备生物柴油方法。湿微藻用于生物柴油的制备能大幅减少传统工艺中干燥环节能耗,并且盐酸作为催化剂在反应后存在于甲醇相中,更有利于催化剂的物质回收以及生物柴油的品质要求。
本发明为解决背景技术的技术问题,采用的技术方案是:基于盐酸催化水解-酯化反应利用湿微藻直接制备生物柴油的方法,包括如下步骤:
1)微藻粉在80℃下干燥2h后存于-20℃冰箱中备用,将预处理后的干藻粉与超滤水按质量比20:80的比例混合用以实现含水率80%的湿微藻;
2)将湿微藻放入离心管中,并加入300±50ml/kg干藻粉的36%浓盐酸催化剂,并加入4ml甲醇溶液后混匀;
3)放入120±10℃烘箱中进行水解-酯化反应,持续6±1h;
4)反应结束后,取出冷却至室温,在每支离心管中加入3ml己烷,放入高速离心机,在3000rpm转速下离心5分钟,取出己烷层后再加入3ml己烷萃取,重复萃取操作,最后将萃取得到的己烷层汇入试管进行脂肪酸甲酯含量的测定。
所述步骤2)中催化剂用量优选300ml/kg。
所述步骤3)中水解-酯化反应温度优选120℃。
所述步骤3)中水解-酯化反应时间优选6h。
所述步骤2)同时设置加入4ml甲醇溶液作为对照组。
与现有技术相比,本发明具有的优点:
本发明通过盐酸催化水解-酯化反应,能够实现一步反应对含水率80%的湿微藻生物柴油制备过程,避免干燥脱水等操作。经测定,fame(脂肪酸甲酯)含量及产率分别达4.75%,64.4%,,均略高于传统硫酸催化剂催化的水解-酯化反应。同时,生成的fame(脂肪酸甲酯)成分组成主要是棕榈酸(c16:0)、棕榈酸(c16:2)、硬脂酸(c18:0)、油酸(c18:1)、亚油酸(c18:2)、亚麻酸(c18:3)等,其中十六烷值含量达18.52%,使得经盐酸催化水解-酯化反应制得的生物柴油符合生物柴油标准。
附图说明
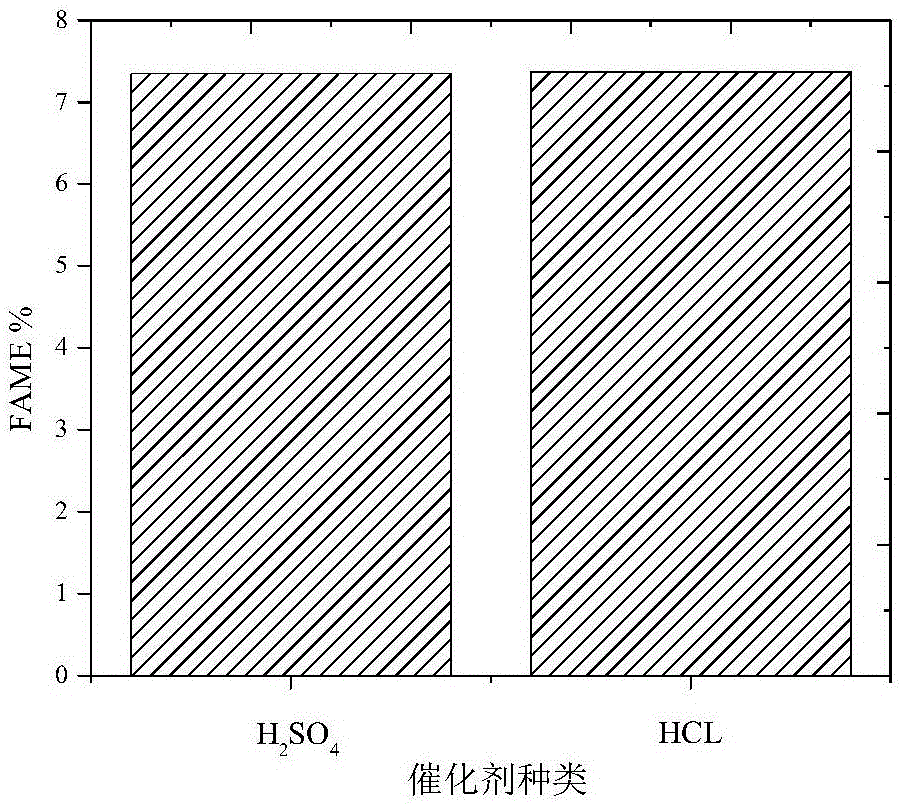
图1是两种催化剂条件下干燥粉直接酯交换反应fame最大含量图。
图2是不同实验方案下湿微藻制备fame含量图。
图3是两种催化剂条件下fame含量图。
图4是两种催化剂条件下fame产率图。
图5是两种催化剂条件下fame成分组成图。
具体实施方式
下面通过具体实施例和附图对本发明作进一步的说明。本发明的实施例是为了更好地使本领域的技术人员更好地理解本发明,并不对本发明作任何的限制。
本发明是一种基于盐酸催化水解-酯化反应的湿微藻直接制备生物柴油方法,包括如下步骤:
1)微藻粉在80℃下干燥2h后存于-20℃冰箱中备用,将预处理后的干藻粉与超滤水按质量比20:80的比例混合用以实现含水率80%的湿微藻;
2)将湿微藻放入离心管中,并加入300±50ml/kg干藻粉的36%浓盐酸催化剂,并加入4ml甲醇溶液后混匀;设置加入4ml甲醇溶液作为对照组;
3)放入120±10℃烘箱中进行水解-酯化反应,持续6±1h;
4)反应结束后,取出冷却至室温,在每支离心管中加入3ml己烷,放入高速离心机,在3000rpm转速下离心5分钟,取出己烷层后再加入3ml己烷萃取,重复两次萃取操作,最后将两次萃取得到的己烷层汇入试管进行脂肪酸甲酯含量的测定。
实施例1不同催化剂浓度、反应温度及时间对脂肪酸甲酯产量的影响
1)干微藻制备生物柴油测定脂肪酸甲酯最大含量
(1)微藻粉在80℃下干燥2h后存于-20℃冰箱中备用,将99.9%的甲醇溶液分别与95%的浓硫酸溶液、36%浓盐酸溶液按体积98:2的比例混合摇匀备用。将预处理后的干微藻粉放入离心管中,分别加入4ml制备好的2%h2so4、hcl甲醇溶液作为催化剂。
(2)同时,设置加入4ml甲醇溶液作为对照组。
(3)将每支离心管关闭紧密,确保没有泄露,放入80℃烘箱中进行酯交换反应,持续6h。反应结束后,取出冷却至室温,在每支离心管中加入3ml己烷,放入高速离心机,在3000rpm转速下离心5分钟,取出己烷层后再加入3ml己烷萃取,重复两次萃取操作,最后将多次萃取得到的己烷层汇入试管进行脂肪酸甲酯最大含量的测定。
从图1可以看出,传统的干法制备生物柴油,在传统催化剂h2so4及本实验中使用的hcl的催化剂作用条件下,微藻中的脂肪酸甲酯(fame)最大含量分别细胞干重的7.35%、7.37%,二者基本持平,略高于文献中微藻细胞中的脂肪酸甲酯(fame)含量水平,可认为是微藻细胞中的脂肪酸甲酯(fame)最大含量。本发明在测定了脂肪酸甲酯最大含量的基础上探究利用不同浓度hcl作为催化剂湿法直接水解-酯化制备生物柴油的方法。
2)不同催化条件对湿微藻制备生物柴油脂肪酸甲酯含量测定
实验设置了不同的催化剂浓度、反应温度及时间的条件,探究最佳的制备条件。设置了三因子三水平的正交实验设计方案,如下表1所示。
表1
具体实验步骤如上文所述,测定湿法直接水解-酯化制备脂肪酸甲酯(fame)的含量,并与干微藻细胞中的脂肪酸甲酯(fame)最大含量对比,计算脂肪酸甲酯产率。从图2中可以看出催化剂的浓度对反应的影响较大,其中300ml/kg的催化剂用量明显高于其余两组对比实验。而反应时间及温度影响相对较小,综合考虑反应时间、温度耗能及最终产量因素,最佳反应的条件为120℃、6h、300ml/kg的催化剂使用量,即第5号实验条件。
3)两种催化剂直接制备生物柴油对比
在探究最佳反应条件的情况下,设计两组实验与传统硫酸(h2so4)作为催化剂进行脂肪酸甲酯产量对比,具体实验方案如下表2所示,实验步骤如上述操作。
表2
从图3、图4可以看出,hcl作为催化剂时,水解-酯化反应利用湿微藻直接制备生物柴油时,fame产量及都略高于h2so4,分别达到4.95%、67.20%。
实施例2两种催化剂脂肪酸甲酯成分组成分析对比
本实验对获得的脂肪酸甲酯(fame)进行了组成成分的测定,分析其组成与传统石化柴油的组成区别,同时与传统硫酸直接制备的生物柴油组成成分进行对比,用以判断该发明方法制备的生物柴油质量的优劣。从图5能看出两种催化剂作用条件下,fame的成分主要为棕榈酸(c16:0)、棕榈酸(c16:2)、硬脂酸(c18:0)、油酸(c18:1)、亚油酸(c18:2)、亚麻酸(c18:3)等,而hcl作为催化剂时,其制备的生物柴油成分组成中含有更高的十六烷值,更加符合国际生物柴油制备标准。
应当理解的是,这里所讨论的实施方案及实例只是为了说明,对本领域技术人员来说,可以加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
相关文献:
1.chen,h.,wang,j.,zheng,y.,zhan,j.,he,c.,wang,q.2018.algalbiofuelproductioncoupledbioremediationofbiomasspowerplantwastesbasedonchlorellasp.c2cultivation.appliedenergy,211,296-305.
2.milano,j.,ong,h.c.,masjuki,h.h.,chong,w.t.,lam,m.k.,loh,p.k.,vellayan,v.2016.microalgaebiofuelsasanalternativetofossilfuelforpowergeneration.renewableandsustainableenergyreviews,58,180-197.
3.show,k.y.,lee,d.j.,tay,j.h.,lee,t.m.,chang,j.s.2015.microalgaldryingandcelldisruption--recentadvances.bioresourtechnol,184,258-66.
4.wu,w.,wang,p.-h.,lee,d.-j.,chang,j.-s.2017b.globaloptimizationofmicroalgae-to-biodieselchainswithintegratedcogasificationcombinedcyclesystemsbasedongreenhousegasemissionsreductions.appliedenergy,197,63-82.
5.zhu,l.,nugroho,y.k.,shakeel,s.r.,li,z.,martinkauppi,b.,hiltunen,e.2017.usingmicroalgaetoproduceliquidtransportationbiodiesel:whatisnext?renewableandsustainableenergyreviews,78,391-400.
6.salam,k.a.,velasquez-orta,s.b.,harvey,a.p.2016.asustainableintegratedinsitutransesterificationofmicroalgaeforbiodieselproductionandassociatedco-product-areview.renewableandsustainableenergyreviews,65,1179-1198.
7.beneroso,d.,monti,t.,kostas,e.t.,robinson,j.2017.microwavepyrolysisofbiomassforbio-oilproduction:scalableprocessingconcepts.chemicalengineeringjournal,316,481-498.
8.jazzar,s.,olivares-carrillo,p.,pérezdelosríos,a.,marzouki,m.n.,acién-fernández,f.g.,fernández-sevilla,j.m.,molina-grima,e.,smaali,i.,quesada-medina,j.2015.directsupercriticalmethanolysisofwetanddryunwashedmarinemicroalgae(nannochloropsisgaditana)tobiodiesel.appliedenergy,148,210-219.
9.kim,t.-h.,oh,y.-k.,lee,j.w.,chang,y.k.2017.levulinateproductionfromalgalcellhydrolysisusinginsitutransesterification.algalresearch,26,431-435.
10.navarrolópez,e.,roblesmedina,a.,estebancerdán,l.,gonzálezmoreno,p.a.,macíassánchez,m.d.,molinagrima,e.2016.fattyacidmethylesterproductionfromwetmicroalgalbiomassbylipase-catalyzeddirecttransesterification.biomassandbioenergy,93,6-12.
11.pérez,l.,salgueiro,j.l.,maceiras,r.,cancela,
12.cheng,j.,qiu,y.,zhang,j.,huang,r.,yang,w.,fan,z.2017.conversionoflipidsfromwetmicroalgaeintobiodieselusingsulfonatedgrapheneoxidecatalysts.bioresourtechnol,244(pt1),569-574.
13.shwetharani,r.,balakrishna,r.g.2016.efficientalgallipidextractionviaphotocatalysisanditsconversiontobiofuel.appliedenergy,168,364-374.
14.song,c.,chen,g.,ji,n.,liu,q.,kansha,y.,tsutsumi,a.2015.biodieselproductionprocessfrommicroalgaeoilbywasteheatrecoveryandprocessintegration.bioresourtechnol,193,192-9.
15.mohamadzadehshirazi,h.,karimi-sabet,j.,ghotbi,c.2017.biodieselproductionfromspirulinamicroalgaefeedstockusingdirecttransesterificationnearsupercriticalmethanolcondition.bioresourtechnol,239,378-386.
16.chiu,c.w.,goff,m.j.,suppes,g.j.2005.distributionofmethanolandcatalystsbetweenbiodieselandglycerinphases.aichejournal,51(4),1274–1278。
- 还没有人留言评论。精彩留言会获得点赞!