高密度微腔阵列以及使用了该高密度微腔阵列的测定方法与流程
本发明涉及高密度微腔阵列以及使用了该高密度微腔阵列的测定方法。
背景技术:
专利文献1公开了一种高密度微腔阵列,其中,该高密度微腔阵列具备:平坦的基板;在基板的表面由疏水性的物质有规则地高密度排列而形成的容量为4000×10-18m3以下的多个微腔;以及形成在充满了试验用水溶液的状态的多个微腔的开口部以便对试验用水溶液进行液封的脂质双重膜。
在先技术文献
专利文献
专利文献1:日本特开第2015-040754号
技术实现要素:
发明要解决的课题
期望以上述以往的高密度微腔阵列为基础开发出其应用技术。
用于解决课题的技术方案
第一侧面涉及的高密度微腔阵列构成为,具备:具有透光性的平坦的基板;疏水层,是设置在所述基板上且由疏水性物质构成的层,多个微腔的开口部被设置成在该层的主面上有规则且高密度地排列,所述微腔的容量为4000×10-18m3以下;以及脂质双重膜,形成在充满了试验用液体的状态的所述多个微腔的开口部,以便对所述试验用液体进行密封,在每个所述微腔内设置有电极,在所述基板中,在将设置有所述疏水层的一侧设为上方时,通过满足下述a)以及b)中的至少任一者,从而从所述基板的下方向所述基板入射的光透射所述基板而向所述微腔的内部进入,并且从所述微腔的内部向所述基板入射的光透射所述基板而向所述基板的下方逃逸。
a)所述电极设置在每个所述微腔的内侧面。
b)所述电极作为透明电极而设置在每个所述微腔的底面。
在第二侧面涉及的膜蛋白质的分析方法中,准备高密度微腔阵列,所述高密度微腔阵列构成为,具备:具有透光性的平坦的基板;以及疏水层,是设置在所述基板上且由疏水性物质构成的层,多个微腔的开口部被设置成在该层的主面上有规则且高密度地排列,所述微腔的容量为4000×10-18m3以下,该高密度微腔阵列在每个所述微腔内设置有电极,在所述基板中,在将设置有所述疏水层的一侧设为上方时,通过满足下述a)以及b)中的至少任一者,从而从所述基板的下方向所述基板入射的光透射所述基板而向所述微腔的内部进入,并且从所述微腔的内部向所述基板入射的光透射所述基板而向所述基板的下方逃逸,在该膜蛋白质的分析方法中,在所述多个微腔的开口部形成脂质双重膜,在此,所述脂质双重膜保持膜蛋白质,通过在所述电极与设置在所述脂质双重膜的上方的相反电极之间施加电压,从而使所述膜蛋白质的性质变化。
a)所述电极设置在每个所述微腔的内侧面。
b)所述电极作为透明电极而设置在每个所述微腔的底面。
在第三侧面涉及的方法中,准备高密度微腔阵列,所述高密度微腔阵列构成为,具备:具有透光性的平坦的基板;以及疏水层,是设置在所述基板上且由疏水性物质构成的层,多个微腔的开口部被设置成在该层的主面上有规则且高密度地排列,所述微腔的容量为4000×10-18m3以下,该高密度微腔阵列在每个所述微腔内设置有电极,在所述基板中,在将设置有所述疏水层的一侧设为上方时,通过满足下述a)以及b)中的至少任一者,从而从所述基板的下方向所述基板入射的光透射所述基板而向所述微腔的内部进入,并且从所述微腔的内部向所述基板入射的光透射所述基板而向所述基板的下方逃逸,在该方法中,通过在所述电极施加电压,从而在所述多个微腔的内部聚集生物体高分子,此后,形成脂质双重膜,以便在所述多个微腔的开口部对所述生物体高分子进行密封。
a)所述电极设置在每个所述微腔的内侧面。
b)所述电极作为透明电极而设置在每个所述微腔的底面。
发明效果
可提供一种高密度微腔阵列的应用技术。
附图说明
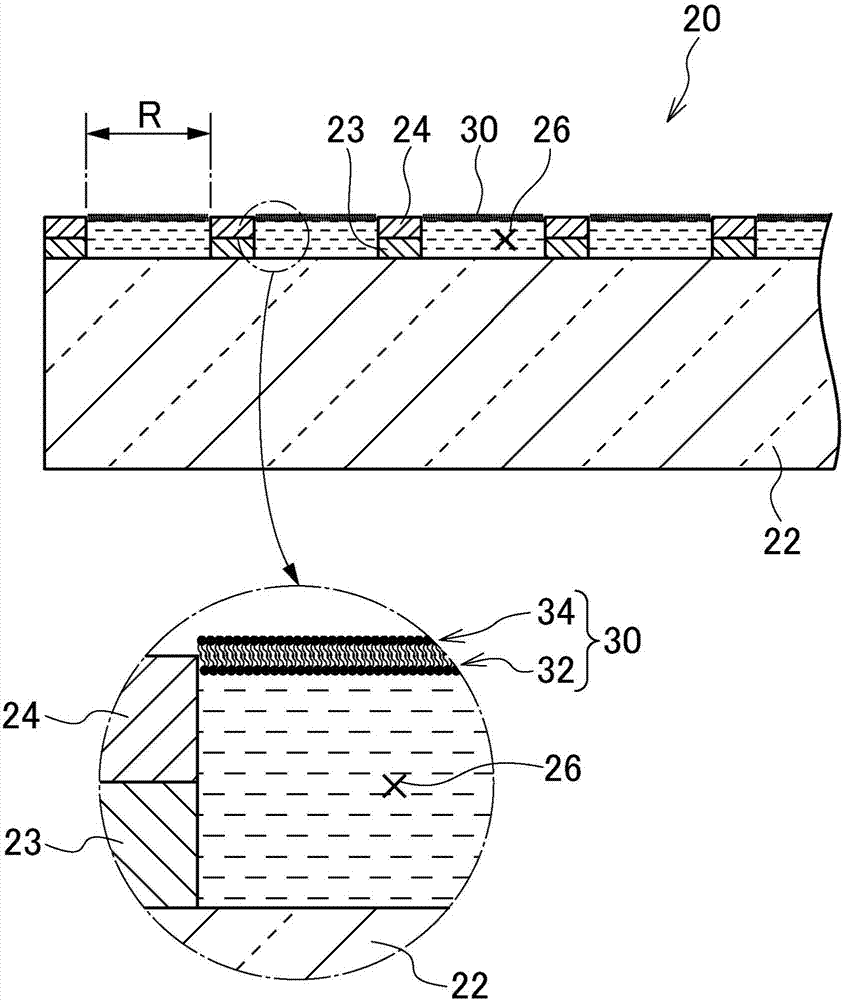
图1是示出第一实施方式涉及的高密度微腔阵列的概略结构的一个例子的俯视图。
图2是示出第一实施方式涉及的高密度微腔阵列的图1中的a-a剖面以及将该剖面的一部分放大而示出的图。
图3是示出第一实施方式涉及的高密度微腔阵列系统的一个例子的概念图。
图4是示出第一实施方式的变形例涉及的高密度微腔阵列的概略结构的俯视图。
图5是示出第一实施方式涉及的高密度微腔阵列的制造方法的一个例子的工序图。
图6是示出第一实施方式中的微腔器件的形成(工序s100)的一个例子的工序图。
图7是示出第一实施方式中的脂质双重膜的形成(工序s120)的一个例子的工序图。
图8a是示出在第一实施方式的微腔器件的形成中准备基板的工序的图。
图8b是示出在第一实施方式的微腔器件的形成中在基板上形成电极层的工序的图。
图8c是示出在第一实施方式的微腔器件的形成中在电极层上形成物质膜的工序的图。
图8d是示出在第一实施方式的微腔器件的形成中在物质膜上形成抗蚀剂的工序的图。
图8e是示出在第一实施方式的微腔器件的形成中对抗蚀剂进行图案形成的工序的图。
图8f是示出在第一实施方式的微腔器件的形成中将图案形成后的抗蚀剂作为掩模而对物质膜进行蚀刻的工序的图。
图8g是示出在第一实施方式的微腔器件的形成中去除抗蚀剂的工序的图。
图8h是示出在第一实施方式的微腔器件的形成中将图案形成后的物质膜作为掩模而对电极层进行蚀刻的工序的图。
图9a是示出在第一实施方式涉及的高密度微腔阵列中的脂质双重膜的形成中用试验用液体来充满液体流路的工序的图。
图9b是示出在第一实施方式涉及的高密度微腔阵列中的脂质双重膜的形成中导入含有脂质的有机溶剂的工序的图。
图9c是示出在第一实施方式涉及的高密度微腔阵列中的脂质双重膜的形成中导入膜形成用液体的工序的图。
图10是示出第一实验例中的施加电压(虚线)和荧光强度(实线)的变化的图。
图11是示出第二实验例中的荧光强度的时间变化与膜电位的关系的图。
图12是示出第二实验例中的f型atp合成酶的质子输送速度(纵轴)与膜电位的大小(横轴)的关系的图。
图13是示出第二实施方式涉及的高密度微腔阵列系统的概略结构的一个例子的图。
图14是示出在第三实施方式中聚集了生物体高分子的高密度微腔阵列的概略结构的一个例子的图。
图15是示出第三实施方式中的生物体高分子聚集高密度微腔阵列的制造方法的一个例子的工序图。
图16a是示出在第四实施方式的使细胞向脂质双重膜融合的方法中在液体流路导入细胞的工序的图。
图16b是示出在第四实施方式的使细胞向脂质双重膜融合的方法中使细胞向脂质双重膜融合后的状态的图。
具体实施方式
在经由脂质双重膜发生的各种生物体分子反应中,例如,在膜输送过程、膜透射反应、膜表面中的酶反应等中,因为反应生成物的扩散需要很长时间、与酶活性相伴的物质浓度的变化极缓慢等,所以以高灵敏度对经由脂质双重膜发生的各种生物体分子反应进行检测容易变得很困难。若腔的容量大,则腔内的浓度变化就变小,作为浓度变化的检测将变得困难。若腔数少,则生物体分子的反应就极慢,因此会发生全部的腔中不发生反应的情况,检测变得困难。因此,需要以下高密度微腔阵列,即,以高密度形成有被脂质双重膜液封的容量极小的许多的微腔的高密度微腔阵列。专利文献1公开了这样的高密度微腔阵列。然而,关于其应用技术,仍有未研究的部分。
发明人为了找到以往的高密度微腔阵列的应用技术,进行了精心研究。其结果是,得到了以下的见解。另外,以下的见解仅是完成本发明的契机,并不限定本发明。
即,由于开发出了上述高密度微腔阵列,从而能够高效地实施基于膜蛋白的膜横穿型的物质输送等的计测。可是,有时膜蛋白的活性会受到膜电位的影响。在生物体内,还存在如下情况,即,通过离子的主动输送,膜电位被积极地控制,由此膜蛋白的活性被调节。如果能够在形成于高密度微腔阵列的脂质双重膜中控制膜电位,则有可能能够更详细地弄清楚膜蛋白的性质。然而,在以往的高密度微腔阵列中,并未实现膜电位的控制。
基于这样的洞察,发明人想到,在以往的高密度微腔阵列中,能够通过在腔内部形成电极来控制脂质双重膜的膜电位。通过使用电极来控制膜电位,从而能够测定膜蛋白的性质根据膜电位而如何变化。
在腔内部设置电极,还可拓展对以往的高密度微腔阵列的进一步应用领域。即,如果通过对电极施加电流而使其发热,则能够控制腔的温度。通过使用电极来产生电场,从而还能够将生物体高分子等引导到腔内部而聚集。为了使细胞表面的膜蛋白转移到张设于腔的脂质双重膜,能够使用细胞融合的技术。
基板等构成为具有透光性。通过构成为,从基板的下方向基板入射的光透射基板而向微腔的内部进入,并且从微腔的内部向基板入射的光透射基板而向基板的下方逃逸,从而能够有效地检测微腔内的反应。
以下,参照附图对本发明的实施方式进行说明。另外,以下的实施方式仅是一个例子,并不限定本发明。
以下说明的实施方式均示出了本发明的优选的一个具体例子。在以下的实施方式中示出的数值、形状、材料、构成要素、构成要素的配置位置以及连接方式、步骤、步骤的顺序等仅是一个例子,并不限定本发明。此外,关于以下的实施方式中的构成要素中的、未记载于示出本发明的最上位概念的独立权利要求的构成要素,作为构成更优选的方式的任意的构成要素来进行说明。此外,在图中,关于标注了相同的附图标记的部分,有时省略说明。此外,图中为了使得理解容易而示意性地示出了每个构成要素,关于形状以及尺寸比等,有时不是准确的表示。此外,在制造方法中,可以根据需要而变更各工序的顺序等,也可以追加其它工序。
(第一实施方式)
第一实施方式涉及的高密度微腔阵列构成为,具备:具有透光性的平坦的基板;疏水层,是设置在基板上且由疏水性物质构成的层,多个微腔的开口部被设置成在该层的主面上有规则且高密度地排列,微腔的容量为4000×10-18m3以下;以及脂质双重膜,形成在充满了试验用液体的状态的多个微腔的开口,以便对试验用液体进行密封,在每个微腔内设置有电极,在基板中,在将设置有疏水层的一侧设为上方时,通过满足下述a)以及b)中的至少任一者,从而从基板的下方向基板入射的光透射基板而向微腔的内部进入,并且从微腔的内部向基板入射的光透射基板而向基板的下方逃逸。
a)电极设置在每个微腔的内侧面。
b)电极作为透明电极而设置在每个微腔的底面。
上述高密度微腔阵列也可以进一步在脂质双重膜的上方具备相反电极。
上述高密度微腔阵列也可以进一步具备形成了微腔的面成为底面的液体流路。
上述液体流路可以形成在疏水层的上表面与配置在疏水层的上方的顶板的下表面之间。顶板可以由玻璃板构成。
第一实施方式涉及的高密度微腔阵列系统具备:上述高密度微腔阵列、和在电极与相反电极之间施加电压的电压施加装置。
在第一实施方式涉及的膜蛋白质的分析方法中,准备高密度微腔阵列,所述高密度微腔阵列构成为,具备:具有透光性的平坦的基板;以及疏水层,是设置在基板上且由疏水性物质构成的层,多个微腔的开口部被设置成在该层的主面上有规则且高密度地排列,微腔的容量为4000×10-18m3以下,该高密度微腔阵列在每个微腔内设置有电极,在基板中,在将设置有疏水层的一侧设为上方时,通过满足下述a)以及b)中的至少任一者,从而从基板的下方向基板入射的光透射基板而向微腔的内部进入,并且从微腔的内部向基板入射的光透射基板而向基板的下方逃逸,在该膜蛋白质的分析方法中,在多个微腔的开口部形成脂质双重膜,在此,脂质双重膜保持膜蛋白质,通过在电极与设置在脂质双重膜的上方的相反电极之间施加电压,从而使膜蛋白质的性质变化。
a)电极设置在每个微腔的内侧面。
b)电极作为透明电极而设置在每个微腔的底面。
[装置结构]
图1是示出第一实施方式涉及的高密度微腔阵列的概略结构的一个例子的俯视图。图2是示出第一实施方式涉及的高密度微腔阵列的图1中的a-a剖面以及将该剖面的一部分放大示出的图。以下,参照图1以及图2对第一实施方式的高密度微腔阵列20的装置结构进行说明。
如图1以及图2例示的那样,高密度微腔阵列20具备:基板22、疏水层24、脂质双重膜30、以及电极23。
基板22具有透光性且平坦。基板22例如可以由玻璃、丙烯酸树脂等构成。关于基板22的材料、厚度、以及形状等,只要从基板22的下方向基板22入射的光能够透射基板22而向微腔26的内部进入,并且从微腔26的内部向基板22入射的光能够透射基板22而向基板22的下方逃逸,就没有特别限定。具体地,例如,厚度可以为0.1mm以上且5mm以下,也可以为0.3mm以上且3mm以下,还可以为0.7mm以上且1.5mm以下。俯视下的基板22的大小没有特别限定。
疏水层24是设置在基板22上且由疏水性物质构成的层。作为疏水性物质,例如,包括氟树脂等疏水性的树脂、以及玻璃等树脂以外的物质。疏水层24的厚度能够根据后述的微腔的容积而适当地进行调整。具体地,例如,可以为10nm以上且100μm以下,也可以为100nm以上且5μm以下,还可以为250nm以上且1μm以下。
在疏水层24,多个微腔26的开口部被设置成在疏水层24的主面上有规则且高密度地排列。微腔26的容量为4000×10-18m3以下(4000μm3以下)。微腔26的容量例如可以为0.1×10-18m3以上且4000×10-18m3以下,也可以为0.5×10-18m3以上且400×10-18m3以下,还可以为1×10-18m3以上且40×10-18m3以下。
如图1以及图2所示,微腔26可以形成筒状的形状。如图1以及图2所示,微腔26可以形成如下的筒状的形状,即,基板22构成底面,疏水层24(或者,疏水层24以及电极23)构成侧面。
因为将微腔26的容量设为4000×10-18m3以下,所以通过将第一实施方式的高密度微腔阵列20用于生物体分子反应的检测,从而能够减少微腔26内的生物体分子数。其结果是,能够增大因一个生物体分子的反应导致的腔内的浓度变化,能够提高作为浓度变化而进行检测时的检测灵敏度,即使生物体分子的反应极慢,也能够以高灵敏度检测生物体分子的反应。此外,因为成为以高密度形成了许多这样的微小的微腔26的阵列,所以即使生物体分子的反应所发生的频度低,也会在任一个腔中发生反应,因此能够以高灵敏度检测生物体分子的反应。在此,微腔26的容量根据试验对象的生物体分子的反应速度的大小、生物体分子的含有率等来决定,如果生物体分子的反应速度的大小大,则优选设为4000×10-18m3以下,在生物体分子的反应速度的大小小等时,也可以设为1000×10-18m3以下、100×10-18m3以下。
微腔26的深度例如可以为10nm以上且100μm以下,也可以为100nm以上且5μm以下,还可以为250nm以上且1μm以下。
微腔26的开口部例如能够设为圆形。设为圆形的情况下的圆的直径例如可以为0.1μm以上且100μm以下,也可以为0.5μm以上且50μm以下,还可以为1μm以上且10μm以下。
所谓有规则是指,例如,从基板的厚度方向观察,各腔在基板上排列成格子状、矩阵状、锯齿状等。所谓有规则,例如意味着,以固定间隔进行排列,使得各腔形成多个列。
所谓高密度,例如,可以是每1平方毫米(1mm2)的腔的数目为0.1×103个以上且2000×103个以下,也可以是1×103个以上且1000×103个以下,还可以是5×103个以上且100×103个以下。若换算为每1cm2(1×10-4[m2]),则可以是10×103个以上且200×106个以下,也可以是100×103个以上且100×106个以下,还可以是0.5×106个以上且10×106个以下。
在高密度微腔阵列20中,多个微腔26还能够形成为深度为100μm以下且换算为圆形时直径成为100μm以下,或者能够形成为深度为2μm以下且换算为圆形时直径成为10μm以下,或者能够形成为深度为1μm以下且换算为圆形时直径成为5μm以下。这样,则能够在基板20的表面形成由疏水性物质以及电极层构成的薄膜,并能够使用在薄膜形成多个微腔26的方法来形成高密度微腔阵列20,能够比较容易地形成高密度微腔阵列20。
微腔26还能够分别在由厚度为包括500mn在内的给定厚度范围的疏水性物质以及电极层构成的薄膜中形成为换算为圆形时直径成为包括1μm在内的给定直径范围。若考虑试验对象的生物体分子的反应速度的大小、生物体分子的含有率,并且也考虑制造的难易度,则认为微腔26的深度、直径优选为几百nm至几μm。在此,“给定厚度范围”例如能够设为500nm的0.1倍的50nm以上且500nm的10倍的5μm以下的范围,或者设为500nm的0.5倍的250nm以上且500nm的2倍的1μm以下的范围。“给定直径范围”例如能够设为1μm的0.1倍的100nm以上且1μm的10倍的10μm以下的范围,或者能够设为1μm的0.5倍的500nm以上且1μm的2倍的2μm以下的范围。
“给定厚度范围”没有特别限定。例如,可以为10nm以上且500nm以下,也可以为20nm以上且500nm以下,还可以为30nm以上且500nm以下。“给定厚度范围”例如可以为10nm以上且100nm以下,也可以为20nm以上且100nm以下,还可以为30nm以上且100nm以下。若减小微腔的深度(几十nm)且减小微腔的容积(几百al程度),则测定灵敏度进一步提高(soga,n.etal.,2015,attolitre-sizedlipidbilayerchamberarrayforrapiddetectionofsingletransporters,scientificreports,5∶11025)。
在一个例子中,每个微腔26在厚度d为1μm的疏水层24和电极23形成为直径r成为5μm。因此,每个微腔26的容量l成为l=π(2.5×10-6)2×1×10-6[m3]≈19.6×10-18[m3]。若假设以纵横2μm的间隔排列了微腔26,则一个微腔26所需的面积s成为一边为7μm的正方形,可计算出s=(7×10-6)2[m2]=49×10-12[m2]。因此,在玻璃基板22,每1em2(1×10-4[m2])形成大约2×106个(每1平方毫米20×103个)微腔26。
脂质双重膜30形成在充满了试验用液体的状态的多个微腔26的开口部,以便对试验用液体进行密封。关于试验用液体,只要是能够形成脂质双重膜30的液体,就没有特别限定,具体地,例如能够设为水溶液。
脂质双重膜30形成为,脂质的亲水基朝向微腔26侧(图2中,下侧)的第一脂质膜32和脂质的疏水基朝向微腔26侧(图2中,下侧)的第二脂质膜34重叠,以使得疏水基成为内侧。作为构成第一脂质膜32、第二脂质膜34的脂质,能够使用来源于大豆、大肠杆菌等的天然脂质、dope(二油酰磷脂酰乙醇胺)、dopg(二油酰磷脂酰甘油)等人工脂质。
脂质双重膜30还能够设为膜蛋白质被进行了重构的脂质双重膜。这样,则能够将高密度微腔阵列20用于经由各种膜蛋白质的生物体分子反应等的检测。关于将膜蛋白质重构为脂质双重膜30的方法将后述。
电极23设置在每个微腔26的内部。各电极23也可以相互电连接。在基板22中,在将设置有疏水层24的一侧设为上方时,满足以下的a)以及b)中的至少任一者。也可以满足a)以及b)双方。
a)电极23设置在每个微腔26的内侧面。
b)电极23作为透明电极而设置在每个微腔26的底面。
在采用了上述a,即,电极设置在微腔的内侧面的结构的情况下,与如上述b那样采用了透明电极的情况相比,通过底面的光的衰减变少,测定灵敏度提高。在上述b中透明电极表面的亲水性低的情况下,液体从微腔流出可能会成为问题,但是在如上述a那样将电极设置在微腔的内侧面的情况下,能够减轻这样的问题。
在图2所示的例子中,电极23设置在每个微腔26的内侧面。电极23也可以由金属构成。作为金属,例如能够使用铜、银、金、铂、铝、铬、氯化银等。电极23也可以由金属以外的材料构成。具体地,例如可以由ito(indium-tin-oxide:氧化铟锡)、izo(由氧化铟锡和氧化锌构成的材料)、zno、igzo(由铟、镓、锌、氧构成的材料)等构成。
电极23的厚度例如可以为10nm以上且100μm以下,也可以为100nm以上且5μm以下,还可以为250nm以上且1μm以下。
在这样的结构中,从基板22的下方向基板22入射的光透射基板22向微腔26的内部进入,并且从微腔26的内部向基板22入射的光透射基板22向基板22的下方逃逸。
通过使用电极23来施加电压,从而能够促进微腔26内的反应。因而,也能够将高密度微腔阵列20应用于检查装置以及培养装置等。
图3是示出第一实施方式涉及的高密度微腔阵列系统的一个例子的概念图。在图3所示的变形例中,高密度微腔阵列20a除了高密度微腔阵列20的结构以外,还在脂质双重膜30的上方具备相反电极27。以下,参照图3,对第一实施方式涉及的高密度微腔阵列系统100进行说明。
如图3例示的那样,高密度微腔阵列系统100具备:基板22、疏水层24、脂质双重膜30、电极23、相反电极27、以及电压施加装置28。关于基板22、疏水层24、脂质双重膜30、以及电极23,如上所述,因此省略详细的说明。
相反电极27是设置在脂质双重膜30的上方的电极。相反电极27可以设置为横跨多个微腔26。相反电极27也可以设置为横跨全部的微腔26。从基板22的厚度方向观察的相反电极27的大小以及形状可以与基板22大致一致。相反电极27可以由金属构成。作为金属,例如能够使用铜、银、金、铝、铬等。从基板22到相反电极27的距离例如可以为1μm以上且10mm以下,也可以为2μm以上且1mm以下,还可以为10μm以上且100μm以下。
相反电极27可以设置为与每个微腔26对应。具体地,例如,在将一对本实施方式涉及的微腔器件(参照图1、图2)粘合为微腔的开口部相互相向的情况下,一个微腔器件的电极成为电极23,另一个微腔器件的电极作为相反电极27。
电压施加装置28在电极23与相反电极27之间施加电压。电压施加装置28例如可以施加直流电压。作为电压施加装置28,具体地,例如能够使用函数发生器(例如,株式会社nf电路设计模块制造)。
通过在电极23与相反电极27之间施加电压,从而能够促进微腔26内的反应。因而,也能够将高密度微腔阵列系统100应用于检查装置以及培养装置等。
[变形例]
图4是示出第一实施方式的变形例涉及的高密度微腔阵列的概略结构的俯视图。以下,参照图4对变形例涉及的高密度微腔阵列20b进行说明。
在图4所示的例子中,高密度微腔阵列20b具备:基板22、疏水层24、脂质双重膜30、以及电极23t。关于基板22、疏水层24、以及脂质双重膜30,如上所述,因此省略详细的说明。
电极23t作为透明电极而设置在每个微腔26的底面。在图4所示的例子中,电极23t构成为覆盖基板22的整面。作为电极23t,可以由ito(indium-tin-oxide:氧化铟锡)、izo(由氧化铟锡和氧化锌构成的材料)、zno、igzo(由铟、镓、锌、氧构成的材料)等构成。
在这样的结构中,从基板22的下方向基板22入射的光也透射基板22以及电极23t而向微腔26的内部进入,并且从微腔26的内部向电极23t以及基板22入射的光也透射电极23t以及基板22而向基板22的下方逃逸。
在本变形例中,关于电极23t的厚度,只要从基板22的下方向基板22入射的光能够透射基板22而向微腔26的内部进入,并且从微腔26的内部向基板22入射的光能够透射基板22而向基板22的下方逃逸,就没有特别限定。
另外,可以将设置在微腔26的内侧面的电极和作为透明电极而设置在底面的电极进行组合而构成为一个电极。具体地,例如,也可以将图1所示的电极23和图4所示的电极23t进行组合而作为一个电极。
[制造方法]
以下,对第一实施方式的高密度微腔阵列20的制造方法进行说明。图5是示出第一实施方式涉及的高密度微腔阵列的制造方法的一个例子的工序图。
关于第一实施方式的高密度微腔阵列20,首先,形成开口部未被脂质双重膜30液封的微腔器件(工序s100),在形成的微腔器件导入试验用液体(工序s110),在试验用液体充满了各微腔26的状态下形成脂质双重膜30,以便对各微腔26的开口部进行液封(工序s120),由此完成。微腔器件的形成(工序s100)例如通过图6所示的工序图进行,脂质双重膜30的形成(工序s120)例如通过图7所示的工序图进行。以下,对微腔器件的形成进行说明,此后,对脂质双重膜30的形成进行说明。
1.微腔器件的形成
微腔器件的形成工序例如能够设为如下,即,在基板22的表面依次形成电极材料和疏水性物质的薄膜,在薄膜表面的要形成多个微腔26的部分以外的部分形成抗蚀剂,通过干蚀刻在疏水性物质的薄膜形成多个微腔26的一部分,将抗蚀剂去除,进而通过以疏水性物质的层作为掩模的湿蚀刻在电极材料的薄膜形成多个微腔26的剩余部分。这样,则能够以高精度比较容易地制造高密度微腔阵列20。另外,当然也可以使用干蚀刻以外的方法,例如,使用纳米压印等方法在疏水性物质的薄膜形成多个微腔26的一部分。
图6是示出第一实施方式中的微腔器件的形成(工序s100)的一个例子的工序图(工序s200~s270)。在图8a~图8h示出微腔器件的形成的各工序的状态。在微腔器件的形成中,首先,作为用于对玻璃基板22的玻璃表面进行清洗的表面处理,将玻璃基板22浸泡在10m的氢氧化钾(koh)溶液中24小时左右(工序s200,图8a)。
接着,通过在玻璃基板22的表面使用真空蒸镀装置来蒸镀金属,从而形成电极层23a(工序s210,图8b)。作为金属的种类,例如,能够使用银、金、铬等。作为厚度,例如能够设为500nm左右。
接着,旋涂疏水性的物质(例如,旭硝子株式会社制造的氟树脂(cytop))而形成物质膜24a,并使物质膜24a与电极层23a的表面密接(工序s220,图8c)。作为旋涂的条件,例如能够使用4000rps(revolutionpersecond,每秒转速)且30秒,在该情况下,物质膜24a的膜厚成为大约500nm。物质膜24a向电极层23a表面的密接例如能够通过用180℃的热板烘烤一小时来进行。
接着,通过旋涂在物质膜24a的表面形成抗蚀剂25a,并使抗蚀剂25a与物质膜24a的表面密接(工序s230,图8d)。作为抗蚀剂25a,能够使用azelectronicmaterials制造的az-4903等。作为旋涂的条件,例如能够使用4000rps(revolutionpersecond,每秒转速)且60秒。抗蚀剂25a向物质膜24a的表面的密接例如能够通过用110℃的热板烘烤5分钟而使抗蚀剂25a内的有机溶剂蒸发来进行。
接着,使用微腔26的图案的掩模对抗蚀剂25a进行曝光,并浸泡在抗蚀剂专用的显影液中进行显影而形成将要形成微腔26的部分去掉的抗蚀剂25b(工序s240,图8e)。关于曝光的条件,例如能够使用如下条件,即,利用san-ei制造的曝光机以uv功率250w进行7秒钟的照射。作为显影的条件,例如能够使用在azelectronicmaterials制造的az显影剂中浸泡5分钟的条件。
接着,对被抗蚀剂25b掩盖的物质膜24a进行干蚀刻,从而做成为从物质膜24a除掉了成为微腔26的部分的物质膜24b(工序s250,图8f),并去除抗蚀剂25b(工序s260,图8g)。干蚀刻例如能够使用samco制造的反应性离子蚀刻装置,作为蚀刻条件,能够使用o250sccm、压力10pa、功率50w、时间30min。抗蚀剂25b的去除能够通过如下方式来进行,即,浸泡在丙酮中,用异丙醇进行清洗,然后用纯水进行清洗。
接着,通过对金属层23a进行湿蚀刻,从而完成微腔26(工序s270,图8h)。湿蚀刻例如能够通过如下方式来进行,即,在将形成中途的微腔器件浸渍到金属蚀刻液中之后,用纯水进行清洗。
通过这样的方法,能够完成在玻璃基板22的表面由疏水层24和电极23形成了多个微腔26的微腔器件。
微腔26的形状、大小只要根据生物体分子的反应速度的大小等而适当决定即可。例如,可以将微腔26形成为深度d为10μm且直径r为40μm,或者也可以将微腔26形成为深度d为2μm且直径r为10μm。作为实用且能够实现的微腔26的最小的尺寸,可认为深度d以及直径r均为几100nm程度。此外,若考虑试验对象的生物体分子的反应速度的大小、生物体分子的含有率,并且也考虑制造的难易度,则可认为,在实用上微腔26的深度、直径优选为几百nm至几μm。因此,只要将微腔26形成为深度成为包含500nm在内的给定深度范围且换算为圆形时直径成为包含1μm在内的给定直径范围。
作为“给定深度范围”,只要认为是包含500nm的量级即可,例如,只要使用500nm的0.1倍的50nm以上且500nm的10倍的5μm以下的范围,或者使用500nm的0.5倍的250nm以上且500nm的2倍的1μm以下的范围即可。
“给定厚度范围”没有特别限定。例如,可以是10nm以上且500nm以下,也可以是20nm以上且500nm以下,还可以是30nm以上且500nm以下。“给定厚度范围”例如可以是10nm以上且100nm以下,也可以是20nm以上且100nm以下,还可以是30nm以上且100nm以下。若减小微腔的深度(几十nm),并减小微腔的容积(几百al程度),则测定灵敏度会进一步提高(soga,n.etal.,2015,attolitre-sizedlipidbilayerchamberarrayforrapiddetectionofsingletransporters,scientificreports,5:11025)。
作为“给定直径范围”,只要认为是包含1μm的量级即可,例如,只要使用1μm的0.1倍的100nm以上且1μm的10倍的10μm以下的范围,或者使用1μm的0.5倍的500nm以上且1μm的2倍的2μm以下的范围即可。
针对生物体分子的反应的检测灵敏度与微腔26内的分子数成反比,因此可认为,用于以高灵敏度检测生物体分子反应的实用且能够实现的微腔26的最大的容量l为4000×10-18[m3]程度。例如,形成深度为5μm且直径r为30μm的微腔(容量l为3532.5×10-18[m3])并进行了实验,得到了针对生物体分子的反应的良好的检测灵敏度。在该情况下,若将相邻的微腔的间隔设为4μm,则一个微腔所需的面积s成为一边为34μm的正方形,可计算出s=(34×10-6)2[m2]=1156×10-12[m2]。因此,在玻璃基板中,每1cm2(1×10-4[m2])形成大约0.86×105个微腔,即使发生生物体分子的反应的频度低,也会在任一个微腔中发生反应,因此能够以高灵敏度检测生物体分子的反应。
2.脂质双重膜30的形成
脂质双重膜30的形成工序例如是如下的工序,即,通过在形成了多个微腔26的面形成大致水平的底面的液体流路48流过试验用液体,从而在多个微腔26填充试验用液体,通过在液体流路48流过含有形成脂质双重膜30的脂质的含脂质有机溶剂,从而在微腔26的开口部形成脂质的亲水基朝向多个微腔26的试验用液体侧的状态的第一脂质膜32,通过在液体流路48流过膜形成用液体,从而以与第一脂质膜32重叠的方式形成脂质的疏水基朝向第一脂质膜32侧的状态的第二脂质膜34,由此形成脂质双重膜30。
图7是示出第一实施方式中的脂质双重膜30的形成(工序s120)的一个例子的工序图(工序s300~s310)。在图9a~9c示出脂质双重膜30的形成的各工序的状态。作为脂质双重膜30的形成的前阶段,一边使隔离器42介于微腔器件间,一边载置形成了液体导入孔46的玻璃板44。由此,形成如下的液体流路48,即,微腔器件的形成了微腔26的面成为大致水平的底面。从液体导入孔46导入试验用液体,用试验用液体充满液体流路48(图9a)。在此,作为试验用液体的组成,例如能够设为水溶液,具体地,例如能够使用含有10mm的ph缓冲液(ph5~9)、20μm的荧光指示试剂(cal520、phrodo等)、以及10mm的氯化钠的液体等各种液体。
在液体流路48被试验用液体充满的状态下,从液体导入孔46导入含有脂质35的有机溶剂(图7的工序s300,图9b)。在此,作为脂质35,能够使用来源于大豆、大肠杆菌等的天然脂质、dope(二油酰磷脂酰乙醇胺)、dopg(二油酰磷脂酰甘油)等人工脂质。作为有机溶剂,能够使用十六烷、三氯甲烷。若导入了含有脂质35的有机溶剂,则在微腔26充满了试验用液体的状态下,由脂质35的亲水基朝向微腔26侧的状态的第一脂质膜32对微腔26的开口部进行液封。
然后,从液体导入孔46导入用于形成脂质双重膜30的膜形成用液体(图7的工序s310,图9c),形成脂质双重膜30。作为膜形成用液体的组成,例如,能够使用包含10mm的ph缓冲液(ph5~9)和10mm的氯化钠的液体。另外,在形成了脂质双重膜30之后,通过将玻璃板44和隔离器42除掉,从而第一实施方式的高密度微腔阵列20得以完成。
还能够在脂质双重膜30的形成工序之后具备在脂质双重膜30重构膜蛋白质的重构工序。这样,则能够得到在脂质双重膜30重构了膜蛋白质的高密度微腔阵列20。这样的在脂质双重膜30重构了膜蛋白质的高密度微腔阵列20能够用于经由膜蛋白质的生物体分子反应等的检测。在设为该方式的情况下,重构工序可以是如下工序,即,将包含膜蛋白质的细胞膜片段、埋入了蛋白质的脂质双重膜、水溶性蛋白质、引入了蛋白质的脂质体、通过界面活性剂进行了可溶化的蛋白质中的任一者导入到脂质双重膜30,在脂质双重膜30嵌入蛋白质而作为膜蛋白质。作为在脂质双重膜嵌入蛋白质的方法,在脂质体的情况下,能够使用膜融合等,在通过界面活性剂进行了可溶化的蛋白质的情况下,能够使用热涨落(熱摇動)等。
根据以上说明的实施方式的高密度微腔阵列20的制造方法,能够比较容易地制造以高密度形成了利用脂质双重膜30进行了液封的容量极小的许多的微腔26的高密度微腔阵列20。
根据第一实施方式的高密度微腔阵列20,因为各微腔26的容量l极小,为19.6×10-18[m3],所以通过将第一实施方式的高密度微腔阵列20用于生物体分子反应的检测,从而能够减少微腔26内的生物体分子数。其结果是,能够增大因一个生物体分子的反应导致的微腔26内的浓度变化的程度,从而能够提高作为浓度变化而进行检测时的检测灵敏度。即使生物体分子的反应极慢,也能够以高灵敏度检测生物体分子的反应。此外,因为做成为以每1cm2(1×10-4[m2])约2×106个这样的高密度形成了许多微小的微腔26的阵列,所以即使生物体分子的反应所发生的频度低,也会在任一个微腔26中发生反应,因此能够以高灵敏度检测生物体分子的反应。
[膜蛋白质的分析方法]
第一实施方式的高密度微腔阵列20能够进一步通过在脂质双重膜30重构膜蛋白质,从而用于膜蛋白质的分析。即,在第一实施方式涉及的膜蛋白质的分析方法中,准备第一实施方式的高密度微腔阵列,并在多个微腔的开口部形成脂质双重膜。使脂质双重膜保持膜蛋白质。在此基础上,通过在电极与设置在脂质双重膜的上方的相反电极之间施加电压,从而使膜蛋白质的性质变化。
作为膜蛋白质的性质,例如,能够包括经由脂质双重膜的物质的输送特性、膜蛋白质的催化剂特性、膜蛋白质的构造等。
首先,对在脂质双重膜30重构膜蛋白质的方法进行说明。作为将蛋白质嵌入到脂质双重膜的方法,在脂质体的情况下能够使用膜融合等,在通过界面活性剂使其可溶化的蛋白质的情况下,能够使用热涨落等。以下,更具体地进行说明。
膜蛋白质的重构能够通过如下方式来进行,即,在将玻璃板44隔着隔离器42载置于微腔器件而形成了液体流路48的状态(参照图9a)下,从玻璃板44的液体导入孔46导入重构在容量为50μl的脂质体的膜蛋白质的溶液,并培养一小时,从而通过膜融合将膜蛋白质嵌入到脂质双重膜30。
如图9a所示,液体流路48形成在疏水层24与配置在疏水层24的上方的顶板之间。液体流路48也可以是厚度恒定的空间。在图9a所示的例子中,顶板是玻璃板44的下表面。
为了高效地形成均匀的脂质膜,需要以恒定的流速流过水溶液以及脂质溶液。通过在微腔的上方配置液体流路,从而能够对全部的微腔同时且均匀地供给流体。由此,能够高效地形成脂质膜。
在形成功能性的脂质膜的情况下,需要将脂质膜薄膜化。对于薄膜化,基于流体的剪切力是有效的。通过配置液体流路,能够在脂质膜上流过水溶液,能够通过该剪切力高效地将脂质膜薄膜化。
通过在流路的顶板部对金属进行图案形成,从而还能够容易地设置相反电极27。例如,可以在玻璃板44的表面形成相反电极27。相反电极27能够利用于膜电位的控制以及其它生物体分子的操作。
作为膜蛋白质的溶液的组成,例如,能够使用包含10nm的fof1(作为膜蛋白质的atp合成酶)、1mm的ph7的mops(3-morpholinopropane-1-sulfonicacid,3-吗啉丙磺酸)、10mm的氯化钠(nacl)、以及2mm的氯化镁(mgcl2)的溶液。
如果如这样在第一实施方式的高密度微腔阵列20的脂质双重膜30重构了膜蛋白质,则能够将第一实施例的高密度微腔阵列20用于经由膜蛋白质的生物体分子反应等的检测。
另外,在脂质双重膜30重构膜蛋白质的方法并不限定于使用脂质体的方法。例如,也可以导入用界面活性剂使其可溶化的膜蛋白质、水溶性蛋白质等而在脂质双重膜30进行重构。例如,在将用界面活性剂使其可溶化的膜蛋白质在脂质双重膜30进行重构的情况下,只要从玻璃板44的液体导入孔46导入容量为50μl的用界面活性剂使其可溶化的膜蛋白质溶液,培养一小时,并通过热涨落将膜蛋白质嵌入到脂质双重膜30即可。作为膜蛋白质溶液的组成,例如,能够使用包含10nm的fof1(作为膜蛋白质的atp合成酶)、0.01~0.1%的n-癸基-β-麦芽糖苷(n-decyl-β-maltoside:界面活性剂)、1mm的ph7的mops(3-morpholinopropane-1-sulfonicacid,3-吗啉丙磺酸)、10mm的氯化钠(nacl)、以及2mm的氯化镁(mgcl2)的溶液。
作为在第一实施方式的高密度微腔阵列20的脂质双重膜30重构膜蛋白质的方法,在将脂质双重膜30形成于微腔器件之前的阶段中,即,在从液体导入孔46导入试验用液体而用试验用液体充满液体流路48的阶段中,作为试验用液体,也可以使用至少使蛋白质可溶化或悬浊化于试验用液体的状态的含蛋白质液体。即,从液体导入孔46作为试验用液体而导入含蛋白质液体,并用该含蛋白质液体充满液体流路48。通过从液体导入孔46依次导入含有脂质35的有机溶剂和用于形成脂质双重膜30的膜形成用液体(也可以是膜形成用水溶液),从而在微腔26中充满了含蛋白质液体的状态下,通过脂质双重膜30对微腔26的开口部进行液封。微腔26被脂质双重膜30液封,微腔26内的含蛋白质液体中的蛋白质通过膜融合、热涨落等而在脂质双重膜30进行重构。另外,作为含蛋白质液体中的蛋白质,能够使用包含膜蛋白质的细胞膜片段、埋入了蛋白质的脂质双重膜、水溶性蛋白质、引入了蛋白质的脂质体、通过界面活性剂使其可溶化的蛋白质等。
根据第一实施方式的高密度微腔阵列,能够通过在电极23与设置在脂质双重膜30的上方的相反电极27之间施加电压,从而使膜蛋白质的性质变化。施加电压例如能够在-300mv~+300mv之间适当地进行调整。
在此,从基板22的下方向基板22入射的光透射基板22以及电极23t而向微腔26的内部进入,并且从微腔26的内部向电极23t以及基板22入射的光透射电极23t以及基板22而向基板22的下方逃逸。膜蛋白质的性质的变化能够通过使用共焦激光显微镜检测容纳在微腔26的内部的试验用液体中包含的荧光物质所发出的光等来进行分析。作为显微镜,可以使用落射型共焦显微镜。
具体地,如图3例示的那样,用分色镜14使从激光光源12射出的光l1反射,并向基板22入射。向基板22入射的光透射基板22而向微腔26进入。微腔26内的荧光物质接收该进入的光而放射不同的波长的光。该放射的光l2向基板22入射,并透射基板22而向基板22的下方逃逸。进而,光透射分色镜14,到达照相机10。另外,也可以在激光光源12与分色镜14之间、以及分色镜14与照相机10之间适当地插入光学系统。
1.第一实验例
在第一实验例中,使用第一实施方式的高密度微腔阵列20a(参照图1、图2、图3)和荧光性膜电位指示试剂进行了膜电位的检测。本实验例的实验条件如下所示。
基板22的材料:无色玻璃
基板22的厚度:0.12mm
基板22的形状:24mm×32mm的矩形
相反电极27的材料:金
相反电极27的形状:18mm×18mm的矩形
从基板22到相反电极27的距离:0.2mm
疏水层24的材料:旭硝子株式会社制造的氟树脂(cytop)
疏水层24的厚度:约500nm
电极23的材料:金
电极23的厚度:约500nm
微腔:直径约5μm、高度约1μm的圆筒形状
脂质双重膜:使用二油酰磷脂酰乙醇胺(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine,dope)与二油酰磷脂酰甘油(1,2-dioleoyl-sn-glycero-3-phosphoglycerol,dopg)的1∶1(重量比)混合物的三氯甲烷溶液形成
试验用液体:包含10mm的ph缓冲液(ph5~9)、20μm的荧光性膜电位指示试剂(dibac4)、以及10mm的氯化钠的水溶液
电压施加装置:函数发生器(株式会社nf电路设计模块制造)
共焦激光显微镜:a1r(nikon公司制造)
荧光性膜电位指示试剂:dibac4(dojindo公司制造)
另外,dibac4是bis-oxonol型的阴离子性膜电位感受性色素,伴随着细胞膜的去极化,向细胞质中的分布增加,且荧光增强。
图10是示出第一实验例中的施加电压(虚线)和荧光强度(实线)的变化的图。关于施加电压,以电极23为基准(0v),由相反电极27的电位示出(在其它实验例中也同样)。如图10所示,dibac4的荧光强度跟随施加电压而变化。可知,荧光强度的变化比施加电压的变化慢一些。根据本实验例的结果可知,如果使用第一实施方式的高密度微腔阵列,则能够通过向电极施加电压来控制膜电位(去极化以及过极化)。
2.第二实验例
在第二实验例中,在与第一实验例同样的高密度微腔阵列20a(参照图1、图2、图3)中,作为膜蛋白而将来源于大肠杆菌的f型atp合成酶(fof1)使用脂质体导入到脂质双重膜30,并检测了质子的主动输送。
作为微腔26的内侧的试验用液体,使用了组成包含10μm的tricine缓冲液(ph8)、10mm的氯化钠(nacl)、10mm的氯化钙(cacl2)、2mm的氯化镁(mgcl2)、1μm的腺苷二磷酸(adp:adenosinediphosphate)、以及20μm的荧光ph指示试剂(rhp-m)的水溶液。
作为微腔26的外侧的液体,使用了包含10μm的mops(3-morpholinopropanesulfonicacid)缓冲液(ph8)、10mm的氯化钠(nacl)、10mm的氯化钙(cacl2)、2mm的氯化镁(mgcl2)、以及240μm的腺苷三磷酸(atp:adenosinetriphosphate)的水溶液。
关于其它装置结构,设为与第一实验例相同,因此省略详细的说明。
图11是示出第二实验例中的荧光强度的时间变化与膜电位的关系的图。图12是示出第二实验例中的f型atp合成酶的质子输送速度(纵轴)与膜电位的大小(横轴)的关系的图。
如图11所示,可知膜电位越高,荧光强度的变化越快,质子输送速度越高。
(第二实施方式)
在第二实施方式中,通过在电极流过电流,从而对微腔的内部进行加热。
第二实施方式涉及的高密度微腔阵列是第一实施方式涉及的高密度微腔阵列,进而,电极为金属,并设置在每个微腔的内侧面。
在上述高密度微腔阵列中,金属可以是铬。
第二实施方式涉及的高密度微腔阵列系统具备:上述任一个高密度微腔阵列;以及通过在电极内与基板平行地流过电流而使电极发热的电流施加装置。
上述高密度微腔阵列系统也可以进一步具备:设置在脂质双重膜的上方的相反电极;和在电极与相反电极之间施加电压的电压施加装置。
在第二实施方式涉及的方法中,准备上述任一个高密度微腔阵列,并通过在电极流过电流而使电极发热,从而对密封在微腔内的试验用液体的温度进行控制。
[装置结构]
图13是示出第二实施方式涉及的高密度微腔阵列系统的概略结构的一个例子的图。以下,参照图13对第二实施方式的高密度微腔阵列系统200的装置结构进行说明。
如图13例示的那样,高密度微腔阵列系统200具备:基板22、电极23、疏水层24、微腔26、脂质双重膜30、以及电流施加装置29。
基板22、疏水层24、微腔26、以及脂质双重膜30能够与第一实施方式同样地构成,因此省略详细的说明。
关于电极23,只要能够作为发热体使用,则可以由任何材料构成。具体地,例如,电极23可以由金属构成。更具体地,例如,电极23可以由铬构成。
或电极23能够使用为发热体,并且可以由难以受到由试验用液体造成的变质的材料构成。具体地,例如,电极23可以由铬构成。
在图13所示的例子中,与多个微腔26对应的电极23相互电连接。即,与图1所示的疏水层24同样地,电极23也可以连续地构成为包围多个微腔26。在这样的结构中,能够统一对多个微腔26进行加热。
电流施加装置29通过在电极23内与基板22平行地流过电流,从而使电极23发热。作为电流施加装置29,具体地,例如能够使用函数发生器(株式会社nf电路设计模块制造)。
[方法]
在第二实施方式的方法中,使用电流施加装置29在电极23流过电流,从而使电极23发热,由此能够对密封在微腔26内的试验用液体、脂质双重膜30、膜蛋白等的温度进行控制。
通过使用电极23来控制试验用液体、脂质双重膜30、膜蛋白等的温度,从而能够分析更多样的条件下的膜蛋白质的行为。
在第二实施方式中,也能够进行与第一实施方式同样的变形。例如,高密度微腔阵列系统200也可以除了电流施加装置29以外还具备电压施加装置28。关于电压施加装置28,能够与第一实施方式同样地构成,因此省略详细的说明。
(第三实施方式)
在第三实施方式中,在用脂质双重膜密封的微腔的内部聚集生物体高分子。
第三实施方式涉及的高密度微腔阵列是第一实施方式以及第二实施方式中的至少任一者涉及的高密度微腔阵列,在微腔的内部聚集有生物体高分子。
在第三实施方式涉及的方法中,准备高密度微腔阵列,该高密度微腔阵列构成为,具备:具有透光性的平坦的基板;以及疏水层,其是设置在基板上且由疏水性物质构成的层,多个微腔的开口部被设置成在该层的主面上有规则且高密度地排列,微腔的容量为4000×10-18m3以下,该高密度微腔阵列在每个微腔内设置有电极,在基板中,在将设置有疏水层的一侧设为上方时,通过满足下述a)以及b)中的至少任一者,从而从基板的下方向基板入射的光透射基板而向微腔的内部进入,并且从微腔的内部向基板入射的光透射基板而向基板的下方逃逸,在该方法中,通过在电极施加电压,从而在多个微腔的内部聚集生物体高分子,此后,在多个微腔的开口部形成脂质双重膜,以便对生物体高分子进行密封。
a)电极设置在每个微腔的内侧面。
b)电极作为透明电极而设置在每个微腔的底面。
[装置结构]
图14是示出在第三实施方式中聚集了生物体高分子的高密度微腔阵列的概略结构的一个例子的图。以下,参照图14对第三实施方式的高密度微腔阵列300的装置结构进行说明。
如图14例示的那样,高密度微腔阵列300具备:基板22、电极23、疏水层24、微腔26、以及脂质双重膜30。
基板22、电极23、疏水层24、以及脂质双重膜30能够与第一实施方式以及第二实施方式中的至少任一者同样地构成,因此省略详细的说明。
在微腔26的内部聚集有生物体高分子36。所谓生物体高分子,例如包括蛋白质、dna、rna等。
[制造方法]
以下,对第三实施方式的高密度微腔阵列300的制造方法进行说明。图15是示出第三实施方式中的生物体高分子聚集高密度微腔阵列的制造方法的一个例子的工序图。
关于第三实施方式的高密度微腔阵列300,首先,形成开口部未被脂质双重膜30液封的微腔器件(工序s400),在形成的微腔器件导入试验用液体(工序s410),在各微腔聚集生物体高分子(工序s420),在试验用液体充满各微腔26且生物体高分子聚集在各微腔26的状态下,形成脂质双重膜30,以便对各微腔26的开口部进行液封(工序s430),由此完成。
工序s400能够设为与图5的工序s100相同,因此省略详细的说明。
工序s410能够设为与图5的工序s110或图9a相同,因此省略详细的说明。
工序s430能够设为与图5的工序s120或图9b~图9c相同,因此省略详细的说明。
在工序s420中,例如使用电极23将生物体高分子36引导到微腔26的内部。生物体高分子36也可以具有电荷。在该情况下,通过使电极23带电为与生物体高分子36相反的极性,从而能够将生物体高分子36向微腔26引导。
生物体高分子36也可以通过介电电泳而引导到微腔26。在介电电泳中,即使是电中性的粒子,也能够通过施加不均匀的电场而使粒子极化,从而使其移动。介电电泳根据流体与粒子的介电常数的关系、以及电场的空间梯度来产生。在使用介电电泳的情况下,即使在生物体高分子36不具有电荷的情况下,也能够向微腔26引导生物体高分子36。在本实施方式中,因为电场集中在腔的开口部,所以能够向腔内部引导物质。
在第三实施方式中,能够在用脂质双重膜30密封的微腔26的内部聚集生物体高分子36。因而,在对生物体高分子36彼此的相互作用、保持于脂质双重膜30的膜蛋白与生物体高分子36的相互作用等进行分析方面是有利的。
(第四实施方式)
在第四实施方式中,通过细胞融合向脂质双重膜导入膜蛋白质。
在第四实施方式的方法中,准备具有相反电极的第一实施方式至第三实施方式中的至少任一个高密度微腔阵列,通过在电极与相反电极之间施加电流而使细胞融合到脂质双重膜,由此使来源于细胞的膜蛋白质向脂质双重膜转移。
第四实施方式的方法在第一实施方式至第三实施方式中的至少任一个方法中包括在脂质双重膜的上方设置相反电极的步骤,膜蛋白质可以是如下膜蛋白质,即,是通过在电极与相反电极之间施加电流,从而使细胞融合于脂质双重膜,由此导入到脂质双重膜的、来源于细胞的膜蛋白质。
图16a是示出在第四实施方式的使细胞向脂质双重膜融合的方法中在液体流路导入细胞的工序的图。图16b是示出在第四实施方式的使细胞向脂质双重膜融合的方法中细胞向脂质双重膜融合的状态的图。以下,参照图16a以及图16b对第四实施方式的方法进行说明。另外,在图16a以及图16b中,对于与图3共同的构成要素,能够设为与第一实施方式同样的结构,因此标注相同的附图标记以及名称,并省略详细的说明。
使用了细胞融合技术的、膜蛋白质54向脂质双重膜30的导入例如能够如以下那样执行。即,将玻璃板44隔着隔离器42载置于微腔器件而形成液体流路48。在该状态下,从玻璃板44的液体导入孔46导入包含具有膜蛋白质54的细胞52的溶液(图16a),并在电极23与相反电极27之间使用电流施加装置28(省略图示)施加脉冲状的直流电流,由此通过细胞融合将膜蛋白质54嵌入到脂质双重膜30(图16b)。作为溶液的组成,例如能够使用包含10nm的fof1(atp合成酶)、1mm的ph7的mops(3-morpholinopropane-1-sulfonicacid,3-吗啉丙磺酸)、10mm的氯化钠(nacl)、以及2mm的氯化镁(mgcl2)的溶液。
如果在第一实施方式至第三实施方式中的任一个高密度微腔阵列的脂质双重膜30重构了膜蛋白质54,则能够将高密度微腔阵列用于经由膜蛋白质的生物体分子反应等的检测。膜蛋白质54能够从细胞52直接向脂质双重膜30导入,因此能够简化操作。因为能够直接对细胞52所具有的膜蛋白质54进行分析,所以还能够对细胞所表达的未知的膜蛋白质进行分析。
在细胞融合中,脂质双重膜中的内(细胞质侧)和外(细胞外基质侧)被保存。因而,通过利用细胞融合,从而能够适当地控制向脂质双重膜30导入的膜蛋白质54的取向。如果从微腔26的外部向脂质双重膜30融合细胞,则微腔26的内部成为细胞质侧。如果在微腔26的内部聚集细胞并从微腔26的内部向脂质双重膜30融合细胞,则微腔26的内部成为细胞外基质侧。
根据上述说明,对于本领域技术人员而言,本发明的许多的改良、其它实施方式是清楚的。因此,上述说明应仅作为例示来解释,是以对本领域技术人员启示执行本发明的最佳的方式作为目的来提供的。在不脱离本发明的精神的情况下,能够对其构造和/或功能的细节进行实质性变更。
附图标记说明
10:照相机;
12:激光光源;
14:分色镜;
20:高密度微腔阵列;
22:基板;
23:电极;
23a:电极层;
24:疏水层;
24a:物质膜;
24b:物质膜;
25a:抗蚀剂;
25b:抗蚀剂;
26:微腔;
27:相反电极;
28:电压施加装置;
29:电流施加装置;
30:脂质双重膜;
32:第一脂质膜;
34:第二脂质膜;
35:脂质;
36:生物体高分子;
42:隔离器;
44:玻璃板;
46:液体导入孔;
48:液体流路;
52:细胞;
54:膜蛋白质;
100:高密度微腔阵列系统;
200:高密度微腔阵列系统;
300:高密度微腔阵列。
- 还没有人留言评论。精彩留言会获得点赞!