电化学不对称双羟化反应合成手性非环核苷类化合物的方法
1.本发明具体涉及了电化学不对称双羟化反应合成手性非环核苷类化合物的方法,属于有机化学中电化学不对称合成领域。
背景技术:
2.非环核苷化合物具有重要的抗病毒活性,例如r-布昔洛韦、s-西多福韦、d-香菇嘌呤等。通过构效关系研究发现这些化合物侧链均具有手性邻二羟基官能团。
3.目前此类化合物的合成主要有两种途径:第一种途径为传统手性池的方法,即以手性化合物为原料通过多步合成构建非环核苷,该方法一般存在反应步骤长,操作繁琐,收率较低等缺点;第二种途径为不对称催化的方法,即利用手性催化剂参与不对称反应,该方法存在底物范围窄、重金属残留、环境不友好等缺点。
4.因此,开发更加简单高效和绿色不对称合成方法构建此类非环核苷类化合物仍是非常必要的。
技术实现要素:
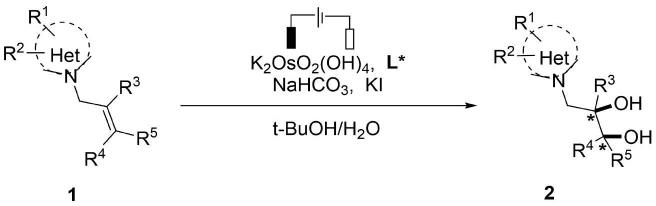
5.为了克服上述缺陷,公开了电化学不对称双羟化反应合成手性非环核苷类化合物的方法。以n9-烯丙基核苷碱基为原料,在催化剂k2oso2(oh)4和叔胺类奎宁配体存在下,碘化钾和碳酸氢钠/碳酸氢钾分别为反应媒介和碱,叔丁醇和水混合溶剂中,采用未分割电解池,碳毡和铂片分别为阳极和阴极,通过恒电流电解反应,得到系列侧链含邻二羟基手性非环核苷化合物,反应收率和对映选择性中等至优秀,收率和对映选择性最高分别可达97%和99%。该方法为合成侧链含有邻二羟基的手性非环核苷类化合物提供了一种简便、高效、绿色的途径。
6.本发明所述电化学不对称双羟化反应合成手性非环核苷类化合物的方法,包括以下步骤:
[0007][0008]
以n9-烯丙基取代核苷碱基1为原料,在催化剂k2oso2(oh)4和叔胺类奎宁配体l*存在下,碘化钾和碳酸氢钠/碳酸氢钾分别为反应媒介和碱,叔丁醇和水混合溶剂中,采用未分割电解池,碳毡和铂片分别为阳极和阴极,进行恒电流电解,得到侧链含有邻二羟基非环核苷化合物2。
[0009]
进一步地,在上述技术方案中,het选自嘌呤、嘧啶或苯并咪唑;r
1-r2选自氢、卤素、c1-c4烷基、c1-c4烷氧基、苄氧基、苯基、萘基、c1-c4烷胺基、叔丁氧羰基胺基、苯甲酰胺基;r3-r5选自:氢、c1-c4烷基、苯基。
[0010]
进一步地,在上述技术方案中,所述叔胺类奎宁配体l*选自:
[0011][0012]
在最优选条件下,所述叔胺类奎宁配体l*为l4。
[0013]
进一步地,在上述技术方案中,反应溶剂为叔丁醇和水等体积混合溶剂。
[0014]
进一步地,在上述技术方案中,所述n9-烯丙基核苷碱基、二水合锇酸钾、叔胺类奎宁配体、碘化钾与碳酸氢钠/碳酸氢钾摩尔比为1:0.001-0.002:0.05-0.10:0.2-0.5:2-3。
[0015]
进一步地,在上述技术方案中,反应温度为0-30℃。
[0016]
进一步地,在上述技术方案中,未分割电解池中阳极为碳毡电极,阴极为的铂电极,4ma恒电流电解。
[0017]
发明有益效果:
[0018]
1、本方法原料廉价易得,反应条件温和,对环境友好,产物结构多样化,为合成侧链含有邻二羟基手性非环核苷化合物提供了一条简洁、高效、绿色的合成方法,反应收率(高达97%)和对映选择性(高达99%)良好。
[0019]
2、采用电化学电子代替对环境有污染氧化剂或还原剂,完全符合绿色化学的理念。将电化学和简洁高效的不对称双羟化反应有效结合构建有高对映选择性侧链含有邻二羟基的手性非环核苷,有着显著的意义。
具体实施方式
[0020]
实施例1
[0021][0022]
(m+h)
+
requires 305.0800,found 305.0801.
[0027]
实施例2
[0028][0029]
在25ml茄形瓶中,依次加入k2oso2(oh)4(0.4mg,0.001mmol)、l4(77.9mg,0.1mmol)、ki(82.9mg,0.5mmol)、nahco3(252.0mg,3.0mmol)和20ml水/叔丁醇(1:1),室温下搅拌均匀,待固体全部溶解,加入n9-烯丙基嘌呤化合物1l(312.1mg,1mmol),将碳毡电极(1.5*1.5cm2)与铂电极(1.5*1.5cm2)平行放置,浸于反应体系中,采用4ma电流进行电解。tlc跟踪反应完全,终止反应,真空浓缩,经柱层析得到化合物2l,收率89%,98%ee。chiralcel ia,n-hexane/2-propanol=80/20,0.6ml/min,256nm,retention time:20.1min,21.1min;tlc:rf=0.35(dcm/meoh=20:1);1h nmr(400mhz,cd3od)δ8.78(s,1h),8.54-8.52(m,2h),8.20(s,1h),7.51-7.46(m,5h),7.24-7.13(m,3h),4.76-4.67(m,2h),3.85(d,j=11.2hz,1h),3.74(d,j=11.6hz,1h);
13
c nmr(100mhz,cd3od)δ155.6,154.2,152.7,148.2,142.7,136.5,132.0,131.1,130.8,129.5,129.1,128.5,126.8,77.6,68.5,51.5;hrms(esi-tof)m/z calcd for c
20h18
n4o2(m+h)
+
requires 347.1503,found 347.1504.
[0030]
实施例3
[0031][0032]
在25ml茄形瓶中,依次加入k2oso2(oh)4(0.4mg,0.001mmol)、l4(77.9mg,0.1mmol)、ki(82.9mg,0.5mmol)、nahco3(252.0mg,3.0mmol)和20ml水/叔丁醇(1:1),室温下搅拌均匀,待固体全部溶解,加入n9-烯丙基嘌呤化合物3a(270.1mg,1mmol),将碳毡电极(1.5*1.5cm2)与铂电极(1.5*1.5cm2)平行放置,浸于反应体系中,采用4ma电流进行电解。tlc跟踪反应完全,终止反应,真空浓缩,经柱层析得到化合物4a,收率90%,》20:1dr,97%ee。chiralcel od-h,n-hexane/2-propanol=70/30,0.8ml/min,256nm,retention time:9.1min,10.7min;tlc:rf=0.31(dcm/meoh=20:1);1h nmr(600mhz,cd3od)δ8.66(s,1h),8.46(s,1h),7.44(d,j=7.8hz,2h),7.34-7.24(m,3h),4.70(d,j=4.8hz,1h),4.42(dd,j=14.4,3.0hz,1h),4.29-4.25(m,1h),4.19-4.16(m,1h);
13
c nmr(150mhz,cd3od)δ153.3,152.7,150.9,149.2,142.6,132.0,129.3,128.7,128.0,76.2,74.1,48.6;hrms(esi-tof)m/z calcd for c
14h13
cln4o2(m+h)
+
requires 305.0800,found 305.0791.
[0033]
实施例4
[0034]
根据实施例2-3中反应条件,仅仅将反应底物进行改变,得到如下反应结果:
[0035][0036][0037]
实施例5
[0038][0039]
在100ml未分割电解池中,加入k2oso2(oh)4(1.472mg,0.004mmol)、l4(311.6mg,0.4mmol)、ki(331.6mg,2.0mmol)、nahco3(1.008g,12mmol)和20ml水/叔丁醇(1:1),室温下搅拌均匀,待固体全部溶解,加入n9-烯丙基嘌呤化合物1a(1.080g,4.0mmol),将碳毡电极(1.5*1.5cm2)与铂电极(1.5*1.5cm2)平行放置,浸于反应体系中,采用4ma电流进行电解。tlc跟踪反应,终止反应,真空浓缩,经柱层析得到950.0mg白色固体2a,收率78%,96%ee。
[0040]
以上实施例描述了本发明的基本原理、主要特征及优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原
理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1