在癌症诊断中的血小板生物标记物的制作方法
本发明总体上涉及癌症诊断领域。更特别地,具体实施方式涉及应用于癌症诊断中的血小板生物标记。
背景技术:
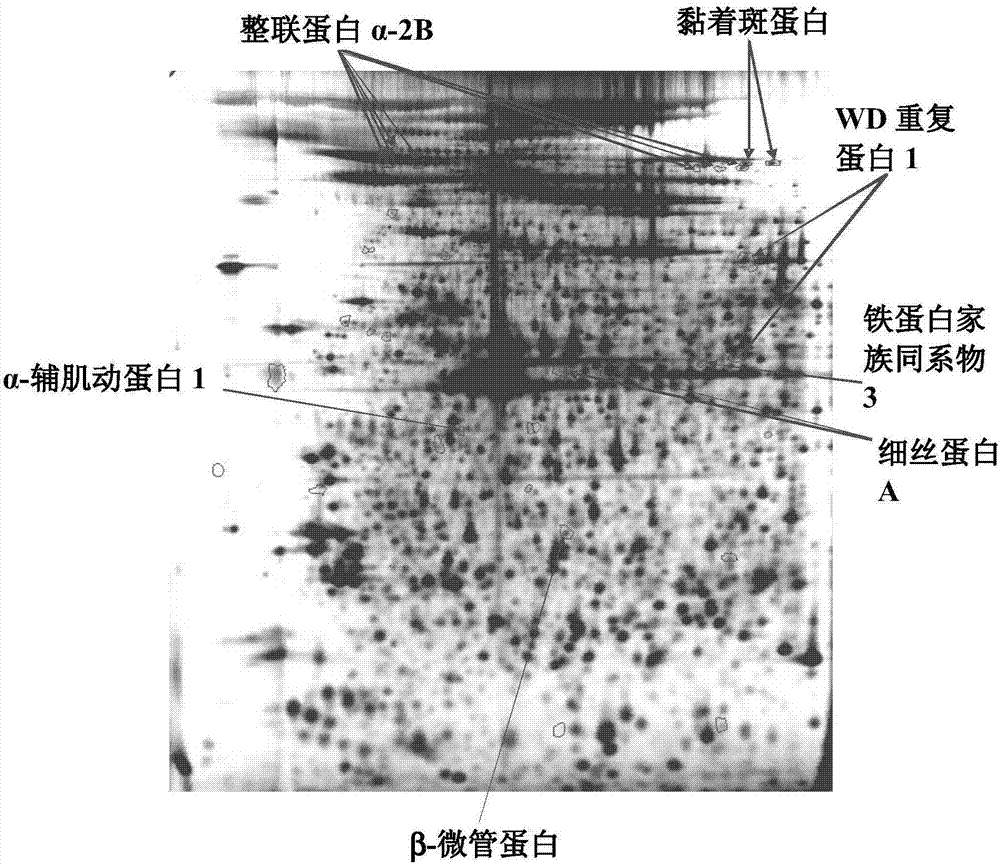
:癌症,在医学上被称为“恶性新生物”,是一组广泛的涉及非正常细胞生长的疾病。在癌症中,细胞不受控制地分化和生长、形成恶性肿瘤,并侵入附近的身体部分。癌症也可通过淋巴系统或血流扩散到身体的更远部分。并非所有肿瘤都是致癌的;良性肿瘤不会入侵邻近组织,也不会扩散到全身。有超过200种不同的已知癌症会感染人类。癌症可以多种方式而被检测,包括存在特定信号和症状、筛选测试或者医疗成像。一旦检测到可能的癌症,通常通过显微镜检查来自活组织检查的组织样本来诊断。越早检测和诊断癌症是非常重要的,当癌症开始治疗的后果和幸存,特别是当它成为高恶性肿瘤时。癌,在本领域通常也指上皮癌,是在人类中发生最普遍类型的恶性新生物(癌症),它是来源于推定上皮细胞的肿瘤组织,这些细胞的基因组已经被改变或损伤至这样的程度,即这些细胞变成已改变的,并开始展现不正常的恶性特性。癌能通过活组织检查来诊断,包括细针抽吸活检(FNA)、针芯活检或者外科活检。通过病理医生的显微镜检查是必要的以便鉴定细胞的或组织的人工特性以及组织特异性生物标记物模式。增加的证据表明:可能癌症的诊断活检可能诱导肿瘤细胞浸染和逐步向远处转移。因此,有迫切需要通过不使肿瘤组织受伤导致癌症扩散的诊断方法来替代危险的肿瘤组织采样活检方法,但该替代方法仍然具有早期检测和诊断癌症的可能性。因此,对于病人的友好、简单和无风险的癌症和癌症状况的检测和诊断是急需的。特别对于大多数高恶性肿瘤、卵巢癌、胰腺癌和结直肠癌,非常希望能够进行早期的非侵入式诊断以挽救生命。同时,能够以非侵入式方法诊断恶性前列腺癌,这是非常有利的,因为采取前列腺活检是特别困难的。所有这些癌症都是典型分类的癌,也就是上皮细胞来源的癌症。卵巢癌是一种从卵巢出现成长的癌,其中疑似癌症需要以外科手术来确认,该外科手术检查异常的腔、在异常流体中组织活检和检测癌症细胞。这些方法都是麻烦的和对于病人有风险的。由于无临床症状的发展,卵巢癌通常是在晚期才被诊断出来,预后较差。容易执行的测试能确认癌症和癌症状况,因此这是非常有利于卵巢癌的诊断。大多数卵巢癌是被分类为“上皮的”和从卵巢的上皮中发生。上皮卵巢癌(EOC)是所有妇科的恶性的致命癌症——EOC无症状地发展,在大多数例子中,在晚期阶段才能被检测到。由于它在异常腹腔中对于无症状生长和扩增的声名狼藉的能力,医疗效果是很难获得的。对于EOC的肿瘤标志物(例如CA-125)是在今天临床应用。由于低特异性,他们仅被用作支持信息与超声和物理检查一起的支持信息,但提供了有限的灵敏性。测量在卵巢癌的治疗期间,或者CA-125的水平具有在监控过程中更大的值。例如,在一个研究中,CA-125是被用于展示具有盆腔肿块的病人的评估。升高的CA-125水平具有72%灵敏性和78%特异性(72%的正预测值以及78%的负预测值)。然而,在另一个研究中,对于,对于早期卵巢癌的术前灵敏度仅为40%(SkatesSJ等人,当结合癌症抗体CA-125II、CA15-3、CA72-4时,对于早期卵巢癌的术前灵敏度和特异性)以及采用多元的正常分布的混合物的巨噬细胞集落刺激因子。疑似肿瘤病变的术前活检和其他断裂受伤是强烈忌用的,因为EOC的扩展的高风险。取代的是妇科专家的超声波法,它是在附件包块的评估中选择的方法。然而,在许多例子中,即使有经验的医疗检查者不能提供结论性答案。为了达到显著的进步,迫切需要改善EOC前期检测的转置,以及后续检测,区分良性和恶性肿瘤的装置,作为对于不同优化的治疗的前提条件。血小板增多症是一种在癌症预后病人中的常用观察因素,它也已经特别地关联于较差的预后以及关联于非晚期EOC的手术病人。也有增加的、引人注意的证据表明:血小板除了参与止血之外,还能影响血管生成和免疫反应,因而对肿瘤发展产生决定性的贡献。血小板的蛋白质组学分析已经表明:血管生成因子能被血小板隔离,然后特别地释放并输送到在早期肿瘤中激活的上皮位点。所谓“转移性/恶性血小板表型”能以不同的新诊断的恶性疾病的方式在病人中被观察到。前列腺癌是一种在前列腺上皮组织中发生的癌症。目前,前列腺癌是采用前列腺特异抗原(PSA)来诊断的。这仅仅是一种指示方法,而不是对于恶性肿瘤的特异性方法。由于这样的事实,总是需要采取多重组织活检来确证诊断。对于病人,采取组织活检是不舒服的,有报道认为也会带来严重的副作用。有些病人不得不在活检当天到急诊室以治疗由于活检带来的副作用。无力也是一种相当频繁的副作用。最危险的长期副作用是:癌症细胞在活检期间从前列腺渗漏出来。这些癌症细胞能扩散并潜在地导致癌转移。在前列腺癌中,约70%是低恶性的,不需要立即或积极治疗。因此,既能指示癌症,又能区分高恶性和低恶性的测试是很受欢迎的。本发明的保护范围就是提供这样的实现这些标准的测试。前列腺癌的全球发病量是约每年900,000例。如果所有这些病例能采用本发明所述的测试而被检测出来,每年约有600,000人不需要采用不舒服的和潜在损伤的活检来进行测试。因此,不需要活检的前列腺诊断方法是令人期待的。胰腺癌是一种源于在形成胰腺的组织中转化细胞的恶性新生物。最普遍形式的胰腺癌,占这些肿瘤的95%,是在胰腺的外分泌部分内发生的腺癌(在光学显微镜上具有腺结构的肿瘤)。少数产生于胰岛细胞,分类为神经内分泌肿瘤。最终导致诊断的体征和症状取决于肿瘤的位置、尺寸和组织类型,可包括腹部疼痛、下背痛,以及黄疸(如果肿瘤发展到胆管)、无法解释的体重减轻,以及消化问题。胰腺癌是美国第四大最常见的致死性癌症,也是世界第八大致死性癌症。胰腺癌具有极差的预后:对于合并的所有阶段,1年和5年相关生存率分别是25%和6%;对于本地疾病,5年存活率是约15%,而对于局部晚期疾病和对于转移性疾病的平均生存率,对于80%的个体的统计表明,分别是约10个月和6个月。然而,个体变化,一些被诊断出来的病人已经在疾病末期,因此只有几天或几星期的存活时间。其他具有较慢的发展,即使不外科手术也可生存两年。相比于女性,男性有30%的可能会患上胰腺癌。胰腺癌是一种全球性高致命性恶性肿瘤,因此有迫切需求改进早期检测的筛选工具。在早期阶段的胰腺癌诊断是极为重要的,因为在早期肿瘤阶段的成功手术是目前仅有的治愈治疗方法。只有10-30%的胰腺癌病人能进行手术倾向治愈,而这些人中仅有一半实际接受R0切除术。R0切除术后的病人的期望5年存活率在额外的辅助化疗下是约4-26%。对于早期检测的诊断测试是很受欢迎的。挑战是寻找:在癌症在体内开始与他太晚开始治疗之前之间是否有时间窗口。如果这个时间窗口足够大,则诊断方法是极有价值的。由于疾病的高恶性和攻击性,非常期待找到一种早期诊断胰腺癌的方法,优选是不需要采取活检的危险方法。结直肠癌也被称为结肠癌、直肠癌或肠癌,是在结肠或直肠(大肠的一部分),或在阑尾中生长的不受控细胞产生的癌症。遗传性分析表明,结肠癌和直肠癌在遗传学上是相同的癌症。结肠癌的症状通常包括直肠出血和贫血,它们有时与体重减轻和在肠习性上的改变有关联。大多数结肠癌时由于生活习惯和年龄增长而发生,仅有少数病例是与遗传疾病相关联。它通常开始于肠的内膜,如果不注意治疗,能发展进入下面的肌肉层,然后穿过肠壁。筛查对于减少结肠癌的死亡机会是有效的,并推荐在50岁开始筛查,持续到75岁。局部肠癌通常是通过乙状结肠镜或结肠镜检查来诊断。局限在肠壁内的癌症通常是可手术治愈的,而已经扩散到全身的癌症通常是不能治愈的,管理的焦点在于通过化疗和改善生活质量来延长病人的寿命。结直肠癌是世界上第三大最普遍的可诊断癌症,但它在发达国家更普遍。约60%的病例是在发达国家诊断出来的。据估计,全球在2008年有123万新的结直肠癌病例被临床诊断,并使608,000死亡。在大多数频繁恶性肿瘤中肠癌级别是第四大全球致死性癌症。对于介入治疗,在早期阶段对肠癌的检测是极为重要的:虽然国际抗癌联盟(UICC)宣称对于I期肿瘤的5年无疾病存活率超过90%,但在UICC的III期的存活率下降为63%,而在UICC的IV期的存活率是<5%。不论目前筛查程序如何实施,约50%的这些恶性肿瘤是在晚期肿瘤阶段才被检测到的。目前,结直肠癌是采用影像技术结合结肠镜检查来诊断的。在市场上有一些可用的生物标记物测试,但这些生物标记物测试不能足够好得用于临床诊断。因此,人们非常期望找到一种早期诊断胰腺癌的方法,优选是不需要承受组织活检的风险方法。因此,总体上需要开发一种技术,使能够早期检测癌症,因为它能够更有效地对病人进行治疗,以及带来更高的生存率。而且,如果该技术能被用于确定癌症的进展,也就是,如果它是在早期或晚期发现,这是更有利的,因为,早期通常是局部的,晚期通常是散布为恶性,它们需要不同的治疗选择,并具有不同的预后特征。美国专利US8,173,433描述了一种临床症状的早期检测,它具有在全身血管生成活性上关联的改变,特别是癌症、免疫状况、感染和与妊娠和流产有关的事件。技术实现要素:本发明的总体目标是提供一种能被用于癌症诊断的改进技术。它的特别目的是提供一种能替代用于癌症诊断的组织活检的改进技术。这些和其他目标将通过这里所揭示的具体实施方式来阐述。具体实施方式的一个方面涉及一种确定对象是否患有良性病变或者癌病变的方法。该方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物。所述至少两种血小板来源的生物标记物是选自:α-辅肌动蛋白1(ACTN1)、α-辅肌动蛋白4(ACTN4)、Crk样蛋白(CRKL)、内质网蛋白29(ERP29)、FERM蛋白、纤维蛋白原γ链(FIBG)、细丝蛋白A(FLNA)、凝溶胶蛋白(GELS)、线粒体应激70蛋白(GRP75)、HP蛋白、热冲击蛋白70kDa(HSP70)、热冲击蛋白71kDa(HSP71)、整联蛋白α-2b(ITGA2B)、整联蛋白β-3(ITB3)、核糖核酸酶抑制因子(RINI)、原癌基因蛋白酪氨酸激酶Src(SRC)、微管蛋白(TBA)、微管蛋白α-4A链(TBA4A)、3-巯基丙酮酸硫转移酶(THTM)、踝蛋白-1(TLN1)、微管蛋白β-1链(TUBB1)、黏着斑蛋白(VCL)和WD重复蛋白1(WDR1)。该方法还包括:基于所述测量而确定所述对象是否患有良性病变或者癌病变。具体实施方式的另一个方面涉及一种预测在对象中是否存在良性病变和/或癌病变的方法。该方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物。所述至少两种血小板来源的生物标记物是选自:二(5’核苷)四磷酸酶(AP4A)、F-肌动蛋白的蛋白质亚基α-1(CAZA1)、细胞质特异性肽(CNDP2)、糖蛋白IX(GPIX)、白细胞弹性蛋白酶抑制物(ILEU)、cAMP依赖性蛋白激酶亚基RII-β(KAP3)、抑制素(PHB)、内啡肽-B1(SHLB1)、丝氨酸蛋白酶抑制蛋白B6(SPB6)和原肌球蛋白α-1(TMP1)。该方法还包括:基于所述测量预测在所述对象中是否存在良性病变和/或癌病变。具体实施方法的进一步方面涉及一种预测在对象中是否存在结直肠癌或者胰腺癌的方法。该方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物。所述至少两种血小板来源的生物标记物是选自:β-肌动蛋白(ACTB)、α-辅肌动蛋白1(ACTN1)、半胱天冬酶3(CASP3)、丝切蛋白1(CFL1)、丛生蛋白(CLU)、法尼基焦磷酸合成酶(FPPS)、凝溶胶蛋白(GELS)、谷胱甘肽S-转移酶Ω-1(GST01)、热冲击蛋白HPS90-β(HSP90AB1)、卤酸脱卤酶样包含水解酶结构域蛋白2(HDHD2)、整联蛋白α-2b(ITGA2B)、整联蛋白β-3(ITB3)、整联蛋白α-6(ITGA6)、半乳凝集素(MLEC)、抑制素(PHB)、核糖核酸酶抑制因子(RINI)、α-突触核蛋白(SNCA)、丝氨酸蛋白酶抑制蛋白B6(SPB6)、微管蛋白α-4A链(TBA4A)、踝蛋白-1(TLN1)、肿瘤易感基因101蛋白(TSG)、微管蛋白β-1链(TBB1)、黏着斑蛋白(VCL)和WD重复蛋白1(WDR1)。该方法还包括:基于所述测量而预测在所述对象中是否存在结直肠癌或者胰腺癌。具体实施方式的还一个方面涉及一种预测在对象中是否存在癌的方法。该方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物。所述至少两种血小板来源的生物标记物是选自:α-辅肌动蛋白1(ACTN1)、凝溶胶蛋白(GELS)、整联蛋白α-2b(ITGA2B)、整联蛋白β-3(ITB3)、抑制素(PHB)、核糖核酸酶抑制因子(RINI)、丝氨酸蛋白酶抑制蛋白B6(SPB6)、微管蛋白α-4A链(TBA4A)、踝蛋白-1(TLN1)、微管蛋白β-1链(TBB1)、黏着斑蛋白(VCL)和WD重复蛋白1(WDR1)。该方法还包括:基于所述测量而预测在所述对象中是否存在癌。具体实施方式的进一步方面涉及一种选择对于对象的癌症治疗方案的方法。该方法包括:根据前述方法来确定所述对象是否患有良性病变或者癌病变;根据前述方法来预测在所述对象中是否存在良性病变和/或癌病变;根据前述方法来预测在所述对象中是否存在结直肠癌或者胰腺癌;或者根据前述方法来预测在对象中是否存在癌。该方法还包括:基于以下情形对于所述对象而选择治疗方案:所述对象是否患有良性病变或者癌病变的所述确定;在所述对象中是否存在良性病变和/或癌病变的所述预测;在所述对象中是否存在结直肠癌或者胰腺癌的所述预测;在对象中是否存在癌的所述预测。这些具体实施方式使得病人能基于生物样本友好地进行癌症预测。这种病人友好的和容易获得关于癌症状况信息的方法是通过采用例如血液样本来进行,它是无需进行活检的癌症诊断工具。本发明的具体实施方式将提供安全和精确的诊断工具,潜在地能进行个体化癌症治疗。因此,取代了采取活检的危险方法,可采用这些具体实施方式的非侵入式方法,使得例如区分良性病变和早期阶段的癌变,因此在早期阶段实现恶性癌症的诊断。这里所揭示的具体实施方式能被用作非侵入式癌症诊断的客观工具,包括:疑似癌症的筛查、临床诊断以及遗传性指征,用于癌症的后续治疗和潜在反复的监控。这些具体实施方式也能潜在地被用作比较诊断,与多种不同治疗方案一起。该工具能被用作病变的检测,该病变可能是恶性的,例如区别健康对象与患有良性或恶性病变的对象,用于预测、确证或评估癌症状况和/或预测、确证或评估癌症进展状况。这些具体实施方式使得能够基于生物学样本友好地、非侵入式地预测病人的癌症状况。这种病人友好的和容易获得关于癌症状况信息的方法是通过采用例如血液样本来进行的癌症诊断工具,无需进行活检。本发明的具体实施方式提供了安全和精确的诊断工具,潜在地能实现个体化癌症治疗。附图说明本发明结合它的进一步目标和优势,将通过参考下面的说明书并结合所附的附图而得到最好的理解。在这些附图中:图1显示了研究1A中样本的主成分分析(PCA),表示扩散的癌症与对照相比较。黑点表示扩散的癌症样本,而黑块表示对照样本。图2显示了研究1的血小板蛋白在2D凝胶上进行胶分离的结果,其中鉴定位点被标出。箭头指示被鉴定的生物标记物的位置。图3显示了基于从归一化积分点体积计算的内部评估的研究1A的样本的分布。该运算提供了在癌症样本与对照之间的清晰分离。图4是根据一个具体实施方式所述的诊断系统的示意图。图5显示了研究1B样本的偏最小二乘法,表示扩散的癌症与对照相比较。黑点表示扩散的癌症样本,而黑块表示对照样本。图6显示了研究1B的血小板蛋白在2D凝胶上进行胶分离的结果,其中鉴定位点被标出。箭头指示被鉴定的生物标记物的位置。图7显示了本发明的一个具体实施方式的示例。样本制备:采集血液样本,采用顺序离心步骤从中分离血小板。然后将最终颗粒存储在-80℃或者直接处理。然后将该颗粒溶解在加入的缓冲液中,离心去除不溶解的细胞。然后将样本存储于-80℃,或直接进行检测分析。该检测是基于抗体(即ELISA或类似方法)的,在现有的仪器设备上进行这种类型的检测。从仪器中的读数在标准电脑或软件上进行分析。对于生物标记物板的特定分析的专用算法是被整合在仪器的软件中。软件模块:数据是通过特定算法进行输入和分析的。然后,该数据与预测模型进行比较,该预测模型是在检测的发展过程中从病人数据中构建的。该预测模型提供了在0至1之间的每个新的样本数值,其中值>0.5表示癌症,而值<0.5表示良性病变。这个方法可被用于持续构建本地预测数据库,采用标准方法以及附加的可与来自其他鉴定分析实验室的数据库相对应的比较的结果。图8显示了代表性的2D凝胶图像,其中研究3和4的不同表达的蛋白被标记(用数字)。这些蛋白是在患有结直肠癌和胰腺癌的病人的血小板中被鉴定的。所有鉴定结果被描述在表7和表8中。图9显示了研究3中的主成分分析(PCA),表示健康对照(方块)与结直肠癌(点)的样本(目标)之间的分离,基于在表7中所描述的鉴定的生物标记物的差别表达水平。数字表示个别的蛋白位点(变量)作为在分析中的装载。图10显示了研究4中的主成分分析(PCA),表示健康对照(方块)与结直肠癌(点)的样本之间的分离,基于在表8中所描述的鉴定的生物标记物的差别表达水平。数字表示个别的蛋白位点(变量)作为在分析中的装载。图11显示了健康对照(方块)与结直肠癌(点)的样本(目标)之间的分离中的主成分分析(PCA),基于候选生物标记物的差别表达水平。具体实施方式本发明的具体实施方式总体上涉及癌症诊断领域。更特别地,这些具体实施方式涉及用于上皮癌症预测和诊断的血小板生物标记物。因此,本发明的这些具体实施方式采用了精选的血小板来源蛋白的组合作为生物标记物。可以发现,这些具体实施方式所述的血小板来源的蛋白能被用于有效的、可靠的和安全的癌症诊断方法,优选是哺乳类对象,更优选是人类。本发明的具体实施方式的保护范围是使得能够简单、病人友好地和无风险地对癌症和癌症状态的检测或诊断,特别是对于癌或“上皮”癌症,可能已经在疾病的早期阶段。癌症的早期检测是期望的,因为能使病人得到更有效的治疗,因而得到更高的存活率。而且,也具有这样的优势:能确定癌症的进展,如果它是在早期或晚期发现,这是更有利的,因为,早期通常是局部的,晚期通常是散布为恶性,它们需要不同的治疗选择,并具有不同预后特征。为清楚地与这些具体实施方式相比较,在
背景技术:
中提到的美国专利第8,173,433号公开了:血管生成的血小板蛋白可以被用作检测癌症的生物标记物。在该文揭示的血管生成蛋白涉及从已经存在的血管生成新血管的过程。这些新血管总体上对于肿瘤生长是重要的,也就是提供了这样的途径:能被用于转移肿瘤为扩散到对象体内的其他位置。在美国专利第8,173,433号中揭示的方法通常需要至少两个来自相同对象的两个不同时间地点的样本。这两个样本被分析,将血管生成蛋白模式进行比较,看从一个时间点到另一个时间点的变化,以便确定癌症状态。本发明的具体实施方式是基于新板的血小板来源的蛋白,这些蛋白可被用于癌症诊断。在这些板中表示的蛋白是令人惊喜的,与美国专利第8,173,433号相比较,本发明不限于血管生成蛋白。本发明所述的血小板来源的生物标记物能被用于癌症诊断领域中的多种诊断目的,取决于所选择的血小板来源的生物标记物的组合。例如,所选择的一板血小板来源的生物标记物可被用于将在对象中的病变分类为良性或者恶性病变,优选是癌或者上皮癌病变。因此,所选择的一板血小板来源的生物标记物可被用于确定对象是否患有良性病变或者癌病变。而且,本发明所述的另一种选择的一板血小板来源的生物标记物能被用于将对象分类为健康的或者患有良性和/或恶性病变,优选是良性和/或癌病变。因此,这个选择的一板血小板来源的生物标记物能被用于预测在对象体内是否存在良性和/或癌病变。本发明的具体实施方式所选择的一板血小板来源的生物标记物能被用于总体癌症诊断,也就是,确定对象是否患有癌症,特别是患有上皮癌,例如患有结直肠癌或前列腺癌。因此,这个选择的一板血小板来源的生物标记物能被用于预测结直肠癌或前列腺癌是否在对象中存在。这些具体实施方式的血小板来源的生物标记物也能被用于不仅预测癌在对象中的存在,也能被用于预测早期癌的存在。本发明的具体实施方式所选择的另一板血小板来源的生物标记物能被用于癌症诊断以区分恶性病变是否处于早期阶段。这板的血小板来源的生物标记物因而也能被用于监控癌的发展以及可能区分在早期和后期恶性病变,特别是早期或后期的癌。因此,所选择的一板血小板来源的生物标记物能被用于预测在对象中早期癌的存在。这里使用的一些术语将在下面进行解释以便简化对所揭示的具体实施方式的理解。这里所采用的术语“生物标记物”是指在来自对象的生物标本中任意的能被直接或间接检测到的蛋白质,例如通过同源、代谢、片段或分解产物,包括后转译修饰,例如糖基化、岩藻糖基化、甲基化和/或乙酰化。改变,例如生物标记物的量与对照的对象(例如无病的对象或在相同对象中无病的组织)中的量相比的增加或减少,是疾病例如癌症在对象中的存在或风险指征。生物标记物的同源、代谢、片段或分解产物可以具有或者不具有该生物标记物的功能活性。本发明的具体实施方式所述的生物标记物是血小板来源的生物标记物,因此,是从对象的生物学样本的血小板中获得的。术语“相对量”(或仅仅“量”)是指给出的标记物蛋白的测定量,相对于不同标记物蛋白的测定量。也即是,对于给定的标记物蛋白的术语“相对量”是被用于描述归一化的量(相对于在样本中所有蛋白的总量的百分比或标准的量)或者该蛋白相对于在给定的多种标记物蛋白的板内的其他蛋白的量。术语“改变的细胞”或“改变的组织”是指病变或类似物的存在或发生,它可能是良性或恶性的。在这里所用的术语“改变的细胞/改变的组织/病变的发生”是指细胞/组织/病变的良性或恶性的发生。因此,这样的“改变的细胞/改变的组织/病变”的预测是指这样的细胞/组织/病变在对象中的发生。因此,这些具体实施方式中选择的血小板来源的生物标记物能被用于预测对象是否健康,或者对象是否患有改变的细胞/改变的组织/病变,也就是患有良性和/或恶性病变。因此,血小板来源的生物标记物区分健康个体和发生某些类型的良性或恶性病变的个体。这里所采用的术语“癌症状况”是指定义癌症(也就是恶性肿瘤组织或病变)的状况,或者非癌症(也就是良性组织或病变)的状况,对于带有一些种类的病变的病人来说,所述状况也可以是指“疾病状况”。当划分为良性和恶性时,人们也能采用术语“肿瘤状况”。而且,癌症状况也可指癌症的发展,无论该癌症是在早期还是晚期,也即是在早期阶段或在后期阶段。因此,本发明的具体实施方式可被用于检测癌症,也就是区分癌和非癌。没有癌症可能是良性病变或者完全健康个体,取决于情境。这些具体实施方式也可替换地被用于确定癌症的发展,如果该癌症是在早期阶段或在后期阶段,因而确定癌症或癌症状况的发展。所预测的癌症状况可以附加地被应用于对象的改进的预后和/或治疗。术语“良性病变”或“良性组织”是指包含非不典型增生细胞,它缺乏侵入式生长和恶性扩散的能力。良性病变和组织仍然产生负健康效应。术语“恶性病变”或“癌症”是以不控制细胞分化、侵入式生长、血管新生的激活、自然细胞凋亡的受损机制,也就是凋亡,是从间变细胞构建的,并形成远处恶性肿瘤,称为转移。转移扩散是通过淋巴细胞、血管而发生,以及通过剥片,类似在卵巢癌过程中。这里所采用的术语“健康对照”或“HC”是等同于健康对象,没有正在感染或疾病的体征。健康对照没有良性或恶性病变。术语“对照”是包括健康对照或“良性对照”或具有良性病变的“BC”。术语“早期阶段”是指还没有扩散的癌症或者还没有严重感染对象,该对象患有了所述早期癌症。关于癌,例如上皮癌,包括例如卵巢癌、前列腺癌、结直肠癌和胰腺癌,总体上采用四级(I-IV)或四阶段来分类癌症的阶段和癌症的进程。早期癌包括I级和II级癌,而“后期”癌包括III级和IV级癌。术语“晚期”癌症或“后期”癌症是指已经扩散或严重感染对象的癌症,该对象患有了所述晚期癌症。关于癌,后期癌包括III级和IV级癌。后期癌症有时也是指“已扩散”或“已弥散”。上皮卵巢癌(EOC)或“LC”的术语“局部肿瘤”通常等同于EOC的早期阶段,包括I期和II期,EOC或“SC”的术语“扩散肿瘤”通常等同于后期EOC,包括III期和IV期。这里所采用的局部癌症或肿瘤是指大致上存在于对象体内的一个位置的癌症或肿瘤。这个肿瘤优选地没有扩散到该对象体内的其他位置。已扩散或已弥散的癌症或肿瘤是以恶性的存在为特征的。术语“癌”也就是上皮癌,是指确信为从特定组织的表面(上皮)产生的癌症。这样的癌症包括卵巢癌、前列腺癌、结直肠癌和胰腺癌。这里所采用的术语“癌症诊断”或“诊断”是指提供这样的指示,即对象可能遭受疾病,例如癌症,例如卵巢癌、前列腺癌、结直肠癌或胰腺癌。需要重视的是,没有这样的技术是完美的,这样的诊断可以通过其他方法来确认,例如外科检查、影像、组织样本的组织学检查等。诊断可以预测现有的病变是良性还是恶性。也可诊断对象是患有癌症还是没有癌症,其中没有癌症可以是良性病变或没有病变(健康对象)。术语“癌症预测”是指预测所检验的对象患有癌症疾病的可能性。例如,预测可以是癌症或非癌症。预测通常是不完全的,但产生可信的场景或指示。术语“癌症治疗方案”是指如何采用程序和药物治疗患有疾病或病症的病人。在这个例子中,如果对于某个对象所预测的癌症状况是癌症,则对于该对象选择抗癌治疗方案。这样的抗癌治疗方案的非限制性例子包括:化疗、外科手术和/或辐射。如果对于某个对象所预测的癌症状况是无癌症(健康或良性),总体上不需要癌症治疗方案。在这个实施例中,选择治疗方案包括:基于癌症状况而选择抗癌治疗方案或非抗癌治疗方案。正如这里所采用的,术语“对象”和“病人”是可替换使用的。正如这里所采用的,对象可以是动物,优选是哺乳动物,例如非灵长目动物,例如牛、猪、马、猫、狗、鼠等,或者灵长目动物,例如猴,例如猕猴、食蟹猴或黑猩猩,以及人类,更优选是人类。本发明的具体实施方式所述的蛋白板可被用于确定在对象中的良性和/或恶性病变的发生,区分在对象中的良性和恶性病变,和/或预测在对象中的癌症状况,包括预测在对象中恶性病变的癌症阶段。在对象中的良性和/或恶性病变的发生可以是存在,也就是对象患有良性和/或恶性病变,或者不存在,也就是健康个体。因此,血小板来源的生物标记物可被用于区分健康对象和患有一些种类的改变的组织、良性和/或恶性病变的对象。癌症状况,例如指定义为癌症的当前改变的组织的状况,也就是恶性病变,或定义为非癌症的状况,也就是良性病变。因此,血小板来源的生物标记物可被用于区分具有良性病变的对象与患有恶性病变(癌症)的对象。癌症状况的预测也可指作为癌症诊断,因此诊断对象的病变为良性或恶性。而且,癌症状况也可指癌症的发展,其中可能的状况是早期或晚期癌症。因此,血小板来源的生物标记物可被用于区分患有在早期阶段的癌症和患有在晚期阶段的癌症。这也可指癌症发展状况的预测。因此,这些具体实施方式可被用于检测癌症,也即是区分癌症和良性组织(非癌症)。这些具体实施方式也可替代地被用于确定癌症的进程,如果该癌症是处于早期或晚期阶段,因而确定癌症的发展作为癌症状况。所预测的癌症状况可而外地被应用于病人的改善的预后和/或治疗。这些具体实施方式的特定优势是早期诊断高恶性癌症,也就是确定带有小的或良好定义的病变的对象是否患有良性病变或早期恶性病变,并能非侵入地完成。这样的高恶性癌症包括卵巢癌、前列腺癌和结直肠癌。同时,也能够诊断胰腺癌,无需活检,这是本发明的优势。本发明的具体实施方式提供了可用于癌症诊断的在血小板中的特别蛋白质组模式。这里展示的这些具体实施方式能基于生物样本,例如血液样本或其他含有血小板的生物样本,进行病人友好的检测、癌症的预测和诊断。这种病人友好和容易的方法可通过采用生物学样本而获得关于疾病的信息,它是用于癌症诊断而无需组织活检的有效工具。本发明的具体实施方式可提供最小的损伤,同时更精确的诊断方法。例如,采用血液样本代签活检也具有这样的优势:没有将癌症细胞种入血液系统的风险,因此避免诊断带来疾病发展的风险,也避免了目前病人在取样过程中经受伤害的情形。在讨论多种不同的具体实施方式之前,简短地讨论用于下面的具体实施方式的多种血小板来源的生物标记物。ACTB,β-肌动蛋白,是已经在人体中鉴别的六种不同肌动蛋白异构体之一。这是两种非肌肉细胞骨架的肌动蛋白。肌动蛋白是高度保守蛋白,参与细胞运动性、结构和完整性。ACTN1,α-辅肌动蛋白1,是由人的ACTN1基因编码的。α-辅肌动蛋白是一种细胞骨架蛋白和肌动蛋白结合蛋白,具有在不同细胞类型中的多种角色。在非肌肉细胞中,细胞骨架异构体是沿着微丝束和粘结型连接找到的,它参与将肌动蛋白结合到膜上。ACTN4,α-辅肌动蛋白4,Q96BG6,参见上面关于ACTN1即α-辅肌动蛋白1的总体信息。AP4A,二(5’核苷)四磷酸酶,也称为二(5-核)四磷酸化酶,是一种假定的信号素,普遍存在于自然界,从细菌到人都很常见。磷酸腺苷能够诱导多种生理学效应。该分子的作用是作为第二信使,近来已经被发现在LysRS-Ap4A-MITF信号通路中。它不对称地水解Ap4A以产生AMP和ATP。在维持动态平衡中扮演重要角色。(描述在研究1C中)CASP3,半胱天冬酶3,是半胱氨酸-天冬氨酸蛋白酶(半胱天冬酶)家族的成员。半胱天冬酶的顺序激活在细胞凋亡的实施阶段扮演重要角色。半胱天冬酶存在时为失活的蛋白酶,被保护的天冬氨酸残基经过蛋白水解过程产生大和小的两个亚单位,二聚形成活性酶。这个蛋白质剪切和激活了半胱天冬酶6和7;该蛋白自身是由半胱天冬酶8、9和10处理和激活的。CAZA1,F-肌动蛋白的蛋白质亚基α-1,P52907,以Ca2+依赖方式结合到肌动蛋白长丝(带刺端)的快速生长端,因而阻止在这些末端亚单位的交换。不像其他加帽蛋白质,例如凝溶胶蛋白和肌割蛋白,这些蛋白不会作为肌动蛋白长丝。CFL1,丝切蛋白1,是一种广泛分布的细胞内肌动蛋白调控蛋白,它结合和解聚细丝状的F-肌动蛋白,并抑制单体的G-肌动蛋白以pH依赖方式的聚合。它参与肌动蛋白-丝切蛋白复合体从细胞质到细胞核的迁移。CLU,丛生蛋白,也称为载脂蛋白J,是一种75-80kDa的二硫键异二聚体蛋白,与细胞碎片的清理和凋亡相关联。这个蛋白有几种同义词:二聚酸性糖蛋白(DAG蛋白)、睾酮抑制前列腺信使-2(TRPM-2)、硫酸化糖蛋白-2(SGP-2)以及补充裂解抑制剂(CLI)。CNDP2,细胞质特异性肽,Q96KP4,水解多种二肽,包括L-肌肽,但对于Cys-Gly具有强的偏好。异构体2可作为肿瘤抑制剂在肝细胞瘤(HCC)细胞中扮演重要角色。CRKL,Crk样蛋白,P46109,可介导细胞内信号传导。增加的证据表明,Crk蛋白的失调与人的疾病(包括癌症)以及病原菌感染的易感性相关联。ERP29,内质网蛋白29,P30040,在内质网(ER)内的分泌蛋白的处理中扮演重要角色,可能通过参与蛋白在ER中的折叠。顺序类似于蛋白质二硫化物异构酶家族,但不作为二硫化物异构酶。FERM,铁蛋白家族成员3,也称为FERMT3、引火物-3、MIG2样蛋白或者unc-112相关蛋白2,具有结合和激活整联蛋白的能力和功能。铁蛋白家族成员总体上在细胞粘附、迁移、分化和增殖中起作用。FERM在止血与血栓形成的调控中扮演重要角色。这个蛋白也可协助维持红细胞的膜骨架。FIBG,纤维蛋白原γ链,或FGG,具有双重功能:产生单体,聚合进入血纤维蛋白并作为在血小板聚集过程中的辅助因子。纤维蛋白原γ部分,血源的糖蛋白,是三对不恒等的多肽链之一。伴随血管损伤,纤维蛋白原被凝血酶剪切而产生纤维蛋白,它是血凝块的冗余部分。此外,纤维蛋白原的多种剪切产物和纤维蛋白调控细胞粘附和扩散,显示血管收缩和趋化活性,是对于几种细胞类型的促细胞分裂剂。FLNA,细丝蛋白A,也称为细丝蛋白α和肌动蛋白结合蛋白280(ABP-280),协助构建蛋白长丝(细胞骨架)网络,给出对于细胞的结构,使得它们能改变形状和移动。FLNA结合到另一种称为肌动蛋白的蛋白,并协助该蛋白形成长丝的分支网络,组成细胞骨架。FLNA还将肌动蛋白连接到许多其他蛋白以执行在细胞内的多种功能,包括调控骨骼和脑发育、血管的形成以及血凝块。细胞骨架的重构是调控细胞形状和迁移的核心。FLNA是广泛表达的蛋白,它通过与整联蛋白、跨膜受体复合物和次级信使的相互作用而调控肌动蛋白细胞骨架的重建。在一个具体实施例中,FLNA是FLNA蛋白C末端的形式。FPPS,法尼基焦磷酸合成酶,是一种将二甲基烯丙基焦磷酸和异戊烯焦磷酸转化为法尼基焦磷酸。它也被称为法尼基焦磷酸合成酶或者法尼基二磷酸合成酶。GELS,凝溶胶蛋白,也称为肌动蛋白解聚因子,P06396,是一种钙调控的肌动蛋白调控蛋白,它结合到肌动蛋白单体或细丝的正(或带刺)端,阻止单体交换(末端阻遏或加帽)。它能促进单体组装为细丝(成核)以及作用于已经形成的细丝。凝溶胶蛋白在纤毛发生中扮演重要角色。GPIX,糖蛋白IX,P14770。GPIb-V-IX复合物起到vWF受体和介导vWF依赖性血小板粘附到血管的功能。在动脉循环中血小板粘附到受伤的血管表面是启动止血的关键。GP-IX可提供用于膜插入和GP-lb的起源。(描述在研究IC中)GRP75,线粒体应激70蛋白,也指mtHSP70和HSPA9,参与细胞增殖和细胞衰老的控制。它也可作用为伴侣蛋白。GST01,谷胱甘肽S-转移酶Ω-1,是一种在人体的酶,由GST01基因编码。这个基因编码θ级谷胱甘肽S-转移酶样(GSTTL)蛋白家族的一个成员。在小鼠中,编码蛋白作用为小应激反应蛋白,参与细胞的氧化还原平衡。这个蛋白具有脱氢抗坏血酸还原酶活性,并可作用在抗坏血酸-谷胱甘肽循环中作为抗氧化剂代谢的一部分。HDHD2,卤酸脱卤酶样包含水解酶结构域蛋白2,是一种在人体内的酶,由HDHD2基因编码。HP蛋白,Q6NSB4,属于肽酶S1家族。序列长度是281个氨基酸,在HP蛋白中的氨基酸残基34-281对应于在结合珠蛋白(P00738)的氨基酸残基159-406。HSP70,热冲击蛋白70kDa,Q53HF2,具有ATP结合功能。热冲击蛋白(HSPs)或者应激蛋白是高度保守的,并存在于所有器官和所有器官的所有细胞中。选择的热冲击蛋白,也称为伴侣蛋白,在蛋白的折叠/解折叠、多蛋白复合物的组装、蛋白输送到正确的亚细胞隔间、细胞循环控制和发出信号以及对抗应激/凋亡的细胞保护中扮演重要角色。HSP71,热冲击蛋白71kDa。HSP90AB1,热冲击蛋白HPS90-β,是一种在人体内的蛋白,由HSP90AB1基因编码。ILEU,白细胞弹性蛋白酶抑制物,也称为LEI,P30740,调节中性粒细胞蛋白酶弹性蛋白酶、组织蛋白酶G、蛋白酶-3、胃促胰酶、胰凝乳蛋白酶和激肽释放酶-3的活性。它也可用作颗粒酶H的潜在细胞内抑制剂。ITGA2B(或ITA2B),整联蛋白α-2b,也称为ITGA2B、血小板糖蛋白库(GPIIb)或CD41,P08514,是由人体内的ITGA2B基因来编码。整联蛋白是由α链和β链组成的异二聚体整合膜蛋白。整联蛋白α-IIb/β-3是纤连蛋白、纤维蛋白原、纤溶酶原、凝血酶原、凝血酶敏感蛋白和玻连蛋白的受体。随着激活整联蛋白α-IIb/β-3导致血小板/血小板相互作用,通过结合溶解的纤维蛋白原。这个步骤有助于快速凝集血小板,这样物理上阻塞破裂的内皮细胞表面。ITB3,整联蛋白β-3,也称为血小板糖蛋白IIIa(GPIIIa)或CD61,P05106。整联蛋白是由α链和β链组成的异二聚体整合膜蛋白。整联蛋白α-V/β-3是细胞趋化素原、纤连蛋白、层粘连蛋白、基质金属蛋白酶-2、骨桥蛋白、凝血素、凝血酶敏感蛋白、玻连蛋白和血管性血友病因子的受体。整联蛋白α-IIb/β-3是纤连蛋白、纤维蛋白原、纤溶酶原、凝血酶原、凝血酶敏感蛋白和玻连蛋白的受体。随着激活整联蛋白α-IIb/β-3导致血小板/血小板相互作用,通过结合溶解的纤维蛋白原。这个步骤有助于快速凝集血小板,这样物理上阻塞破裂的内皮细胞表面。ITGA6,整联蛋白α-6,对于整联蛋白的更多信息,参见上面的ITGA2B和ITB3。KAP3,cAMP依赖性蛋白激酶亚基RII-β,P31323,是一种cAMP依赖蛋白激酶的调节性亚单位,参与在细胞中的cAMP信号调控。II型调控链通过结合到锚定蛋白(包括MAP2激酶)而介导膜关联。MLEC,半乳凝集素,是一种内质网的糖类结合蛋白以及在蛋白N-糖基化的早期步骤中的候选角色。PHB,抑制素,Q6PUJ7,是由PHB基因编码的人体内的蛋白。抑制素被分为两类,分别基于它们对于酵母PHB1和PHB2的相似性而命名为I型和II型抑制素。每种器官具有每种类型的抑制素基因的至少一份拷贝。PHB被认为是细胞增殖的负调控,也可是肿瘤抑制物。RINI,核糖核酸酶抑制因子,P13489,抑制RNASE1、RNASE2和ANG。它可在氧化还原平衡中扮演角色。SHLB1,内啡肽-B1异构体1,Q9Y371,可以是对于正常外线粒体膜动力学所必需。它是在特定细胞内衣被介导的逆行运输所需要的。它可以招募其他蛋白到具有高曲度的膜上。SHLB1可促进膜融合。所编码的蛋白与Bcl-2家族的促凋亡成员、Bcl-2-关联的X蛋白(Bax)相互作用,并可被参与调节凋亡信号通路。这个蛋白也可参与维持线粒体形态。SNCA,α-突触核蛋白,与磷脂和蛋白相互作用。突触前终端从已知的突触囊泡的隔间释放化学信使,称为神经递体。神经递体的释放延缓了在神经之间的信息,这对于正常脑功能是非常重要的。它在突触前终端维持突触囊泡的供应扮演重要角色。它也可协助多巴胺的释放,多巴胺是一种神经递体,对于控制主动和非主动运动的开始和停止具有重要作用。SPB6,丝氨酸蛋白酶抑制蛋白B6,是一种由SERPINB6基因编码的人体内的蛋白。它可参与在脑内或来自血液的丝氨酸蛋白酶的调节。它是组织蛋白酶G、激肽释放酶-8和凝血酶的抑制剂。SPB6可在内耳中扮演重要角色,在导致细胞死亡和感觉神经听力受损的这个保护的压力和损失过程中保护内耳以免溶酶体内容的泄漏。SRC,原癌基因蛋白酪氨酸激酶Src,P12931,参与信号通路,以控制在包括基因转录、免疫反应、细胞粘附、细胞周期进展、凋亡、迁移和转化等的生物学活动中的不同光谱。TBA,微管蛋白,高度类似于微管蛋白α-普遍链,B3KPS3。微管蛋白是小家族的球状蛋白的几种成员之一。微管蛋白超级家族包括五种区分的家族:α-、β-、γ-、θ-和ε-维管蛋白。维管蛋白家族中最常见的成员是α-维管蛋白和β-微管蛋白,这些蛋白组成微管。每种蛋白具有约55千道尔顿的分子量。微管是从α-维管蛋白和β-微管蛋白的二聚体组装的。这些亚单位是微酸性的,等电点在5.2至5.8。为了形成微管,α-维管蛋白和β-微管蛋白的二聚体结合到GTP,并组装在微管的(+)端上,同时处于GTP结合状态。β-微管蛋白的亚单位被暴露在维管的正端,同时α-维管蛋白亚单位被暴露在负端上。在该二聚体被整合进入微管之后,GTP分子结合到β-微管蛋白亚单位,通过验证微管原丝的内部二聚体接触而最终水解为GDP。无论微管二聚体的β-微管蛋白成员是否结合到GTP或者GDP影响该二聚体在微管内的稳定性。结合到GTP的二聚体倾向于组装进入微管,同时结合到GDP的二聚体倾向于散开;因此,这个GTP循环对于微管的动态不稳定性是至关重要的。TBA4A,微管蛋白α-4A链,P68336,参见上面的TBA。THTM,3-巯基丙酮酸硫转移酶,也称为PST、TST2和硫氰酸酶,P5325,将硫离子转变为氰化物或者转变为其他巯基化合物。它也具有弱的硫氰酸酶活性。THTM使氰化物解毒,且对于硫代硫酸盐生物合成是必需的。它作用为抗氧化剂。与半胱氨酸氨基转移酶(CAT)相结合,它贡献于半胱氨酸的分解代谢,是在脑、肾和血管内皮细胞里的氢化硫的一个重要制造者。氢化硫H2S是一种重要的突触调质、信号分子、平滑肌收缩物和神经保护剂。通过3MST/CAT途径的产生是由钙离子来调控的。TLN1,踝蛋白-1,Q9Y490,可能参与将主要细胞骨架结构连接到基质膜。它是高分子量细胞骨架蛋白,浓缩在细胞底层接触区域以及在淋巴细胞内,在细胞-细胞接触处。TPM1,原肌球蛋白α-1,F5H7S3。原肌球蛋白是广泛分布的肌动蛋白结合蛋白。TSG,肿瘤易感基因101蛋白,属于一组明显不活跃的泛肽交联酶同系物。该蛋白包括与微管去稳蛋白相互作用的螺旋-螺旋区、在肿瘤发生中涉及的胞内磷酸化蛋白。该蛋白在细胞生长和分化中扮演角色,并作为负生长调控物。TUBB1,微管蛋白β-1链,也称为VI级和VI级β-微管蛋白,QH4B7,是由TUBB1基因编码的人体内蛋白。β-微管蛋白是两种核心蛋白家族之一,它们是异源的和组装以形成微管。微管参与广泛的多种细胞程序,包括有丝分裂、形态发生、血小板形成和纤毛和鞭毛的迁移。这个蛋白是在血小板和巨噬细胞中特异表达的,可以涉及前血小板产生和血小板释放。VCL,黏着斑蛋白,是由VCL基因编码的人体内的蛋白。VCL是一种细胞骨架蛋白,与细胞-细胞和细胞-基质连接相关联,并可在细胞形态和运动中扮演重要角色。WDR1,WD重复蛋白1,是由WDR1编码的人体内的蛋白。WDR1总体上包含9WD重复体。这样的WD重复体是约30至40个氨基酸区域,包含几个保守残基,WD域总体上涉及蛋白质-蛋白质相互作用。WDR1可有助于引导肌动蛋白细丝的解组装。本发明的一个方面涉及一种确定对象是否患有良性病变或者癌病变的方法。该方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物,所述至少两种血小板来源的生物标记物是选自:α-辅肌动蛋白1(ACTN1)、α-辅肌动蛋白4(ACTN4)、Crk样蛋白(CRKL)、内质网蛋白29(ERP29)、FERM蛋白、纤维蛋白原γ链(FIBG)、细丝蛋白A(FLNA)、凝溶胶蛋白(GELS)、线粒体应激70蛋白(GRP75)、HP蛋白、热冲击蛋白70kDa(HSP70)、热冲击蛋白71kDa(HSP71)、整联蛋白α-2b(ITGA2B)、整联蛋白β-3(ITB3)、核糖核酸酶抑制因子(RINI)、原癌基因蛋白酪氨酸激酶Src(SRC)、微管蛋白(TBA)、微管蛋白α-4A链(TBA4A)、3-巯基丙酮酸硫转移酶(THTM)、踝蛋白-1(TLN1)、微管蛋白β-1链(TUBB1)、黏着斑蛋白(VCL)和WD重复蛋白1(WDR1)。该方法还包括:基于所述测量而确定所述对象是否患有良性病变或者癌病变。因此,在上面所展示的组或板中列出的血小板来源的生物标记物能被用于区分对象是患有良性病变还是患有癌病变。这意味着这些血小板来源的生物标记物能被用于那些患有病变的对象,也就是,改变的细胞或组织,以便验证或至少预测该病变是否良性的,也就是总体上较少有害性,或者该病变是否癌,也就是恶性的。在一个具体实施方式中,所述方法包括:基于所述测量而确定所述对象是否感染良性病变或者卵巢癌或者前列腺癌。在这个具体实施方式中,在上面所展示的组或板中列出的血小板来源的生物标记物是特别适用于用于诊断卵巢癌或前列腺癌病变,它们作为癌病变的优选例子。正如这里所进一步揭示的,实验数据表明:所列出的一些血小板来源的生物标记物可以是比其他血小板来源的生物标记物在确定病变种类时更为重要,也就是良性vs.癌或恶性。六种最重要的这样的血小板来源的生物标记物包括:ERP29、ACTN4、HP-蛋白、TLN1、SRC和THTM。在这样的具体实施方式中,所述方法优选地包括:测量在所述生物样本中选自以下的至少两种血小板来源的生物标记物:ERP29、ACTN4、HP蛋白、TLN1、SRC和THTM。因此,在来自这个有限群组的特别的血小板来源的生物标记物中,它们提供了关于将病变分类为良性或癌的最显著的信息。在可替代的方法中,以所述方法测量的每个血小板来源的生物标记物可以具有相关联的权重值,该权重值是基于和表示在诊断中该特别的血小板来源的生物标记物的重要性类确定的。这样的权重可以基于下面进一步列出的这些血小板来源的生物标记物的VIP(重要性的变量)等级而被确定。在一个具体实施方式中,所述方法包括:测量在所述生物样本中所述至少两种血小板来源的生物标记物的各自的量。该方法还包括:将表示在所述生物样本中所述血小板来源的生物标记物的各自的量与表示来自对照对象的所述血小板来源的生物标记物的各自的量进行比较。该方法还包括:基于所述比较而确定所述对象是否感染良性病变或者癌病变。因此,在这个具体实施方式中,对于将被测量的每种血小板来源的生物标记物,各自的对照的量是优选地被确定。对照的对象可以是被诊断为患有良性病变但没有任何癌病变的对象。可替代地,对照的对象可以是被诊断为患有癌病变但没有任何良性病变的对象。然后,将在来自对象的生物样本中测量的血小板来源的生物标记物的情况与对照的对象的对照情况进行比较,以便确定该情况是否匹配对照的情况。这样一种比较能被用于对在对象中的任何病变进行分类。在一个特定的具体实施方式中,所述方法包括:基于所述测量而确定所述对象是否感染良性病变或者早期癌症。因此,在优选的具体实施方式中,所述方法可被用于区分相对无害的良性病变与早期阶段的癌病变。总体上,以现有技术中的技术非常难以在良性病变与早期癌病变之间做出这样的区分,也就是,早于癌的任何转移或至少明显的扩散的形成之前做出这样的区分。因此,该具体实施方式将会是在早期癌症检测中有价值的工具,以便从在扩散之前已经癌病变中区分相对无害的良性病变。本发明的具体实施方式的另一个方面涉及一种预测在对象中是否存在良性病变和/或癌病变的方法。该方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物,所述至少两种血小板来源的生物标记物是选自:二(5’核苷)四磷酸酶(AP4A)、F-肌动蛋白的蛋白质亚基α-1(CAZA1)、细胞质特异性肽(CNDP2)、糖蛋白IX(GPIX)、白细胞弹性蛋白酶抑制物(ILEU)、cAMP依赖性蛋白激酶亚基RII-β(KAP3)、抑制素(PHB)、内啡肽-B1(SHLB1)、丝氨酸蛋白酶抑制蛋白B6(SPB6)和原肌球蛋白α-1(TMP1)。所述方法还包括:基于所述测量预测在所述对象中是否存在良性病变和/或癌病变。在这第二组或板中的血小板来源的生物标记物是适合于区分健康对象(也就是没有任何病变或癌)或患有癌(也就是恶性病变)的对象以及患有良性病变、患有癌病变或同时患有良性病变和癌病变的对象。这个方法可具有优势地被用作初始筛查以便检测任何病变,然后通过前面所述的方面来执行,以分类任何检侧到的病变为良性还是恶性。在一个具体实施方式中,所述方法包括:基于所述测量而预测所述对象是否感染良性病变和/或卵巢癌或者前列腺癌。因此,这个方法与所列出的血小板来源的生物标记物是特别适用于用于连接作为癌的例子的卵巢癌和前列腺癌。在一个具体实施方式中,所述方法包括:测量在所述生物样本中所述至少两种血小板来源的生物标记物的各自的量。所述方法还包括:将表示在所述生物样本中所述血小板来源的生物标记物的各自的量与表示来自对照对象的所述血小板来源的生物标记物的各自的量进行比较。该方法还包括:基于所述比较而预测在所述对象中是否存在良性病变和/或癌病变。在这个具体实施方式中,对照的对象优选是健康的对象,也就是,没有任何良性病变或癌病变的对象。优选地进行这样的比较,类似于前面已经讨论的采用血小板来源的生物标记物的情况进行比较。这些具体实施方式IDE进一步方面涉及一种预测在对象中是否存在结直肠癌或者胰腺癌的方法。所述方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物。在这个方面,所述至少两种血小板来源的生物标记物是选自:β-肌动蛋白(ACTB)、α-辅肌动蛋白1(ACTN1)、半胱天冬酶3(CASP3)、丝切蛋白1(CFL1)、丛生蛋白(CLU)、法尼基焦磷酸合成酶(FPPS)、凝溶胶蛋白(GELS)、谷胱甘肽S-转移酶Ω-1(GST01)、热冲击蛋白HPS90-β(HSP90AB1)、卤酸脱卤酶样包含水解酶结构域蛋白2(HDHD2)、整联蛋白α-2b(ITGA2B)、整联蛋白β-3(ITB3)、整联蛋白α-6(ITGA6)、半乳凝集素(MLEC)、抑制素(PHB)、核糖核酸酶抑制因子(RINI)、α-突触核蛋白(SNCA)、丝氨酸蛋白酶抑制蛋白B6(SPB6)、微管蛋白α-4A链(TBA4A)、踝蛋白-1(TLN1)、肿瘤易感基因101蛋白(TSG)、微管蛋白β-1链(TBB1)、黏着斑蛋白(VCL)和WD重复蛋白1(WDR1)。所述方法还包括:基于所述测量而预测在所述对象中是否存在结直肠癌或者胰腺癌。因此,这个方法与所列出的血小板来源的生物标记物可被用于诊断对象是否患有结直肠癌或胰腺癌,它们作为癌病变的优选例子。因而,血小板来源的生物标记物可被用于区分健康对象(也即是没有良性或癌病变)与患有良性病变的对象,即患有结直肠癌或胰腺癌的对象。在一个具体实施方式中,所述方法包括:测量在所述生物样本中选自以下的至少两种血小板来源的生物标记物:ACTB、ACTN1、CAPS3、CFL1、CLU、FPPS、GELS、GST01、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。该方法还包括:基于所述测量而预测在所述对象中是否存在结直肠癌。在另一个具体实施方式中,所述方法包括:测量在所述生物样本中选自以下的至少两种血小板来源的生物标记物:ACTB、ACTN1、CAPS3、CFL1、CLU、FPPS、GELS、HSP90AB1、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。所述方法还包括:基于所述测量而预测在所述对象中是否存在胰腺癌。因此,前面所列出的群组的血小板来源的生物标记物可被用于本具体实施方式,通常既用于结直肠癌,又用于胰腺癌。而且,血小板来源的生物标记物看来是对于胰腺癌特异的,而GST01看来是对于结直肠癌特异的。在一个具体实施方式中,所述方法包括:测量在所述生物样本中所述至少两种血小板来源的生物标记物的各自的量。该方法还包括:将表示在所述生物样本中所述血小板来源的生物标记物的各自的量与表示来自对照对象的所述血小板来源的生物标记物的各自的量进行比较。该方法还包括:基于所述比较而预测在所述对象中是否存在结直肠癌或者胰腺癌。在这个具体实施方式中,对照的对象优选是健康的对象,也就是,没有任何良性病变或癌病变的对象,或者患有良性病变但没有任何癌病变的对象。可替代地,对照的对象可以是被诊断为患有结直肠癌或胰腺癌的对象。该比较是优选地类似于在前面已经描述的采用血小板来源的生物标记物的情况的比较。这些具体实施方式的还一个方面是涉及一种预测在对象中是否存在癌的方法。所述方法包括:测量来自所述对象的生物样本中的至少两种血小板来源的生物标记物,所述至少两种血小板来源的生物标记物是选自:α-辅肌动蛋白1(ACTN1)、凝溶胶蛋白(GELS)、整联蛋白α-2b(ITGA2B)、整联蛋白β-3(ITB3)、抑制素(PHB)、核糖核酸酶抑制因子(RINI)、丝氨酸蛋白酶抑制蛋白B6(SPB6)、微管蛋白α-4A链(TBA4A)、踝蛋白-1(TLN1)、微管蛋白β-1链(TBB1)、黏着斑蛋白(VCL)和WD重复蛋白1(WDR1)。该方法还包括:基于所述测量而预测在所述对象中是否存在癌。因此,上面所列出的群组的血小板来源的生物标记物可被用于检测在对象中早期阶段的癌,也即是,检测在非常早期阶段(I级或II级)以及早于扩散的任何这样的癌症。在这样的例子中,所述方法包括:基于所述测量而预测在所述对象中是否存在早期癌。根据这些具体实施方式所述,这样的对于早期阶段的癌的检测是特别有优势的。因此,当该癌症优选地限制于单一位置时,以这种方法可以在癌广泛转移之前检测在对象中的癌。原因是:癌症治疗是非常成功的,如果该治疗是起始用于早期阶段癌症,与治疗晚期癌症相比较。在特定的具体实施方式中,所述方法包括:基于所述测量而预测在所述对象中是否存在上皮癌,优选地基于所述测量而预测在所述对象中是否存在早期阶段的上皮癌。目前,这样的癌和上皮癌的优选的例子包括:卵巢癌、前列腺癌、结直肠癌和胰腺癌。在一个具体实施方式中,所述方法包括:测量在所述生物样本中所述至少两种血小板来源的生物标记物的各自的量。所述方法还包括:将表示在所述生物样本中所述血小板来源的生物标记物的各自的量与表示来自对照对象的所述血小板来源的生物标记物的各自的量进行比较。所述方法还包括:基于所述比较而预测在所述对象中是否存在癌。对照的对象优选是健康的对象或者患有良性病变的对象。所述比较是优选地类似于在前面已经讨论的采用血小板来源的生物标记物的情况进行比较的方法来实施。对于被测量的至少两个血小板来源的生物标记物,生物样本可以是包含血小板的任意生物学样本。这里所采用的生物学样本是指采集自对象的身体的任何材料,它可携带这里所述的测试的目标化合物,包括组织样本和生物学流体例如血液样本、唾液样本、尿液样本等。在代表性实施例中,生物样本是血液样本、提取的血小板样本以及类似物。这里所采用的血液样本是指全血或者它们的任意部分(例如,血浆、血清),它可包含可检测水平的血小板来源的生物标记物(如果生物标记物是存在于全血样本,从中可获得所述部分),在特定实施例中,它是指血浆样本或血液血小板样本。在特定实验的实施例中,所述方法包括以下步骤:a)从对象的生物样本,优选是血液样本中分离血小板;b)从在a)中所分离的血小板中提取血小板蛋白质;c)在二维凝胶电泳(2-DE)的凝胶上分离在b)中提取的血小板蛋白质;d)在2-DE凝胶上鉴定至少两种血小板来源的生物标记物;以及e)测量在2-DE凝胶上所鉴定的至少两种血小板来源的生物标记物的量。在特定具体实施例中,分离步骤a)包括:一个或多个(通常三个)离心步骤。在第一个离心步骤中,血液样本被离心以形成红细胞和血浆的沉淀。如果生物样本是血浆样本,这个离心步骤可被忽略。在第二个离心步骤中,血浆被离心以形成沉淀和血小板较少的血浆。在可选的具体实施例中,富含血小板的沉淀被重悬和清洗,进行第三个离心步骤以形成纯的富含血小板的沉淀,弃去上清。在步骤b)中从血小板中提取血小板-蛋白能根据已知的裂解和提取方法来实施,通常采用溶解缓冲液。最终得到的血小板蛋白溶解产物是优选地进行一个离心步骤以形成具有血小板蛋白的上清,弃去沉淀。步骤c)优选地执行2-DE,即基于等电点和质量来分离血小板蛋白质。因此,第一个分离步骤是等电点聚焦,基于它们的等电点分离血小板蛋白。第二个分离步骤是基于它们的分子量或质量采用SDS-PAGE分离血小板蛋白质。在2-DE凝胶上的血小板蛋白能在步骤d)中被标记以使得能鉴定相关的血小板来源的生物标记物,然后在步骤e)中测量血小板来源的生物标记物的量。可采用多种蛋白标记规程和方法,例如银染色。在这样的例子中,银染色是优选地采用质谱兼容染色方法来实施。然后,染色的血小板来源的生物标记物能被扫描,至少两种血小板来源的生物标记物的各自的量可从在步骤e)中的染色的2-DE凝胶的图像中被确定。方法步骤a)至e)的变化是可行的,都落入本发明的保护范围之内。例如,特异性结合到各个至少两个血小板来源的生物标记物的抗体可被用于鉴定和量化相关的生物标记物。酶联免疫分析(ELISA)、质谱分析、平板测试(例如复合微球测试)以及多重反应监控(MRM)是可替代或附加技术的例子,它们能被用于代替2-DE或作为2-DE的补充。一个这样的改变的实施方式将在下面进行描述。在特定实验的实施例中,所述方法包括以下步骤:a)从对象的生物样本,优选是血液样本中分离血小板;b)从在a)中所分离的血小板中提取血小板蛋白质;c)将从b)中提取的血小板蛋白质施加到基于抗体的分析平台,所述分析平台包括对应于至少两种生物标记物的抗体;d)测量从c)的分析的信号;在诊断仪器中,采用算法分析所测量的信号,展现结果用于诊断评估。在一个特定实施例中,分离步骤a)包括:一个或多个(通常三个)离心步骤。在第一个离心步骤中,血液样本被离心以形成红细胞和血浆的沉淀。如果生物样本是血浆样本,这个离心步骤可被忽略。在第二个离心步骤中,血浆被离心以形成沉淀和血小板较少的血浆。在可选的具体实施例中,富含血小板的沉淀被重悬和清洗,进行第三个离心步骤以形成纯的富含血小板的沉淀,弃去上清。在步骤b)中从血小板中提取血小板-蛋白能根据已知的裂解和提取方法来实施,通常采用溶解缓冲液。最终的血小板蛋白溶解产物是优选地进行一个离心步骤以形成具有血小板蛋白的上清,弃去沉淀。步骤c)优选地执行基于抗体的多重分析型ELISA(或Luminex),这些抗体已经开发出来特异针对在特定板中采用的生物标记物以适合选择的分析类型。该板可包含对于所选择的至少两种生物标记物的抗体。步骤d)的信号的定量读数是从在抗体与生物标记物之间的结合相互作用获得的,生物标记物是存在于从步骤b)获得的血小板-蛋白质;步骤d)在仪器中完成。这个信号可以来自产生的荧光信号、基于酶反应或其他生物学报告系统的颜色变化。然后,在仪器中处理该信号,更特别地,采用特别用于所选择的生物标记物板的算法的软件来处理该信号。然后,已处理的信号的结果被给出0至1之间的数值。该值可以基于数值水平来判定,该数值水平是被用于每个生物标记板、在特定癌症诊断以及特定类型的癌症的诊断中所采用的板。算法是通过给出的PLS模型(采用适当多元软件,例如SIMCAPv13、UmetricsAB)来产生的,并可根据已知的在PLS模型(对于一个例子,参见OttervaldJ.,etal.,MultipleSclerosis:IdentificationandclinicalevaluationofnovelCSFbiomarkers.JProteomics.2010.April18:73(6):1117-1132.)领域技术人员所熟知的方法来提供在0-1之间的预测分数。该预测模型提供了对于每种新样本的0和1之间的数值,数值>0.5指示癌症,而数值<0.5指示良性病变。板测试或多变量分析是指一组个别的实验室测试,它们以一些方式相关联,包括但不限于:它们被设计为检测的医疗状况(例如癌症)、样本类型(例如血液)以及由该测试带来的形态学(例如,生物标记物蛋白的改变的水平的检测)。在特定实验的实施例中,所述方法包括以下步骤:a)从对象的生物样本,优选是血液样本中分离血小板;b)从在a)中所分离的血小板中提取血小板蛋白质;c)采用各自的抗体测量所述至少两种血小板来源的生物标记物的量,所述抗体特异地结合到所述至少两种血小板来源的生物标记物中的各自的生物标记物。本发明的具体实施方式可被用作客观工具适用于非侵入式癌症诊断、疑似癌症的临床诊断和遗传性指示,用于癌症的后续治疗,以及用于监控潜在的反复,以及用于筛查。该诊断方法也可被潜在地与当前和将来的治疗方案一起用作到比较诊断,以及用于早期筛查。该工具可被用于检测病变是否恶性(区分健康对象与患有良性或恶性病变的对象),用于预测/确定/评估癌症状况,以及预测/确定/评估癌症发展状况。这些具体实施方式具有特别的优势以使得能够预测在对象中的癌症状况,例如,能够在扩散可被检测之前早期诊断癌症,以及排除良性病变。这些具体实施方式的进一步优势是能检测或预测在对象中可能的恶性病变的发生。另一个优势是预测在具有可能恶性病变发生的对象中的癌症(肿瘤)状况/疾病状况(良性或恶性病变)。另一个优势是可预测癌症发展的癌症状况,确定患有恶性癌症的对象是处于疾病早期还是晚期。在一个特定实施例中,在对象中出现病变,但还非常小或者很好地局限性,它们很难被区分为良性病变或早期恶性病变(肿瘤)。代替采用活检的危险方法,本发明可采用非侵入的方法,使得能够区分良性病变和早期恶性病变(肿瘤),因此能在早期阶段进行恶性癌症的诊断。本发明的一个特别优势是能够诊断早期阶段的高恶性癌症,例如卵巢癌、胰腺癌和结直肠癌,如果诊断在后期,它们是更多或更少无法治愈的。进一步的优势是执行这样的诊断无需侵入式方法,例如采用活检。特别地,可诊断上皮癌症,包括卵巢癌、前列腺癌、结直肠癌和胰腺癌。血小板来源的生物标记物的板是替代使用的,通过分析两种或多种这些标记物的表达,能预测/检测病变的恶性。特别的优势是能够诊断早期阶段的高恶性癌症,也就是,检测具有小的或良好局限的病变的对象是患有良性病变或早期恶性病变,也能够非侵入地完成。这样的高恶性癌症包括卵巢癌、胰腺癌和结直肠癌。同时,能够诊断前列腺癌,无需活检,这是目前具体实施方式的优势。本发明的具体实施方式提供了在血小板中的特殊的蛋白质组模式,有用于检测:改变的病变或恶性细胞/组织/病变的发生、癌症状况预测、癌症的诊断以及用于区分早期癌症和晚期癌症。这里展示的具体实施方式使得能基于血液样本或其他含有血小板的生物样本用于病人友好的检测、预测和诊断癌症。这个病人友好和容易的方法可获得关于疾病的信息,通过采用生物学样本,例如血液样本,这是用于癌症诊断的工具,无需组织活检。本发明可提供最小的创伤,同时更精确的诊断过程。例如,采用血液样本代替活检,这也会具有优势,即没有将癌症细胞播种进入血液系统的风险,这样避免对于疾病进展的诊断贡献的风险,创伤病人可经历整个样本收集过程,今天是可避免的。本发明的具体实施方式所述的至少两种血小板来源的生物标记物是优选地至少两种蛋白,它们来源于在存在血小板的生物样本中。在特定的实施例中,至少两个蛋白是非血管生成蛋白,来源于也即是获得于血小板。在一个特定实施例中,血小板来源的生物标记物是选自包含以下蛋白的一板或一群蛋白:ACTB、ACTN1、ACTN4、AP4A、CASP3、CAZA1、CFL1、CLU、CNDP2、CRKL、ERP29、FERM、FIBG、FLNA、FPPS、GELS、GPIX、GRP75、GST01、HDHD2、HP蛋白、HSP70、HSP71、HSP90AB1、ILEU、ITGA2B、ITB3、ITGA6、KAP3、LEC、PHB、RINI、SHLB1、SNCA、SPB6、SRC、TBA、TBA4A、THTM、TLN1、TMP1、TSG、TUBB1、VCL和WDR1。当预测改变的细胞/组织/病变的发生,也就是在特定癌、病变中是良性和/或恶性,这可以潜在地是恶性的卵巢癌和前列腺癌,至少两种生物标记可选自以下的组:AP4A、CAZA1、CNDP2、GPIX、ILEU、KAP3、PHB、SHLB1、SPB6和TMP1。当预测涉及癌症发生的癌症状况时,也就是确定当前病变是良性还是恶性时,或者当预测涉及癌症进展的癌症状况时,也就是确定癌症是在早期阶段还是晚期阶段,或者当诊断是卵巢癌还是前列腺癌时,至少两种生物标记可选自以下的组:ACTN1、ACTN4、CRKL、ERP29、FERM、FIBG、FLNA、GELS、GRP75、HP蛋白、HSP70、HSP71、ITGA2B、ITB3、RINI、SRC、TBA、TBA4A、THTM、TLN1、TUBB1、VCL和WDR1。当诊断胰腺癌、癌或非癌(健康)时,至少两种生物标记可选自以下的组:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、HSP90AB1、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。当诊断结直肠癌、癌或非癌(健康)时,至少两种生物标记可选自以下的组:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、GST01、HDHD2、ITA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。也有一板的十二个血小板来源的生物标记物,它可以被应用,而不考虑将被诊断的癌症。因此,结直肠癌、卵巢癌、胰腺癌和前列腺癌都可采用所述板而被诊断,它包括:ACTN1、GELS、ITGA2B、ITB3、PHB、RINI、SPB6、TBA4A、TLN1、TUBB1、VCL和WDR1。当诊断胰腺癌和/或结直肠癌时,22个生物标记物的板已经被证实是可鉴别的,而两种胰腺癌特异的生物标记物和两种结直肠癌特异的生物标记物已经被找到。适用于同时诊断结直肠癌和胰腺癌的该板的生物标记物是:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。当仅诊断胰腺癌时,可采用23个生物标记物的板,可采用以下的这些生物标记:ACTB、ACT1、CASP3、CFL1、CLU、FPPS、GELS、HSP90AB1、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。当仅诊断结直肠癌时,可采用23个生物标记物的板,可采用以下的这些生物标记:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、GST01、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。因此,有几种生物标记物的板,都落入本发明的保护范围之内。一个12种生物标记物的生物标记物板是被应用于确定癌症状况,不论癌症的类型。这个板包括:ACTN1、GELS、ITGA2B、ITB3、PHB、RINI、SPB6、TBA4A、TLN1、TUBB1、VCL和WDR1。另一个10种生物标记物的生物标记物板可区分健康对象和患有卵巢癌和/或前列腺癌病变(良性或恶性)的对象,这个板包括:AP4A、CAZA1、CNDP2、GPIX、ILEU、KAP3、PHB、SHLB1、SPB6和TMP1。另一个23种生物标记物的生物标记物板用于预测卵巢癌或前列腺癌的癌症状况(良性vs恶性或者早期vs晚期),该板包括:ACTN1、ACTN4、CRKL、ERP29、FERM、FIBG、FLNA、GELS、GRP75、HP蛋白、HSP70、HSP71、ITGA2B、ITB3、RINI、SRC、TBA、TBA4A、THTM、TLN1、TUBB1、VCL和WDR1。另一个22种生物标记物的生物标记物板可被用于预测结直肠癌和/或胰腺癌的癌症状况,该板包括:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。对于仅预测结直肠癌状况,可采用一个23种生物标记物的生物标记物板,除了上述的22种生物标记物,还补充生物标记物GST01,而对于仅预测胰腺癌状况,可采用一个23种生物标记物的生物标记物板,除了上述的22种生物标记物,还补充生物标记物HSP90AB1。在一个具体实施例中,相关组或板的两种血小板来源的生物标记物是以各自的方法测量的。在另一个实施例中,测量了两个以上的血小板来源的生物标记物,例如3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种或23种血小板来源的生物标记物(取决于在各自组中的血小板来源的生物标记物),包括所有或至少大多数的在各自组中的血小板来源的生物标记物。为了预测在对象中病变和/或癌的发生,例如卵巢癌或前列腺癌的发生,需测量的血小板来源的生物标记物的数量可以是至少10种生物标记物中的至少两种,例如2种、3种、4种、5种、6种、7种、8种、9种或10种生物标记物,选自:AP4A、CAZA1、CNDP2、GPIX、ILEU、KAP3、PHB、SHLB1、SPB6和TMP1。为了预测在患有卵巢癌或前列腺癌的对象中的癌症状况,需测量的血小板来源的生物标记物的数量可以是至少23种生物标记物中的至少两种,例如2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种或23种生物标记物,选自:ACTN1、ACTN4、CRKL、ERP29、FERM、FIBG、FLNA、GELS、GRP75、HP蛋白、HSP70、HSP71、ITGA2B、ITB3、RINI、SRC、TBA、TBA4A、THTM、TLN1、TUBB1、VCL和WDR1。为了预测在患有卵巢癌或前列腺癌的对象中的癌症状况,需测量的血小板来源的生物标记物的数量可以是至少23种生物标记物中的至少两种,例如2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种或23种生物标记物,选自:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、HSP90AB1、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。为了预测在患有结直肠癌的对象中的癌症状况,需测量的血小板来源的生物标记物的数量可以是至少23种生物标记物中的至少两种,例如2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种或23种生物标记物,选自:ACTB、ACTN1、CASP3、CFL1、CLU、FPPS、GELS、GST01、HDHD2、ITGA2B、ITB3、ITGA6、MLEC、PHB、RINI、SNCA、SPB6、TBA4A、TLN1、TSG、TUBB1、VCL和WDR1。为了预测在患有胰腺癌、卵巢癌、结直肠癌或前列腺癌的对象中的癌症状况,需测量的血小板来源的生物标记物的数量可以是至少12种生物标记物中的至少两种,例如2种、3种、4种、5种、6种、7种、8种、9种、10种、11种或12种生物标记物,选自:ACTN1、GELS、ITGA2B、ITB3、PHB、RINI、SPB6、TBA4A、TLN1、TUBB1、VCL和WDR1。这些实施例的任意一个可与测量至少一个其他生物标记物相结合,优选是至少一个其他血小板来源的生物标记物。然后,癌症状况的预测是优选地基于这些实施例的至少两种血小板来源的生物标记物的测量的量以及至少一种其他生物标记物的测量的量。目前的实施例是特别有用于癌的。因此,癌症是有利的癌或上皮癌。对于这些具体实施例,癌症类型的优选例子包括:卵巢癌和/或前列腺癌。在这样的例子中,癌症状况可以是卵巢癌(或前列腺癌)的存在相比于没有卵巢癌(或前列腺癌),也就是,仅是良性病变,或者是晚期卵巢癌(或晚期前列腺癌)相比于早期卵巢癌(或早期前列腺癌)。同时,在对象中是否存在改变的细胞/组织也可被预测,将对象分类为健康个体或带有改变的细胞/组织(良性或恶性病变)的个体。这些具体实施例也可被应用于胰腺癌或结直肠癌,区分癌与非癌、良性或恶性病变/肿瘤。本发明的方法包括:根据本发明从一板的生物标记物中测量一个或多个生物标记物。优选地,测量至少两个或更多的生物标记物。这些生物标记物可不同地贡献,当被列出时,可采用VIP值。具有最高VIP级别的一种生物标记物可贡献最大,然后递减。取决于用于预测的生物标记物的量,该预测的可靠性会增强。因此,所采用的生物标记物的数量可以基于预测的期望可靠性来选择。这些具体实施方式的另一个方面涉及选择对于对象或病人的癌症治疗方案的方法,优选是哺乳类对象,更优选是人类。该方法包括:根据上述确定该对象是否患有良性病变或癌病变;根据上述预测在该对象中是否存在良性和/或癌病变;根据上述预测在该对象中是否存在结直肠癌或前列腺癌;或者根据上述预测在该对象中是否存在癌。该方法也包括:基于该对象是否患有良性病变或癌病变、基于在该对象中是否存在良性和/或癌病变的预测、基于在该对象中是否存在结直肠癌或前列腺癌的预测、或者基于在该对象中是否存在癌的预测来选择治疗方案。因此,基于根据这些具体实施方式的而至少两种血小板来源的生物标记物的确定或预测的癌症状况或疾病状况能被用于鉴别用于对象的合适的治疗方案。例如,对于对象的癌症状况或疾病状况的预测是癌症(恶性或良性)或非癌症。如果对于对象的癌症状况或疾病状况的预测是癌症,对于该对象选择抗癌治疗方案。这样的抗癌治疗方案的非限制性例子包括:化疗、外科手术和/或辐射。如果对于对象的癌症状况或疾病状况的预测不是癌症,总体上不需要癌症治疗方案。在这个实施例中,选择治疗方案包括:基于癌症状况或疾病状况来选择抗癌治疗方案或者非抗癌治疗方案。在另一个实施例中,对于对象的癌症状况的预测是早期癌症或晚期癌症。在这样的例子中,抗癌治疗方案可被选择为更有效地针对特定的癌症状况,也就是早期或晚期。例如,外科手术可以是对于早期癌症的合适的治疗方案,可选地补充温和的药物治疗,例如激素治疗。对于晚期癌症的合适的治疗方案通常是系统治疗,例如化疗和/或辐射,可选地补充外科手术和佐剂治疗。在这个实施例中,选择治疗方案包括:基于癌症状况来选择对于早期癌症或晚期癌症的治疗方案。在另一个实施例中,对于对象的癌症状况或疾病状况的预测是良性病变或恶性肿瘤。在这样的例子中,抗癌治疗方案可被选择为更有效地针对特定的癌症状况或疾病状况,也就是良性或恶性。例如,外科手术或实际上根本不治疗可以是对于良性病变的合适的治疗方案。对于恶性肿瘤的合适的治疗方案通常是系统治疗,例如化疗和/或辐射,可选地补充外科手术和佐剂治疗。在这个实施例中,选择治疗方案包括:基于癌症状况或疾病状况来选择对于良性病变或恶性肿瘤的治疗方案。这些具体实施方式IDE进一步方面涉及治疗患有癌症的对象的方法。在一个具体实施例中,该方法包括:在来自对象的生物样本中测量选自以下组中的每种血小板来源的生物标记物的各自的量:ITGA2B、WDR1、ACT1、FLNA、FERMT3、TUBB1和VCL,或者上面定义的任意其他生物标记物板。请注意的是,FERMT3在这里也指FERM。该方法还包括:基于这些测量的量来计算状况值。该方法还包括:如果状况值超过预定的阈值时,以抗癌治疗方案治疗该对象。在一个特定实施例中,根据研究1A,计算状态值包括:根据上述方程式(1)计算状态值;然后治疗该对象优选地包括:如果该状态值超过0.25至0.30的阈值范围,优选是0.29,则以抗癌治疗方案治疗该对象。在另一个特定实施例中,根据研究1A,治疗患有癌症的对象的方法包括:在来自对象的生物样本中测量选自以下组中的至少两种、优选每种血小板来源的生物标记物的各自的量:ITGA2B、WDR1、ACT1、FLNA、FERMT3、TUBB1和VCL,或者上面定义的任意其他生物标记物板。该方法还包括:以各自的参考量来比较至少两种、优选每种血小板来源的生物标记物的各自的量。该方法还包括:如果FERMT3、TUBB1、VCL和碱性ITGA2B的至少一种的各自的量超过FERMT3、TUBB1、VCL和碱性ITGA2B的各自的参考量,和/或WDR1,FLNA,ACTN1和酸性ITGA2B的至少一种的各自的量超过WDR1,FLNA,ACTN1和酸性ITGA2B的各自的参考量时,以抗癌治疗方案治疗该对象。在一个特定实施例中,根据研究1A,治疗对象包括:如果FERMT3、TUBB1、VCL和碱性ITGA2B的各自的量超过FERMT3、TUBB1、VCL和碱性ITGA2B的各自的参考量时,以及如果WDR1,FLNA,ACTN1和酸性ITGA2B的各自的量超过WDR1,FLNA,ACTN1和酸性ITGA2B的各自的参考量时,以抗癌治疗方案治疗该对象。各自的参考量可从对照组或之前对象自身在这里所讨论的组中被确定。这些具体实施方案的进一步方面涉及试剂盒,包括:固定支持物,被配置为支持选自上述展示组的至少两种血小板来源的生物标记物。该试剂盒也包括:使用说明书,用于使用该固定支持物来从来自对象的生物样本中测量至少两种血小板来源的生物标记物。该试剂盒还包括:使用说明书,用于确定对象是否患有良性病变或者患有癌病变;用于预测在对象中是否存在良性和/或癌病变;用于预测在对象中是否存在结直肠癌或胰腺癌;或者用于预测在对象中是否存在癌,取决于所采用的特定组的血小板来源的生物标记物。在一个特定的实施例中,所述试剂盒的固体支持物是2-DE凝胶。这些用于使用固体支持物的使用说明书优选地包括:基于等电点和质量来运行2D凝胶电泳以从生物样本中分离血小板蛋白质的使用说明书。这些用于使用固体支持物的使用说明书优选地包括:采用该固体支持物来测量在生物样本中每种血小板来源的生物标记物的各自的量。在一个具体实施例中,用于预测癌症状况或疾病状况的使用说明书可包括:基于上面的方程式(1)来计算状态值。用于预测癌症状况或疾病状况的使用说明书还包括:基于状态值的比较和预定的阈值来预测癌症状况或疾病状况的使用说明书。预定的阈值范围优选是0.25至0.30,更优选是等于0.29。上述的试剂盒可根据在前面讨论的方法的任意方面而被采用。在这样的例子中,用于预测癌症状况或疾病状况的使用说明书通常可由以下使用说明书来替代:基于测量而用于检测或预测在对象中的良性或恶性病变/肿瘤的发生的使用说明书、用于将测量关联到在对象中的癌症状况或疾病状况的使用说明书、基于测量来诊断对象的使用说明书、基于测量来检测在对象中是否存在癌症的使用说明书、基于测量而确定对象的癌症是早期或者晚期的使用说明书,或者基于测量而确定对象的病变或肿瘤是良性或恶性的使用说明书。可替代地,除了用于预测癌症状况或疾病状况的使用说明书,所述试剂盒还包括:基于癌症状况或疾病状况对于对象选择治疗方案的使用说明书。这些具体实施方式的相关方面定义了一种试剂盒,包括:固体支持物,被配置为支持选自以下组的血小板来源的生物标记物:ACTB、ACTN1、ACTN4、AP4A、CASP3、CAZA1、CFL1、CLU、CNDP2、CRKL、ERP29、FERM、FIBG、FLNA、FPPS、GELS、GPIX、GRP75、GST01、HDHD2、HP蛋白、HSP70、HSP71、HSP90AB1、ILEUJTGA2B、ITB3、ITGA6、KAP3、MLEC、PHB、RINI、SHLB1、SNCA、SPB6、SRC、TBA、TBA4A、THTM、TLN1、TMP1、TSG、TUBB1、VCL和WDR1。所述试剂盒也包括:用于使用固体支持物以在来自对象的生物样本中测量在该组中的每种血小板来源的生物标记物的各自的量。该试剂盒还包括:基于测量的量而计算状态值的使用说明书,以及如果该状态值例如超过预定的阈值,以抗癌治疗方案治疗该对象的使用说明书。在另一个具体实施例中,所述试剂盒包括:固体支持物,被配置为支持选自以下组的血小板来源的生物标记物:ACTB、ACTN1、ACTN4、AP4A、CASP3、CAZA1、CFL1、CLU、CNDP2、CRKL、ERP29、FERM、FIBG、FLNA、FPPS、GELSGPIX、GRP75、GST01、HDHD2、HP蛋白、HSP70、HSP71、HSP90AB1、ILEU、ITGA2B、ITB3、ITGA6、KAP3、MLEC、PHB、RINI、SNCA、SPB6、SRC、SHLB1、TBA、TBA4A、THTM、TLN1、TMP1、TSG、TUBB1、VCL和WDR1,在来自对象的生物样本中。该试剂盒也包括:以各自的参考量比较至少两种、优选每种血小板来源的生物标记物的各自的量的使用说明书。在一个特定实施例中,用于治疗对象的使用说明书包括:如果FERMT3、TUBB1、VCL和碱性ITGA2B的各自的量超过FERMT3、TUBB1、VCL和碱性ITGA2B的各自的参考量时,以及如果WDR1,FLNA,ACTN1和酸性ITGA2B的各自的量超过WDR1,FLNA,ACTN1和酸性ITGA2B的各自的参考量时,以抗癌治疗方案治疗该对象。这些具体实施方式的另一个方面定义了诊断系统1,参见图4。该诊断系统1包括:固体支持物2,被配置为支持选自以下组的至少两种血小板来源的生物标记物:ACTB、ACTN1、ACTN4、AP4A、CASP3、CAZA1、CFL1、CLU、CNDP2、CRKL、ERP29、FERM、FIBG、FLNA、FPPS、GELS、GPIX、GRP75、GST01、HDHD2、HP蛋白、HSP70、HSP71、HSP90AB1、ILEU、ITGA2B、ITB3、ITGA6、KAP3、MLEC、PHB、RINI、SHLB1、SNCA、SPB6、SRC、TBA、TBA4A、THTM、TLN1、TMP1、TSG、TUBB1、VCL和WDR1。该诊断系统1也包括:检测器3,被配置为在固定支持物2上检测来自对象的生物样本的至少两种血小板来源的生物标记物。该检测器3也可被配置为产生至少两种血小板来源的生物标记物的各自估计的量。该检测器3是优选地连接到诊断系统1的处理器4。该处理器4是被配置为处理各自量的估算。该处理器4也被配置为产生以下评估:对象是否患有良性病变或癌病变;在对象中存在良性和/或癌病变的预测;在对象中存在结直肠癌或胰腺癌的预测;或者在对象中存在癌的预测,取决于所采用的哪一特定组的血小板来源的生物标记物。在一个特定实施例中,固体支持物2是2-DE凝胶2,被配置为基于等电点(等电聚焦)和质量(SDS-PAGE)从生物样本中分离血小板蛋白质。在一个特定实施例中,检测器3是被配置为在固体支持物2上检测在来自生物样本中的一组中的每个血小板来源的生物标记物,并产生每种血小板来源的生物标记物的各自估算的量。所述检测器3可以是任意检测器,被配置为对固体支持物2摄像。根据这些具体实施方式能被采用的检测器3的非限制性例子是具有16比特分辨率的爱普生图像扫描仪。适用于该目标的任何高分辨率图像扫描仪也可被应用于在本发明中使用。参考量可被存储在存储器5,它连接到处理器4。之前已经对于特定的对象确定了这些参考量,然后将这些参考量输入到存储器5。可替代地,之前已经采用诊断系统1对于对照组确定了这些参考量。另一种替代方式是:已经由用户采用合适的用户输入方式(例如键盘(未示出)或者触摸感应显示屏6)将这些参考量输入到诊断系统1和存储器5。在一个可替代的具体实施例中,处理器4被配置为根据上述的方程式(1)基于血小板来源的生物标记物的各自的量来计算状态值。然后,上述的存储器5是优选地被配置为存储定义的阈值。然后,处理器4被配置为比较状态值和定义的阈值,并基于所述比较产生在对象中的癌症状况的预测。所预测的癌症状况或疾病状况优选地是被显示在诊断系统1的显示器6上或被显示在连接到诊断系统1的显示器6上。所显示的癌症状况或疾病状况可以是癌或非癌、早期癌症或晚期癌症、良性肿瘤或恶性肿瘤。所述处理器4可以是具有硬件和/或软件的任意计算机或处理终端,这些硬件和/或软件被配置为执行在前面所公开的处理器的操作。处理器4的非限制性例子包括:包含软件SameSpots的计算机。这些具体实施方式的进一步方面涉及一种计算机程序产品,被配置为预测在对象中的癌症状况或疾病状况。该计算机程序产品包括:计算机可读介质,具有内置的计算机可读程序编码。该计算机可读程序编码包括:配置为根据本发明在来自对象的生物样本中测量至少两种血小板来源的生物标记物的计算机可读程序编码。该计算机可读程序编码还包括:配置为产生以下估计的计算机可读程序编码:对象是否患有良性病变或癌病变;在对象中存在良性和/或癌病变的预测;在对象中存在结直肠癌或胰腺癌的预测;或者在对象中存在癌的预测,取决于所采用的哪一特定组的血小板来源的生物标记物。这里所采用的诊断装置提供了以下预测:对象可能患有疾病,例如癌症,例如卵巢癌、前列腺癌、结直肠癌或胰腺癌。需要重视的是,没有技术是完美的,这样的诊断可通过其他放方法来确认,例如外科检查、影像、组织样本的遗传学检查等。关于个体化癌症治疗的突破将会是血液测试,使它可以区分(1)完全健康或一些细胞/组织改变(存在良性或恶性病变)和/或(2)早期(通常局部)和晚期(通常扩散或传播)肿瘤疾病。该测试将具有区分正常健康个体和带有改变的细胞/组织(例如良性/恶性)的个体的能力,也就是区分健康对象和带有一些种类的细胞或组织改变(例如良性或恶性病变)的对象。该测试还进一步能确定带有改变的细胞/组织(例如良性/恶性)的对象是否具有良性病变或恶性病变(癌症),也就是,区分良性病变和恶性病变。该测试也能确定或区分患有恶性新生物疾病(癌症、恶性肿瘤)的对象是处于疾病的早期阶段还是晚期阶段,也即是区分早期癌症和晚期癌症。所揭示的检测癌症的诊断或发展以用于治疗方案的方法可被用于结合其他诊断方法,包括但不限于:执行活检、执行扫描(X光、MRI、PET、CT等类似)、筛查其他生物标记物或该疾病的可能的其他指标。本领域技术人员应当明确的是,这里列出的用于诊断或筛查的检测疾病的其他方法并不是完全的,小样品的其他可能的诊断方法也能容易地被结合到所公开的方法中,用于癌症诊断的目的,例如卵巢癌、前列腺癌、结直肠癌和/或胰腺癌。这里所描述的对象包括人类和病人以及其他哺乳类动物,在兽医或研究设置中,包括小鼠。这些对象可以是雄性的或雌性的,可以是任何种族或民族,包括但不限于:高加索人、非裔美国人、非洲人、亚洲人、西班牙人、印度人等。对象可以是任何年龄,包括新生儿、婴儿、儿童、未成年人、成人和老年人。对象也可包括动物对象,特别是哺乳类对象,例如狗、猫、马、鼠等,筛选用于兽医药物或药学研究目的。对象包括但不限于:那些具有、拥有、已经暴露给或者之前已经诊断为具有一种或多种癌症的风险因素的对象。风险因素包括:年龄、性别、种族、吸烟、体重、肥胖、糖尿病、工作暴露、家族史、酒精和药物使用和类似因素。这些风险因素可被考虑为结合所揭示的用于诊断或筛查的检测癌症的方法。发明人已经开展了几种实验性研究,它们具有所揭示的有用于癌症预测和诊断的血小板来源的生物标记物板。研究1揭示了用于卵巢癌的生物标记物。研究1A揭示了有用于检测癌症状况和进展的7种生物标记物,研究1B揭示了21种生物标记物,附加的16种生物标记物(5个重复)给出了总共23种生物标记物,有用于预测或诊断卵巢癌;以及研究1C揭示了10种生物标记物,有用于区分健康对象和患有一些种类的病变(良性或恶性病变)的对象。关于前列腺癌的研究2表明:来自研究1的23种生物标记物也可被应用于前列腺癌。研究3和研究4鉴定了34种生物标记物用于胰腺癌和/或结直肠癌,其中22种生物标记物可应用于这两种癌症,而一种生物标记物是胰腺癌特异的,一种生物标记物是结直肠癌特异的。一板的12种生物标记物显示了在所有癌症检测中都被采用,因此能用于诊断不论要诊断哪种癌症。总的来说,所有研究揭示了45种特异的生物标记物,它们有用于诊断和预测癌症和癌症状况。其中一些生物标记物显示为上调性,一些显示了下调性。然而,取决于用于评估这些生物标记物的方法,这可以改变。因此,本发明的总的概念是:生物标记物(对于给出的板)的相对的量恶改变是在特定阈值之上,正如下面详细定义的,不论它是增加还是减少,都可被视为同等有兴趣,当预测或诊断癌症和/或癌症状况和/或病变(改变的组织)的发生时,正如在本发明中所述。研究1A来自研究1A的实验数据,正如这里进一步展示的,已经表明:这里揭示的7种血小板来源的生物标记物,在其中一个具体实施例中,根据在通过或至少在对象的血小板的生物标记物的表达量的改变或变化,可被划分为两组,该对象患有癌症或者非癌症(良性),并使能够诊断患有早期癌症的对象。非常重要的是,这些生物标记物可增加或减少,取决于所采用的检测和分析方法。虽然如此,在研究1A中第一组血小板来源的生物标记物显示了对于严重癌症状况的生物标记物的相对量的增加。因此,患有癌症或患有晚期癌症或早期癌症的对象总体上具有这些生物标记物的较高的改变的(较高)相对量,与没有癌症或患有良性病变的对象相比较。这个第一组生物标记物包括:FERMT3、TUBB1、VCL和碱性ITGA2B。碱性ITGA2B是ITGA2B的异构体,可发现在二维电泳胶的碱性部分,也就是,具有pH大于6的等电点,因此在中性pH带上负电荷。在研究1A中的第二组血小板来源的生物标记物显示了对于严重癌症状况的生物标记物的相对量的减少。患有癌症或患有晚期癌症或早期癌症的对象总体上具有这些生物标记物的较低的改变的相对量,与没有癌症或患有良性病变的对象相比较。这个第一组生物标记物包括:WDR1、FLNA、ACTN1和酸性ITGA2B。酸性ITGA2B是ITGA2B的异构体,可发现在二维电泳胶的酸性部分,也就是,具有pH小于6的等电点,因此在中性pH带上正电荷。在一个具体实施例中,至少两种血小板来源的生物标记物是选自上述的第一组。在这样的例子中,能基于至少两种血小板来源的生物标记物的量是否已经增加,优选是增加高于参考量,来预测在对象中的癌症状况。在另一个具体实施例中,至少两种血小板来源的生物标记物是选自上述的第二组。在这样的例子中,能基于至少两种血小板来源的生物标记物的量是否已经减少,优选是减少低于参考量,来预测在对象中的癌症状况。对于至少两种血小板来源的生物标记物的各自的量的各自的参考量是被(个别地)比较的,能作为在对照组中用于相关的血小板来源的生物标记物的确定的参考量。例如,如果该预测是存在改变的组织或不存在改变的组织(病变),对照组可以是一组具有未检测到改变的组织(病变)的健康对象。然后,对于对照组,至少两种血小板来源的生物标记物的量是被测量,从这个对照组中确定参考量,例如在该对照组的健康对象所确定恶量的平均值。对于卵巢癌和前列腺癌,区分健康对象与患有病变的对象,所测量或检测的至少两种血小板来源的生物标记物可被选自以下特定的至少两种血小板来源的生物标记物:AP4A、CAZA1、CNDP2、GPIX、ILEU、KAP3、PHB、SHLB1、SPB6和TMP1。类似地,当在对象中存在改变的组织(病变)以及预测癌症状况时,存在癌症或不存在癌症(良性),对照组可以是一组良性对照,也就是,被诊断为仅患有良性病变的对象。类似地,对于对照组,至少两种血小板来源的生物标记物的量被测量,从这个对照组中确定参考量,例如在该对照组的健康对象所确定恶量的平均值。这个方法也可被应用于这样的例子,当癌症状况是晚期癌症或肿瘤,相对于早期癌症或肿瘤。有利地,对照组可以是已经被诊断为早期癌症的对象。在一个替代方法中,参考量可早于疾病的发展而从对象自身被检测,也就是,早于任何癌症或在当对象仅患有早期癌症或良性病变的时期。在生物样本中生物标记物的量可以是:该生物标记物在生物样本中的数量或浓度、基于该生物标记物在生物样本中的检测量的分值、基于病人群体的百分比、该生物标记物在生物样本中的定量值或半定量值,或者基于所检测的生物标记物的其他定量。在这里所用的血小板来源的生物标记物的量上的增加或减少是指在来自对象的生物样本中或通过生物样本的在血小板蛋白质的相对量上增加的相对量或减少的相对量,与在对照中的血小板蛋白质的相对参考量相比较。对照样本包括:来自相应对象的未感染癌症(例如卵巢癌、前列腺癌)的生物样本,或者来自非患病组织或相同对象的组织的非患病部分的生物样本,或者来自相同对象的早于疾病发展的生物样本。血小板来源的生物标记物的可检测量的存在与否也可被视为一种增加或减少。这里所采用的在血小板来源的生物标记物的量上的增加或减少是指例如在来自对象的生物样本中或通过生物样本的在血小板蛋白可检测的量上的增加的量(例如,增加10%、20%、30%、40%、50%、100%或更多)或减少的量(例如,减少10%、20%、30%、40%、50%、100%或更多),与在对照中的血小板蛋白质的相对参考量相比较。关于卵巢癌,卵巢癌分期的国际系统鉴别了在诊断点的传播。在早期诊断期间的正确分期影响治疗决策。该分期系统被称为FIGO系统,来自它的作者——国际妇科肿瘤学家协会。根据卵巢癌的2013版FIGO分期系统,阶段1的特征是肿瘤局限在卵巢或输卵管,阶段2的特征是肿瘤涉及一侧或双侧卵巢或输卵管,带有骨盆扩散(低于真假骨盆界限)或主要是腹膜癌;阶段3的特征是肿瘤涉及一侧或双侧卵巢或输卵管,或主要是腹膜癌,具有确认的(细胞学或组织学)扩散到腹膜表面,涉及盆腔和腹腔腹膜,和/或扩散到腹膜后淋巴结;以及阶段4的特征是在腹膜腔之外的远端转移(包括实质肝/脾转移和腹外转移)。在一个进一步的实施例中,所述方法包括:在生物样本中测量来自研究1A的第一组的至少一个血小板来源的生物标记物的各自的量,以及在生物样本中测量第二组的至少一个血小板来源的生物标记物的各自的量。因此,在这个实施例中,对于严重的癌症状况,至少一个被检测的血小板来源的生物标记物是被期望为增加,而对于严重的癌症状况,至少另一个被检测的血小板来源的生物标记物是被期望为减少。在这样的例子中,基于至少两个确定量,对于对象可计算状态值,优选是在这两个确定值之间的商数。这样的商数可以是在来自第一组的血小板来源的生物标记物的量除以来自第二组的血小板来源的生物标记物的量的商。然后,对于患有癌症的对象,这样的商数将会显著较高,相比于没有癌症的对象,并且对于患有扩散的癌症的对象,该商数将会是显著较高,相比于患有局部癌症的对象,且对于患有恶性肿瘤的对象,该商数将会显著较高,相比于患有良性肿瘤的对象。一个可替代的例子是计算在来自第二组的血小板来源的生物标记物的量除以在来自第一组的血小板来源的生物标记物的量的商。在这样的例子中,对于患有癌症的对象,这样的商数将会显著较低,相比于没有癌症的对象,并且对于患有扩散的癌症的对象,该商数将会是显著较低,相比于患有局部癌症的对象,且对于患有恶性肿瘤的对象,该商数将会显著较低,相比于患有良性肿瘤的对象。如果超过一个血小板来源的生物标记物是从第一组和/或对于第二组测量的,从第一组的血小板来源的生物标记物的量的总数是优选地除以从第二组的血小板来源的生物标记物的量的总数,反之亦然。本发明的方法学除了能被用作诊断多种不同癌症的分析,还可被用于组合。如果在多重平台(也即是Luminex或其他平台)上运行所有用于指示的生物标记物,普通组是在一个分析中被运行。从该分析中,多种不同诊断结果会被分别过滤掉。分析的合并可被这样设计以致卵巢癌、前列腺癌、胰腺癌、结直肠癌和其他普通组的任意组合能以成对或较大的群组的方式被结合在一起。这将使得癌症的分析能够或不能结合特定的癌症。来自研究1A的具体实施例在一个特定实施例中,这些具体实施方式的每个血小板来源的生物标记物的各自的量是优选地在生物样本中被测量,也就是:ITGA2B、WDR1、ACTN1、FLNA、FERMT3、TUBB1和VCL。在这样的例子中,在对象中癌症状况的预测可以是基于在FERMT3、TUBB1、VCL和碱性ITGA2B的各自的量上的任何增加,以及在WDR1、FLNA、ACTN1和酸性ITGA2B的各自的量上的任何减少,相对于各自的参考量。在一个特定实施例中,基于这些具体实施方式的血小板来源的生物标记物的测量量计算状态值。在一个特定实施例中,基于第一组的血小板来源的生物标记物(也就是FERMT3、TUBB1、VCL和碱性ITGA2B)的各自的量的第一总数来计算状态值,以及基于第二组的血小板来源的生物标记物(也就是WDR1、FLNA、ACTN1和酸性ITGA2B)的各自的量的第二总数来计算状态值。在一个具体实施例中,基于在第一总数与第二总数之间的商数来计算状态值。因此,在特定实施例中,状态值如下式计算:([FERMT3]+[TUBB1]+[VCL]+[ITGA2B]碱性)/([WDR1]+[FLNA]+[ACTN1]+[ITGA2B]酸性)(1)其中,[ITGA2B]碱性表示负电荷的ITGA2B的量,[ITGA2B]酸性表示正电荷的ITGA2B的量,[X]表示相关的血小板来源的生物标记物的量,X=FERMT3、TUBB1、VCL、WDR1、FLNA或ACTN1。在上面公开的实施例中,基于所测量的血小板来源的生物标记物的量来计算状态值,这个状态值是优选地与设定的阈值相比较。因此,在这样的实施例中,癌症状态的预测优选地包括:将状态值与设定的阈值相比较,基于该比较来预测在对象中的癌症状况,也就是,该状态值是高于还是低于阈值。在方程式(1)中定义的算法产生了对于非癌症或良性生物样本的低值、对于局部癌症的中间值,以及对于恶性或扩散的/晚期癌症的高值。阈值可以通过计算以下的状态值而确定:对于一组癌症对象的状态值与对于对照组的健康对象的状态值、对于一组患有扩散的癌症的对象的状态值与对于患有早期癌症的对照组的对象的状态值,或者对于一组患有恶性肿瘤的对象的状态值与患有良性病变的对照组的对象的状态值。在这样的例子中,阈值可以是基于来自这两个组的状态值的比较而确定。在特定的实施例中,阈值是以下式计算:[(癌症平均值–1SDEV)+(对照平均值+1SDEV)]×1/2(2)其中,癌症平均值表示从癌症组的对象中获得的平均状态值,对于患有晚期癌症或患有恶性肿瘤的对象的组;SDEV表示标准偏差;对照平均值表示从对照组的对象中获得的平均状态值。阈值的合适数值通常取决于特定的癌症类型,以及通常基于癌症状态,也就是,癌比非癌、晚期癌症比早期癌症,或者恶性肿瘤比良性病变。该阈值可采用上述的方程式(1)和(2)对于相关的癌症类型和癌症状态而被确定。在一个具体实施例中,阈值优选是在0.25至0.30的范围内,优选等于0.29。这个阈值已经被确定,正如这里进一步所揭示,对于患有恶性卵巢癌的对象组和患有良性病变(例如子宫肌瘤或囊性腺瘤)的对照组。在一个特定实施例中,在0.25至0.30的范围内、优选等于0.29的阈值是被用于区分癌与非癌。不患有任何癌症的对象通常具有这样的状态值,即采用方程式(1)计算的在0.05至0.25之间的状态值。相应地,患有癌症的对象通常具有这样的状态值,即采用方程式(2)计算的在0.30至0.60之间的状态值。至少对于卵巢癌,用于区分晚期癌症与早期癌症的合适的阈值通常是在0.25至0.60的范围,例如在0.30至0.60的范围内。相应地,用于区分恶性肿瘤与良性肿瘤的合适的阈值通常是在0.25至0.60的范围,例如在0.30至0.60的范围内。研究1B接着研究1A和它的正输出,开始了对于进一步确证这些生物标记物的广泛研究。在这个研究中,更大群的病人被采用以便有足够的病人来覆盖常规生物学变化性以及该癌症自身的生物传播。涉及基于PLS的结果统计分析的更高级评估策略也可被采用。研究1B包括16种良性对照(BC)和20个患有晚期卵巢癌并扩散到腹腔的女性(SC)。对照是患有良性病变的妇女,例如子宫肌瘤或良性囊性腺瘤。所有病人在瑞典索尔纳的Karolinska大学医院的妇产科接受诊断和治疗。根据本地道德伦理委员会Dnr.2010/504-31的允许,病人捐血用于研究。根据(实施例1和2)所述的标准规程制备和分析血小板。在2D凝胶分离的蛋白质的图像分析之后,代表所有样本的数据被进一步通过多变量统计来分析(偏最小二乘判别分析,PLS)。具有两个组件的PLS模型显示了最好的结果(参见图5)。对于最优化和交叉验证模型,获得90%的敏感度和94%特异性。根据它们对于预测的贡献,采用VIP(变量的重要性)参数,对变量分级。然后,通过质谱分析选择顶级的变量(表示最高VIP值的蛋白点)用于鉴定。总共>75%的顶级16种蛋白质,和>50%的顶级50种蛋白质被鉴定。成功的鉴定是列在表4,一些鉴定未包括,因为它们是被视为对于确认较低可行的。随着选择生物标记物的候选者,根据VIP等级(在支架[VIP级]内给出)分类:ERP29[1]、ACTN4[3]、HP[4、8]、TLN1[6、10、11、12、27、50]、SRC[6]、ITB3[13]、HSP71[16]、TBA4A[19]、ITA2B[24]、TBA[25]、CRKL[26]、GRP75[32]、GELS[34、79]、TUBB1[37]、HSP70[39]、FIBG[40]和ITA2B[45]。一个附加的生物标记物候选者(RINI)是通过数据组(p<0.05)的VNOVA分析找到的。为了详细说明,参见表4和标签(总结)。为了评估该模型,采用了一组独立测试的11个SC和8个LC样本。采用训练组构建预测模型,包括选自模型最优化方法的模型参数。结果显示:9个SC和全部8个LC样本被正确地分类,对于所分类的模型,它们对应于89%灵敏度。因此,我们确信,我们首次显示新的血小板来源的生物标记物板,它可被用于非侵入式诊断或在患有高度恶性癌症的对象内预测癌症状况,例如卵巢癌、结直肠癌或胰腺癌或前列腺癌。目前,由病理学家进行的显微镜检测是需要的,以便确定癌症状况,这可导致改变结果,取决于病理学家。本发明的具体实施方式提供了比目前所用的更多客观的诊断和癌症的预后。本发明能被用于癌症的诊断、治疗和预后,无需活检。血小板来源的生物标记物的结合是被设计用于区分健康对照(无癌症、无病变)、良性对照(无癌症、良性病变)和癌症样本,以及用于从这两组中区分早期(通常局部、未扩散)癌症晚期癌症,已经明显影响治疗策略的选择。实施例实施例1——研究1A病人和样本制备本研究包括11种对照和6名妇女,具有确定的扩散到腹腔的卵巢癌。对照是年龄在42-70岁(平均年龄65岁)的人。这些对照是患有良性病变的妇女,例如子宫肌瘤或良性囊腺瘤。癌症病人是在49-74岁(平均年龄67岁)。所有病人在瑞典索尔纳的Karolinska大学医院的妇产科接受诊断和治疗。参见下面的表1。表1:对照和癌症病人分离方法(采用在研究1B和1C中的相同方法)血小板的分离是通过散布离心法来实现。在含有乙二胺四乙酸(EDTA)的vaccutainer管中收集血液以避免凝结,处理30分钟,室温保持。收集病人的信息,每个样本给予特定的身份编号。第一次离心是在+4℃以1500g离心10分钟。收集血浆,弃去红细胞。然后,将收集的血浆在+4℃以3700g离心10分钟。在5x1mLEppendorf管中收集血小板较少的血浆(PPP),-70℃存储以用于进一步分析。以500μ10.9%NaCl重悬和清洗残留的沉淀(分离的血小板部分),在Eppendorf管中在+6℃以5600g离心10分钟。弃去上清,记录沉淀的重量。制备血小板沉淀的代表性样本,以显微镜确认分离的血小板的纯度和质量。抽提血小板部分,进一步冻干至完全干粉,重悬于溶解缓冲液,含有9M尿素、2M硫脲、1MEDTA,25mM3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、蛋白酶抑制剂和载体两性电解质。血小板蛋白质溶解产物在室温摇3小时,然后以12000RPM离心15分钟。收集上清,采用Bradford蛋白质分析方法(Bio-Rad实验室公司的QuickStartTM)测定蛋白质浓度。蛋白质分离在二维凝胶电泳(2-DE)分析之前,将蛋白质溶解产物稀释为300μl含75.0g总蛋白的浓度,对于每个样本,再水化缓冲液含有9M尿素、2M硫脲、65mMCHAPS、0.5%TritonX100、0.5%v/v固定pH梯度(IPG)缓冲液pH4-7以及18mM二硫苏糖醇。第一个分离步骤是等电聚焦(IEF),其中蛋白质是根据它们的等电点而被分离,跑胶22.5小时。采用胶长17cm,pH4-7IPG带(BioRad公司)。第二尺寸、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),根据它们的分子量分离这些蛋白质。该2-DE凝胶是10-13%丙烯酰胺梯度,以哌嗪双丙烯酰胺(PDA)作为交联剂,尺寸为200×250×1.5mm。样品蛋白在100volt、12℃分离约20小时。采用质谱兼容染色协议对SDS凝胶进行银染色,然后在爱普生影像扫描仪III(16比特分辨率)扫描。进一步采用ProgenesisSameSpots软件(非线性动态有限公司)分析图像。通过质谱分析鉴定蛋白质从胶中切出银染带,胶内消化处理,在瑞典乌普萨拉路德维格研究所进行分析,如前面所述(赫尔曼,U.(2000)通过SDS/PAGE和胶内消化来制备样品。EXS88,43-54.)。简言之,采用Farmer氏试剂进行银脱色,引入胰蛋白酶(猪的修饰的测序级,Promega公司,美国威斯康星州麦迪逊)到干燥的胶片中。在胰蛋白酶过夜消化后,多肽被吸附到C18ZipTip柱,清洗,然后以含有基质(α-氰基-4-羟基肉桂酸)的乙腈直接洗脱到目标板上。通过在德国不莱梅的布鲁克·道尔顿公司的UltraflexIIITOF/TOF仪器上通过MALDI-TOF质谱法产生质量清单。采用搜索引擎MASCOT(英国伦敦的矩阵科学公司)执行鉴别的检索,通过扫描NCBI序列数据库的当前版本。采用自溶胰蛋白酶肽内部地校准质谱,公差被设为0.02Da。蛋氨酸的氧化是允许的。从搜索引擎的评分系统中判断身份的重要性。结果与讨论当比较对照与患有扩散的卵巢癌的病人时,找到35个增加或减少的蛋白点(图1)。在扩散的卵巢癌样本中,共有19个点是减少的,而17个点是增加的。蛋白质的鉴定所有一起,35种蛋白点从胶中被切除,并通过质谱来分析。我们获得15种成功的鉴定身份;8种蛋白点在癌症组是下降的,而7种蛋白点是上升的,相比于对照(表2)。表2:生物标记物的鉴定1–点数#2–所观察的等电点(pi)和分子量(Mr)3–箭头显示增加或减少4–整联蛋白α-2b是由7个不同的蛋白点表示,四个蛋白点是在癌症中下降,其余3个蛋白点是上升。整联蛋白α2b是由所鉴定的15个蛋白点的7个来表示的。当看位置时,我们观察到:它们中的4个是位于胶的酸性部分,在100kDa之上,且都是减少的(图2)。整联蛋白α2b的磷酸化异构体的减少水平可以与在癌症中功能丧失有关联。其他两个鉴定的整联蛋白是位于2-DE胶的右边,在100kDa之上,它们是增加的。整联蛋白具有至少13个磷酸化位点,它们可能给出蛋白点的“火车编队”,并可导致许多不同的点翻译修饰。诊断算法生物标记物的相对质量是根据下面的诊断算法来计算的:([FERMT3+TUBB1+VCL]+[ITGA2B(碱性)])/([WDR1+FLNA+ACTN1]+[ITGA2B(酸性)])(3)区分癌与非癌的阈值是如下定义的:[(癌症平均值–1SDEV)+(对照平均值+1SDEV)]×1/2(4)其中,癌症平均值表示采用上述的诊断算法(3)应用于6个癌症病人所获得的平均值,SDEV表示标准偏差,而对照平均值表示采用上述的诊断算法(3)应用于11个对照所获得的平均值。图3显示了采用上述的诊断算法(3)对于17个样本的输出值。从方程式(4)获得的阈值是0.29。实施例2——研究1B研究2包括16个良性对照(BC)和20个患有晚期卵巢癌并扩散到腹腔的女性(SC)。对照是患有良性病变的妇女,例如子宫肌瘤或良性囊性腺瘤。所有病人在瑞典索尔纳的Karolinska大学医院的妇产科接受诊断和治疗。根据(实施例1和2)所述的标准规程制备和分析血小板。在2D凝胶分离的蛋白质的图像分析之后,代表所有样本的数据被进一步通过多变量统计来分析(偏最小二乘判别分析,PLS)。具有两个组件的PLS模型显示了最好的结果(参见图5)。对于最优化和交叉验证模型,获得90%的敏感度和94%特异性。根据它们对于预测的贡献,采用VIP(变量的重要性)参数,对变量分级。然后,通过质谱分析选择顶级的变量(表示最高VIP值的蛋白点)用于鉴定。总共>75%的顶级16种蛋白质,和>50%的顶级50种蛋白质被鉴定。成功的鉴定是列在表4,一些鉴定未包括,因为它们是被视为对于确认较低可行的。随着选择生物标记物的候选者,根据VIP等级(在支架[VIP级]内给出)分类:ERP29[1]、ACTN4[3]、HP[4、8]、TLN1[6、10、11、12、27、50]、SRC[6]、ITB3[13]、HSP71[16]、TBA4A[19]、ITA2B[24]、TBA[25]、CRKL[26]、GRP75[32]、GELS[34、79]、TUBB1[37]、HSP70[39]、FIBG[40]和ITA2B[45]。一个附加的生物标记物候选者(RINI)是通过数据组(p<0.05)的VNOVA分析找到的。为了详细说明,参见表4和标签(总结)。为了评估该模型,采用11个SC和8个LC样本作为一个独立测试组。采用训练组建立一个预测模型,该训练组包括选自模型最优化方法的模型参数。结果显示:11个SC样本中的9个以及所有8个LC样本都被正确地归类,这相当于对于分类模型的89%的灵敏度。病人和样本制备本研究包括16名对照和31名患有扩散到腹腔的卵巢癌妇女。这些对照的平均年龄是62+14(标准偏差)岁,在瑞典索尔纳的Karolinska大学医院的妇产科收集样本。这些对照是患有良性病变的妇女,例如子宫肌瘤或良性囊性腺瘤。癌症病人的年龄是65+14(标准偏差)岁。这些癌症病人都是在Karolinska大学医院的妇产科被诊断的,参见下面的表3。表3:对照和癌症病人——研究1B样品分离和制备方法his采用在上述实施例1A中采用的相同方法。数据分析偏最小二乘法(PLS)被用于对数据建模(PLS-regression:abasictoolofchemometricsChemometricsandIntelligentlaboratorysystemsWoldS,M,Eriksson,L,2001,58,109-130)。它是一种回归方法,能通过以下方法减少数据尺寸:最大化预测矩阵(X)与响应矩阵(Y)的协方差,保持相应的尺寸(PLS组件/潜变量)。对于在X和Y之间的关系,识别变量是重要的。一个这样的变量重要性测量是在预测(VIP)参数上的变量重要性。VIP是PLS权重的加权平方和,权重是从在模型中的每个PLS组件的Y变量的量中计算得到的。这里,预测矩阵是2DE数据,而响应矩阵是表示类成员的二元向量,在本例中,零表示对照(BC)类,一表示癌症(SC)类(表3)。为确定以该模型预测的新样本的类成员,对y设置阈值,以致如果所预测的y值是低于阈值,在本例中所预测的类成员可以是BC,以及如果所预测的y值是高于阈值,在本例中所预测的类成员可以是SC。我们选择阈值=0.5。该PLS建模是在SIMCAPv13.0(瑞典Umetrics公司)上运行的。可替代地,采用由SameSpots图像分析软件(非线性动态公司)提供的统计工具(ANOVA)来选择变量(蛋白点)。通过质谱分析的蛋白质鉴定从胶中切出银染带,胶内消化处理,在瑞典乌普萨拉路德维格研究所进行分析,如前面所述(赫尔曼,U.(2000)通过SDS/PAGE和胶内消化来制备样品。EXS88,43-54.)。简言之,采用Farmer氏试剂进行银脱色,引入胰蛋白酶(猪的修饰的测序级,Promega公司,美国威斯康星州麦迪逊)到干燥的胶片中。在胰蛋白酶过夜消化后,多肽被吸附到C18ZipTip柱,清洗,然后以含有基质(α-氰基-4-羟基肉桂酸)的乙腈直接洗脱到目标板上。通过在德国不莱梅的布鲁克道尔顿公司的UltraflexIIITOF/TOF仪器上通过MALDI-TOF质谱法产生质量清单。采用搜索引擎MASCOT(英国伦敦的矩阵科学公司)执行鉴别的检索,通过扫描NCBI序列数据库的当前版本。采用自溶胰蛋白酶肽内部地校准质谱,公差被设为0.02Da。蛋氨酸的氧化是允许的。从搜索引擎的评分系统中判断身份的重要性。结果2D凝胶的图像分析结果是1283例被检测、被匹配、被选择和被分析的蛋白点(变量)代表了完整的数据组(病人组被描述在表3中)。在2D-凝胶分离的蛋白质的图像分析之后,代表所有样本的数据被进一步通过多变量统计来分析(偏最小二乘判别分析,PLS)。在分析之前,以及早于多元建模,对所有数据进行正常化,数据也被预处理(log2转换)。具有两个组件的PLS模型显示了最好的结果(参见图5)。对于最优化和交叉验证模型,获得90%的敏感度和94%特异性。根据变量对于预测的贡献,采用VIP参数对变量进行分级。然后,通过质谱鉴定来选择顶级的变量(蛋白点)。成功的鉴定是被列在下面的表4中。表4:基于PLS模型对研究1B中的生物标记物的鉴定(1)-基于质谱数据的主要EMBL登录号(2)-对应的UNIPROT登录号(3)-点数#是由SameSpot软件给出的,参见图6,对于在2D参考图上的位置(*)-这些生物标记物候选者也是明显改变的,根据ANOVA测试(P<0.05)($)-这些生物标记物候选者也被描述在研究1(实施例1)(¤)-这些生物标记物候选者也可在研究1中被找到。通过ANOVA(选择标准:p<0.05,q<0.05;倍性变化>1.5x)分析完全的数据组产生补充结果。为了评估该模型,采用了一组独立测试的11个SC和8个LC样本。模型被构建在训练组上,该训练组具有选自模型最优化方法的模型参数。我们选择阈值=0.5。9个SC和全部8个LC样本被正确地分类,对于所分类的模型,它们对应于89%灵敏度。实施例3——研究1C在研究1A和1B中的主要目标是描述一板能被用于在早期阶段诊断盆腔肿块为恶性的生物标记物。然后,在研究1C中,我们描述了一个附加的板,它指示了来自正常健康状况的偏离。该偏离可以是良性病变或者癌症,据此,在研究1A和1B中描述的板将会是必要的用于后面的癌症诊断。所有材料和方法都与在研究1A和1B中描述的一样。在表3中描述了对应于健康对照(HC)的病人样本。以下10个生物标记物显示了在来自HC和BC和/或癌症(SC/LC)的样本之间的显著差异水平(P<0.01):KAP3、CNDP2、ILEU、SPB6、SHLB1、CAZA1、PHB、TMP1、GPIX和AP4A。所有标记物被描述在下面的表5中。这个板的生物标记物候选者显示了在健康对象与患有良性和/或可能卵巢癌的恶性盆腔肿块的对象之间在表达上的显著差异(p<0.01)。表5:来自研究1C的生物标记物从健康对照中区分病变实施例4——研究2目前,对于病人的前列腺癌的诊断是非常高要求的。通常所用的生物标记物PSA仅是一种指示测量。这导致这样的事实:PSA水平的增加导致活检的需求。这是非常麻烦的,且副作用是明显的。初始,高达5%的病人不得不在一天内进入紧急状态以获得活检的治疗。同时,也存在性别功能缺失的问题。最坏的副作用是:采用活检方法存在扩散活的癌症细胞的潜在风险。基于这些事实,有迫切需要对于前列腺癌的诊断提供改进的和更可靠的工具。我们采用正如卵巢癌研究(研究1)中的相同的方法来收集血液样本。总的来说,在Karolinska大学医院的泌尿科收集了来自49名男性病人的样本。所有病人显示了高PSA(前列腺特异抗原)评分,根据TNM分级(T1-T3)对诊断进行分级。最年老的病人是出生于1936年,癌症诊断的日期是76岁。最年青的病人是出生于1960年,癌症诊断日期是53岁。收集来自健康对照(10名男性志愿者)的样本。所有对象是被包括在“Stockholm2研究”(在丹德吕德医院)中,其中,病人给出活检材料用于前列腺生物银行和筛查工程。所有对照都显示低的PSA水平,都被宣布为健康的。最年老者是出生于1942年,最年青者是出生于1957年。血液采集的时间分别是70岁和56岁。对于研究2,我们包括了10名健康对照、10名在T3阶段(对应于晚期癌症)的病人、9名在T2阶段的病人与2名在T1阶段的病人。T1和T2组是被视为早期癌症。以前述(研究1)的方法制备和分析所有样本。初步数据表明:生物标记物的情况是非常类似于从研究1(卵巢癌)得到的结果。PCA分析显示在健康对照与晚期癌症之间的分离。在这个研究中鉴定的蛋白质生物标记物候选者指示了与从卵巢癌研究中鉴定的生物标记物的显著重叠。然而,一些并未鉴定的生物标记物候选者显示了在前列腺癌与卵巢癌之间表达上的差异。在研究1和研究2中鉴定的用于卵巢癌和前列腺癌的生物标记物是总结在下面的表6中。表6:在研究1至2中所描述的生物标记物候选者,卵巢癌和前列腺癌实施例5——研究3和4胰腺癌和结直肠癌是一些最致命的全球性的恶性病,因此显示有迫切需要开发用于早期检测的改进的筛查工具。然而,不论目前的筛查程序的实施,约50%的这些恶性病是在晚期肿瘤阶段被检测到的。虽然基于临床和前临床研究已经获得了显著的进步,这些进步不能转变为在期望上的同等的显著改进。在目前的临床实践中,对于胰腺癌和结直肠癌的筛查是基于本领域状况的影像或者甚至侵入性诊断。诊断模式包括:超声内镜(EUS)、剖腹探查、计算机断层扫描(CT)和磁共振成像(MRI)。基于来自健康供体的血小板的蛋白质组的可行性可能是不同于患有结肠癌和胰腺癌的病人,本研究的目标是采用二维凝胶电泳(2-DE)来分析这些血小板是否会在区分组中根据蛋白表达而不同。总的来说,我们筛查了12个来自患有胰腺癌的病人的样本、12个来自患有结直肠癌的病人的样本和12个来自健康对象的样本,通过2-DE和质谱方法进行筛查以鉴定血小板的全部癌症相关蛋白和相关的肿瘤相关蛋白。材料与方法病人这个研究得到本地道德伦理委员会的批准。包括在本研究中的所有病人都签署了书面同意书。病人被分为:健康对照组(n=12)和胰腺癌病人组(n=12)和结直肠癌病人组(n=12)。在用于血小板分离的样本管中收集和获得血液样本。血小板分离在9ml的含EDTA的monovette管中收集人血,在标准实验室离心机中室温以200xg离心20分钟。接着,没有棕黄血层的血浆被小心地转移进入新的2.0ml反应管,以1300μlPBS缓冲液稀释。在第二个离心步骤,在室温以800xg离心10分钟,去除上清,将血小板重悬在溶解缓冲液中,存储在-80℃。采用EZQ蛋白定量试剂盒(Invitrogen公司)进行蛋白质鉴定。在标记每种样本的蛋白质和以荧光染料(NHDyeAGNOSTIC)内标之后,在450μl再水化缓冲液[7M尿素、2M硫脲、2%CHAPS、2%两性电解质(pH4-7,保存)、0.3%DTT和微量溴酚蓝]中溶解每胶150pg蛋白质(2x50g样品加50g内标)。第一维度在固定的pH4-7梯度(IPG)带,24cm(GE健康医疗公司)上获得,第二维度是在12.5%预制凝胶上通过SDS-PAGE(聚丙烯酰胺凝胶电泳)获得。在SDS-PAGE后,立即采用TyphoonFLA9000(GE健康医疗公司)扫描凝胶图像。在不同组之间的蛋白表达水平的折叠改变是通过采用ProgenesisSameSpots软件(v4.1,非线性动态公司)进行胶内分析而获得。基质辅助激光解吸/电离质谱法(MALDI-MS)对于基质辅助激光解吸/电离渡越时间质谱法(MALDI-TOF)分析,显著的点被自动切下,清洗几次以去除染料和其他抑制化合物。干燥的胶点被再水化在12.5ng/μl冰冻溶液,在10mMNH4HCO3中的测序级胰蛋白酶(Promega公司)。在37℃胶内消化蛋白质4小时。以10μl的0.1%TFA抽提多肽30分钟,直接加入到MALDI提前点样的AnchorChip靶标(BrukerDaltoniks),根据生产商的指示说明书进行操作。接着,在渡越时间Ultraflex-Tof/Tof质谱仪(BrukerDaltoniks)中分析样本。自动校正获得的质谱,采用校准1.3软件(BrukerDaltoniks)做注释,从每个个体点中获得的结果是被用于检索Swiss-Prot(Sprot_57.8,20401个蛋白质条目)非冗余数据库的人亚组,采用Mascot搜索引擎(版本2.2,矩阵科学有限公司)考虑以下设置:酶“胰蛋白酶”,种族“人”,固定的修饰“脲甲基化”,可选的修饰“蛋氨酸氧化”和不完全酶解位点数目(missedcleavages)“1”。质量公差被设为50ppm。采用这些设置,大于70的mascot评分是被认为是显著(p<0.01)。结果采用2-DE多重荧光技术(NHDyeAGNOSTIC)比较在肿瘤(胰腺癌与结肠癌)与正常样本的血小板之间的蛋白质表达,带有混合的内标,包含在研究中包括的所有36名病人的蛋白质提取物。在2-DE之后,Cy2、Cy3和Cy5胶图像是以SameSpots软件进行分析,揭示了在35种蛋白质的丰度改变,在胰腺癌与正常点体积比之间具有统计学差异,以及36种蛋白质在结肠肿瘤与正常点体积比之间具有统计学差异(p<0.05)。所有蛋白质都是从胶中切出,并通过质谱进一步分析。总的来说,这些研究揭示了特殊蛋白质的新的个体模式,具有潜在的对于诊断癌的较高的特异性和灵敏度,相比于之前报道的血清生物标记物,参见图8至图10以及表7至表8。表7:在研究4中描述的生物标记物候选者,结直肠癌蛋白质鉴定(Acc#EMBL或UniprotAcc#)研究ACTB,P60709(ACTB_人)3,4ACTN1,ACTN1蛋白,(A1L0V1_人)1a,2,3,4CASP3,P42574(CASP3_人)3,4CFL1,P23528(COF1_人),丝切蛋白3,4CLU,P10909(CLUS_人),丛生蛋白3,4FPPS_人3,4GELS,凝溶胶蛋白(GELS_人)1b,2,3,4GSTO1,P78417(GSTO1_人),谷胱甘肽S-转移酶Ω-13HDHD2_人,Q9H0R4(HDHD2_人)3,4ITA2B(ITGA2B),整联蛋白α2b,CD41(ITA2B_人)1a,2,3,4ITB3,整联蛋白β-3(ITB3_人)1b,2,3,4ITGA6,P23229(ITA6_人)3,4MLEC,(MLEC_人)3,4PHB,(Q6PUJ7_人)1c,2,3,4RINI,核糖核酸酶抑制因子(RINI_人)1b,2,3,4SNCA,P37840(SYUA_人),α-突触核蛋白3,4SPB6,(SPB6_人),丝氨酸蛋白酶抑制蛋白B61c,2,3,4TBA4A,微管蛋白α-4A链(TBA4A_人)1b,2,3,4TLN1,踝蛋白-1(TLN1_人)1b,2,3,4TSG,Q99816(TS101_人)3,4TUBB1,微管蛋白β-1链(TBB1_人)1a,1b,2,3,4VCL,黏着斑蛋白(VINC_人)1a,2,3,4WDR1,WD重复蛋白1异构体1(Q59ER5_人)1a,2,3,4表8:在研究4中描述的生物标记物候选者,胰腺癌实施例6卵巢癌的早期检测是非常困难的,但对于早开始治疗和生产率是至关重要的。通过临床标准方法从病人中获得血液样本,根据在实施例1所述的方法制备血小板部分。制备血小板裂解物,分离蛋白质,根据在实施例1所述的方法检测和鉴定生物标记物(特别列出在表2和图2中)。根据诊断算法(3)计算生物标记物的相对量。然后,将从诊断算法得到的输出值与设定的阈值相比较,阈值优选是0.29。如果输出值大于0.29,则指示对于卵巢癌有高风险,因此将尽可能开始进一步的检查和后续治疗。实施例7根据实施例1至2或4至5对于病人获得的结果被用于选择合适的治疗方案,用于病人的改进的预后。对于鉴定为患有癌症的病人,根据推荐的治疗程序,毫不迟延地开始治疗。实施例8采用基于定量抗体技术的卵巢癌的基于血小板的诊断在实际临床设定中,当我们需要采用测量上述的生物标记物的方法进行诊断以及采用基于该技术的抗体进行诊断时,下面的情形时可应用的:(1)采用来自至少20个良性对照和20个患有晚期卵巢癌的病人的制备的血小板,上述的生物标记物板是通过定量Westernblot(可替代地,ELISA或者Luminex技术)进行分析。然后,将每种生物标记物的定量信号标准化为合适的选择的内标的定量信号(例如,GAPDH或gamma14-3-3,BaumgartnerR等,Identificationandvalidationofplateletlowbiologicalvariationproteins,superiortoGAPDH,actinandtubulin,astoolsinclinicalproteomics.J.Proteomics,2013(94)540-51)。(2)然后,通过合适的多变量软件(例如,Umetrics公司的SIMCAPv13)分析数据,正如在实施2中所述。这个方法导致预测模型可被用作诊断新的未知样本的预测工具。该预测模型提供了对于每个新样本的在0至1之间的值,其中,值>0.5指示癌症,而值<0.5指示良性病变。这个方法可被用于构建本地预测数据库,采用标准方法构建,此外,结果可与来自其他鉴定分析实验室的相应的数据库进行比较。(3)在最后的诊断之后,在对应于之前未知样本的外科组织样本的组织病理学检查的基础上获得的信息(诊断和生物标记物水平)可被加到本地预测数据库(参见上面的1)。通过这个交互过程,预测模型是逐步升级的以便获取增加的敏感度和特异性。总的来说,个体研究一起检测的普遍蛋白质标记物,用于早期非侵入式癌症诊断,正如在本发明中所述的。所有这些标记物,在研究中,它们的身份被描述在下面的表9中。表9:总结表,描述在研究1-4的任意之一的生物标记物候选者(n=45)这些研究揭示了一板的12种生物标记物,它们是可被应用于所描述的所有四种癌症的诊断中,参见表10。表10:普遍对于所有研究1-4的生物标记物候选者蛋白质鉴定(Acc#EMBLorUniprotAcc#)研究ACTN1,ACTN1蛋白,(A1L0V1_人)1a,2,3,4GELS,凝溶胶蛋白(GELS_人)1b,2,3,4ITA2B(ITGA2B),整联蛋白α-2b,CD41(ITA2B_人)1a,2,3,4ITB3,整联蛋白β-3(ITB3_人)1b,2,3,4PHB,(Q6PUJ7_人)1c,2,3,4RINI,核糖核酸酶抑制因子,(RINI_人)1b,2,3,4SPB6,(SPB6_人),丝氨酸蛋白酶抑制蛋白B61c,2,3,4TBA4A,微管蛋白α-4A链(TBA4A_人)1b,2,3,4TLN1,踝蛋白-1(TLN1_人)1b,2,3,4TUBB1,微管蛋白β-1链(TBB1_人)1a,1b,2,3,4VCL,黏着斑蛋白(VINC_人)1a,2,3,4WDR1,WD重复蛋白1异构体1(Q59ER5_人)1a,2,3,4上述具体实施方式已经作为本发明的一些示例性实施例而得到理解。本领域技术人员应当知晓,也可对这些具体实施方式作出多种不同的修饰、合并和改变,它们都不脱离本发明的保护范围。特别地,在不同具体实施方式中的不同部分的解决方案能被合并在其他结构中,只要技术上是可能的。然而,本发明的保护范围是由所附的权利要求所定义的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1