一种氧化介孔碳纳米球适体传感器及其制备方法及其用途与流程
本发明属分析化学领域,涉及适体传感器,具体涉及一种氧化介孔碳纳米球适体传感器及其制备方法及其在癌症检测中的应用。
背景技术:
据报道,癌症发生率和致死率与日俱增,已成为威胁人类健康的重大疾病,因此,发展有效的肿瘤诊断技术,包括检测和成像,已刻不容缓。目前肿瘤诊断实践中,主要有联合不同的生化检测或成像技术,如酶联免疫吸附法(ELISA)、苏木精-伊红染色法(H&E染色)、电子计算机X射线断层扫描技术(CT)、磁共振成像(MRI)等,用于不同组织水平的诊断,实践显示,所述的检测诊断技术复杂,难度高,并且其中多数技术缺乏特异性,容易出现假阳性结果。近年来,基于荧光猝灭-恢复的生物传感器被认为是一种灵敏度高、可靠的肿瘤检测工具,然而多数荧光生物传感器易于检测液体组织的肿瘤标志物如核酸、多肽或蛋白,但鲜见用于体内肿瘤组织的在体检测,因此,发展新型的荧光猝灭材料,制备特异性高的生物传感器,用于多层面的肿瘤检测,是该技术领域重要的研究方向。
已知碳纳米材料,包括一维碳纳米管、二维氧化石墨烯具有特殊功能,如通过与荧光标记单链DNA间的非共价π-π相互作用产生优良的荧光猝灭能力以及暴露于靶点后的定量荧光恢复能力,已经被开发应用于荧光“Turn-on”生物传感器的制备;但目前主要仍用于体外液体组织的单一检测,其中主要原因在于碳纳米管或氧化石墨烯毒性较大、易聚集、功能基团主要存在于界面边缘等,更重要的是,所述的一维和二维结构不利于与固体瘤组织均匀相互作用;相较之下,三维碳纳米材料,如介孔碳纳米球(MCN)有潜力克服所述一维、二维材料的缺陷,如,(1)三维球形结构中具有均匀介孔,比表面积大,孔体积大,容易通过表面功能基团与生物大分子相互作用;(2)三维纳米球,旋转能低,在体内与 实体瘤相互作用后,传感信号稳定,灵敏;(3)MCN生物相容性好,目前已经被探索用作肿瘤光热治疗的药物载体。因此,MCN是一种有潜力的可用于“Turn-on”生物传感的荧光猝灭剂,有望用于体内外肿瘤组织不同水平上的多重检测。
基于现有技术的现状,本申请的发明人拟提供一种新的适体传感器,使实现体内外的肿瘤多重诊断。
技术实现要素:
本发明的目的是提供一种高效灵敏的适体传感器,具体涉及一种氧化介孔碳纳米球适体传感器及其制备方法。所述的适体传感器通过特异性结合恶性肿瘤表面高度表达的MUC1,实现体内外的肿瘤多重诊断。
本发明中,合成了一种氧化介孔碳纳米球(OMCN),通过π-π相互作用在其表面非共价连接Cy3荧光标记的单链DNA探针(P0适体),制备适体传感器(OMCN/P0-Cy3),通过特异性结合恶性肿瘤表面高度表达的标志物——细胞表面黏蛋白1(MUC1),实现“Turn-on”的生物传感肿瘤检测。该新型适体传感器不仅可以高灵敏定量液体中MUC1分子和乳腺癌MCF-7细胞,还可以实现肿瘤细胞、离体组织和实体瘤的清晰特异性成像,实现体内外的肿瘤多重诊断。
具体的,本发明所述的氧化介孔碳纳米球适体传感器,以氧化介孔碳纳米球OMCN为载体,表面通过π-π相互作用非共价连接一种Cy3荧光标记的单链DNA探针,制成氧化介孔碳纳米球适体传感器。
本发明制备氧化介孔碳纳米球适体传感器的方法,包括如下步骤:介孔碳纳米球使用强酸混合物处理,超声,搅拌,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。适量OMCN与P0-Cy3混合,摇床振摇,制得OMCN/P0-Cy3适体传感器,储存备用。
上述制备方法中,合成OMCN时所述强酸混合物为硫酸和硝酸的混合物,体积比为2~4:1;
上述方法中,合成OMCN时,超声方式为普通超声和超声破碎仪超声;
上述方法中,合成OMCN时,超声时间为0.5~4h;
上述方法中,合成OMCN时,搅拌温度为30~70℃;
上述方法中,合成OMCN时,搅拌时间为0.5~4h;
上述方法中,制备OMCN/P0-Cy3适体传感器时,OMCN与P0-Cy3的用量比为:30~780mg:100~300nmol;
上述方法中,制备OMCN/P0-Cy3适体传感器时,OMCN与P0-Cy3的混合方式为摇床振摇;
上述方法中,制备OMCN/P0-Cy3适体传感器时,OMCN与P0-Cy3的振摇混合速率为100~200rpm;
上述方法中,制备OMCN/P0-Cy3适体传感器时,OMCN与P0-Cy3的振摇混合时间为10~30min;
上述方法中,所得OMCN/P0-Cy3适体传感器的适宜储存温度为4~25℃。
本发明使用OMCN/P0-Cy3适体传感器检测的溶液体系为Tris-HCl溶液、含血浆溶液和含肿瘤细胞溶液。
本发明使用OMCN/P0-Cy3适体传感器检测的目标对象为MUC1分子、肿瘤细胞、离体肿瘤组织和活体肿瘤组织。
本发明可通过多种方法对所制备的OMCN进行表征,表征方法包括:扫描电镜、透射电镜、小角X射线散射(SAXS)、X射线衍射(XRD)和X射线光电子能谱(XPS)。
本发明使用荧光光谱仪考察OMCN/P0-Cy3适体传感器的线性范围和检测限。OMCN/P0-Cy3适体传感器分别与含有MUC1的不同溶液体系(Tris-HCl溶液或含4%血浆的Tris-HCl溶液)或含MCF-7肿瘤细胞的Hank’s缓冲溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察线性范围和检测限。结果显示,本发明所制备的OMCN/P0-Cy3适体传感器在Tris-HCl溶液、含4%血浆的Tris-HCl溶液和含MCF-7肿瘤细胞的Hank’s缓冲溶液中的线性范围分别为1.06–10.6μM、1.06–10.6μM和105–2×106个细胞/mL,检测限分别为67.8nM、49.5nM和9.3×104个细胞/mL。
本发明进一步使用Infinite M1000Pro酶标仪考察OMCN/P0-Cy3适体传感器的线性范围和检测限。OMCN/P0-Cy3适体传感器分别与含有MUC1的不同溶液体系(Tris-HCl溶液或含4%血浆的Tris-HCl溶液)或含MCF-7肿瘤细胞的Hank’s缓冲溶液混合,孵育10min,使用Infinite M1000 Pro酶标仪检测溶液荧 光,考察线性范围和检测限。结果显示,本发明所制备的OMCN/P0-Cy3适体传感器在Tris-HCl溶液、含4%血浆的Tris-HCl溶液和含MCF-7肿瘤细胞的Hank’s缓冲溶液中的线性范围分别为0.10–2.12μM、0.10–2.12μM和104–2×105个细胞/mL,检测限分别为7.05nM、6.52nM和8500个细胞/mL。
本发明使用共聚焦显微镜考察OMCN/P0-Cy3适体传感器对肿瘤细胞的选择特异性。OMCN/P0-Cy3适体传感器分别与人乳腺癌MCF-7细胞和乳腺上皮MCF-10A细胞孵育0min、5min、30min和60min,PBS淋洗,共聚焦显微镜拍照观察。结果显示,MCF-7乳腺癌细胞上的红色荧光随着时间逐渐增强,而乳腺上皮MCF-10A细胞几乎无荧光,表明本发明所制备的OMCN/P0-Cy3适体传感器对乳腺癌细胞有非常好的选择特异性响应。
本发明使用倒置荧光显微镜观察OMCN/P0-Cy3适体传感器在离体肿瘤组织切片的响应效果。雌性Balb/c裸鼠皮下接种MCF-7细胞,待瘤体积增大至200mm3可用。荷瘤鼠处死,取肿瘤,冰冻切片,部分切片与OMCN/P0-Cy3适体传感器孵育1h,PBS淋洗,倒置荧光显微镜观察切片。结果显示,经OMCN/P0-Cy3适体传感器处理的肿瘤切片可观察到红色荧光,而未经处理的肿瘤切片没有荧光,表明本发明所制备的OMCN/P0-Cy3适体传感器对离体肿瘤组织有非常有效的响应。
本发明使用活体成像系统观察OMCN/P0-Cy3适体传感器对体内肿瘤的响应效果。雌性Balb/c裸鼠皮下接种MCF-7细胞,待瘤体积增大至200mm3可用。正常鼠和荷瘤鼠分别皮下注射或瘤内注射P0-Cy3溶液和OMCN/P0-Cy3适体传感器,分别于0min、5min、15min、30min和60min使用Maestro-2活体成像系统观察裸鼠。结果显示,荷瘤鼠瘤内注射P0-Cy3溶液,荧光信号非常弱,荷瘤鼠瘤内注射OMCN/P0-Cy3适体传感器,荧光信号随着时间延长先增强后减弱,正常鼠皮下注射P0-Cy3溶液,荧光信号随着时间延长减弱,正常鼠皮下注射OMCN/P0-Cy3适体传感器,未检测到荧光信号,表明本发明所制备的OMCN/P0-Cy3适体传感器对活体肿瘤组织有非常有效的响应。
表1显示了OMCN/P0-Cy3适体传感器检测MUC1或MCF-7细胞的线性范围和检测限。
本发明的突出优点及特征在于,提供了一种基于OMCN的高效灵敏的适体 传感器,通过特异性结合恶性肿瘤表面高度表达的MUC1,可实现体内外的肿瘤多重诊断。本发明所制备的基于OMCN的适体传感器,与现有的基于氧化石墨烯的适体传感器相比较,检测限明显降低,且可应用于MUC1分子、肿瘤细胞、离体肿瘤组织和活体肿瘤组织不同水平上的检测,确保诊断真实可靠。
本发明提供了一种经济实用简单的基于OMCN的适体传感器及其制备方法,该适体传感器能实现体内外的肿瘤多重诊断。
附图说明
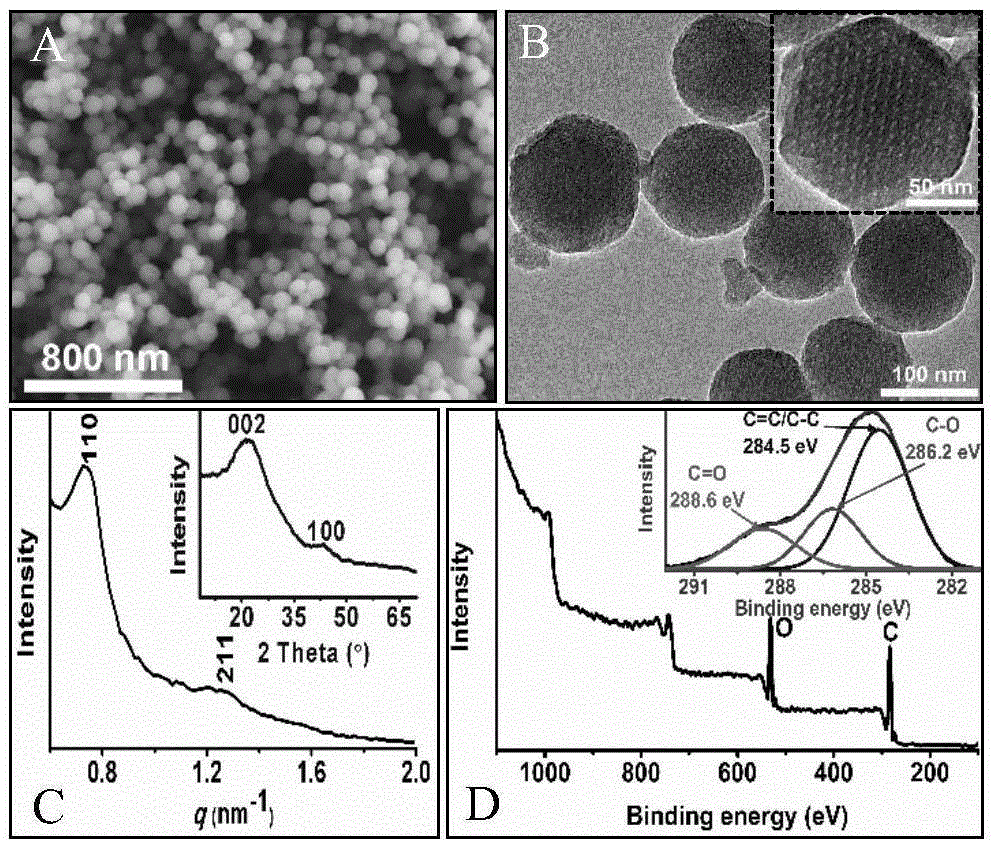
图1 OMCN的物理表征结果。
其中,A:扫描电镜图;
B:透射电镜图(插入图:单个纳米球的透射电镜图);
C:小角X射线散射图(插入图:X射线衍射图);
D:X射线光电子能谱图(插入图:相应的C 1s图)。
图2共聚焦显微镜法考察OMCN/P0-Cy3适体传感器对MCF-7肿瘤细胞的摄取情况,
其中,A:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育0min(200倍放大,bar=50μm);
B:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育0min(900倍放大,bar=10μm);
C:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育0min(2.5D切面图);
D:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育5min(200倍放大,bar=50μm);
E:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育5min(900倍放大,bar=10μm);
F:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育5min(2.5D切面图);
G:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育30min(200倍放大,bar=50μm);
H:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育30min(900倍放 大,bar=10μm);
I:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育30min(2.5D切面图);
J:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育60min(200倍放大,bar=50μm);
K:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育60min(900倍放大,bar=10μm);
L:MCF-7细胞与OMCN/P0-Cy3适体传感器孵育60min(2.5D切面图)。
图3共聚焦显微镜法考察OMCN/P0-Cy3适体传感器对正常乳腺上皮MCF-10A细胞的摄取情况,
其中,A:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育0min(200倍放大,bar=50μm);
B:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育0min(900倍放大,bar=10μm);
C:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育0min(2.5D切面图);
D:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育5min(200倍放大,bar=50μm);
E:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育5min(900倍放大,bar=10μm);
F:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育5min(2.5D切面图);
G:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育30min(200倍放大,bar=50μm);
H:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育30min(900倍放大,bar=10μm);
I:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育30min(2.5D切 面图);
J:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育60min(200倍放大,bar=50μm);
K:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育60min(900倍放大,bar=10μm);
L:MCF-10A细胞与OMCN/P0-Cy3适体传感器孵育60min(2.5D切面图)。
图4倒置荧光显微镜观察OMCN/P0-Cy3适体传感器在离体肿瘤组织切片的响应效果,
其中,A:离体肿瘤组织切片未经OMCN/P0-Cy3适体传感器处理的明场图(bar=200μm);
B:离体肿瘤组织切片未经OMCN/P0-Cy3适体传感器处理的荧光图(bar=200μm);
C:离体肿瘤组织切片经OMCN/P0-Cy3适体传感器处理1h的明场图(bar=200μm);
B:离体肿瘤组织切片经OMCN/P0-Cy3适体传感器处理1h的荧光图(bar=200μm)。
图5活体成像系统观察OMCN/P0-Cy3适体传感器对体内肿瘤的响应效果,
其中,I组:荷瘤鼠皮下注射或瘤内注射P0-Cy3溶液;
II组:荷瘤鼠瘤内注射OMCN/P0-Cy3适体传感器;
III组:正常鼠皮下注射P0-Cy3溶液;
IV组:正常鼠皮下注射OMCN/P0-Cy3适体传感器;
A:裸鼠经不同处理0min后使用Maestro-2活体成像系统观察结果;
B:裸鼠经不同处理5min后使用Maestro-2活体成像系统观察结果;
C:裸鼠经不同处理15min后使用Maestro-2活体成像系统观察结果;
D:裸鼠经不同处理30min后使用Maestro-2活体成像系统观察结果;
E:裸鼠经不同处理60min后使用Maestro-2活体成像系统观察结果。
具体实施方式
实施例1.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为2:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例2.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例3.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为4:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例4.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声0.5h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例5.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声4h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例6.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h, 30℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例7.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,70℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例8.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,30℃搅拌0.5h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例9.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,30℃搅拌4h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例10.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,超声破碎2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例11.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(30μg/mL)与P0-Cy3(100nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例12.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(780μg/mL)与P0-Cy3(300nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例13.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,100rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例14.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,200rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例15.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇20min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例16.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇30min,即得OMCN/P0-Cy3适体传感器,4℃储存备用。
实施例17.
介孔碳纳米球使用硫酸和硝酸的混合物(体积比为3:1)处理,普通超声2h,50℃搅拌2h,离心,水洗,干燥,即得氧化介孔碳纳米球OMCN。OMCN(300μg/mL)与P0-Cy3(200nmol/L)混合,160rpm摇床振摇10min,即得OMCN/P0-Cy3适体传感器,25℃储存备用。
实施例18.
通过Philips XL-30扫描电镜观察实施例2制备的OMCN,结果显示该OMCN具有均一的尺寸,呈圆整球形,粒径在100nm左右,请见附图1A。
实施例19.
通过JEOL-2100F透射电镜观察实施例2制备的OMCN,结果显示该OMCN分散性好,具有有序介孔,孔径约为3nm,请见附图1B。
实施例20.
将实施例2制备的OMCN进行小角X射线散射(SAXS)测试和X射线多晶衍射(XRD)分析,结果显示该OMCN具有高度有序的体心立方Im3m介孔结构,其骨架具有石墨化碳区域,请见附图1C。
实施例21.
将实施例2制备的OMCN进行X射线光电子能谱扫描,结果显示该OMCN的元素组成为74.6at%C和24.8at%O,其结构组成为石墨化碳(C=C/C-C)和氧化的碳(C-O/C=O),请见附图1D。
实施例22.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的Tris-HCl溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察线性范围,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在Tris-HCl溶液中的线性范围为1.06–10.6μM,
表1
实施例23.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的含4%血浆的Tris-HCl溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察线性范围。结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含4%血浆的Tris-HCl溶液中的线性范围为1.06–10.6μM。
实施例24.
将实施例2制备的OMCN/P0-Cy3适体传感器与含MCF-7肿瘤细胞的Hank’s缓冲溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察线性范围,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含MCF-7肿瘤细胞的Hank’s缓冲溶液中的线性范围为105–2×106个细胞/mL。
实施例25.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的Tris-HCl溶液混合,孵育10min,使用Infinite M1000Pro酶标仪检测溶液荧光,考察线性范围,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在Tris-HCl溶液中的线性范围为0.10–2.12μM。
实施例26.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的含4%血浆的Tris-HCl溶液混合,孵育10min,使用Infinite M1000Pro酶标仪检测溶液荧光,考察线性范围,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含4%血浆的Tris-HCl溶液中的线性范围为0.10–2.12μM。
实施例27.
将实施例2制备的OMCN/P0-Cy3适体传感器与含MCF-7肿瘤细胞的Hank’s缓冲溶液混合,孵育10min,使用Infinite M1000Pro酶标仪检测溶液荧光,考察线性范围,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含MCF-7肿瘤细胞的Hank’s缓冲溶液中的线性范围为104–2×105个细胞/mL。
实施例28.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的Tris-HCl溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察检测限,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在Tris-HCl溶液中的检测限为 67.8nM。
实施例29.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的含4%血浆的Tris-HCl溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察检测限,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含4%血浆的Tris-HCl溶液中的检测限为49.5nM。
实施例30.
将实施例2制备的OMCN/P0-Cy3适体传感器与含MCF-7肿瘤细胞的Hank’s缓冲溶液混合,孵育10min,使用荧光光谱仪检测溶液荧光,考察检测限,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含MCF-7肿瘤细胞的Hank’s缓冲溶液中的检测限为9.3×104个细胞/mL。
实施例31.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的Tris-HCl溶液混合,孵育10min,使用Infinite M1000Pro酶标仪检测溶液荧光,考察检测限,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在Tris-HCl溶液中的检测限为7.05nM1。
实施例32.
将实施例2制备的OMCN/P0-Cy3适体传感器与含有MUC1的含4%血浆的Tris-HCl溶液混合,孵育10min,使用Infinite M1000Pro酶标仪检测溶液荧光,考察检测限,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含4%血浆的Tris-HCl溶液中的检测限为6.52nM。
实施例33.
将实施例2制备的OMCN/P0-Cy3适体传感器与含MCF-7肿瘤细胞的Hank’s缓冲溶液混合,孵育10min,使用Infinite M1000Pro酶标仪检测溶液荧光,考察检测限,结果显示(如表1所示),所制备的OMCN/P0-Cy3适体传感器在含MCF-7肿瘤细胞的Hank’s缓冲溶液中的检测限为8500个细胞/mL。
实施例34.
将实施例2制备的OMCN/P0-Cy3适体传感器与人乳腺癌MCF-7细胞孵育0min、5min、30min和60min,PBS淋洗,共聚焦显微镜拍照观察,结果显示, MCF-7乳腺癌细胞上的红色荧光随着时间逐渐增强,表明所制备的OMCN/P0-Cy3适体传感器对乳腺癌细胞有非常好的响应,请见附图2。
实施例35.
将实施例2制备的OMCN/P0-Cy3适体传感器与乳腺上皮MCF-10A细胞孵育0min、5min、30min和60min,PBS淋洗,共聚焦显微镜拍照观察。结果显示,乳腺上皮MCF-10A细胞几乎无荧光,表明所制备的OMCN/P0-Cy3适体传感器对乳腺上皮MCF-10A细胞无响应,请见附图3。
实施例36.
雌性Balb/c裸鼠皮下接种MCF-7细胞,待瘤体积增大至200mm3可用。荷瘤鼠处死,取肿瘤,冰冻切片,部分切片与实施例2制备的OMCN/P0-Cy3适体传感器孵育1h,PBS淋洗,倒置荧光显微镜观察切片,结果显示,经OMCN/P0-Cy3适体传感器处理的肿瘤切片可观察到红色荧光,而未经处理的肿瘤切片没有荧光,表明本发明所制备的OMCN/P0-Cy3适体传感器对离体肿瘤组织有非常好的响应,请见附图4。
实施例37.
雌性Balb/c裸鼠皮下接种MCF-7细胞,待瘤体积增大至200mm3可用。正常鼠和荷瘤鼠分别皮下注射或瘤内注射P0-Cy3溶液和实施例2制备的OMCN/P0-Cy3适体传感器,分别于0min、5min、15min、30min和60min使用Maestro-2活体成像系统观察裸鼠,结果显示,荷瘤鼠瘤内注射P0-Cy3溶液,荧光信号非常弱,荷瘤鼠瘤内注射OMCN/P0-Cy3适体传感器,荧光信号随着时间延长先增强后减弱,正常鼠皮下注射P0-Cy3溶液,荧光信号随着时间延长减弱,正常鼠皮下注射OMCN/P0-Cy3适体传感器,未检测到荧光信号,表明本发明所制备的OMCN/P0-Cy3适体传感器对活体肿瘤组织有非常好的响应,请见附图5。
- 还没有人留言评论。精彩留言会获得点赞!