一种参苏制剂的检测方法与流程
本发明涉及药物质量控制
技术领域:
,特别涉及一种参苏制剂的检测方法。
背景技术:
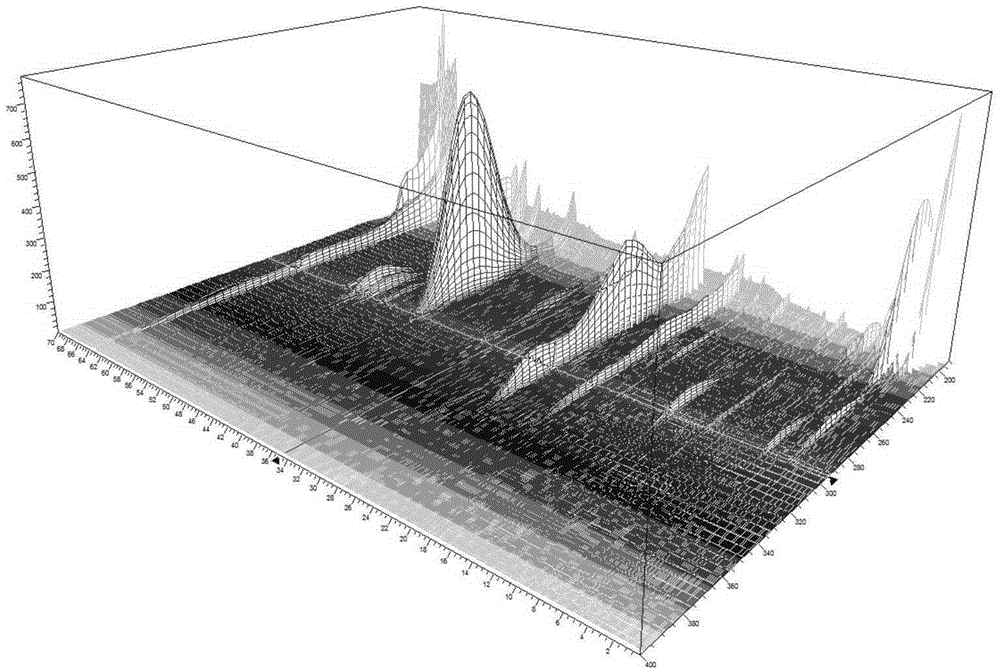
:参苏制剂由党参、紫苏叶、葛根、前胡、茯苓、半夏(制)、陈皮、枳壳(炒)、桔梗、甘草、木香、生姜、大枣十三味药材组成。该方具有益气解表、祛痰止咳的功效,主要用于治疗体虚感冒、风寒感冒、恶寒发热、头痛鼻塞、咳嗽多痰。参苏饮出自宋代的《太平惠民和剂局方》,临床应用较为广泛。现有技术中,根据参苏中药方,已制得多种剂型的参苏制剂,市场上参苏制剂主要有口服液、丸剂、片剂、胶囊剂等。通常的制备工艺为:将原料药材碎断后,按现有常规方法制成口服液、丸剂、片剂或胶囊剂。参苏制剂作为中成药,其药效是多种活性成分共同作用的结果。但目前参苏制剂现有的质量标准仅测定单一指标成分葛根素的含量,未对其他有效成分进行监测,存在一定局限性,不能全面反映参苏制剂的质量水平。针对参苏制剂的质量检测方法的公开专利只有一个,中国专利200810069061.8(公开号CN101474274A),仅采用HPLC法控制其葛根素与橙皮苷的含量。针对参苏制剂的质量检测方法如下,《湖南中医药导报》2003年4月第9卷第4期《参苏口服液的质量标准研究》、《中国医药导刊》2009年第11卷第9期《参苏感冒片质量标准研究》、《中国实验方剂学杂志》2008年3月第14卷第3期《参苏感冒片质量标准研究》等文章中记载了一种测定参苏制剂中葛根素的含量的HPLC方法;《西北药学杂志》2014年5月第29卷第3期《提高参苏丸质量标准的研究》记载了一种测定参苏丸中白花前胡甲素、白花前胡乙素的含量的HPLC方法;《中国药房》2007年第18卷第18期《HPLC法测定参苏丸中橙皮苷的含量》记载了一种测定参苏丸中橙皮苷的含量的HPLC方法。现有技术中,尚无较全面的质量控制方法反映现有中药材、中间体及成 品的质量状况,也无法对生产过程及产品质量有效控制,不能较好地保证其临床疗效。因此,建立参苏制剂的质量检测方法具有非常重要的意义。技术实现要素:有鉴于此,本发明提供了一种参苏制剂的检测方法。该参苏制剂质量检测方法的建立有利于对其原料药材、中间体及其终产品有效成分质量的有效控制及保证其临床疗效。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种参苏制剂的检测方法,包括如下步骤:将参苏制剂制成供试品溶液,葛根素作为参照物,采用高效液相色谱法检测获到参苏制剂的检测结果,色谱条件为:色谱柱为C18反相色谱柱,流动相为流动相A与流动相B组成的梯度洗脱液,流动相A为乙腈,流动相B为磷酸溶液,采用梯度洗脱,梯度洗脱程序如下:作为优选,高效液相色谱的检测波长为260~300nm。在本发明提供的一些实施例中,高效液相色谱的检测波长为283nm。在本发明提供的另一些实施例中,高效液相色谱的检测波长为260nm。在本发明提供的另一些实施例中,高效液相色谱的检测波长为300nm。作为优选,磷酸溶液中磷酸的体积百分含量为0.05%~0.1%。在本发明提供的一些实施例中,磷酸溶液中磷酸的体积百分含量为0.05%。在本发明提供的另一些实施例中,磷酸溶液中磷酸的体积百分含量为0.1%。作为优选,高效液相色谱的柱温为25℃~40℃。在本发明提供的一些实施例中,高效液相色谱的柱温为30℃。在本发明提供的另一些实施例中,高效液相色谱的柱温为25℃。在本发明提供的另一些实施例中,高效液相色谱的柱温为40℃。作为优选,流动相的流速0.8~1.2mL/min。在本发明提供的一些实施例中,流动相的流速1.0mL/min。在本发明提供的另一些实施例中,流动相的流速0.8mL/min。在本发明提供的另一些实施例中,流动相的流速1.2mL/min。在本发明提供的一些实施例中,供试品溶液的进样量为10μL。作为优选,色谱柱为UnitaryC18(5μm,4.6×250mm),ThermoSyncronis-C18(5μm,4.6×250mm),岛津InertsilODS-2(5μm,4.6×250mm)。在本发明提供的一些实施例中,参苏制剂为口服液,供试品溶液的制备方法采用直接稀释的方法;参苏制剂为丸剂、片剂或胶囊剂,供试品溶液的制备方法采用回流提取的方法。在本发明提供的一些实施例中,供试品溶液的制备方法为:取参苏制剂,加甲醇或乙醇,采用加热回流方法提取,用微孔滤膜滤过,取续滤液,即得供试品溶液。作为优选,回流提取的溶剂为0%~50%甲醇或0%~50%乙醇。在本发明提供的一些实施例中,参照物的制备方法为:将葛根素溶解于50%~100%甲醇,制成参照物。作为优选,高效液相色谱的分析时间不低于60min。本发明还提供了一种参苏制剂的特征图谱检测方法,其检测方法包括如下步骤:将参苏制剂制成供试品溶液,葛根素作为参照物,采用高效液相色谱法检测获到参苏制剂的特征图谱,色谱条件为:色谱柱为C18反相色谱柱,流动相为流动相A与流动相B组成的梯度洗脱液,流动相A为乙腈,流动相B为磷酸溶液,采用梯度洗脱,梯度洗脱程序如下:作为优选,特征图谱具有7个特征峰,其中2号峰为葛根素作为参照峰,6号峰为柚皮苷,7号峰为橙皮苷,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026;2号峰:相对保留时间1.000±0.000;3号峰:相对保留时间1.322±0.066;4号峰:相对保留时间1.784±0.089;5号峰:相对保留时间1.830±0.091;6号峰:相对保留时间1.910±0.095;7号峰:相对保留时间1.962±0.098。在本发明提供的一些实施例中,特征图谱具有7个特征峰,其中2号峰为葛根素作为参照峰,6号峰为柚皮苷,7号峰为橙皮苷,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.20%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.13%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.18%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.18%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.19%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.19%。在本发明提供的另一些实施例中,特征图谱具有7个特征峰,其中2号峰为葛根素作为参照峰,6号峰为柚皮苷,7号峰为橙皮苷,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.12%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.15%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.10%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.16%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.14%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.14%。在本发明提供的另一些实施例中,特征图谱具有7个特征峰,其中2号峰为葛根素作为参照峰,6号峰为柚皮苷,7号峰为橙皮苷,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.15%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.18%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.08%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.21%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.17%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.19%。在本发明提供的另一些实施例中,特征图谱具有7个特征峰,其中2号峰为葛根素作为参照峰,6号峰为柚皮苷,7号峰为橙皮苷,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.16%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.10%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.02%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.14%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.10%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.09%。在本发明提供的另一些实施例中,特征图谱具有7个特征峰,其中2号峰为葛根素作为参照峰,6号峰为柚皮苷,7号峰为橙皮苷,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.21%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.08%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.06%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.13%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.14%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.14%。作为优选,高效液相色谱的检测波长为260~300nm。作为优选,磷酸溶液中磷酸的体积百分含量为0.05%~0.1%。优选地,磷酸溶液中磷酸的体积百分含量为0.05%。作为优选,高效液相色谱的柱温为25℃~40℃。作为优选,流动相的流速0.8~1.2mL/min。优选地,流动相的流速1.0mL/min。作为优选,供试品溶液的进样量为10μL。在本发明提供的一些实施例中,参苏制剂为口服液,供试品溶液的制备方法采用直接稀释的方法;参苏制剂为丸剂、片剂或胶囊剂,供试品溶液的制备方法采用回流提取的方法。在本发明提供的一些实施例中,回流提取的溶剂为0%~50%甲醇或0%~50%乙醇。在本发明提供的一些实施例中,参照物的制备方法为:将葛根素溶解于50%~100%甲醇,制成参照物。作为优选,高效液相色谱的分析时间不低于60min。本发明提供了一种参苏制剂的检测方法。该参苏制剂的检测方法包括:将参苏制剂制成供试品溶液,葛根素作为参照物,采用高效液相色谱法检测获到参苏制剂的检测结果,色谱条件为:色谱柱为C18反相色谱柱,流动相为流动相A与流动相B组成的梯度洗脱液,流动相A为乙腈,流动相B为磷酸溶液,采用梯度洗脱。与现有技术相比,本发明的有益效果是:(1)本发明参苏制剂的特征图谱检测方法对各供试品的前处理方法简单,特征性成分保留完整,且供试品溶液稳定性良好;(2)该高效液相色谱方法的精密度较高、重现性良好,分析时间较短,具有一定的专属性;所得特征图谱中各特征峰分离效果较好,且参苏制剂特征图谱和中间体特征图谱具有较好的相关性;(3)本发明所建立的特征图谱有7个特征峰,信息量较大,较完整的保 留了供试液中的有效成分,明确了3个特征峰,经比较采用保留时间适中,分离度较好,峰面积较大的葛根素参照物作为参照峰;(4)参苏制剂中间体特征图谱的应用可增加参苏制剂生产过程的可控性,参苏制剂特征图谱的应用则有利于保证参苏制剂的有效成分质量稳定和临床疗效,本发明提供的方法有利地保障了从原料到终端制剂的全程质量控制。附图说明图1为检测波长3D图;图2为参照物叠加色谱图;S1示5-乙氧基家基糠醛对照品;S2示橙皮苷对照品;S3示葛根素对照品;S4示柚皮苷对照品;图3为参苏制剂特征图谱;1~7号峰为特征峰,其中2号峰为参照峰;图4为10批参苏制剂特征图谱;图5为参苏制剂中间体特征图谱;图6为10批参苏制剂中间体特征图谱;图7为参苏胶囊特征图谱;图8为10批参苏胶囊特征图谱;图9为参苏片特征图谱;图10为10批参苏片特征图谱;图11为参苏丸特征图谱;图12为10批参苏丸特征图谱;图13为参苏制剂特征图谱各特征峰归属图谱;图14为参苏制剂共有峰图谱。具体实施方式本发明公开了一种参苏制剂特征图谱及其检测方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能 在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明提供的参苏制剂特征图谱及其检测方法中所用药物、试剂、仪器均可由市场购得。本发明药材、药品的来源及对照品来源如下:党参药材(厂家:湖南天宏药业有限公司、批号:YP1505016);紫苏叶药材(厂家:湖南天宏药业有限公司、批号:YP1505006);葛根药材(厂家:湖南天宏药业有限公司、批号:YP1505007);前胡药材(厂家:湖南天宏药业有限公司、批号:YP1505008);茯苓药材(厂家:湖南天宏药业有限公司、批号:YP1505014);半夏(制)药材(厂家:湖南天宏药业有限公司、批号:YP1505009);陈皮药材(厂家:湖南天宏药业有限公司、批号:ZY1406025);枳壳(炒)药材(厂家:湖南天宏药业有限公司、批号:YP1505010);桔梗药材(厂家:湖南柳红药业有限公司、批号:YP1505006);甘草药材(厂家:湖南柳红药业有限公司、批号:ZY1401003);木香药材(厂家:湖南天宏药业有限公司、批号:YP1505012);生姜药材(厂家:湖南天宏药业有限公司、批号:ZY1505013);大枣药材(厂家:湖南天宏药业有限公司、批号:YP1505011);天然澄清剂A组份(厂家:天津天成科技有限公司、批号:20150428);天然澄清剂B组份(厂家:天津天成科技有限公司、批号:20150428);山梨酸钾(厂家:湖南尔康制药、批号:1054-20150201);山梨酸钾对照品(中国药品生物制品检定研究所、批号:101075-200901);葛根素对照品(中国食品药品检定研究院、);5-乙氧基家基糠醛对照品(中国食品药品检定研究院、);橙皮苷对照品(中国食品药品检定研究院、);柚皮苷对照品(中国食品药品检定研究院、);新橙皮苷对照品(中国食品药品检定研究院、);参苏口服液(湖南康寿制药有限公司,批号为20130406、20131101、20141205、20141011、20140101、20140709、20140606、150601、150301、150108);参苏丸剂(湖南时代阳光药业股份有限公司,批号为20120111、20141214,其余8批为实验室自制)、参苏片剂、胶囊剂(实验室自制);参苏中间体(湖南康寿制药有限公司,150601)。本发明自制的参苏制剂主要由下述重量份数的原药材制得:90份党参、90份紫苏叶、90份葛根、90份前胡、90份茯苓、90份半夏(制)、60份陈皮、 60份枳壳(炒)、60份桔梗、60份甘草、60份木香、36份生姜、36份大枣。参苏制剂为由下述方法制得的参苏制剂:1、参苏制剂为口服液时,半夏用70%乙醇渗漉提取。紫苏叶、陈皮、枳壳、木香、生姜提取挥发油3小时,备用;药渣再加水煎煮0.5小时,合并所得滤液,备用。党参、葛根、前胡、茯苓、桔梗、甘草、大枣加水80~90℃动态提取2小时,滤液备用。将以上水煎液合并,浓缩,加入ZTC1+1天然澄清剂,加入乙醇至含醇量为30%,冷藏过夜,醇沉滤液与半夏渗漉液合并,回收乙醇,所得药液与挥发油,混匀,加水至1000ml即得。2、参苏制剂为丸剂、片剂、胶囊剂时,将原药材碎断后,按现有常规方法制成丸剂、片剂、胶囊剂。参苏制剂为口服液时,混匀,量取1.0~5.0ml;所述的制剂为丸剂、片剂、胶囊剂时,称取粉末7~9g。下面结合实施例,进一步阐述本发明:实施例1参苏制剂的检测方法参苏制剂的检测方法,包括如下步骤:(a)参照物溶液的制备:称取葛根素参照物,置于容量瓶中,加50%~100%甲醇溶解并定容至刻度,摇匀,制成参照物溶液;(b)供试品溶液的制备:取参苏制剂,加0%~50%甲醇或0%~50%乙醇25~125mL,采用常规方法提取,用微孔滤膜滤过,取续滤液,即得供试品溶液;(c)色谱条件:色谱柱为C18反相色谱柱;采用梯度洗脱,流动相为流动相A与流动相B组成的梯度洗脱液,流动相A为乙腈,流动相B为0.05~0.1%磷酸溶液;检测波长为260~300nm,见图1;柱温25℃~40℃;流速0.8mL/min~1.2mL/min;分析时间60min。洗脱梯度如表1所示。表1梯度运行表时间(min)乙腈(%)0.05~0.1%磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(d)测定:精密吸取参照物溶液与供试品溶液注入高效液相色谱仪,照高效液相色谱法测定,得到特征图谱。实施例2参苏制剂口服液特征图谱的建立(1)仪器与试药安捷伦1260高效液相色谱仪,含在线真空脱气机器(G-1311C)、二元泵(G-1311C)、标准自动进样器(G-1329B)、智能化柱温箱(G-1316A)、DAD检测器(G-1314B)、Agilent1260Infinity色谱工作站(美国安捷伦科技有限公司);SB-5200D超声波清洗仪(宁波新芝生物科技股份有限公司);FAZ004B分析天平(上海佑科);BT125D电子天平(赛多利斯科学仪器(北京)有限公司)。(2)色谱条件色谱柱为ThermoSyncronis-C18(5μm,4.6×250mm)反相色谱柱;柱温为25℃;检测波长为285nm;流动相A为乙腈,流动相B为0.08%磷酸溶液,总流速为1.0mL/min;分析时间60分钟;洗脱梯度如表2所示。表2梯度运行表时间(min)乙腈(%)0.05%磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(3)参照物溶液的制备称取葛根素参照物,置于容量瓶中,加甲醇溶解并稀释制成每1mL含0.08mg的溶液,摇匀,即得参照物溶液。见图2。(4)供试品溶液的制备取参苏口服液5支,混匀,精密量取5mL于50mL量瓶中,用水稀释至刻度, 摇匀,滤过,取续滤液,即得参苏口服液供试品溶液。(5)分析时间在上述色谱条件下进样考察120分钟,结果表明,在60分钟内,样品中所有峰均可被完全洗脱出,故分析时间确定为60分钟。(6)方法学考察①稳定性试验取同一供试品溶液,在上述液相色谱条件下,分别在0、2、4、6、12、24小时进行检测,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明供试品溶液24小时内较稳定。②精密度试验取同一份供试品溶液,在上述液相色谱条件下,重复进样6次,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明仪器精密度良好。③重复性试验取同一批样品,按供试品制备方法制备6份供试品溶液,在上述液相色谱条件下,进样分析,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明该方法重复性好。(7)参苏口服液标准特征图谱的制定精密吸取上述对照品溶液和供试品溶液各10μL,分别注入高效液相色谱仪中,照高效液相色谱法测定,记录色谱图;依据所得的10批参苏口服液的特征图谱,制定特征图谱。见图3、4。比较参苏制剂色谱图,其特征图谱具有7个特征峰,其中2号峰为葛根素峰为参照峰,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.20%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.13%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.18%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.18%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.19%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.19%;(8)特征图谱各特征峰的评价。参苏制剂特征图谱具有均具有7个特征峰,将参苏制剂特征图谱各特征相对保留时间与制定的各特征峰上述标准相对保留时间进行比较,其相对保留时间相对偏差应在规定值的±5%以内。具体结果见下表。表310批参苏制剂HPLC特征图谱相对偏差结果表实施例3参苏制剂中间体特征图谱的建立(1)仪器与试药安捷伦1260高效液相色谱仪,含在线真空脱气机器(G-1311C)、二元泵(G-1311C)、标准自动进样器(G-1329B)、智能化柱温箱(G-1316A)、DAD检测器(G-1314B)、Agilent1260Infinity色谱工作站(美国安捷伦科技有限公司);SB-5200D超声波清洗仪(宁波新芝生物科技股份有限公司);FAZ004B分析天平(上海佑科);BT125D电子天平(赛多利斯科学仪器(北京)有限公司)。(2)色谱条件色谱柱为ThermoSyncronis-C18(5μm,4.6×250mm)反相色谱柱;柱温为30℃;检测波长为283nm;流动相A为乙腈,流动相B为0.05%磷酸溶液,总流速为1.0mL/min;分析时间60分钟;洗脱梯度如表4所示。表4梯度运行表时间(min)乙腈(%)0.05%磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(3)参照物溶液的制备称取葛根素参照物,置于容量瓶中,加甲醇溶解并稀释制成每1mL含0.08mg的溶液,摇匀,即得参照物溶液。(4)供试品溶液的制备精密量取参苏制剂中间体1mL于10mL量瓶中,用水稀释至刻度,摇匀,滤过,取续滤液,即得参苏制剂中间体供试品溶液。(5)方法学考察①稳定性试验取同一供试品溶液,在上述液相色谱条件下,分别在0、2、4、6、12、24小时进行检测,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明供试品溶液24小时内较稳定。②精密度试验取同一份供试品溶液,在上述液相色谱条件下,重复进样6次,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明仪器精密度良好。③重复性试验取同一批样品,按供试品制备方法制备6份供试品溶液,在上述液相色谱条件下,进样分析,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明该方法重复性好。(6)参苏制剂中间体以葛根素为参照峰的特征图谱制定。精密吸取上述参照物溶液和供试品溶液各10μL,分别注入高效液相色谱仪中,照高效液相色谱法测定,记录色谱图;依据所得的10批参苏制剂中间体的特征图谱,制定标准特征图谱。见图5、6。比较参苏制剂中间体色谱图,其特征图谱具有7个特征峰,其中2号峰为葛根素峰为参照峰,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.12%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.15%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.10%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.16%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.14%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.14%;(7)特征图谱各特征峰的评价。参苏制剂特征图谱具有均具有7个特征峰,将参苏制剂特征图谱各特征相对保留时间与制定的各特征峰标准相对保留时间进行比较,其相对保留时间相对偏差应在规定值的±5%以内。具体结果见下表。表510批参苏制剂中间体HPLC特征图谱相对偏差结果表实施例4参苏制剂特征图谱的建立(以参苏制剂胶囊剂为例)(1)仪器与试药安捷伦1260高效液相色谱仪,含在线真空脱气机器(G-1311C)、二元泵 (G-1311C)、标准自动进样器(G-1329B)、智能化柱温箱(G-1316A)、DAD检测器(G-1314B)、Agilent1260Infinity色谱工作站(美国安捷伦科技有限公司);SB-5200D超声波清洗仪(宁波新芝生物科技股份有限公司);FAZ004B分析天平(上海佑科);BT125D电子天平(赛多利斯科学仪器(北京)有限公司)。(2)色谱条件色谱柱为ThermoSyncronis-C18(5μm,4.6×250mm)反相色谱柱;柱温为25℃;检测波长为300nm;流动相A为乙腈,流动相B为0.1%磷酸溶液,总流速为0.8mL/min;分析时间60分钟;洗脱梯度如表6所示。表6梯度运行表时间(min)乙腈(%)0.10磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(3)参照物溶液的制备称取葛根素参照物,置于容量瓶中,加甲醇溶解并稀释制成每1mL含0.08mg的溶液,摇匀,即得参照物溶液。(4)供试品溶液的制备取参苏胶囊粉末7g,精密称定,置具塞锥形瓶中,精密加入水100mL,密塞,称定重量,加热回流1小时,放冷,再称定重量,用水补足减失的重量,摇匀,滤过,取续滤液,即得参苏胶囊供试品溶液。(5)方法学考察①稳定性试验取同一供试品溶液,在上述液相色谱条件下,分别在0、2、4、6、12、24小时进行检测,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明供试品溶液24小时内较稳定。②精密度试验取同一份供试品溶液,在上述液相色谱条件下,重复进样6次,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明仪器精密度良好。③重复性试验取同一批样品,按供试品制备方法制备6份供试品溶液,在上述液相色谱条件下,进样分析,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明该方法重复性好。(6)参苏制剂特征图谱的制定。精密吸取上述参照物溶液和供试品溶液各10μL,分别注入高效液相色谱仪中,照高效液相色谱法测定,记录色谱图;依据所得的10批参苏制剂的特征图谱,制定特征图谱。见图7、8。比较参苏制剂色谱图,其特征图谱具有7个特征峰,其中2号峰为葛根素峰为参照峰,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.15%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.18%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.08%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.21%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.17%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.19%;(7)特征图谱各特征峰的评价。参苏制剂特征图谱具有均具有7个特征峰,将参苏制剂特征图谱各特征相对保留时间与制定的各特征峰标准相对保留时间进行比较,其相对保留时间相对偏差应在规定值的±5%以内。具体结果见下表。表710批参苏胶囊剂HPLC特征图谱相对偏差结果表实施例5参苏制剂特征图谱的建立(以参苏片剂为例)(1)仪器与试药安捷伦1260高效液相色谱仪,含在线真空脱气机器(G-1311C)、二元泵(G-1311C)、标准自动进样器(G-1329B)、智能化柱温箱(G-1316A)、DAD检测器(G-1314B)、Agilent1260Infinity色谱工作站(美国安捷伦科技有限公司);SB-5200D超声波清洗仪(宁波新芝生物科技股份有限公司);FAZ004B分析天平(上海佑科);BT125D电子天平(赛多利斯科学仪器(北京)有限公司)。(2)色谱条件色谱柱为岛津InertsilODS-2(5μm,4.6×250mm)反相色谱柱;柱温为40℃;检测波长为260nm;流动相A为乙腈,流动相B为0.05%磷酸溶液,总流速为1.2mL/min;分析时间60分钟;洗脱梯度如表8所示。表8梯度运行表时间(min)乙腈(%)0.05%磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(3)对照品溶液的制备称取葛根素对照品,置于容量瓶中,加甲醇溶解并稀释制成每1mL含0.08mg的溶液,摇匀,即得对照品溶液。(4)供试品溶液的制备取参苏片剂粉末9g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25mL,密塞,称定重量,加热回流2小时,放冷,再称定重量,用水补足减失的重量,摇匀,滤过,取续滤液,即得参苏片剂供试品溶液。(5)方法学考察①稳定性试验取同一供试品溶液,在上述液相色谱条件下,分别在0、2、4、6、12、24小时进行检测,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明供试品溶液24小时内较稳定。②精密度试验取同一份供试品溶液,在上述液相色谱条件下,重复进样6次,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明仪器精密度良好。③重复性试验取同一批样品,按供试品制备方法制备6份供试品溶液,在上述液相色谱条件下,进样分析,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明该方法重复性好。(6)参苏制剂颗粒特征图谱的制定。精密吸取上述参照物溶液和供试品溶液各10μL,分别注入高效液相色谱仪中,照高效液相色谱法测定,记录色谱图;依据所得的10批参苏制剂的特征图谱,制定特征图谱。见图9、10。比较参苏制剂颗粒色谱图,其特征图谱具有7个特征峰,其中2号峰为葛根素峰为参照峰,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.16%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.10%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.02%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.14%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.10%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.09%;(7)特征图谱各特征峰的评价。参苏制剂特征图谱具有均具有7个特征峰,将参苏制剂特征图谱各特征相对保留时间与制定的各特征峰标准相对保留时间进行比较,其相对保留时间相对偏差应在规定值的±5%以内。具体结果见下表。表910批参苏片剂HPLC特征图谱相对偏差结果表实施例6参苏制剂特征图谱的建立(以参苏丸剂为例)(1)仪器与试药安捷伦1260高效液相色谱仪,含在线真空脱气机器(G-1311C)、二元泵(G-1311C)、标准自动进样器(G-1329B)、智能化柱温箱(G-1316A)、DAD检测器(G-1314B)、Agilent1260Infinity色谱工作站(美国安捷伦科技有限公司);SB-5200D超声波清洗仪(宁波新芝生物科技股份有限公司);FAZ004B分析天平(上海佑科);BT125D电子天平(赛多利斯科学仪器(北京)有限公司)。(2)色谱条件色谱柱为UnitaryC18(5μm,4.6×250mm)反相色谱柱;柱温为35℃;检测波长为290nm;流动相A为乙腈,流动相B为0.05%磷酸溶液,总流速为1.0mL/min;分析时间60分钟;洗脱梯度如表10所示。表10梯度运行表时间(min)乙腈(%)0.05%磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(3)对照品溶液的制备称取葛根素对照品,置于容量瓶中,加甲醇溶解并稀释制成每1mL含0.08mg的溶液,摇匀,即得对照品溶液。(4)供试品溶液的制备取参苏丸,粉碎,取8g,精密称定,置具塞锥形瓶中,精密加入50%乙醇50mL,密塞,称定重量,回流处理2小时,放冷,再称定重量,用水补足减失的重量,摇匀,滤过,取续滤液,即得参苏口服液供试品溶液。(5)方法学考察①稳定性试验取同一供试品溶液,在上述液相色谱条件下,分别在0、2、4、6、12、24小时进行检测,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明供试品溶液24小时内较稳定。②精密度试验取同一份供试品溶液,在上述液相色谱条件下,重复进样6次,每次进样10μL,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明仪器精密度良好。③重复性试验取同一批样品,按供试品制备方法制备6份供试品溶液,在上述液相色谱条件下,进样分析,考察主要色谱峰的相对保留时间和相对峰面积的一致性。结果主要色谱峰的相对保留时间和相对峰面积的RSD<3%,表明该方法重复性好。(6)参苏制剂口服液特征图谱的制定。精密吸取上述参照物溶液和供试品溶液各10μL,分别注入高效液相色谱仪中,照高效液相色谱法测定,记录色谱图;依据所得的10批参苏制剂的特征图谱,制定特征图谱。见图11、12。比较参苏制剂口服液色谱图,其特征图谱具有7个特征峰,其中2号峰为葛根素峰为参照峰,各特征峰的相对保留时间和相对标准偏差为:1号峰:相对保留时间0.529±0.026,相对标准偏差为0.21%;2号峰:相对保留时间1.000±0.000,相对标准偏差为0.00%;3号峰:相对保留时间1.322±0.066,相对标准偏差为0.08%;4号峰:相对保留时间1.784±0.089,相对标准偏差为0.06%;5号峰:相对保留时间1.830±0.091,相对标准偏差为0.13%;6号峰:相对保留时间1.910±0.095,相对标准偏差为0.14%;7号峰:相对保留时间1.962±0.098,相对标准偏差为0.14%;(7)特征图谱各特征峰的评价。参苏制剂特征图谱具有均具有7个特征峰,将参苏制剂特征图谱各特征相对保留时间与制定的各特征峰标准相对保留时间进行比较,其相对保留时间相对偏差应在规定值的±5%以内。具体结果见下表。表1110批参苏片剂HPLC特征图谱相对偏差结果表实施例7成品与各原料药材的相关性及特征峰归属(1)仪器与试药安捷伦1260高效液相色谱仪,含在线真空脱气机器(G-1311C)、二元泵(G-1311C)、标准自动进样器(G-1329B)、智能化柱温箱(G-1316A)、DAD检测器(G-1314B)、Agilent1260Infinity色谱工作站(美国安捷伦科技有限公司);SB-5200D超声波清洗仪(宁波新芝生物科技股份有限公司);FAZ004B分析天平(上海佑科);BT125D电子天平(赛多利斯科学仪器(北京)有限公司)。(2)色谱条件色谱柱为ThermoSyncronis-C18(5μm,4.6×250mm)反相色谱柱;柱温为30℃;检测波长为280nm;流动相A为乙腈,流动相B为0.05%磷酸溶液,总流速为1.0mL/min;分析时间60分钟;洗脱梯度如表12所示。表12梯度运行表时间(min)乙腈(%)0.05%磷酸溶液(%)0~51995~131~899~9213~158~1292~8815~3612~1488~8636~3814~1786~8338~6017~2683~74(3)参照物溶液的制备称取葛根素对照品,置于容量瓶中,加甲醇溶解并稀释制成每1mL含0.08mg的溶液,摇匀,即得对照品溶液。(4)供试品溶液的制备取参苏口服液5支,混匀,精密量取5mL于50mL量瓶中,用水稀释至刻度,摇匀,滤过,取续滤液,即得参苏口服液供试品溶液。药材溶液的制备方法:分别取各单味药材,按处方制备成溶液,按参苏制剂中间体供试品溶液制备方法制备对应的单味药材溶液,共13味药材溶液。阴性药材溶液的制备方法:分别取除其中某味药材的其他药材,按处方制备成溶液,按参苏制剂中间体供试品溶液制备方法制备对应的阴性药材溶液,共13味阴性药材溶液。(5)单味药材、阴性、成品各特征峰图谱归属的制定。精密吸取上述参照物溶液和供试品溶液各10μL,分别注入高效液相色谱仪中,照高效液相色谱法测定,记录色谱图;依据所得的图谱,制定各特征峰的归属。见表13,附图13。表13各特征峰图谱归属所述参苏制剂的HPLC在283nm的特征图谱有13个共有峰(见图14),其中归属于枳壳的共有峰为:峰1、峰2、峰10、峰11、峰12、峰13;归属于陈皮的共有峰为:峰2、峰10、峰12;归属于葛根的共有峰为:峰3、峰4、峰5、峰6、峰7;归属于紫苏叶的共有峰为:峰9。其中选取保留时间及峰面积适宜的共有峰为特征峰建立特征图谱,其中有:峰2、峰4(S)、峰7、峰9、峰10、峰11、峰12。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1