用于诊断、预后和确认先兆子痫的方法与组合物与流程
本申请要求于2014年7月30日提交的美国临时专利申请62/031,132、于2014年7月31日提交的美国临时专利申请62/031,834和于2015年2月11日提交的美国临时专利申请62/115,077的权益和优先权。每个前述专利申请的内容和公开通过引用整体并入本文。
相关领域
本公开涉及提供先兆子痫的诊断和预后。
发明背景
先兆子痫(pe)是严重的妊娠多系统并发症,对母亲和婴儿有不良影响。该障碍的发生率是美国和全世界所有妊娠的约5-8%,并且该障碍占美国所有孕产妇死亡的18%。先兆子痫的病因和发病机制仍不确定,并且当前pe的实验室标志和临床症状发生在疾病过程的晚期,有时使得确定pe和临床管理决策很困难。具体地,区分先兆子痫与妊娠症状的并发症(例如妊娠高血压、慢性高血压和妊娠糖尿病,其中每一种需要不同的治疗选择)是关键的。更早和更可靠的诊断、预后、确认和监测疾病将导致更及时和个性化的先兆子痫治疗,并且因此将显著促进对先兆子痫发病机理的理解。
发明概述
本公开提供了用于在任何受试者、优选妊娠受试者中确认先兆子痫的方法,包括:评估来源于受试者的样品中的多个生物标志物以计算指数或以确认受试者是否患有先兆子痫,其中该确认具有大于90%的灵敏度、大于90%的特异性或大于0.9的接受者操作特征曲线(roc和/或auc)下的面积。
本公开提供了用于确认受试者、优选妊娠受试者中的先兆子痫的测试,其中该测试能够以至少0.80、0.85、0.90、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99、0.995或更大的roc值辨别没有患有pe但具有与pe相关的一个或多个症状的受试者与患有pe的受试者。与pe相关的一个或多个症状可以是糖尿病(例如妊娠糖尿病、i型或ii型糖尿病)、高于正常葡萄糖水平、高血压(例如慢性或非慢性高血压)、过度或突然的体重增加、高于正常体重、肥胖、高于正常体重指数(bmi)、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产(nulliparity)、异常巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、先前妊娠的pe、肾病、血栓形成倾向或其任何组合。
本公开提供了用于确认受试者、优选妊娠受试者中的先兆子痫的测试,其中该测试能够以至少80%、85%、90%、95%、96%、97%、98%、99%、99.5%或更高的灵敏度、特异性和/或阴性预测值(npv)辨别没有患有pe但具有与pe相关的一个或多个症状的受试者与患有pe的受试者。与pe相关的一个或多个症状可以是糖尿病(例如妊娠糖尿病、i型或ii型糖尿病)、高于正常葡萄糖水平、高血压(例如慢性或非慢性高血压)、过度或突然的体重增加、高于正常体重、肥胖、高于正常体重指数(bmi)、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、先前妊娠的pe、肾病、血栓形成倾向或其任何组合。
本公开提供了用于确认受试者、优选妊娠受试者中的先兆子痫的方法,包括对来源于受试者的样品进行测试,其中该测试包括测量多个标志物的水平,并使用水平以至少80%、85%、90%、95%、96%、97%、98%、99%、99.5%或更高的灵敏度、特异性和/或阴性预测值(npv)值或者以至少0.80、0.85、0.90、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99、0.995或更大的roc值确认pe。与pe相关的一个或多个症状可以是糖尿病(例如妊娠糖尿病、i型或ii型糖尿病)、高于正常葡萄糖水平、高血压(例如慢性或非慢性高血压)、过度或突然的体重增加、高于正常体重、肥胖、高于正常体重指数(bmi)、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、先前妊娠的pe、肾病、血栓形成倾向或其任何组合。
本公开还提供了用于确认受试者、优选妊娠受试者是否没有患有先兆子痫的方法,该方法包括:评估来源于受试者的样品以确定样品中多个生物标志物的水平,使用多个生物标志物的水平以计算代表受试者没有患有先兆子痫的可能性的指数;并且基于该指数,确认受试者是否没有患有先兆子痫。
一种用于确认受试者、优选妊娠受试者是否确实患有先兆子痫的方法,该方法包括:(a)评估来源于受试者的样品以确定样品中多种生物标志物的水平,(b)使用多个生物标志物的水平以计算代表受试者患有先兆子痫的可能性的指数;和(c)基于该指数,确认受试者是否确实患有先兆子痫。
本公开还提供了用于确认受试者、优选妊娠受试者是否没有患有先兆子痫的方法,该方法包括:(a)评估来源于受试者的样品以确定样品中生物标志物的水平;和(b)使用该生物标志物的水平以计算代表受试者没有患有先兆子痫的可能性的指数;其中该生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(pikachurin)(egflam)或血红素。
本公开提供了用于确认受试者、优选妊娠受试者是否确实患有先兆子痫的方法,该方法包括:(a)评估来源于受试者的样品以确定样品中生物标志物的水平;和(b)使用该生物标志物的水平以计算代表受试者确实患有先兆子痫的可能性的指数;其中该生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)或血红素。
本公开还提供了用于确认具有至少一个与pe相关的症状的受试者、优选妊娠受试者是否患有pe的方法,该方法包括:(a)评估来源于受试者的样品以确定样品中的一个或多个生物标志物的水平;和(b)使用一个或多个生物标志物的水平计算代表女性确实患有pe的可能性的指数,以计算指数,其中一个或多个生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)或血红素。
本公开还提供了用于确认没有至少一个与pe相关的症状的受试者、优选妊娠受试者是否没有患有pe的方法,该方法包括:(a)评估来源于受试者的样品以确定样品中一个或多个生物标志物的水平;和(b)使用一个或多个生物标志物的水平计算表示受试者没有患有pe的可能性的指数,以计算指数,其中一个或多个生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)或血红素。
本公开还提供了用于诊断或确认受试者、优选妊娠受试者中存在先兆子痫的方法,该方法包括:(a)进行多个不同的测定,所述测定确定来源于受试者的样品中纤连蛋白的水平;和(b)评估样品并使用来自多个不同测定的水平以诊断或确认先兆子痫的存在并计算指数。
本公开还提供了用于确认受试者、优选妊娠受试者没有患有先兆子痫的方法,该方法包括:进行多个不同的测定,所述测定确定来源于受试者的样品中纤连蛋白的水平;以及评估样品并使用来自多个测定的水平以确认受试者没有患有先兆子痫并计算指数。
本公开还提供了用于诊断或确认受试者、优选妊娠受试者中存在先兆子痫的方法,该方法包括:(a)进行至少一个测定,所述测定利用结合纤连蛋白的抗体或选择性结合与该抗体相同的纤连蛋白的抗原,其中该抗体的结合决定来源于受试者的样品中纤连蛋白的水平;和(b)评估样品并使用来自至少一个测定的纤连蛋白的水平来诊断或确认先兆子痫的存在并计算指数。
本公开还提供了用于诊断或证实受试者、优选妊娠受试者中存在先兆子痫的方法,该方法包括:(a)测量来源于受试者的样品中sflt-1和plgf(plgf)的比率水平和多个不同生物标志物的水平,其中不同的生物标志物中没有一个是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)或血红素;和(b)评估样品并使用来自步骤(a)的水平来确定诊断或确认存在先兆子痫的指数并计算指数。
本公开还提供了通过评估来源于受试者、优选妊娠受试者的样品用于诊断、监测、表征或确认先兆子痫的方法,其通过使用至少2、3、4、5、6、7、8、9或10个选自图5a-5f(或表2)的标志物(例如生物标志物),以计算指数值,其中指数值用于在受试者中确定诊断、相对水平或表征先兆子痫。
本公开还提供了用于确认受试者、优选妊娠受试者,没有患有先兆子痫的方法,该方法由以下组成:测量来源于受试者的样品中sflt-1和plgf的比率水平和多个不同生物标志物的水平,其中不同的生物标志物中没有一个是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)或血红素;和评估样品并使用来自步骤(a)的水平来确定确认不存在先兆子痫的指数并计算指数。
本公开还提供了用于区分患有先兆子痫的受试者与没有患有先兆子痫但具有与先兆子痫相关的症状的受试者的方法。与先兆子痫相关的此类症状包括例如慢性高血压、妊娠高血压、自身免疫性疾病和/或妊娠糖尿病。本文的方法和测试具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或99.5%的特异性、灵敏度和/或阴性预测值(npv)。本文的方法和测试优选以至少0.8、0.85、0.9或0.95的roc值或在曲线下的面积区分患有先兆子痫的受试者与没有患有先兆子痫但具有与先兆子痫相关的症状的受试者。本文的方法包括测量来源于受试者的样品中的多个不同生物标志物(例如,诸如选自图5a-5f(或表2)中的列表的那些生物标志物)的水平,使用不同指数的水平产生指数,并且使用该指数作为确认先兆子痫的存在、先兆子痫的不存在和/或先兆子痫的严重性的手段。
本公开还提供了用于确认受试者、优选妊娠受试者中先兆子痫的存在、不存在或严重性的方法,该方法包括:使用选择性结合纤连蛋白的单克隆抗体以测定来源于样品的纤连蛋白的水平,基于该水平产生指示先兆子痫的存在、不存在或严重性和含有指数的报告;评估样品;并且基于该指数,提示先兆子痫的治疗,其中治疗涉及阿司匹林、早产、用抗高血压或抗先兆子痫药物或卧床休克治疗。
本公开还提供了用于确认来源于受试者、优选妊娠受试者的样品中先兆子痫的存在、不存在或严重性的方法,该方法包括:利用针对至少一个纤连蛋白elisa试剂盒中纤连蛋白抗体的抗原的抗体来分析和评估来源于受试者的样品。
本公开还提供了用于确认受试者、优选妊娠受试者中先兆子痫的存在、不存在或严重性的方法,该方法包括:进行至少一个测定,其利用选择性结合纤连蛋白、纤连蛋白的一部分(portion)、纤连蛋白的一部分(part)或纤连蛋白的片段的抗体,其中抗体的结合决定来源于受试者的样品中纤连蛋白的水平;评估样品;并使用来自至少一个测定的纤连蛋白的水平来确认先兆子痫的存在、不存在或严重性并计算指数。
本公开还提供了用于确认受试者、优选女性受试者中不存在先兆子痫的测试,其中该测试测量来自来源于受试者的样品的一个或多个生物标志物,其中该测试具有至少0.8的总体roc值。在一些实例中,该测试测量来自来源于受试者的样品的一个或多个生物标志物,其中该测试具有至少0.7、0.8、0.85、0.9、0.95、0.96、0.97、0.98、0.99或更大的总体roc值。在一些实例中,该测试测量来自来源于受试者的样品的一个或多个生物标志物,并且具有至少0.81、0.82、0.83、0.84、0.85、0.86、0.87、0.88、0.89、0.9、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99、0.995或更大的总体roc值。
本公开还提供了用于确认、诊断、预测、监测或表征受试者、优选妊娠受试者中先兆子痫的试剂盒,所述试剂盒包含至少两种试剂,其特异性用于测定来源于受试者的样品中纤连蛋白的水平。
本公开还提供了商业方法,其包括确定受试者、优选妊娠受试者中先兆子痫的存在、不存在、预测、严重性或特征的步骤,所述方法包括以下步骤:(a)评估来源于受试者的样品中的sflt-1、plgf的水平和多个不同的生物标志物,其中不同的生物标志物中没有一个是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)或血红素,(b)测定生物标志物指数值,所述指数包含sflt-1/plgf和加上多个不同的生物标志物,(c)采用所述生物标志物指数提供先兆子痫测定、先兆子痫诊断确认、确认先兆子痫不存在、先兆子痫的预后或先兆子痫的特征,和(d)提供报告以换取费用,其中报告基于所述生物标志物的分析指示指数值,并且指定所述受试者是否处于低先兆子痫风险、高先兆子痫风险或患有先兆子痫。
本公开还提供了用于确认、诊断、预后、监测或表征受试者、优选妊娠受试者中先兆子痫的系统,包括:(a)输入模块,其用于接收作为sflt-1、plgf和多个不同的生物标志物的输入水平,(b)处理器,其任选地被配置为对所述水平进行对数变换以获得对数变换水平,将每个对数变换水平标准化为标准化水平,将每个标准化水平调整为加权标准化水平,总计每个经调整的水平,平均每个经调整的水平;并基于所述评分提供先兆子痫指数,其中指数评分包括sflt-1/plgf并加上多个不同生物标志物。在一些情况下,对数变换是自然对数变换、常用对数变换、二元对数变换、有理数对数变换或无理数对数变换。在一些示例中,对数变换是log2、log10或loge变换。在一些情况下,对数变换是logb,其中对数底是任何实数(包括自然数、有理数或无理数)。
本公开还提供了用于确认受试者、优选妊娠受试者没有患有先兆子痫的方法,包括:评估来源于受试者的样品中的多个生物标志物以确认受试者没有患有先兆子痫,其中该确认具有大于90%的特异性或具有0.9的auc并用于计算指数。
本公开的一些实施方案是:
1.一种用于确定先兆子痫的严重性或用于确认女性受试者中存在或不存在先兆子痫的方法,包括:
a)测量来源于妊娠女性的样品中一个或多个生物标志物的水平;
b)基于一个或多个生物标志物的水平计算指数;和
c)基于指数,确认妊娠女性是否正经历先兆子痫或妊娠女性是否没有正经历先兆子痫。
2.一种用于诊断、预后(pronging)、监测、表征、确定先兆子痫的严重性或确认女性受试者中存在或不存在先兆子痫的方法,包括:
a)测量来源于妊娠女性的样品中一个或多个生物标志物的水平;
b)将一个或多个生物标志物的水平与各自的重组蛋白水平进行比较;和
c)基于比较,确认妊娠女性是否正经历先兆子痫或妊娠女性是否没有正经历先兆子痫。
3.权利要求2的方法,还包括基于一个或多个生物标志物的水平计算指数。
4.一种用于诊断、预后、监测、表征、确定先兆子痫的严重性或确认女性受试者中存在或不存在先兆子痫的方法,包括:
a)测量来源于妊娠女性的样品中纤连蛋白(fn)和两个或更多个生物标志物的水平,其中两个或更多个生物标志物中的至少两种不同于纤连蛋白,
b)基于纤连蛋白和两个或更多个生物标志物的水平计算指数;和
c)基于比较,确认女性受试者是否正经历先兆子痫或女性受试者是否没有正经历先兆子痫。
5.权利要求4的方法,其中两个或更多个生物标志物选自sflt-1、p1gf、adam-12、hpx和papp-a。
6.权利要求4的方法,其中一个或多个生物标志物是sflt-1、p1gf和papp-a。
7.权利要求4的方法,其中一个或多个生物标志物是sflt-1、p1gf、papp-a和adam-12。
8.权利要求4的方法,其中一个或多个生物标志物是sflt-1、p1gf、papp-a和hpx。
9.权利要求4的方法,其中一个或多个生物标志物是p1gf、papp-a和adam-12。
10.权利要求4的方法,其中一个或多个生物标志物是sflt-1和p1gf。
11.权利要求4的方法,其中一个或多个生物标志物是p1gf和papp-a。
12.权利要求4的方法,其中一个或多个生物标志物是sflt-1、p1gf和adam-12。
13.权利要求4的方法,其中一个或多个生物标志物是sflt-1和adam-12。
14.权利要求4、5、6、7、8、9、10、11、12或13的方法,还包括将指数与阈值进行比较。
15.一种用于确认女性受试者中先兆子痫或不存在先兆子痫的方法,包括:
a)使用选择性结合纤连蛋白(fn)或fn片段的单克隆抗体测量来源于女性受试者的样品中fn或fn片段的水平;和
b)确认女性受试者是否正经历先兆子痫或女性受试者是否没有正经历先兆子痫,其中该确认基于比较。
16.如权利要求15的方法,还包括测量来源于女性受试者的样品中两个或更多个生物标志物的水平。
17.权利要求16的方法,其中两个或更多个生物标志物选自sflt-1、p1gf、adam-12、hpx和papp-a。
18.权利要求16的方法,其中一个或多个生物标志物是sflt-1、p1gf和papp-a。
19.权利要求16的方法,其中一个或多个生物标志物是sflt-1、p1gf、papp-a和adam-12。
20.权利要求16的方法,其中一个或多个生物标志物是sflt-1、p1gf、papp-a和hpx。
21.权利要求16的方法,其中一个或多个生物标志物是p1gf、papp-a和adam-12。
22.权利要求16的方法,其中一个或多个生物标志物是sflt-1和p1gf。
23.权利要求16的方法,其中一个或多个生物标志物是p1gf和papp-a。
24.权利要求16的方法,其中一个或多个生物标志物是sflt-1、p1gf和adam-12。
25.权利要求16的方法,其中一个或多个生物标志物是sflt-1和adam-12。
26.权利要求15的方法,还包括基于结合的单克隆抗体的水平计算指数。
27.权利要求16、18、19、20、21、22、23、24或25的方法,还包括基于结合的单克隆抗体和两个或更多个生物标志物的水平计算指数。
28.权利要求26或27的方法,还包括将指数与阈值进行比较,其中指数指示女性受试者中存在或不存在先兆子痫。
29.一种用于诊断、预后、表征、监测、确定先兆子痫的严重性或确认女性受试者中先兆子痫或不存在先兆子痫的方法,包括:
a)测量来源于妊娠女性的样品中sflt、p1gf和一个或多个生物标志物的水平,其中一个或多个生物标志物仅不同于vegf,其中vegf不包括vegfr-1。
b)基于sflt、p1gf和一个或多个生物标志物的水平计算指数;和
c)基于指数,确认女性受试者是否正经历先兆子痫或女性受试者是否没有正经历先兆子痫。
30.权利要求29的方法,其中一个或多个生物标志物选自纤连蛋白(fn)、adam-12、hpx和papp-a。
31.权利要求29的方法,其中一个或多个生物标志物是adam-12
32.权利要求29的方法,其中一个或多个生物标志物是papp-a。
33.权利要求29的方法,其中一个或多个生物标志物是纤连蛋白(fn)。
34.权利要求29的方法,其中一个或多个生物标志物是纤连蛋白(fn)和papp-a。
35.权利要求29的方法,其中一个或多个生物标志物是纤连蛋白(fn)和adam-12。
36.权利要求29的方法,其中一个或多个生物标志物是纤连蛋白(fn)、adam-12和papp-a。
37.权利要求29的方法,其中一个或多个生物标志物是纤连蛋白(fn)、hpx和papp-a。
38.权利要求29、30、32、33、34、35、36或37的方法,还包括将指数与阈值进行比较。
39.一种用于诊断、预后、表征、监测、确定先兆子痫的严重性或确认女性受试者中先兆子痫或不存在先兆子痫的方法,包括:
a)在两个不同的测定中测量至少一个纤连蛋白(fn)片段的水平,其中测定确定来源于妊娠女性的样品中的fn水平;和
b)基于在两个不同测定中测量的fn水平,诊断、预后、表征、监测、确定先兆子痫的严重性或确认女性受试者中先兆子痫或不存在先兆子痫。
40.权利要求39的方法,其中不同的测定中的每一个测定利用不同的单克隆抗体。
41.权利要求40的方法,还包括测量来源于妊娠女性的样品中一个或多个生物标志物的水平,其中一个或多个生物标志物不同于纤连蛋白(fn)。
42.权利要求41的方法,其中一个或多个生物标志物选自sflt-1、p1gf、adam-12、hpx和papp-a。
43.权利要求40的方法,其中一个或多个生物标志物是sflt-1和p1gf。
44.如权利要求40的方法,其中一个或多个生物标志物是sflt-1、p1gf和papp-a。
45.权利要求40的方法,其中一个或多个生物标志物是sflt-1、p1gf和adam-12。
46.权利要求41、43、44或45的方法,还包括基于结合的单克隆抗体和两个或更多个生物标志物的水平计算指数。
47.如权利要求1、3或46的方法,还包括将指数与阈值进行比较。
48.权利要求14、28、38、47的方法,其中指数通过实函数算法计算,用于对包括一个或多个变量乘以一个或多个对应的权重因子的一个或多个生物标志物的水平进行总计,
其中一个或多个生物标志物水平中的每一个的水平被输入到一个或多个变量的具体变量中,
其中对应的权重因子对于每个具体变量是独特的,
其中对应的权重因子中的至少一个不同于一。
49.权利要求48的方法,其中算法包括至少一个二元运算。
50.权利要求49的方法,其中至少一个二元运算是除法。
51.权利要求49的方法,其中至少一个二元运算是加法或减法。
52.权利要求1、3、4、15、29或39的方法,还包括产生指示存在或不存在先兆子痫的报告。
53.权利要求1、3、4、15、29或39的方法,其中方法不包括测量血压、血糖水平、尿蛋白水平、家族性先兆子痫史或体重增加。
54.权利要求1、3、4、15、29或39的方法,其中女性受试者被诊断为具有由以下组成的组的至少一个症状:高于140/90mmhg的血压、高于100mg/dl的空腹血糖水平、在24小时收集中尿蛋白水平超过5克或者至少分开四小时收集的两个随机尿样的尿蛋白水平超过3+、一周中体重增加超过两磅、血小板水平在妊娠中期低于155,000(每微升)或在妊娠晚期过程中低于145,000(每微升)、在24小时内少于400毫升的少尿、高于25的体重指数、先兆子痫家族史或家族性先兆子痫、孕产妇先兆子痫史、肺水肿、紫绀和视力变化。
55.权利要求1或2的方法,其中一个或多个生物标志物选自sflt-1、p1gf、纤连蛋白(fn)、adam-12、hpx和papp-a。
56.权利要求1、3、4、15、29或39的方法,其中生物标志物不包括铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)和血红素。
57.权利要求14、38或47的方法,其中比较是将一个或多个生物标志物与单个妊娠女性或经历pe的一组妊娠女性和未经历pe的一组妊娠女性的比较。
58.权利要求57的方法,其中单个妊娠女性是正被测试的女性。
59.权利要求57的方法,其中比较包括将一个或多个生物标志物与各自的重组蛋白指数值进行比较。
60.权利要求1、3、4、15、29或39的方法,其中生物标志物包括一个或多个蛋白质或蛋白质片段。
61.权利要求1、3、4、15、29或39的方法,其中生物标志物包括多核苷酸。
62.权利要求1、3、4、15、29或39的方法,其中测量是通过选自由以下组成的组的方法的测量:免疫测定、质谱、色谱、比浊法、辐射状免疫扩散和单向辐射状免疫扩散测定。
63.权利要求1、3、4、15、29或39的方法,其中测量是通过免疫测定的测量。
64.权利要求63的方法,其中免疫测定选自elisa、夹心elisa、竞争性elisa和igm抗体捕获elisa。
65.一种用于诊断、预后、监测、表征、确定先兆子痫的严重性或用于确认妊娠女性中存在或不存在先兆子痫的试剂盒,该试剂盒包含:至少两个不同的试剂,其特异性用于测定来自妊娠女性的样品中纤连蛋白的水平(fn)。
66.权利要求65的试剂盒,其还包含两个或更多个试剂,其测量来源于女性受试者的样品中两个或更多个生物标志物的水平。
67.权利要求66的试剂盒,其中两个或更多个生物标志物是sflt-1、p1gf和papp-a。
68.权利要求66的试剂盒,其中两个或更多个生物标志物是sflt-1、p1gf、papp-a和adam-12。
69.权利要求66的试剂盒,其中两个或更多个生物标志物是sflt-1、p1gf、papp-a和hpx。
70.权利要求66的试剂盒,其中两个或更多个生物标志物是p1gf、papp-a和adam-12。
71.权利要求66的试剂盒,其中两个或更多个生物标志物是sflt-1和p1gf。
72.权利要求66的试剂盒,其中两个或更多个生物标志物是p1gf和papp-a。
73.权利要求66的试剂盒,其中两个或更多个生物标志物是sflt-1、p1gf和adam-12。
74.权利要求66的试剂盒,其中两个或更多个生物标志物是sflt-1和adam-12。
75.权利要求65或66的试剂盒,其中该试剂盒不包括测量选自由以下组成的组的生物标志物的水平的试剂:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离βhpc和血红素。
76.一种用于确认妊娠女性中存在或不存在先兆子痫的试剂盒,该试剂盒包含
a)第一试剂,其特异性用于测定papp-a水平;和
b)第二试剂,其特异性用于测定adam12。
77.权利要求76的试剂盒,其还包含测量来源于女性受试者的样品中一个或多个生物标志物的水平的一个或多个试剂。
78.权利要求77的试剂盒,其中一个或多个生物标志物是sflt-1、p1gf和纤连蛋白(fn)。
79.权利要求77的试剂盒,其中一个或多个生物标志物是p1gf和纤连蛋白(fn)。
80.权利要求76或77的试剂盒,其中该试剂盒不包括测量选自由以下组成的组的生物标志物的水平的试剂:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离βhpc和血红素。
81.一种用于诊断、预后、监测、表征、确定先兆子痫的严重性或用于确认妊娠女性中存在或不存在先兆子痫的试剂盒,该试剂盒包含:
a)第一试剂,其特异性用于测定sflt-1或p1gf之一的水平;
b)第二试剂,其特异性用于测定纤连蛋白(fn);和
c)第三试剂,其特异性用于测定生物标志物的水平,该生物标志物的水平不同于由第一和第二试剂测定的生物标志物的水平。
82.权利要求81的试剂盒,其中第一试剂测定sflt-1的水平,第三试剂测定p1gf的水平,并且该试剂盒还包含测定不同于sflt-1、p1gf和fn的生物标志物的水平的第四试剂。
83.权利要求82的试剂盒,其中第四试剂测定papp-a、hpx或adam12的水平。
84.权利要求81、82或83的试剂盒,其中该试剂盒不包括测量选自由以下组成的组的生物标志物的水平的试剂:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离βhpc和血红素。
85.一种用于确认妊娠女性中存在或不存在先兆子痫的试验,其中该试验测量来自来源于妊娠女性的样品的一个或多个生物标志物并且具有至少0.8或更大的总体roc值。
86.权利要求85的测试,其中总体roc值为至少0.9或更大。
87.权利要求85的测试,其中总体roc值为至少0.95或更大。
88.权利要求85的测试,其中总体roc值为至少0.98或更大。
89.权利要求85的测试,其中总体roc值为至少0.984或更大。
90.一种具有用于诊断、预后、表征、监测、确定先兆子痫的严重性或确认女性受试者中存在或不存在先兆子痫的可执行逻辑的计算机可读介质,包括:
(a)输入字段,其用于提供一个或多个生物标志物水平,
(b)算法,其用于相对于训练集调整一个或多个生物标志物的水平,从而提供一个或多个经调整的生物标志物水平;
(c)算法,其包括使用经调整的生物标志物水平执行至少一个二元运算,其中该算法是得到指数值的实函数;和
(d)输出字段,其呈现指数值,其中指数值指示诊断、预后、表征、监测、确定先兆子痫的严重性或确认女性受试者中存在或不存在先兆子痫。
91.一种具有用于确认女性受试者中存在或不存在先兆子痫的可执行逻辑的计算机可读介质,包括:
(e)输入字段,其用于提供一个或多个生物标志物水平,
(f)算法,其用于相对于对照值调整一个或多个生物标志物水平,从而提供一个或多个经调整的生物标志物水平;
(g)算法,其包括加上或减去一个或多个经调整的生物标志物水平,其中该算法是得到指数值的实函数;和
(h)输出字段,其呈现指数值,其中指数值指示女性受试者中存在或不存在先兆子痫。
92.一种具有用于确认女性受试者中存在或不存在先兆子痫的可执行逻辑的计算机可读介质,包括:
(i)输入字段,其用于提供一个或多个生物标志物水平,
(j)算法,其用于相对于对照值调整一个或多个生物标志物水平,从而提供一个或多个经调整的生物标志物水平;
(k)算法,其包括一个或多个经调整的生物标志物水平中两个之间的比率,其中该算法是得到指数值的实函数;和
(l)输出字段,其呈现指数值,其中指数值指示女性受试者中存在或不存在先兆子痫。
93.权利要求90、91或92的计算机可读介质,其中实函数是复杂统计算法。
94.权利要求90、91或92的计算机可读介质,其中实函数包括至少一个附加二元运算。
95.权利要求94的计算机可读介质,其中实函数包括乘以对应的权重因子的变量。
96.权利要求95的计算机可读介质,其中一个或多个生物标志物中每个生物标志物的水平被输入到对应于具体生物标志物的具体变量,并且其中对应的权重因子对于每个具体变量是独特的或对于两个变量的每个具体比率是独特的。
97.权利要求90的计算机可读介质,还包括用于对一个或多个经调整的生物标志物水平中的每一个进行平均的算法。
权利要求90的计算机可读介质,其中计算机可读介质还包括用于执行水平的对数变换以获得对数变换水平的算法;用于将每个对数变换水平标准化为标准化水平的算法;用于将每个标准化水平调整为加权标准化水平的算法。
98.一种具有用于诊断、预后、监测、表征、确定先兆子痫的严重性或用于确认妊娠女性中存在或不存在先兆子痫的可执行逻辑的计算机可读介质,包括:
(a)输入字段,其用于提供一个或多个生物标志物水平,
(b)调整算法,其用于相对于对应的对照值调整一个或多个生物标志物中的每一个的水平,其中该调整算法提供一个或多个经调整的生物标志物水平;
(c)实函数算法,其用于操作一个或多个经调整的生物标志物水平的,包括一个或多个变量乘以一个或多个对应的权重因子,
其中一个或多个经调整的生物标志物水平中的每一个的水平被输入到一个或多个变量的具体变量中,
其中对应的权重因子对于每个具体变量是独特的,其中对应的权重因子中的至少一个不同于一;和
(d)输出字段,其呈现指数值,其中指数值指示女性受试者中存在或不存在先兆子痫。
99.权利要求90、91、92或98的计算机可读介质,其中使用训练集来产生对照值。
100.权利要求98的计算机可读介质,其中训练集基于模型。
101.权利要求98的计算机可读介质,其中训练集基于从受试者获得的实际值。
102.权利要求98的计算机可读介质,其中对象是至少150个受试者或更多受试者。
103.权利要求98的计算机可读介质,其中实际受试者包括复杂受试者。
104.权利要求98的计算机可读介质,其中复杂受试者包括用于训练集的总受试者的至少10%。
105.权利要求98的计算机可读介质,其中算法包括至少一个二元运算。
106.权利要求105的计算机可读介质,其中至少一个二元运算是除法。
107.权利要求105的计算机可读介质,其中至少一个二元运算是加法或减法。
本公开的一些实施方案是:
1.一种用于确认女性受试者中存在或不存在先兆子痫的方法,该方法包括:
a)测量来源于女性受试者的样品中一个或多个生物标志物的水平;
b)基于一个或多个生物标志物的水平计算指数;和
c)基于指数,确认女性受试者中存在或不存在先兆子痫。
2.权利要求1的方法,其中一个或多个生物标志物的测量水平包括测量三个或更多个生物标志物的水平。
3.权利要求1的方法,其中一个或多个生物标志物的测量水平包括测量四个或更多个生物标志物的水平。
4.权利要求1的方法,其中一个或多个生物标志物的测量水平包括测量五个或更多个生物标志物的水平。
5.一种用于确认女性受试者中存在或不存在先兆子痫的方法,该方法包括:
a)测量来源于女性受试者的样品中一个或多个生物标志物的水平;
b)将一个或多个生物标志物的水平与各自的重组蛋白水平或标准值进行比较;和
c)基于比较,确定女性受试者中存在或不存在先兆子痫。
6.权利要求5的方法,还包括基于一个或多个生物标志物的水平计算指数。
7.一种用于确认女性受试者中存在或不存在先兆子痫的方法,该方法包括:
a)测量来源于女性受试者的样品中纤连蛋白(fn)和两个或更多个生物标志物的水平,其中两个或更多个生物标志物中的至少两个不同于纤连蛋白,
b)基于fn和两个或更多个生物标志物的水平计算指数;和
c)基于指数,确定女性受试者中存在或不存在先兆子痫。
8.权利要求7的方法,其中两个或更多个生物标志物选自sflt-1、p1gf、adam-12、hpx和papp-a。
9.权利要求7的方法,其中生物标志物是sflt-1、p1gf和papp-a。
10.权利要求7的方法,其中生物标志物是sflt-1、p1gf、papp-a和adam-12。
11.权利要求7的方法,其中生物标志物是sflt-1、p1gf、papp-a和hpx。
12.权利要求7的方法,其中生物标志物是p1gf、papp-a和adam-12。
13.权利要求7的方法,其中生物标志物是sflt-1和p1gf。
14.权利要求7的方法,其中生物标志物是p1gf和papp-a。
15.权利要求7的方法,其中生物标志物是sflt-1、p1gf和adam-12。
16.权利要求7的方法,其中生物标志物是sflt-1和adam-12。
17.权利要求7的方法,其中生物标志物是p1gf、adam-12、sflt1、papp-a2和hpx。
18.权利要求7、8、9、10、11、12、13、14、15、16或17的方法,还包括将指数与阈值进行比较。
19.一种用于确认女性受试者中存在或不存在先兆子痫的方法,该方法包括:
a)使用选择性结合纤连蛋白(fn)或fn片段的单克隆抗体测量来源于女性受试者的样品中fn或fn片段的水平;
b)将纤连蛋白(fn)或fn片段的水平与各自的重组蛋白水平或与标准值进行比较;和
c)基于比较,确认存在或不存在先兆子痫。
20.权利要求19的方法,还包括测量来源于女性受试者的样品中两个或更多个生物标志物的水平。
21.权利要求20的方法,其中两个或更多个生物标志物选自sflt-1、p1gf、adam-12、hpx和papp-a。
22.权利要求20的方法,其中生物标志物是sflt-1、p1gf和papp-a。
23.权利要求20的方法,其中生物标志物是sflt-1、p1gf、papp-a和adam-12。
24.权利要求20的方法,其中生物标志物是sflt-1、p1gf、papp-a和hpx。
25.权利要求20的方法,其中生物标志物是p1gf、papp-a和adam-12。
26.权利要求20的方法,其中生物标志物是sflt-1和p1gf。
27.权利要求20的方法,其中生物标志物是p1gf和papp-a。
28.权利要求20的方法,其中生物标志物是sflt-1、p1gf和adam-12。
29.权利要求20的方法,其中生物标志物是sflt-1和adam-12。
30.权利要求20的方法,其中生物标志物是p1gf、fn、adam-12、sflt1、papp-a2和hpx。
31.权利要求19的方法,还包括基于结合的单克隆抗体的水平计算指数。
32.权利要求20、22、23、24、25、26、27、28或29的方法,还包括基于(1)结合的单克隆抗体和(2)两个或更多个生物标志物的水平计算指数。
33.权利要求31或32的方法,还包括将指数与阈值进行比较,其中指数指示女性受试者中存在或不存在先兆子痫。
34.一种用于确认女性受试者中存在或不存在先兆子痫的方法,该方法包括:
a)测量来源于女性受试者的样品中sflt、p1gf和一个或多个生物标志物的水平,其中一个或多个生物标志物不同于vegf,其中vegf不包括vegfr-1;
b)基于sflt、p1gf和一个或多个生物标志物的水平计算指数;和
c)基于指数,确定女性受试者中存在或不存在先兆子痫。
35.权利要求34的方法,其中一个或多个生物标志物选自纤连蛋白(fn)、adam-12、hpx和papp-a。
36.权利要求34的方法,其中生物标志物是adam-12。
37.权利要求34的方法,其中生物标志物是papp-a。
38.权利要求34的方法,其中生物标志物是纤连蛋白(fn)。
39.权利要求34的方法,其中生物标志物是纤连蛋白(fn)和papp-a。
40.权利要求34的方法,其中生物标志物是纤连蛋白(fn)和adam-12。
41.权利要求34的方法,其中生物标志物是纤连蛋白(fn)、adam-12和papp-a。
42.权利要求34的方法,其中生物标志物是纤连蛋白(fn)、hpx和papp-a。
43.权利要求34的方法,其中生物标志物是fn、adam-12、papp-a2和hpx。
44.权利要求34、35、36、37、38、39、40、41或42的方法,还包括将指数与阈值进行比较。
45.一种用于确认女性受试者中存在或不存在先兆子痫的方法,该方法包括:
a.测量由以下组成的生物标志物的水平:sflt和p1gf;
b.基于sflt和p1gf的水平计算指数;和
c.基于指数,确认女性受试者中存在或不存在先兆子痫。
46.权利要求45的方法,其中计算包括将sflt和p1gf的测量水平各自乘以独特的权重因子,以及将一个或多个二元函数应用于sflt和p1gf的加权测量水平。
47.一种用于诊断、预后、表征、监测、确定女性受试者中先兆子痫的严重性、确认女性受试者中存在先兆子痫或确认女性受试者中不存在先兆子痫的方法,该方法包括:
a)在两个不同的测定中测量至少一个纤连蛋白(fn)片段的水平,其中测定确定来源于女性受试者的样品中fn的水平;和
b)基于在两个不同测定中测量的至少一个fn片段的水平,诊断、预后、表征、监测、确定女性受试者中先兆子痫的严重性、确认女性受试者中存在先兆子痫或确认女性受试者中不存在先兆子痫。
48.权利要求47的方法,其中两个不同测定中的每一个测定使用不同的单克隆抗体。
49.权利要求48的方法,还包括测量来源于女性受试者的样品中一个或多个生物标志物的水平,其中一个或多个生物标志物不同于纤连蛋白(fn)。
50.权利要求49的方法,其中生物标志物选自sflt-1、p1gf、adam-12、hpx和papp-a。
51.权利要求49的方法,其中生物标志物是sflt-1或p1gf。
52.权利要求49的方法,其中生物标志物是sflt-1、p1gf或papp-a。
53.权利要求49的方法,其中生物标志物是sflt-1、p1gf或adam-12。
54.权利要求49的方法,其中生物标志物是p1gf、adam-12、sflt1、papp-a2和hpx。
55.权利要求49、50、51、52、53或54的方法,还包括基于(1)结合的单克隆抗体和(2)一个或多个生物标志物的水平计算指数。
56.权利要求1、5、7、34或47的方法,其中测量包括:
用对待测生物标志物具有亲和力的抗体包被免疫测定板;和
用非特异性阻断蛋白包被免疫测定板。
57.权利要求56的方法,还包括:
将标记的生物标志物与样品混合得到混合物;并将混合物加入免疫测定板。
58.权利要求56的方法,还包括:
将样品引入免疫测定板;和
将缀合的二抗引入免疫测定板。
59.权利要求1、6或55的方法,还包括将指数与阈值进行比较。
60.权利要求7、18、31、32、33、34、44或59的方法,其中指数通过用于总计测量的生物标志物水平的实函数算法计算,其中算法包括将一个或多个变量乘以一个或多个对应的权重因子,
其中生物标志物水平中每一个的水平被输入到一个或多个变量中的具体变量中,
其中对应的权重因子对于每个具体变量是独特的,
其中一个或多个对应的权重因子中的至少一个不同于一。
61.权利要求60的方法,其中算法包括至少一个二元运算。
62.权利要求61的方法,其中至少一个二元运算是除法。
63.权利要求61的方法,其中至少一个二元运算是加法或减法。
64.权利要求60的方法,其中一个或多个权重因子是两个生物标志物的测量水平的比率。
65.权利要求1、5、7、19、34或47的方法,还包括产生指示女性受试者中存在或不存在先兆子痫的报告。
66.权利要求1、5、7、19、34或47的方法,其中该方法不包括考虑血压、血糖水平、尿蛋白水平、先兆子痫家族史或体重增加。
67.权利要求1、5、7、19、34或47的方法,其中女性受试者具有以下组中的至少一种症状:高于140/90mmhg的血压、高于100mg/dl的空腹血糖水平、在24小时收集中尿蛋白水平超过5克或者至少分开四小时收集的两个随机尿样的尿蛋白水平超过3+、一周中体重增加超过两磅、血小板水平在妊娠中期低于155,000(每微升)或在妊娠晚期过程中低于145,000(每微升)、在24小时内少于400毫升的少尿、高于25的体重指数、先兆子痫家族史、肺水肿、紫绀和视力变化。
68.权利要求1或5的方法,其中一个或多个生物标志物选自sflt-1、p1gf、纤连蛋白(fn)、adam-12、hpx和papp-a。
69.权利要求1、5、7、19、34或47的方法,其中生物标志物不包括铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)和血红素。
70.权利要求18、44或59的方法,其中比较包括将生物标志物与(1)患有先兆子痫的单个妊娠女性或妊娠女性组的生物标志物和(2)没有患有先兆子痫的妊娠女性组的生物标志物进行比较。
71.权利要求70的方法,其中单个妊娠女性是女性受试者。
72.权利要求70的方法,其中比较包括将生物标志物与各自的重组蛋白指数值进行比较。
73.权利要求1、5、7、19、34或47的方法,其中生物标志物包括一个或多个蛋白质或蛋白质片段。
74.权利要求1、5、7、19、34或47的方法,其中生物标志物包括多核苷酸。
75.权利要求1、5、7、19、34或47的方法,其中测量包括利用免疫测定、质谱、色谱、比浊法、辐射状免疫扩散或单向辐射状免疫扩散测定。
76.权利要求1、5、7、19、34或47的方法,其中测量包括通过免疫测定测量。
77.权利要求76的方法,其中免疫测定选自elisa,夹心elisa,竞争性elisa和igm抗体捕获elisa。
78.一种用于诊断、预后、监测、表征、确定女性受试者中先兆子痫的严重性、确认女性受试者中存在先兆子痫或确认女性受试者中不存在先兆子痫的试剂盒,该试剂盒包含:至少两种不同的特异性用于测定来源于女性受试者的样品中纤连蛋白(fn)的水平的试剂。
79.权利要求78的试剂盒,还包括两个或更多个用于测量来源于女性受试者的样品中两个或更多个生物标志物的水平的试剂。
80.权利要求79的试剂盒,其中生物标志物是sflt-1、p1gf和papp-a。
81.权利要求79的试剂盒,其中生物标志物是sflt-1、p1gf、papp-a和adam-12。
82.权利要求79的试剂盒,其中生物标志物是sflt-1、p1gf、papp-a和hpx。
83.权利要求79的试剂盒,其中生物标志物是p1gf、papp-a和adam-12。
84.权利要求79的试剂盒,其中生物标志物是sflt-1和p1gf。
85.权利要求79的试剂盒,其中生物标志物是p1gf和papp-a。
86.权利要求79的试剂盒,其中生物标志物是sflt-1、p1gf和adam-12。
87.权利要求79的试剂盒,其中生物标志物是sflt-1和adam-12。
88.权利要求79的试剂盒,其中生物标志物是p1gf、fn、adam-12、sflt1、papp-a2和hpx。
89.权利要求78或79的试剂盒,其中该试剂盒不包括用于测量选自以下生物标志物的水平的试剂:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离βhpc和血红素。
90.一种用于确认女性受试者中存在或不存在先兆子痫的试剂盒,该试剂盒包括:
a)特异性用于测定papp-a水平的第一试剂;和
b)特异性用于测定adam12水平的第二试剂。
91.权利要求90的试剂盒,其还包含一个或多个用于测量来源于女性受试者的样品中一个或多个生物标志物的水平的试剂。
92.权利要求91的试剂盒,其中生物标志物是sflt-1、p1gf和纤连蛋白(fn)。
93.权利要求91的试剂盒,其中生物标志物是p1gf和纤连蛋白(fn)。
94.权利要求90或91的试剂盒,其中该试剂盒不包括用于测量选自以下生物标志物的水平的试剂:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离βhpc和血红素。
95.一种用于诊断、预后、监测、表征、确定女性受试者中先兆子痫的严重性、确认女性受试者中存在先兆子痫或确认女性受试者中不存在先兆子痫的试剂盒,该试剂盒包括:
a)特异性用于测定sflt-1或p1gf之一的水平的第一试剂;
b)特异性用于测定纤连蛋白(fn)的第二试剂;和
c)特异性用于测定不同于由第一和第二试剂测定的生物标志物的生物标志物的水平的第三试剂。
96.权利要求95的试剂盒,其中第一试剂特异性用于测定sflt-1的水平,第三试剂特异性用于测定p1gf的水平,并且试剂盒还包括特异性用于测定不同于sflt-1、p1gf和fn的生物标志物的水平的第四试剂。
97.权利要求96的试剂盒,其中第四试剂特异性用于测定papp-a、hpx或adam12的水平。
98.权利要求95、96或97的试剂盒,其中该试剂盒不包括特异性用于测定选自以下生物标志物的水平的试剂:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离βhpc和血红素。
99.一种用于确认女性受试者中存在或不存在先兆子痫的测试,其中该测试测量来源于女性受试者的样品的一个或多个生物标志物,其中与所述生物标志物相关的接受者操作特征(roc)值为至少0.8。
100.权利要求99的测试,其中roc值为至少0.9。
101.权利要求99的测试,其中roc值为至少0.95。
102.权利要求99的测试,其中roc值为至少0.98。
103.权利要求99的测试,其中roc值为至少0.984。
104.一种用于确认受试者中存在或不存在先兆子痫的测试,其中该测试测量来源于受试者的样品中一个或多个生物标志物,其中与所述生物标志物相关的接受者操作特征(roc)值大于与sflt/p1gf相关的roc值。
105.权利要求104的测试,其中女性受试者表现出先兆子痫的临床症状。
106.权利要求104的测试,其中测试包括测量sflt/p1gf的测量水平的比率。
107.权利要求104的测试,其中sflt/p1gf的测量水平的比率是经标准化的、原始的、经调整的或其组合。
108.一种用于诊断、预后、表征、监测、确定女性受试者中先兆子痫的严重性、确认女性受试者中存在先兆子痫或确认女性受试者中不存在先兆子痫的系统,该系统包括:
(a)输入模块,其用于接收一个或多个生物标志物的输入水平;
(b)处理器,其被配置为:
执行将一个或多个生物标志物的水平相对于训练集进行调整的第一算法,从而提供一个或多个经调整的生物标志物水平;和
执行使用经调整的生物标志物水平应用至少一个二元运算的第二算法,其中第二算法是得到指数值的实函数;和
(c)输出模块,其用于输出指数值,其中指数值指示用于女性受试者中先兆子痫的诊断、预后、表征、监测的方面、严重性的确定、存在的确认或不存在的确认。
109.一种用于确认女性受试者中存在或不存在先兆子痫的系统,该系统包括:
(a)输入模块,其用于接收一个或多个生物标志物的输入水平;
(b)处理器,其被配置为:
执行将一个或多个生物标志物的水平相对于对照值进行调整的第一算法;和
执行加上或减去一个或多个经调整的生物标志物水平的第二算法,其中第二算法是得到指数值的实函数;和
(c)输出模块,其用于输出指数值,其中指数值指示女性受试者中不存在或存在先兆子痫。
110.一种用于确认女性受试者中存在或不存在先兆子痫的系统,该系统包括:
(a)输入模块,其用于接收两个或更多个生物标志物的输入水平;
(b)处理器,其被配置为:
执行将两个或更多个生物标志物的水平相对于对照值进行调整的第一算法,从而提供两个或更多个经调整的生物标志物水平;和
执行计算两个或更多个经调整的生物标志物水平中的两个之间的比率的第二算法,其中第二算法是得到指数值的实函数;和
(c)输出模块,其用于输出指数值,其中指数值指示女性受试者中存在或不存在先兆子痫。
111.权利要求108、109或110的系统,其中实函数包括复杂统计算法。
112.权利要求108、109或110的系统,其中实函数包括至少一个二元运算。
113.权利要求112的系统,其中实函数包括将变量乘以对应的权重因子。
114.权利要求113的系统,其中每个生物标志物的水平被输入到对应于生物标志物的具体变量中,并且其中对应的权重因子对于每个变量是独特的或对于每两个变量的比率是独特的。
115.权利要求108的系统,其中处理器还被配置为执行对一个或多个经调整的生物标志物水平中的每一个进行平均的第三算法。
116.权利要求108的系统,其中处理器还被配置为执行对水平应用对数变换以获得对数变换水平的第三算法;将每个对数变换水平标准化为标准化水平的第四算法;以及将每个标准化水平调整为加权标准化水平的第五算法。
117.一种用于诊断、预后、监测、表征、确定女性受试者中先兆子痫的严重性、确认女性受试者中存在先兆子痫或确认女性受试者中不存在先兆子痫的系统,该系统包括:
(a)输入模块,其用于接收一个或多个生物标志物的输入水平;
(b)处理器,其被配置为:
执行将一个或多个生物标志物中的每一个的水平相对于对应的对照值进行调整的算法,由此提供一个或多个经调整的生物标志物水平;
执行实函数算法,其通过将一个或多个变量乘以一个或多个对应的权重因子来操作一个或多个经调整的生物标志物水平,其中一个或多个经调整的生物标志物水平中的每一个的水平被输入到一个或多个变量中的具体变量中,其中对应的权重因子对于每个具体变量是独特的,其中对应的权重因子中的至少一个不同于一;和
(c)输出模块,其用于输出指数值,其中指数值指示女性受试者中先兆子痫的诊断、预后、表征、监测的方面、严重性的确定、存在的确认或不存在的确认。
118.权利要求109、110或117的系统,其中,使用训练集来产生对照值。
119.权利要求117的系统,其中训练集基于模型。
120.权利要求117的系统,其中训练集基于从受试者获得的实际值。
121.权利要求120的系统,其中受试者包括至少150个受试者。
122.权利要求120的系统,其中受试者包括复杂受试者。
123.权利要求122的系统,其中复杂受试者包括用于训练集的所有受试者的至少10%。
124.权利要求117的系统,其中算法应用至少一个二元运算。
125.权利要求124的系统,其中至少一个二元运算是除法。
126.权利要求124的系统,其中至少一个二元运算是加法或减法。
127.一种用于确认受试者中先兆子痫的测试,其中该测试能够以至少为0.8的接受者操作特征(roc)值辨别没有先兆子痫但具有一个或多个与先兆子痫相关的症状的受试者与患有先兆子痫的受试者。
128.权利要求127的测试,其中roc值为至少0.9。
129.权利要求127的测试,其中与先兆子痫相关的一个或多个症状选自糖尿病、高于正常葡萄糖水平、高血压、过度或突然的体重增加、超重、肥胖、高于正常体重指数、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果、先前先兆子痫发作、先兆子痫家族史、肾病和血栓形成倾向。
130.权利要求129的测试,其中糖尿病是妊娠糖尿病、i型或ii型糖尿病。
131.权利要求129的测试,其中高血压是慢性高血压。
132.一种用于确认受试者中先兆子痫的测试,其中该测试能够以至少80%的敏感性辨别没有先兆子痫但具有一个或多个与先兆子痫相关的症状的受试者与患有先兆子痫的受试者。
133.一种用于确认受试者中先兆子痫的测试,其中该测试能够以至少80%特异性辨别没有先兆子痫但具有一个或多个与先兆子痫相关的症状的受试者与患有先兆子痫的受试者。
134.一种用于确认受试者中先兆子痫的测试,其中该测试能够以至少为80%的阴性预测值(npv)辨别没有先兆子痫但具有一个或多个与先兆子痫相关的症状的受试者与患有先兆子痫的受试者。
135.权利要求132、133或134的测试,其中与先兆子痫相关的一个或多个症状选自糖尿病、高于正常葡萄糖水平、高血压、过度或突然的体重增加、超重、肥胖、高于正常体重指数、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果、先前先兆子痫发作、先兆子痫家族史、肾病和血栓形成倾向。
136.权利要求135的测试,其中糖尿病是妊娠糖尿病、i型或ii型糖尿病。
137.权利要求135的测试,其中高血压是慢性高血压。
138.权利要求135的测试,其中灵敏度为至少90%。
139.权利要求133的测试,其中特异性为至少90%。
140.权利要求134的测试,其中npv为至少90%。
141.一种用于确认先兆子痫的方法,该方法包括对来源于女性受试者的样品进行测试,其中测试包括测量多个标志物的水平,并使用多个标志物的水平来以至少为0.90的接受者操作特征(roc)值确认先兆子痫。
142.如权利要求141的方法,其中roc值为至少0.95。
143.一种用于确认先兆子痫的方法,该方法包括对来源于女性受试者的样品进行测试,其中测试包括测量多个标志物的水平,并使用多个标志物的水平来以至少为80%的特异性确认先兆子痫。
144.权利要求143的方法,其中特异性为至少90%。
145.一种用于确认先兆子痫的方法,该方法包括对来源于女性受试者的样品进行测试,其中测试包括测量多个标志物的水平,并使用多个标志物的水平来以至少为80%的灵敏度确认先兆子痫。
146.权利要求145的方法,其中灵敏度为至少90%。
147.一种用于确认先兆子痫的方法,该方法包括对来源于女性受试者的样品进行测试,其中测试包括测量多个标志物的水平,并使用所述水平来以至少为80%的阴性预测值确认先兆子痫。
148.权利要求147的方法,其中阴性预测值为至少90%。
149.权利要求127-140中任一项的测试,其中样品选自全血、尿液、血清和血浆。
150.权利要求141-148中任一项的方法,其中样品选自全血、尿液、血清和血浆。
151.权利要求1-7、31、34、60、141、143或147中任一项的方法,其中生物标志物包括第1组的生物标志物。
152.权利要求30、126或131-134中任一项的测试,其中生物标志物包括第1组的生物标志物。
153.权利要求108-110或116中任一项的系统,其中生物标志物包括第1组的生物标志物。
154.权利要求78、90或95中任一项的试剂盒,其中生物标志物包括第1组的生物标志物。
155.一种包含指令的计算机可读介质,指令在由计算机系统执行时使得计算机系统:
在第一时间点接收与来源于受试者的第一生物样品中的多个先兆子痫生物标志物的第一水平有关的第一数据集;
对第一水平进行第一分析以获得受试者中先兆子痫的第一评估;
在第二时间点接收与来源于受试者的第二生物样品中的多个先兆子痫生物标志物的第二水平有关的第二数据集;
对第二水平进行第二分析以获得受试者中先兆子痫的评估;
将第一评估与第二评估进行比较;和
基于比较确认先兆子痫或缺乏先兆子痫。
156.一种用于诊断或确认受试者中先兆子痫的方法,该方法包括:
检测来源于受试者的生物样品中的sflt、pig和结合于毕赤霉素抗体的蛋白质或蛋白质片段的蛋白质水平;和
使用检测到的蛋白质水平计算先兆子痫指数评分,其中先兆子痫评分指示受试者中存在或不存在先兆子痫。
157.权利要求156的方法,还包括诊断或确认受试者中的先兆子痫。
158.权利要求156的方法,其中计算包括将检测的蛋白质水平乘以独特的权重因子,以及将一个或多个二元函数应用于加权的检测蛋白质水平。
159.权利要求3的方法,其中四个或更多个生物标志物中的每一个选自sflt-1、p1gf、abfn、papp-a、takfn、adam-12和hpx,其中四个或更多个生物标志物中的每一个彼此不同。
160.权利要求5或49的方法,其中一个或多个生物标志物包括四个或更多个生物标志物,其中四个或更多个生物标志物中的每一个选自sflt-1、p1gf、abfn、papp-a、takfn、adam-12和hpx,其中四个或更多个生物标志物中的每一个彼此不同。
161.权利要求7或20的方法,其中两个或更多个生物标志物包括四个或更多个生物标志物,其中四个或更多个生物标志物中的每一个选自sflt-1、p1gf、abfn、papp-a、takfn、adam-12和hpx,其中四个或更多个生物标志物中的每一个彼此不同。
162.权利要求79的试剂盒,其中两个或更多个生物标志物包括四个或更多个生物标志物,其中四个或更多个生物标志物中的每一个选自sflt-1、p1gf、abfn、papp-a、takfn、adam-12和hpx,其中四个或更多个生物标志物中的每一个彼此不同。
通过引用并入
本说明书中提及的所有出版物、专利和专利申请通过引用并入本文,其程度如同每个单独出版物、专利或专利申请被具体和单独地指明通过引用并入。
附图简要说明
当结合附图阅读时,从下面的详细描述可以最好地理解本公开。要强调的是,根据通常的实践,附图的各种特征不是按比例的。相反,为了清楚起见,各种特征的尺寸被任意地扩大或缩小。附图中包括以下附图。
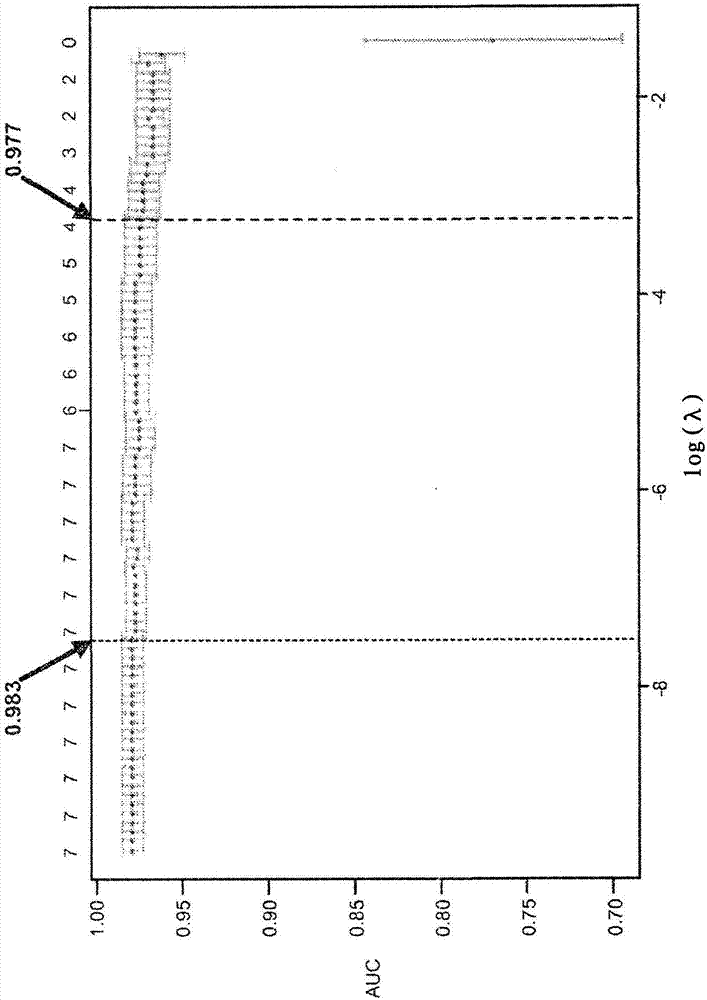
图1描绘了具有数量增加的标志物的一系列惩罚模型的性能。该图显示了平均交叉验证性能和对应的标准误差。顶部的数字表示模型的大小,而箭头标识具有最高曲线的下面积(auc)的模型和具有最大1-se(模型选择的“1-se”规则)内的平均auc的模型。
图2描述了具有不包括sflt-1/plgf的数量增加的标志物的一系列处罚模型的性能。该图显示了平均交叉验证性能和对应的标准误差。顶部的数字表示模型的大小,而箭头标识具有最高auc的模型和具有最大1-se(模型选择的“1-se”规则)内的平均auc的模型。
图3是描述具有2x一式两份的hi和lo质量对照的32个样品的一式两份模板的图。
图4是描述具有3x一式三份的hi和lo质量对照的20个样品的一式三份模板的图。
图5a-5f提供了各种pe生物标志物的列表(也参见表2)。
图6是20个化合物的主要单元的示意图。
发明详述
本文提供了用于确认先兆子痫诊断、确认“先兆子痫(pre-eclampsia)”或“先兆子痫(preeclampsia)”或“pe”的存在和/或不存在、预测受试者将发展pe的可能性、确定和/或确认pe的严重性、确定未妊娠的受试者如果受试者变为妊娠的受试者其发展pe的易感性,以及监测已经诊断患有pe的受试者的pe进展的方法、组合物、系统和软件,所有这些比传统的pe测试具有更大的灵敏度、特异性、置信度、准确度或曲线下的面积。
方法涉及分析来源于受试者的一个或多个样品以确认一个或多个pe生物标志物的存在、不存在、数量和/或构象。来源于受试者的样品可以是全血、尿液、血清、血浆和生物来源的其他液体样品或来源于其的细胞及其后代。样品可以在其采购后以任何方式操作,例如通过用试剂处理、增溶或富集某些组分。“标志物”或“生物标志物”是与不会获得先兆子痫的个体相比,在将获得或患有先兆子痫的个体的样品中以不同方式表示的任何生物实体。如果例如在不同的水平(例如蛋白质、rna或dna的量)、不同的三维状态(天然形式、错误折叠、替代构象)或不同的排列(例如,复杂物、聚集体、错误折叠组装体)发现生物标志物,则以不同方式表示生物标志物。
pe生物标志物可以是蛋白质、蛋白质片段、肽、多核苷酸、基因(dna)或基因片段、rna转录物或其他形式的rna,例如snrna、sirna和微rna。本申请中使用的术语“蛋白质”、“肽”和“多肽”是可以互换的。“多肽”是指氨基酸的聚合物,并且包括翻译后修饰的多肽、糖基化多肽、乙酰化多肽、磷酸化多肽等。
本文考虑的pe生物标志物的实例包括但不限于图5a-5f(或表2)中列出的标志物。
可以通过获得“先兆子痫谱”、“pe谱”或“谱”来进行pe的存在、不存在、监测或预测。pe谱是患者样品中一个或多个先兆子痫生物标志物的水平。pe生物标志物可以通过测量蛋白质水平或表达水平来确定。pe谱可以包括表1所示的pe生物标志物的以下组(小组)中的任何一个或多个。
表1
pe谱的其他示例包括以下中的任何一个或多个:
·sflt1/p1gf的比率和选自fn、papp-a、hpx和adam12的至少一种生物标志物,
·至少两个选自p1gf、adam12、fn、papp-a和hpx的生物标志物。
·fn、fg和至少一个或两个选自hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、p1gf和adam12的生物标志物。
·hpx与fn、fg、sflt-1、papp-a、vegf(不包括vegf-r1)、p1gf和/或adam12组合
·sflt-1与fn、fg、hpx、papp-a、vegf(不包括vegf-r1)、p1gf和/或adam12组合。
·papp-a与fn、fg、hpx、sflt-1、vegf(不包括vegf-r1)、p1gf和/或adam12组合。
·可以与fn、fg、hpx、papp-a、sflt-1、p1gf和/或adam12组合测量vegf(不包括vegf-r1)。
·p1gf与fn、fg、hpx、papp-a、sflt-1、vegf(不包括vegf-r1)和/或adam12组合。
·adam12与fn、fg、hpx、papp-a、sflt-1、p1gf和/或vegf(不包括vegf-r1)组合。
·sflt-1、p1gf、fn、fg和pappa-a;
·sflt-1、p1gf、adam12和fn、fg;
·sflt-1、p1gf、pappa-a和fn、fg;
·sflt-1、p1gf、hpx、papp-a和fn、fg;
·p1gf、adam12、papp-a、fn、fg;
·sflt-1、p1gf和fn、fg、p1gf、fn、fg、papp-a
·fn、fg、sflt-1、p1gf和fn、fg;
·sflt-1、fn、fg和adam12;
·p1gf、fn、fg和papp-a;
·p1gf和adam12;
·fn、fg和adam12、hpx、fn、fg、和adam12、hpx、adam12和pappa、hpx和pappa、sflt-1和p1gf.
本文的任何pe生物标志物谱或小组可任选地不包括一个或多个以下生物标志物:铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)和血红素。
在一些情况下,该生物标志物小组包括至少2、3、4、5、6、7、8、9、10或15个生物标志物。优选地,本公开的方法包括测定本文所述的一个或多个小组的蛋白质水平。当小组包括sflt1和plgf的比率时,比率可以是sflt-1和p1gf的原始水平的比率、sflt-1和plgf的标准化或经调整的水平(例如,相对于持家基因,例如abl1、gapdh、pgk1、或相对于整个小组中的信号)的比率、平均水平的比率或与对照相比的水平的比率(例如,纯化、重组蛋白)。
当分析多个pe生物标志物时,可以使结果经受提供单个分数(例如pe分数)的算法或pe评分函数。先兆子痫评分是代表患者样品中的一个或多个先兆子痫生物标志物的单一度量值。可以在给受试者或受试者的保健服务提供商的报告中报告pe评分。
pe评分可以作为pe指数报告。“pe指数”或“指数”是指示确认pe的可能性、pe的严重性或发展pe的可能性的程度的度量系统。可以使用分类算法从pe评分计算pe指数。受监督和不受监督的分类过程的示例于jain,“statisticalpatternrecognition:areview”,ieeetransactionsonpatternanalysisandmachineintelligence,vol.22,no.1,january2000中。
pe评分或指数可以指示pe诊断的诊断、预后或确认。除了pe评分或pe指数,报告还可以提供一套建议的治疗或当前治疗有效性的评估。本文所使用的术语“诊断”(“diagnosing”或“diagnosis”)是指确定受试者是否患有pe。本文所使用的术语“确认”(“confirming”或“confirmation”)一般包括确定怀疑患有pe或先前诊断为患有pe的受试者是否患有pe。本文使用的术语“预后”(“prognosing”或“prognosis”)一般包括预测受试者中pe的可能病程,例如pe严重性增加的可能性或受试者对治疗的响应性。本文所使用的术语“治疗”(“treating”或“treatment”)一般是指获得所需的药理学和/或生理学效果。该效果可以在以下方面是预防性的:完全或部分预防疾病或其症状(例如,降低发病的可能性)、降低疾病的发病率或严重性,和/或在以下方面是治疗性的:部分或完全治愈疾病,和/或可归因于疾病的不良效果。在确定pe评分时,通过获得例如光密度(od)值来获得生物标志物的原始水平。原始数据可以用于使用本文的方法确定样品中生物标志物的浓度,所述方法可包括与标准曲线的比较。标准曲线可以具有决定系数。在一些情况下,决定系数可以是r2值,例如,本文所述的方法可以使用≥0.5、0.6、0.7、0.75、0.8、0.85、0.9或0.95的r2值。在示例性情况下,使用本文方法的标准曲线的r2≥0.95。可以使用本领域普通技术人员已知的统计方法来评估数据的附加情况。诸如softmaxpro的软件可以用于执行本文所述的至少一些计算和分析。落在标准曲线范围之外的采集数据不会被进一步分析或计算。
生物标志物的原始水平可任选地相对于例如空白、对照或本文所述的另一样品进行标准化。在一些情况下,标准化可以包括从样品的od值中减去空白、对照或另一个样品的od值。标准化还可以包括首先取样品的od的平均值(average)、平均数(mean)或中值(median),并且其次取空白、对照或另一个样品的平均值、平均数或中值od,然后将这两个od值相减。
在一些情况下,将个体样品的原始od值,一组样品的平均值、平均数或中值od值,一个空白、一个对照、另一个样品、一组空白、一组对照或另一组样品的原始od值进行对数变换。通常,对数变换可以包括与标准曲线的比较。
生物标志物水平可以相对于以下的一个或多个进行调整:来源于如下更详细讨论的训练集的对照,在妊娠前被测试的受试者,在pe发作前被测试的受试者,来自没有患有pe的妊娠受试者的平均数值,来源于指定实验室受试者的值,计算值,对应的纯化生物标志物或对应的重组生物标志物,来源于没有患有pe或没有pe症状的妊娠受试者的样品的对照水平,来源于未被诊断为患有pe或没有pe症状的妊娠受试者的样品的对照水平,来源于具有(或被诊断为具有)pe症状(例如妊娠症状的并发症)但没有患有(或未被诊断为患有)pe的妊娠受试者样品的对照水平,来源于没有患有pe但具有一个或多个先兆子痫症状的妊娠受试者(例如,具有复杂妊娠的妊娠受试者)的样品的对照水平,所述先兆子痫症状例如糖尿病(例如,妊娠糖尿病、i型或ii型糖尿病)、高于正常葡萄糖水平、高血压(例如慢性或非慢性高血压)、高于正常体重、肥胖、高于正常体重指数(bmi)、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、先前妊娠的pe、肾病、血栓形成倾向或其任何组合;来源于未被诊断患有pe但具有一个或多个例如上述那些先兆子痫症状的妊娠受试者样品(例如,具有复杂妊娠的怀孕受试者)的对照水平。
当对照值来源于训练集时,训练集可以基于理论模型、从受试者获得的实际(测量)值或两者的组合。优选地,训练集基于从至少10、50、100、150、200、250、300、400或500个受试者获得的实际值。更优选地,训练集中至少5、10、20、30、40、50或60%的受试者患有pe,而其余受试者是怀孕的并且没有患有pe。
在一种情况下,通过将每个生物标志物水平(或标准化水平)乘以权重因子或“权重”来调整pe生物标志物水平,以达到加权水平。
然后使用算法、函数、实函数、多项式等计算生物标志物评分或生物标志物指数。此类算法在本文中称为pe评分函数。pe评分函数中每个生物标志物的权重可以是独特的。每个生物标志物的权重可以是正或负实数。权重可以是两个或更多个生物标志物的比率。pe评分函数可以是包括诸如加法、减法、乘法和除法的二元运算的实函数算法。在一些情况下,pe评分函数包括至多一个、两个、三个、四个、五个、六个或七个二元运算。在一些情况下,所有二元运算是变量的加法或减法(变量是生物标志物值,无论是经调整的还是未经调整的)。在一些情况下,二元运算包括变量的至少一个除法。在一些情况下,二元运算仅包括变量的一个除法。在一些实例中,二元运算不包括变量的除法。在一些情况下,二元运算不包括变量的乘法。
pe评分函数可以是线性的、指数的、对数的、二次的或其任何组合。
用于确定pe评分的pe评分函数可以根据下式表示:
pe评分=a0+a1(比率)+a2(sflt-1)+a3(p1gf)+a4(fn1)+a5(fn2)+a6(pappa)+a7(hpx)+a8(adam12)+a9(fg)+an(选自表1的生物标志物或生物标志物的比率),其中,(i)a0是零或至多-0.5、-1、-5、-10、-20、-30、-40、-50、-60、-70、-80、-90、-100、-110、-120、-130、-140、或-150或者a0是零,(ii)a1是至少0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09或0.10,(iii)a2是零或至少-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、0.001、0.01、0.05、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0或5.0,(iv)a3是零或至少-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、0.001、0.01、0.05、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0或5.0,(iv)a4是零或至少2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0或15.5,(v)a5是零或至少-13.0、-12.0、-11.0、-10.0、-9.0、-8.0、-7.0、-6.0、-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、0.001、0.01、0.05、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0或5.0,(vi)a6是零或至少-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、-0.5、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5或8.0,(vii)a7是零或至少0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.3、1.4、1.5、1.6、1.7、1.8、2.0或2.5,(viii)a8是零或至少-13.0、-12.0、-11.0、-10.0、-9.0、-8.0、-7.0、-6.0、-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、0.001、0.01、0.05、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0或15.5,(ix)a9是零或至少-13.0、-12.0、-11.0、-10.0、-9.0、-8.0、-7.0、-6.0、-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、0.001、0.01、0.05、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0或15.5,(x)an是零或至少-13.0、-12.0、-11.0、-10.0、-9.0、-8.0、-7.0、-6.0、-5.0、-4.0、-3.5、-3.0、-2.5、-2.0、-1.5、-1.0、0.001、0.01、0.05、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0或15.5,以及(xi)比率可以是两个或更多个生物标志物的任意比率,包括,例如sflt-1/p1gf、p1gf/sflt-1、(sflt-1)/(不包括vegf-r1的vegf)、(不包括vegf-r1的vegf)/p1gf、(不包括vegf-r1的vegf)/sflt-1、p1gf/(不包括vegf-r1的vegf);(xii)fn1表示由第一抗体检测的纤连蛋白的同种型,fn2表示由第二抗体检测的纤连蛋白同种型,其中两种同种型可以相同或不同,并且其中两种抗体不同。
提供用于确定pe评分的线性模型的非限制性示例如下:l=-52.651+0.214*比率-0.877plgf-0.715*hpx-0.884*adam12+pappa*3.85+4.473*fn;l=-46.789+0.018*比率-0.879*plgf-0.587*hpx-0.973*adam12+pappa*3.121+4.007*fn;l=-49.789+0.012*比率-0.984*plgf-0.652*hpx-0.968*adam12+pappa*3.22+4.105*fn;l=-50.789+0.019*比率-0.977plgf-0.695*hpx-0.910*adam12+pappa*3.62+4.351*fn;l=-48.989+0.022*比率-0.998plgf-0.731*hpx-0.971*adam12+pappa*3.41+4.317*fn;l=-58.899+0.014*比率-0.912*plgf-0.486*hpx-0.853*adam12+pappa*2.191+4.097*fn;l=-49.211+0.017*比率-0.974plgf-0.785*hpx-0.957*adam12+pappa*3.68+4.324*fn;l=-48.789+0.011*比率-0.899*plgf-0.487*hpx-0.873*adam12+pappa*2.121+4.007*fn;l=-52.838+0.009*比率-0.942*plgf-0.533*hpx-0.899*adam12+pappa*2.460+4.212*fn;l=-51.828+0.119*比率-0.762*plgf-0.618*hpx-0.711*adam12+pappa*2.243+5.921*fn;l=-47.298+0.122*比率-1.298*plgf-0.723*hpx-0.932*adam12+pappa*1.920+3.929*fn;l=-47.562+1.292*比率-0.298*plgf-0.722*hpx-0.921*adam12+pappa*3.291+4.118*fn。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-20.0484+0.1478(比率)+3.2970(pappa);l=-20.1484+0.0478(比率)+3.0970(pappa);l=-21.0484+2.1478(比率)+4.2970(pappa);l=-20.3484+0.4478(比率)+3.5970(pappa);l=-77.6525+0.1405(比率)+5.1705(fn1);l=-79.6525+1.0405(比率)+7.1705(fn1);l=-78.7525+0.2405(比率)+6.2705(fn1);和l=-78.6525+0.0405(比率)+6.1705(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-77.0827+9.0491(比率)+8.5207(plgf)+7.1632(fn1);l=-79.0827+0.1491(比率)+0.2207(plgf)+6.3632(fn1);l=-78.0827+0.0491(比率)+0.5207(plgf)+6.1632(fn1);l=-76.0827+0.4491(比率)+0.6207(plgf)+6.7632(fn1);
l=-87.8431+0.0422(比率)+0.9659(hpx)+6.3886(fn1).l=-86.8431+0.1422(比率)+0.8659(hpx)+6.2886(fn1);l=-88.8431+0.1422(比率)+1.9659(hpx)+7.3886(fn1);和=-85.8431+0.2422(比率)+0.3659(hpx)+6.4886(fn1);
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-49.0767+0.0462(比率)+3.2997(fn2)+3.8873(pappa);l=-48.0767+0.0462(比率)+2.2997(fn2)+2.8873(pappa);l=-48.1767+0.2462(比率)+2.3997(fn2)+2.4873(pappa)和l=-48.5767+0.6462(比率)+2.7997(fn2)+2.9873(pappa)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-85.7092+0.0492(比率)-5.8358(fn2)+12.7388(fn1);l=-85.1092+0.2492(比率)-5.3358(fn2)+12.4388(fn1);l=-86.7092+0.1492(比率)-6.8358(fn2)+13.7388(fn1);和l=-85.5092+0.6492(比率)-5.7358(fn2)+12.8388(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-68.2829+1.0405(比率)+2.0848(adam12)+3.1148(fn1);l=-88.2829+2.0405(比率)+3.0848(adam12)+4.1148(fn1);l=-79.2829+0.1405(比率)+0.2848(adam12)+7.1148(fn1);和l=-78.2829+0.0405(比率)+0.0848(adam12)+6.1148(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-12.2190+2.0500(比率)+3.7240(pappa)+4.2174(fn1);l=-82.2190+0.0500(比率)+2.7240(pappa)+5.2174(fn1);l=-22.2190+3.0500(比率)+4.7240(pappa)+6.2174(fn1);和l=-32.2190+4.0500(比率)+5.7240(pappa)+7.2174(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-29.9815+4.0348(sflt1)-5.5288(fn2)+16.2160(fn1);l=-39.9815+4.0348(sflt1)-5.5288(fn2)+17.2160(fn1);l=-19.9815+2.0348(sflt1)-3.5288(fn2)+14.2160(fn1);和l=-59.9815+3.0348(sflt1)-7.5288(fn2)+12.2160(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-12.4750+-3.8232(plgf)+4.8961(pappa)+6.7670(fn1)l=-92.4750+-2.8232(plgf)+2.8961(pappa)+5.7670(fn1)l=-22.4750+-3.8232(plgf)+4.8961(pappa)+7.7670(fn1);和l=-32.4750+-4.8232(plgf)+5.8961(pappa)+9.7670(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-14.0940+0.0441(比率)+2.4773(sflt1)+3.5748(plgf)+4.8088(fn1);l=-24.0940+3.0441(比率)+4.4773(sflt1)+5.5748(plgf)+6.8088(fn1);l=-74.0940+0.0441(比率)+0.4773(sflt1)+0.5748(plgf)+5.8088(fn1);和l=-34.0940+4.0441(比率)+5.4773(sflt1)+6.5748(plgf)+7.8088(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-70.3822+1.0796(比率)-3.7798(sflt1)+4.8134(fn2)+6.2025(pappa);l=-77.3822+0.0796(比率)-2.7798(sflt1)+3.8134(fn2)+5.2025(pappa);l=-71.3822+2.0796(比率)-3.7798(sflt1)+4.8134(fn2)+6.2025(pappa);和l=-72.3822+3.0796(比率)-4.7798(sflt1)+5.8134(fn2)+7.2025(pappa)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-70.3510+1.0348(比率)+2.4503(sflt1)-3.5868(fn2)+14.8250(fn1);l=-78.3510+0.0348(比率)+1.4503(sflt1)-7.5868(fn2)+13.8250(fn1);l=-71.3510+2.0348(比率)+3.4503(sflt1)-4.5868(fn2)+15.8250(fn1);和l=-72.3510+3.0348(比率)+4.4503(sflt1)-5.5868(fn2)+16.8250(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-74.5657+0.0300(比率)+0.8356(sflt1)-0.5594(adam12)+5.9467(fn1);l=-72.5657+0.0370(比率)+0.2756(sflt1)-0.3894(adam12)+4.6467(fn1);l=-79.5657+0.0350(比率)+0.8756(sflt1)-0.5894(adam12)+5.6467(fn1);和l=-67.5657+0.0230(比率)+0.4756(sflt1)-0.1494(adam12)+4.7867(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-100.6298+1.0845(比率)+-3.8124(sflt1)+4.0643(pappa)+6.5308(fn1);l=-108.6298+0.0845(比率)+-2.8124(sflt1)+5.0643(pappa)+6.5308(fn1);l=-101.6298+2.0845(比率)+-3.8124(sflt1)+4.0643(pappa)+5.5308(fn1);和l=-102.6298+3.0845(比率)+-4.8124(sflt1)+6.0643(pappa)+7.5308(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-41.5704+2.0489(比率)+3.1839(plgf)+4.2834(fn2)+5.8683(pappa);l=-42.5704+3.0489(比率)+4.1839(plgf)+5.2834(fn2)+6.8683(pappa);l=-40.5704+1.0489(比率)+2.1839(plgf)+3.2834(fn2)+4.8683(pappa);l=-47.5704+0.0489(比率)+0.1839(plgf)+2.2834(fn2)+2.8683(pappa);l=-80.6889+1.0607(比率)+2.6545(plgf)-3.9105(fn2)+14.8608(fn1);l=-85.6889+0.0607(比率)+0.6545(plgf)-5.9105(fn2)+12.8608(fn1);l=-81.6889+2.0607(比率)+3.6545(plgf)-4.9105(fn2)+15.8608(fn1);和l=-82.6889+3.0607(比率)+4.6545(plgf)-6.9105(fn2)+17.8608(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-77.8703+0.0491(比率)+0.5191(plgf)+0.0523(adam12)+6.1300(fn1);l=-71.8703+2.0491(比率)+3.5191(plgf)+4.0523(adam12)+5.1300(fn1);l=-72.8703+3.0491(比率)+4.5191(plgf)+5.0523(adam12)+7.1300(fn1);和l=-70.8703+1.0491(比率)+2.5191(plgf)+3.0523(adam12)+4.1300(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-81.9135+0.0433(比率)+0.3154(plgf)+1.7019(pappa)+5.2189(fn1);l=-81.9125+0.0533(比率)+0.2154(plgf)+2.7019(pappa)+5.2199(fn1);l=-82.9125+0.0553(比率)+0.3154(plgf)+2.8019(pappa)+4.2199(fn1);和l=-71.9125+0.0633(比率)+0.2254(plgf)+2.7519(pappa)+5.2399(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-49.5169+0.0464(比率)+0.1807(hpx)+2.3236(fn2)+2.8744(pappa);l=-47.5169+0.1464(比率)+0.1857(hpx)+2.4236(fn2)+2.6744(pappa);l=-45.2169+0.0344(比率)+0.2707(hpx)+1.2236(fn2)+2.4544(pappa);和l=-48.5169+0.0564(比率)+0.2807(hpx)+2.1236(fn2)+2.7744(pappa)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-68.9243+0.0583(比率)-0.7927(hpx)-6.2143(fn2)+10.7478(fn1);l=-78.9243+0.0483(比率)-0.6927(hpx)-6.0143(fn2)+12.7478(fn1);l=-77.9243+0.0583(比率)-0.7727(hpx)-6.1243(fn2)+11.8478(fn1);和l=-79.9243+0.1483(比率)-0.6227(hpx)-6.2143(fn2)+12.9478(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-88.0679+0.0309(比率)+0.5208(hpx)+2.6887(pappa)+5.2737(fn1);l=-97.0679+0.0589(比率)+0.6708(hpx)+2.7787(pappa)+5.2937(fn1);l=-77.0679+0.0609(比率)+0.6308(hpx)+2.8787(pappa)+5.3937(fn1);和l=-87.0679+0.0509(比率)+0.6208(hpx)+2.6787(pappa)+5.2937(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-53.7575+0.0542(比率)+3.2134(fn2)-1.5150(adam12)+3.6894(pappa);l=-56.7575+0.0342(比率)+4.0134(fn2)-1.4160(adam12)+3.7094(pappa);l=-55.7575+0.0442(比率)+3.0134(fn2)-1.4150(adam12)+3.6094(pappa);和l=-45.7575+0.0443(比率)+3.2134(fn2)-1.6150(adam12)+3.6084(pappa)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-85.1599+0.0529(比率)-6.5276(fn2)+0.8455(adam12)+13.1454(fn1);l=-85.1499+0.0509(比率)-6.5286(fn2)+0.8435(adam12)+13.1434(fn1);l=-85.1399+0.0409(比率)-6.2286(fn2)+0.7435(adam12)+13.0434(fn1);和l=-87.1499+1.0509(比率)-8.5286(fn2)+1.8435(adam12)+11.1434(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-94.7950+0.0632(比率)-7.5691(fn2)+3.0857(pappa)+13.8372(fn1);l=-95.7950+0.1632(比率)-7.5491(fn2)+3.2857(pappa)+15.8372(fn1);l=-94.8950+0.0642(比率)-7.5591(fn2)+3.0957(pappa)+13.2372(fn1);和l=-94.7960+0.0631(比率)-7.5791(fn2)+4.0857(pappa)+11.8372(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-91.5034+0.0566(比率)-1.8810(adam12)+3.5597(pappa)+6.1198(fn1);l=-92.5034+0.0466(比率)-1.8910(adam12)+3.6597(pappa)+6.2198(fn1);l=-93.5034+0.0467(比率)-1.7910(adam12)+3.6797(pappa)+7.2198(fn1);和l=-82.5034+0.0476(比率)-1.9910(adam12)+4.6597(pappa)+6.5198(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-73.6418+2.3065(sflt1)-1.3341(plgf)-7.4383(fn2)+13.0395(fn1);l=-72.3418+2.2365(sflt1)-1.3131(plgf)-7.4332(fn2)+13.3595(fn1);l=-71.6418+2.1065(sflt1)-1.1141(plgf)-7.1382(fn2)+13.1595(fn1);和l=-72.6418+2.2065(sflt1)-1.3141(plgf)-7.4382(fn2)+13.0595(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-103.5305+-0.3764(sflt1)-3.3328(plgf)+3.4350(pappa)+6.3890(fn1);l=-105.5305+-0.6564(sflt1)-3.5928(plgf)+3.4550(pappa)+6.5890(fn1);l=-104.5305+-0.6764(sflt1)-3.3928(plgf)+3.4850(pappa)+6.4890(fn1);和l=-104.4305+-0.6464(sflt1)-3.4928(plgf)+3.4450(pappa)+6.4490(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-74.1756+3.9467(sflt1)-8.4664(fn2)-2.4423(adam12)+15.3474(fn1);l=-75.1756+3.9167(sflt1)-8.7664(fn2)-2.4923(adam12)+15.3674(fn1);l=-76.1756+3.9667(sflt1)-8.6664(fn2)-2.4623(adam12)+15.6674(fn1);和l=-73.1756+3.9367(sflt1)-8.7364(fn2)-2.4323(adam12)+13.3674(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-76.5467+2.6634(sflt1)-3.2682(adam12)+1.9649(pappa)+6.6178(fn1);l=-68.5467+2.6634(sflt1)-3.2682(adam12)+1.6349(pappa)+6.6178(fn1);l=-74.5467+2.4634(sflt1)-3.4282(adam12)+1.9449(pappa)+6.4178(fn1);l=-78.5467+2.5634(sflt1)-3.2282(adam12)+1.9349(pappa)+6.1178(fn1)
l=-78.8718-2.6772(plgf)-1.7373(hpx)+2.9707(pappa)+5.5077(fn1);l=-75.8618-2.5762(plgf)-1.5573(hpx)+2.9507(pappa)+5.5557(fn1);l=-77.8618-2.6772(plgf)-1.5673(hpx)+2.9106(pappa)+5.5056(fn1);和l=-78.8618-2.6762(plgf)-1.5373(hpx)+2.9107(pappa)+5.5057(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-109.2319-3.7617(plgf)-6.7308(fn2)+3.5194(pappa)+13.6500(fn1);l=-107.2319-3.5617(plgf)-6.3308(fn2)+3.4194(pappa)+13.6700(fn1);l=-108.2319-3.6617(plgf)-6.6308(fn2)+3.2194(pappa)+11.6500(fn1);和l=-119.2319-3.7117(plgf)-6.1308(fn2)+3.5114(pappa)+13.7500(fn1)。
另外的用于确定pe评分的线性模型的非限制性示例包括:l=-112.4589-2.7282(plgf)-2.7122(adam12)+4.4379(pappa)+7.6259(fn1);l=-113.4589-2.7281(plgf)-2.7121(adam12)+4.4279(pappa)+7.6159(fn1);l=-114.4589-2.7381(plgf)-2.7221(adam12)+4.5379(pappa)+7.7159(fn1);和l=-133.4589-2.8281(plgf)-2.7131(adam12)+4.5279(pappa)+7.6169(fn1)。
在一些情况下,使用线性和指数模型来使用以下算法来确定概率:pe=1/(1+exp(-l))。
然后可以总计小组中所有生物标志物的加权水平,并且在一些情况下,例如在sflt和plgf的水平中,加权水平可以形成比率。加权水平和任选比率的总和得到单个加权水平或“pe评分”。每个生物标志物可以具有独特的权重因子,或者生物标志物的组合可以具有独特的权重因子。在一些情况下,可通过类似于先兆子痫特征(signature)所述的方法测定先兆子痫评分,例如,患者样品中的一个或多个先兆子痫标志物中的每一个的水平可以如上进行log2、loge或log10变换和标准化,用于产生先兆子痫谱。
用于计算评分的加权水平可以由参考数据集、“训练数据集”或“训练集”来定义。训练集可以基于模型、从受试者获得的实际值或其组合。训练集可包括被诊断为具有pe症状的受试者。训练集可以包括具有pe症状但没有患有pe的受试者。训练集可以包括具有pe的症状但没有患有pe并且患有一个或多个其他病症的受试者(例如,患有妊娠并发症的受试者),例如糖尿病(例如妊娠糖尿病、i型或ii型糖尿病)、高于正常葡萄糖水平、高血压(例如慢性或非慢性高血压)、高于正常体重、肥胖、高于正常体重指数(bmi)、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、先前妊娠的pe、肾病、血栓形成倾向或其任何组合。训练集可以包括诊断为患有一个或多个疾病的pe受试者(例如,患有妊娠并发症的受试者),例如糖尿病(例如妊娠糖尿病、i型或ii型糖尿病)、高于正常葡萄糖水平、高血压(例如慢性或非慢性高血压)、高于正常体重、肥胖、高于正常体重指数(bmi)、异常体重增加、异常血压、水潴留、遗传因素、异常蛋白尿、头痛、水肿、异常蛋白质/肌酐比、异常血小板计数、应激、未经产、异常巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、先前妊娠的pe、肾病、血栓形成倾向或其任何组合。训练集可以包括至少30、40、50、60、70、80、90、100、150、200、250、300、350或400个受试者。训练集可以包括来自具有正常妊娠的至少15、50、100、150、200或250个受试者和患有pe的至少15、50、100、150、200或250个妊娠受试者的数据。在一些情况下,多于5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的先兆子痫受试者具有至少一种其他病况(例如高血压、糖尿病、超重等)。
在一些情况下,用于提供本文所述的“先兆子痫指数”的pe的分类不基于例如血压、体重增加、水潴留、遗传因素、蛋白尿、头痛、水肿、蛋白质/肌酐比、血小板计数、应激、先前妊娠的pe、未经产、年龄,年龄小于20岁,年龄大于35岁、种族,非洲裔美国人和菲律宾人、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作(例如pe的个人病史)、pe的家族史、妊娠数、流产数、体重指数(bmi)、妊娠糖尿病、i型糖尿病、肥胖、葡萄糖水平、当前和过去的药物、应激、(受试者或其家庭成员的)妊娠前的pe、慢性高血压、肾病和血栓形成倾向。在一些实例中,pe的分类不基于刚才提到的任何妊娠特征。在一些实例中,pe的分类基于刚才提到的妊娠特征中的至少一个。在一些情况下,pe指数可以基于女性受试者的妊娠期。
本文所述的“报告”是电子或有形文档,其包括提供与受试者相关的信息的报告元素。受试者报告任选地包括以下中的一个或多个:关于受试者的信息、pe谱、pe评分、pe指数、pe确认、pe诊断、pe预后、pe监测状态和/或建议的治疗。受试者报告还可以包括以下中的一个或多个:1)关于测试设施的信息;2)服务提供商信息;3)患者数据;4)样品数据;5)评估报告,其可以包括各种信息,包括:a)采用的参考值,和b)测试数据,其中测试数据可以包括例如蛋白质水平测定;和6)其他特征。该报告可用于pe的阳性确认、pe的阴性确认、pe的诊断、pe的特征、pe的进展、pe的严重性或pe的预后。pe的阳性确认是指具有pe症状的受试者被确认为患有pe的情况。pe的阴性确认是指没有pe症状的受试者被确认为没有患有pe的情况。这样的报告可以包括生物标志物、pe评分或pe指数评分的相对权重或特征值。该报告可以包括关于治疗的建议(例如,卧床休息、阿司匹林、饮用额外的水、低盐饮食、控制血压的药物、皮质类固醇或早期递送的建议)。
受试者和样品
术语“生物样品”和“样品”包括血液、尿液、血清、血浆和生物来源的其他液体样品或来源于其的细胞。一旦从受试者得到样品,其可以直接使用、冷冻或在合适的培养基中短时间维持。可以使来源于血液的样品凝块,并分离和收集血清以用于测定。
2μl至2,000μl的血液、血清或尿液的样品体积可能足以确定pe评分。在一些实例中,样品体积范围为10μl至1,750μl、20μl至1,500μl、40μl至1,250μl、60μl至1000μl、100μl至900μl、200μl至800μl、400μl至600μl。在一些情况下,样品体积为2-10ml或0.5-5ml或至多10、9、8、7、6、5、4、3、2或1ml。
所分析的受试者可能具有零个或至少一个、两个、三个、四个或五个因子,这些因素混淆了先兆子痫的诊断。在一些情况下,混淆因子可以选自:高血压、35岁以上的年龄、高于正常体重、快速体重增加、大于20周的妊娠期、民族性、糖尿病(i型或ii型)、高蛋白尿、肾病、自身免疫疾病、受试者在早期妊娠中的先前pe、以及pe的家族史或孕产妇pe史。
在实施本发明方法中,评估来自受试者的样品以获得一个或多个pe生物标志物的水平表示。一个或多个pe生物标志物的水平可用于提供例如如下更详细描述的pe谱、pe特征、pe评分或pe指数。
可以以多种方式处理受试者样品,以便增强先兆子痫标志物的检测。例如,当样品是血液时,可以在测定之前从样品中除去红细胞(例如通过离心)。此类处理可用于降低使用亲和试剂检测先兆子痫标志物水平的非特异性背景水平。先兆子痫标志物的检测也可以通过使用本领域熟知的程序(例如酸沉淀、醇沉淀、盐沉淀、疏水沉淀、过滤(使用能够保留分子大于30kd的过滤器,例如centrim30tm)或亲和纯化)得到增强。在一些情况下,调整测试样品和对照样品的ph并保持在接近中性的ph(例如ph6.5-8.0)。这样的ph调整将防止复合物形成,从而提供样品中标志物水平的更准确的定量。在样品是尿液的情况下,调整样品的ph并浓缩样品以增强标志物的检测。可以使用本领域普通技术人员已知的方法调整ph,例如向碱性或中性ph样品中加入酸或向酸性或中性ph样品中加入碱。
可以在测定样品中至少一种生物标志物的水平之前,将缓冲剂和/或其他试剂加入样品中以促进样品的制备。在一些情况下,缓冲剂和/或其他试剂可以包括至少但不限于以下之一:乙二胺四乙酸(edta)、磷酸盐缓冲盐水、hanks平衡盐溶液、ficoll、氯化钠、柠檬酸钠、二氧化硅、凝血酶、茶碱(tehophylline)、腺苷、双嘧达莫、抑蛋白酶多肽(aprotinine)、肝素、肝素锂、氟化物、草酸钾、柠檬酸三钠、柠檬酸和/或葡萄糖(dextrose)。缓冲剂和/或其他试剂可以在惰性基质中混合,例如凝胶、水、盐水等。
在具体情况下,可以使用血清分离管(serumseparatortube,sst)收集血液样品。sst可以含有缓冲剂和/或其他试剂。在另一具体情况下,可以使用可含有缓冲剂和/或试剂的clot-2血清分离管收集血液样品。sst和/或clot-2管可以从诸如bectondickenson的制造商获得,然而可以使用任何类似的管。在一些情况下,可以使用本领域普通技术人员已知的方法、试剂或化学品处理样品,使得样品的组分变成彼此分离。有时,分离血液样品,使得血清在包含样品顶部的层中。
受试者样品通常在妊娠中期或晚期过程中从个体获得。“妊娠”是指在哺乳动物中怀孕的持续时间,例如在子宫中从受孕直到出生的发育期。受试者样品可以在妊娠早期,例如在妊娠34周时或之前,例如在妊娠的第20-34周、在妊娠的第24-34周、在妊娠的第30-34周得到。受试者样品可以在妊娠后期,例如在妊娠的第34、35、36、37或38周后得到。
可以从样品来源于受试者的时间后不久或至少2、3或4周测定pe谱、特征、评分或指数。在一些情况下,从样品来源于受试者的时间起最多1、2、3或4天测定pe谱、特征、评分或指数。
一旦从受试者得到样品,可以加工样品(例如,分离血浆或血清)。样品或其部分可以进一步稀释。样品或样品的一部分可以稀释至少5倍、10倍、50倍、100倍、500倍、1,000倍、5,000倍、10,000倍、15,000倍、20,000倍、30,000倍、35,000倍、40,000倍、45,000倍、50,000倍、55,000倍、60,000倍、65,000倍、70,000倍、75,000倍或80,00倍。
用于检测生物标志物的技术。
当生物标志物是差异表达的蛋白质水平时,可以通过测量一个或多个蛋白质、蛋白质片段、肽、核酸转录物(例如mrna)、基因或基因片段的水平或量来检测生物标志物。
使用本文的方法和操作方案测定的每个生物标志物可以具有阈值。通常,生物标志物的阈值是测定、方法或操作方案中生物标志物的性能。在一些情况下,本文所述的方法、操作方案和测定可以是准确的、灵敏的和特异性的,并且可以用作阳性或阴性预测值。本文所述的方法、方案和测定可以是至少70%、75%、80%、85%、90%、95%或99%准确的。本文所述的方法、操作方案和测定可以是至多70%、75%、80%、85%、90%、95%或至多99%准确的。本文所述的方法、操作方案和测定可以是至少70%、75%、80%、85%、90%、95%或99%灵敏的。本文所述的方法、操作方案和测定可以是至多70%、75%、80%、85%、90%、95%或约99%灵敏的。本文所述的方法、操作方案和测定可以是至少70%、75%、80%、85%、90%、95%、99%或更高的特异性。本文所述的方法、操作方案和测定可以是至多70%、75%、80%、85%、90%、95%、99%或更低的特异性。本文所述的方法、操作方案和测定可具有至少70%、75%、80%、85%、90%、95%、99%或更高的阳性预测值。本文所述的方法、操作方案和测定可具有至多70%、75%、80%、85%、90%、95%、99%或更低的阳性预测值。本文所述的方法、操作方案和测定可具有至少70%、75%、80%、85%、90%、95%、99%或更高的阴性预测值。本文所述的方法、操作方案和测定可具有至多70%、75%、80%、85%、90%、95%、99%或更低的阴性预测值。
在一些情况下,使用本文所述的方法和操作方案测定的生物标志物可以高于标准曲线样品的最低浓度存在于样品中。在其他情况下,使用本文所述的方法和操作方案测定的生物标志物可以低于标准曲线样品的最低浓度存在于样品中。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物可以高于标准曲线样品的最高浓度存在于样品中。在其他情况下,使用本文所述的方法和操作方案测定的生物标志物可以低于标准曲线样品的最高浓度存在于样品中。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物可以高于高质量对照样品的最低浓度存在于样品中。在其他情况下,使用本文所述的方法和操作方案测定的生物标志物可以低于高质量对照样品的最低浓度存在于样品中。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物可以高于高质量对照样品的最高浓度存在于样品中。在其他情况下,使用本文所述的方法和操作方案测定的生物标志物可以低于高质量对照样品的最高浓度存在于样品中。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物可以高于低质量对照样品的最低浓度存在于样品中。在其他情况下,使用本文所述的方法和操作方案测定的生物标志物可以低于低质量对照样品的最低浓度存在于样品中。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物可以高于低质量对照样品的最高浓度存在于样品中。在其他情况下,使用本文所述的方法和操作方案测定的生物标志物可以低于低质量对照样品的最高浓度存在于样品中。
通常,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000倍。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500、10,000倍或更多。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加至多2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或小于10000倍。
通常,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000倍。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000倍或更多。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低至多2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000倍或更低。
通常,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加约百分之2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加至少百分之2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间增加至多百分之2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000或更少。
通常,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低约百分之2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低至少百分之2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000或更多。在一些情况下,使用本文所述的方法和操作方案测定的生物标志物的水平可以在第一测定和第二测定之间降低至多百分之2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1250、1500、1750、2000、2500、5000、7500或10000或更少。
可以结合临床测量来考虑本文所述的方法和操作方案。临床测量可以与以下但不限于的相关:总血压、舒张压、收缩压、平均动脉血压、通过例如浸渍棒法或24小时收集法检测的蛋白尿、体重指数、肿胀、腹压、子宫搏动指数、子宫多普勒测量、循环游离dna、循环游离胎儿dna、胎儿dna和/或血小板减少、胎儿异常、妊娠期、母亲年龄、怀孕期间先兆子痫的在先病例、种族或民族性、母亲或更远的先兆子痫史、多胎、首次分娩和受试者的吸烟史。
本公开提供了用于诊断或确认受试者中存在先兆子痫的方法,包括:进行至少两个不同的测定,其测定来自受试者的样品中纤连蛋白的水平;以及评估样品并使用来自多个测定的水平来诊断或确认先兆子痫的存在并计算指数。在一些情况下,该方法还包括基于指数建议用于先兆子痫的治疗,治疗选自阿司匹林、早产或卧床休息。
本公开提供了用于诊断或确认受试者中存在先兆子痫的方法,包括:评估来源于受试者的样品中sflt-1和plgf的比率的水平和多个生物标志物的水平,其中不同的生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素;和评估样品并使用来自前一步骤的水平来确定诊断或确认存在先兆子痫的指数和计算指数。在一些情况下,该方法进一步包括基于该指数,建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。在一些情况下,该方法还包括使用样品对每个生物标志物重复进行相同的测定。在一些情况下,该方法还包括使用来源于多个相同测定中的每一个的水平确定每个生物标志物的平均水平。在一些情况下,该方法还包括对平均水平进行log2、loge或log10变换。在一些情况下,该方法还包括将每个生物标志物的水平与该生物标志物的标准曲线进行比较。在一些情况下,该方法进一步包括对每个生物标志物加权,其中加权包括将数字提供到多项式中,使得每个标志物具有不同的权重。在一些情况下,计算包括确定经调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的原始水平的比率。在一些情况下,计算包括确定经与对照相比调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的原始水平的比率。
本公开提供了用于诊断或确认受试者中存在先兆子痫的方法,包括:评估来源于受试者的样品中sflt-1和plgf的比率和多个生物标志物的水平的水平,其中不同的生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素;和评估样品并使用来自步骤(a)的水平来确定诊断或确认存在先兆子痫的指数。在一些情况下,多个生物标志物选自sflt-1、p1gf、fn和papp-a;sflt-1、p1gf、fn、adam12和papp-a;sflt-1、p1gf、papp-a和fn;sflt-1、p1gf、hpx、fn和papp-a;p1gf、adam12、fn和papp-a;p1gf、fn和papp-a;sflt-1、p1gf和fn;p1gf、fn和papp-a;sflt-1、p1gf、fn和adam12;sflt-1、p1gf和fn;p1gf、sflt-1和fn;sflt-1、fn和adam12;p1gf、fn和papp-a。在一些情况下,该方法进一步包括基于该指数,建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。在一些情况下,该方法还包括使用样品对每个生物标志物重复进行相同的测定。在一些情况下,该方法还包括使用来源于多个相同测定中的每一个的水平确定每个生物标志物的平均水平。在一些情况下,该方法还包括对平均水平进行log2、loge或log10变换。在一些情况下,该方法还包括将每个生物标志物的水平与该生物标志物的标准曲线进行比较。在一些情况下,该方法进一步包括对每个生物标志物加权,其中加权包括将数字提供到多项式中,使得每个标志物具有不同的权重。在一些情况下,计算包括确定经调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的原始水平的比率。在一些情况下,计算包括确定经与对照相比调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的原始水平的比率。
检测试剂和抗体
本公开包括可用于测定本文公开的多个生物标志物的水平的检测试剂和抗体。通常,检测试剂可以包括用于进行elisa的试剂。
可用于elisa操作方案的市售抗体试剂盒的实例包括但不限于抗p1gf(由uscnlifescienceinc.、roche和r&dsystems分销)、抗sflt-1(由bosterbio.、r&dsystems、mybiosource.com、antibodies-online、biotrendchemikaliengmbh和enzolifesciences分销)、抗papp-a(由r&dsystems、raybiotech、ibljapan、drginternational、abnova、uscnlifescience、novusbio、rapidtest、mybiosource、antibodies-online.com、fisherscientific、elabscience、sigmaaldrich、cusabio、anshlabs、demeditec、alpco、amsbio、novateinbio、creativebiomart、biorbyt、biomaticcorporation分销)、抗vegf(由amsbio、mybiosource、abnova、antibodies-online.com、unitedstatesbiological、biomatikcorporation、cloud-clonecorp、biovendor、bosterimmunoleader、enzolifesciences、fitzgerald、abnova、avivasystemsbiology和creativebiomart分销)、抗纤连蛋白(由biovendor、bosterimmunoleader、qedbioscience、ebioscience、biorbyt、fitzgerald、amsbio、mybiosource、novateinbio、abnova、avivasystemsbiology、creativebiomart、antibodies-online.com、abcam、novusbiologicals、unitedstatesbiological、eiaab(hongkong)companylimited、biomatikcorporation、cloud-clonecorp分销)、抗血纤蛋白原(molecularinnovations、fitzgerald、amsbio、biorbyt、mybiosource、novateinbio、abnova,creativebiomart,avivasystemsbiology,antibodies-online.com,abcam、novusbiologicals、unitedstatesbiological、eiaab(hongkong)companylimited、biomatikcorporation、cloud-clonecorp分销)和抗adam12(由bosterimmunoleader、amsbio、mybiosource、abnova、creativebiomart、antibodies-online.com、genetex、biorbyt、unitedstatesbiological、eiaab(hongkong)companylimited、r&dsystems和cloud-clonecorp分销)。
方法包括使用本文所述的一个elisa试剂盒和/或抗体检测本文所述的一个生物标志物的水平。在一些情况下,方法包括使用本文所述的两个elisa试剂盒和/或抗体检测本文所述的一个生物标志物的水平。在其他情况下,方法包括使用本文所述的三个elisa试剂盒和/或抗体检测本文所述的一个生物标志物的水平。在其他情况下,方法包括使用本文所述的四个elisa试剂盒和/或抗体检测本文所述的一个生物标志物的水平。在其他情况下,方法包括使用本文所述的五个elisa试剂盒和/或抗体检测本文所述的一个生物标志物的水平。在其他情况下,方法包括使用本文所述的多于五个elisa试剂盒和/或抗体检测本文所述的一个生物标志物的水平。通常,使用一个、三个、四个、五个或多于五个elisa试剂盒独立地测量一个生物标志物。在一些情况下,一个、两个、三个、四个、五个或多于五个elisa试剂盒可以是相同或不同的elisa试剂盒。
方法包括使用本文所述的两个elisa试剂盒和/或抗体检测本文所述的两个生物标志物的水平。在其他情况下,方法包括使用本文所述的三个elisa试剂盒和/或抗体检测本文所述的两个生物标志物的水平。在其他情况下,方法包括使用本文所述的四个elisa试剂盒和/或抗体检测本文所述的两个生物标志物的水平。在其他情况下,方法包括使用本文所述的五个elisa试剂盒和/或抗体检测本文所述的两个生物标志物的水平。在其他情况下,方法包括使用本文所述的多于五个elisa试剂盒和/或抗体检测本文所述的两个生物标志物的水平。通常,使用两个、三个、四个、五个或多于五个elisa试剂盒独立地测量两个生物标志物。在一些情况下,两个、三个、四个、五个或多于五个elisa试剂盒可以是相同或不同的elisa试剂盒。
在其他情况下,方法包括使用本文所述的三个elisa试剂盒和/或抗体检测本文所述的三个生物标志物的水平。在其他情况下,方法包括使用本文所述的四个elisa试剂盒和/或抗体检测本文所述的三个生物标志物的水平。在其他情况下,方法包括使用本文所述的五个elisa试剂盒和/或抗体检测本文所述的三个生物标志物的水平。在其他情况下,方法包括使用本文所述的多于五个elisa试剂盒和/或抗体检测本文所述的三个生物标志物的水平。通常,使用三个、四个、五个或多于五个elisa试剂盒独立地测量三个生物标志物。在一些情况下,三个、四个、五个或多于五个elisa试剂盒可以是相同或不同的elisa试剂盒。
在其他情况下,方法包括使用本文所述的四个elisa试剂盒和/或抗体检测本文所述的四个生物标志物的水平。在其他情况下,方法包括使用本文所述的五个elisa试剂盒和/或抗体检测本文所述的四个生物标志物的水平。在其他情况下,方法包括使用本文所述的多于五个elisa试剂盒和/或抗体检测本文所述的四个生物标志物的水平。通常,使用四个、五个或多于五个elisa试剂盒独立地测量四个生物标志物。在一些情况下,四个、五个或多于五个elisa试剂盒可以是相同或不同的elisa试剂盒。
在某些情况下,针对所选择的生物标志物的抗体可以是单克隆抗体。在一些情况下,针对所选生物标志物的抗体可以是多克隆抗体。特别感兴趣的是针对选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的多个生物标志物的抗体。此类抗体可以是单克隆抗体或多克隆抗体。此类抗体可以是市售的或由使用者使用本领域普通技术人员已知的方法产生。
本领域普通技术人员已知的任何市售抗体可以用于检测本文列出的生物标志物,并且可以与本发明方法组合使用。例如,市售的抗体可以包括但不限于抗p1gf(由amb、novusbiologicals、nordicbiosite或tebubiologicals分销)、抗hpx(由sinobiological、pierce、sigmaaldrich、origene、lifespan、proteintechgroup、abdsertotec、biorad、thermofisher、agrisera、angio-proteomie、enzolifesciences、avivasystemsbiology、everestbiotech、r&dsystems、st.john'slaboratory、abbiotec、biorbyt、acrisantibodies、mybiosource、amsbio、abgent、santacruzbiotechnology、creativebiomart、novateinbio、raybiotech、genetex、unitedstatesbiological、abcam、cedarlanelabs、gallusimmunotech、abnova和cloud-clonecorp分销)、抗sflt-1(由cellsignalingtechnology、lifespanbiosciences、antibodies-online.com、sinobiological、abdserotec、proteintechgroup、bosterimmunoleader、thermofischerscientific、merckmillipore、agrisera、atlasantibodies、fitzgerald、avivasystemsbiology、angio-proteomie、ebioscience、genway、biorbyt、r&dsystems、lifetechnologies、st.john'slaboratory、abbiotec、acrisantibodies、mybiosource、amsbio、santacruzbiotechnology、creativebiomart、origene、novateinbio、raybiotech、novusbiologicals、prosci、genetex、unitedstatesbiological、abbexa、abcam、bioworldtechnologyinc.、abnova、springbioscience和cloud-clonecorp分销)、抗papp-a(由lifespanbiosciences、thermofisherscientific、abdserotec、bio-rad、merckmillipore、antibodies-online.com、r&dsystems、genway、atlasantibodies、abbiotec、amsbio、mybiosource、santacruzbiotechnology、avivasystemsbiology、biorbyt、creativebiomart、novateinbio、raybiotech、genetex、unitedstatesbiological、fitzgerald、novusbiologicals、abcam、bbisolutions、abnova和cloud-clonecorp分销)、抗vegf(由cellsignalingtechnology、lifespanbiosciences、antibodies-online.com、epigentek、angio-proteomie、avivasystemsbiology、r&dsystems、st.john'slaboratory、thermofisherscientificinc.、biorbyt、acrisantibodies、mybiosource、santacruzbiotechnology、genetex、unitedstatesbiological、abbexa、fitzgerald、novusbiologicals、abcam、bioworldtechnologyinc.、abnova、sinobiological、merckmillipore、avivasystemsbiology、origene、lifetechnologies、amsbio、abgent、creativebiomart、raybiotech、iblamerica、bosterimmunoleader、atlasantibodies、bioworldtechnologyinc.和cloud-clonecorp分销)、抗纤连蛋白(由proteintechgroup、fitzgerald、lifespanbiosciences、bosterimmunoleader、abcam、qedbioscience、sinobiological、abdserotech、bio-rad、protenbiotechnikgmbh、beckmancoulter、antibodies-online.com、takara、merckmillipore、atlasantibodies、agrisera、thermofisherscientific,inc.、rockland、immuquest、enzolifesciences、avivasystemsbiology、genway、ebioscience、biorbyt、r&dsystems、amsbio、st.john'slaboratory、abbiotec、acrisantibodies、mybiosource、santacruzbiotechnology、novusbiologicals、creativebiomart、novateinbio、raybiotech、genetex、prosci、unitedstatesbiological、abbexa、abcam、cedarlanelabs、molecularinnovations、southernbiotech、bioworldtechnologyinc.、gallusimmunotech、abnova、alfaaesar和cloud-clonecorp分销)、抗血纤蛋白原(由lifespanbiosciences、antibodies-online、abdserotec、bio-rad、abseabiotechnology、thermofischerscientificinc.、merckmillipore、agrisera、atlasantibodies、avivasystemsbiology、enzolifesciences、rockland、genway、r&dsystems、st.john'slaboratory、abbiotec、amsbio、acrisantibodies、mybiosource、abgent、biorbyt、santacruzbiotechnology、creativebiomart、origene、novateinbio、raybiotech、genetex、prosci、unitedstatesbiological、fitzgerald、cedarlanelabs、novusbiologicals、molecularinnovations、haematologictechnologiesinc.、dako、oxfordbiomedicalresearch、gallusimmunotech、bioworldtechnologyinc.、abnova、nordicimmunologicallaboratories,和cloud-clonecorp分销)以及抗adam12(由lifespanbiosciences、sinobiological、abdserotec、bio-rad、thermofischerscientificinc.、merckmillipore、antibodies-online.com、atlasantibodies、enzolifesciences、everestbiotech、angio-proteomie、avivasystemsbiology、proteintechgroup、genway、r&dsystems、st.john'slaboratory、acrisantibodies、mybiosource、amsbio、santacruzbiotechnology、biorbyt、creativebiomart、origene、novateinbio、raybiotech、genetex、prosci、unitedstatesbiological、fitzgerald、novusbiologicals、abcam、abnova和cloud-clonecorp分销)。
可以使用本领域普通技术人员已知的方法产生特异性结合本文所列的任何生物标志物的单克隆抗体。这些方法包括kohler和milstein(nature,256:495-497,1975)和campbell("monoclonalantibodytechnology,theproductionandcharacterizationofrodentandhumanhybridomas",于burdon等人编辑,laboratorytechniquesinbiochemistryandmolecularbiology,volume13,elseviersciencepublishers,amsterdam,1985中)的方法,以及huse等人描述的方法(science,246,1275-1281,1989)。
单克隆抗体可以从培养的杂交瘤细胞的上清液或通过将杂交瘤细胞腹膜内接种到小鼠中诱导的腹水制备。这些方法描述于kohler和milstein(eur.j.immunol,6,511-519,1976)中。宿主动物或培养的抗体产生细胞的免疫途径和时间表可以遵循本领域普通技术人员已知的用于抗体刺激和产生的途径和时间表。通常,将小鼠用作测试模型,然而,任何哺乳动物受试者或来自其的产生抗体的细胞可用于生产哺乳动物(包括人)杂交细胞系。
免疫后,免疫淋巴细胞可与骨髓瘤细胞融合以产生可无限培养的杂交细胞系,以产生单克隆抗体。例如,可以选择淋巴细胞用于融合,并且可以从淋巴结组织或免疫动物的脾中分离淋巴细胞。鼠骨髓瘤细胞系可以例如从美国典型培养物保藏中心(atcc;manassas,va)获得。还描述了人骨髓瘤和小鼠-人异源骨髓瘤细胞系(kozbor等人,j.immunol.,133:3001-3005,1984;brodeur等人,monoclonalantibodyproductiontechniquesandapplications,marceldekker,inc.,newyork,pp.51-63,1987)。
杂交细胞系可以在体外维持并以任何量的常规方式储存和保存,包括在液氮下冷冻和储存。冷冻的细胞系可以无限期地复苏和培养。分泌的抗体可以通过常规方法例如沉淀、离子交换色谱、亲和色谱等从组织培养物上清液中回收。抗体可以来自以下免疫球蛋白类别中的任一种:igg、igm、iga、igd或ige及其亚类,并且优选地是igg抗体。
在某些情况下,可以包括第一抗体组,其被特异性设计为与所选择的生物标志物相互作用。例如,第一抗体组可以设计为与选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的蛋白质相互作用。
在一些情况下,除抗体之外的检测试剂可用于实施本文所述的方法。检测试剂特异性结合本文所述的生物标志物。除了抗体之外,检测试剂还可以包括适配体、fc片段、fab片段、fab2片段、scfv结构域、双抗体、非抗体配体、小分子、肽、多肽、蛋白质、纳米颗粒、亲和体等。
本公开提供了用于诊断或确认受试者中先兆子痫的存在的方法,包括:进行至少两个不同的测定,其测定来源于受试者的样品中纤连蛋白的水平;以及评估样品并使用来自多个测定的水平来诊断或确认先兆子痫的存在并计算指数。在一些情况下,该方法进一步包括基于该指数,建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。
本公开提供了用于诊断或确认受试者中存在先兆子痫的方法,包括:测量来源于受试者的样品中sflt-1和plgf的比率的水平和多个生物标志物的水平,其中生物标志物中没有一个是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素;以及评估样品并使用来自第一步骤的水平来确定诊断或确认存在先兆子痫的指数并计算指数。在一些情况下,该方法还包括基于指数建议用于先兆子痫的治疗的步骤,该治疗涉及阿司匹林、早产或卧床休息。在一些情况下,该方法还包括使用样品对每个生物标志物重复进行相同的测定。在一些情况下,该方法还包括使用来源于多个相同测定中的每一个的水平确定每个生物标志物的平均水平。在一些情况下,该方法还包括对平均水平进行log2、loge或log10变换。在一些情况下,该方法还包括将每个生物标志物的水平与该生物标志物的标准曲线进行比较。在一些情况下,该方法进一步包括对每个生物标志物加权,其中加权包括将数字提供到多项式中,使得每个标志物具有不同的权重。在一些情况下,计算包括确定经调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的原始水平的比率。在一些情况下,计算包括确定经与对照相比调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的原始水平的比率。
本公开提供了用于诊断或确认受试者中存在先兆子痫的方法,包括:测量来源于受试者的样品中sflt-1和plgf的比率的水平和多个生物标志物的水平,其中生物标志物中没有一个是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素;以及评估样品并使用来自第一步骤的水平来确定诊断或确认存在先兆子痫的指数并计算指数。在一些情况下,多个生物标志物选自sflt-1、p1gf、fn和papp-a;sflt-1、p1gf、fn、adam12和papp-a;sflt-1、p1gf、papp-a和fn;sflt-1、p1gf、hpx、fn和papp-a;p1gf、adam12、fn和papp-a;p1gf、fn和papp-a;sflt-1、p1gf和fn;p1gf、fn和papp-a;sflt-1、p1gf、fn和adam12;sflt-1、p1gf和fn;p1gf、sflt-1和fn;sflt-1、fn和adam12;p1gf、fn和papp-a。在一些情况下,该方法进一步包括基于该指数,建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。在一些情况下,该方法还包括使用样品对每个生物标志物重复进行相同的测定。在一些情况下,该方法还包括使用来源于多个相同测定中的每一个的水平确定每个生物标志物的平均水平。在一些情况下,该方法还包括对平均水平进行log2、loge或log10变换。在一些情况下,该方法还包括将每个生物标志物的水平与该生物标志物的标准曲线进行比较。在一些情况下,该方法进一步包括对每个生物标志物加权,其中加权包括将数字提供到多项式中,使得每个标志物具有不同的权重。在一些情况下,计算包括确定经调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定sflt-1和p1gf的原始水平的比率。在一些情况下,计算包括确定经与对照相比调整的sflt-1和p1gf水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的标准化水平的比率。在一些情况下,计算包括确定与对照相比sflt-1和p1gf的原始水平的比率。
测量方法
测定蛋白质或肽的水平的方法包括但不限于酶免疫测定(eia)、例如酶倍增免疫测定技术(emit)、酶联免疫吸附测定(elisa)、夹心elisa、竞争性elisa、igm抗体捕获elisa(macelisa)和微粒酶免疫测定(meia);毛细管电泳免疫测定(ceia)、放射免疫测定(ria);免疫放射测定(irma);荧光偏振免疫测定(fpia)或化学发光测定(cl)。这样的测定可以是自动化的。免疫测定也可以与激光诱导荧光结合使用。脂质体免疫测定,例如流动注射脂质体免疫测定和脂质体免疫传感器,也适用于本公开。另外,其中蛋白质/抗体复合物的形成导致增加的光散射的浊度测定法适合用于本公开的方法中,光散射作为标志物浓度的函数被转换为峰值速率信号。
elisa测定方法的一个实例是竞争性elisa。在该方法中,首先用标记的靶(例如,生物素化的血色素结合蛋白)暴露靶的抗体。随后将抗体暴露于未标记的靶(例如,血色素结合蛋白)。当将标记的靶和未修饰的靶引入抗体时,两组靶竞争抗体上的结合位点。可获得的靶越多,与抗体结合的标记靶的量越少。随后,将检测来自标记的靶的可检测信号。标记可以包括放射性同位素(例如14c、3h、32p、33p、35s、125i和131i)、荧光剂、磷光体、化学发光剂、显色染料、酶、抗体、颗粒如磁性颗粒、量子点、重元素、核磁共振(nmr)可检测的同位素,可以通过质谱法检测的分子或包括缀合物的特异性结合分子。标记可以直接连接到靶,或通过间隔臂(例如聚乙二醇或烃)连接。缀合物的实例包括但不限于钙调蛋白结合蛋白(cbp)和钙调蛋白、生物素和抗生物素蛋白的组合、生物素和链霉抗生物素蛋白的组合、生物素和
在elisa和基于elisa的测定和/或操作方案中,可以将一个或多个对目的蛋白质特异性的抗体固定在选择的固体表面,优选显示蛋白质亲和力的表面,例如聚苯乙烯微量滴定板的孔上。在洗涤以除去没有完全吸附的材料后,用非特异性“封闭”蛋白包被测定板孔,非特异性“封闭”蛋白相对于测试样品已知是抗原性中性的,例如牛血清白蛋白(bsa)、酪蛋白或牛奶粉的溶液。这允许封闭固定表面上的非特异性吸附位点,从而减少由抗原非特异性结合到表面上引起的背景。洗涤去除未结合的封闭蛋白后,在有利于免疫复合物(抗原/抗体)形成的条件下使固定表面与待测样品接触。这样的条件包括用稀释剂例如在磷酸盐缓冲盐水(pbs)/tween或pbs/triton-x100中的bsa或牛γ-球蛋白(bgg)稀释样品,其也倾向于有助于减少非特异性背景,样品在约25℃-27℃的数量级的温度下孵育约2-4小时(尽管可以使用其他温度)。孵育后,洗涤抗血清接触的表面以除去非免疫复合材料。示例性洗涤程序包括用溶液如pbs/吐温、pbs/triton-x100或硼酸盐缓冲剂洗涤。然后可以通过使结合的免疫复合物经受不同于第一抗体的对靶具有特异性的第二抗体并检测第二抗体的结合来确定免疫复合物形成的发生和量。在某些情况下,第二抗体将具有相关酶,例如脲酶、过氧化物酶或碱性磷酸酶,其在与适当的显色标记孵育后将产生颜色沉淀。例如,可以使用脲酶或过氧化物酶缀合的抗人igg一段时间并且在有利于形成免疫复合物的条件下(例如,在室温下在含有pbs(例如pbs/吐温)的溶液中孵育2小时)。在与第二抗体孵育并洗涤以除去未结合的物质后,标记的量,例如通过与显色标记如尿素和溴甲酚紫孵育(在脲酶标记的情况下)或2,2'-连氮基-二-(3-乙基-苯并噻唑啉)-6-磺酸(abts)和h2o2(在过氧化物酶标记的情况下)被定量。然后通过测量颜色产生的程度来实现定量,例如使用可见光谱分光光度计。
定量后,数据可以以光学单位表示,例如,如果使用可见光谱分光光度计量化数据,则表示为光密度或od值。在一些情况下,根据如上所述的与第二抗体一起使用的反应性底物,数据可以表示为吸光度、发射、放射性计数等。在任何情况下,可以从含有可检测底物的任何孔定量的光学单元中减去从不含可检测底物(例如空白)的任何孔定量的光学单元的量值。该值可以是经调整的光学单位值或经调整的od,并且包括在本文所述的进一步的计算中。在一些情况下,可以不从含有可检测底物的任何孔定量的光学单元中减去从不含可检测底物(例如空白)的任何孔定量的光学单元的量值。该值可以是原始光学单位值或原始od,并且包括在本文所述的进一步的计算中。
或者,可以使用用于测量样品中一个或多个蛋白质水平的基于非elisa的方法。代表性实例包括但不限于质谱、色谱、蛋白质组阵列、xmaptm微球技术、流式细胞术、蛋白质印迹、光谱术、比浊法、辐射状免疫扩散技术、单向免疫扩散测定、蛋白质消化和肽分析(例如由appliedproteomics描述的方法和系统)和免疫组织化学。
质谱法可以包括任何质谱(massspectrometric,ms)技术,其可以获得关于肽的质量的精确信息,并且优选地还可以获得所选肽的片段化和/或(部分)氨基酸序列的精确信息(例如,在串联质谱,ms/ms;或源后衰变,tofms),在本文中是有用的。合适的肽ms和ms/ms技术和系统本身是众所周知的,并且可以在本文中使用,以及与质谱联用的液相色谱(lc-ms)和与串联质谱联用的二维液相色谱(2d-lc-ms/ms)。适合于生物标志物肽分析的ms排列、仪器和系统可以包括但不限于基质辅助激光解吸/电离飞行时间(maldi-tof)ms;maldi-tof源后衰变(psd);maldi-tof/tof;表面增强激光解吸/电离飞行时间质谱(seldi-tof)ms;电喷雾电离质谱(esi-ms);esi-ms/ms;esi-ms/(ms)n(n是大于零的整数);esi3d或线性(2d)离子阱ms;esi三重四极ms;esi四极正交tof(q-tof);esi傅里叶变换ms系统;硅上解吸/电离(dios);二次离子质谱法(sims);大气压化学电离质谱(apci-ms);apci-ms/ms;apci-(ms)n;大气压光电离质谱(appi-ms);appi-ms/ms;和appi-(ms)n。可以使用本领域中建立的方式(例如,碰撞诱导解离(cid))实现串联ms(ms/ms)排列中的肽离子片段化。通过质谱法对生物标志物的检测和定量可以涉及多反应监测(mrm)。ms肽分析方法可以有利地与上游肽或蛋白质分离或分级分离方法组合,例如与色谱法和其他方法。
在一些情况下,可以在分析、测量、定量等之前衍生或修饰生物标志物蛋白。本领域普通技术人员已知的方法可用于衍生或修饰蛋白质。本文列出的蛋白质生物标志物的多态性或修饰可以使用本文所述的方法、使用本文所述的分析、测量或定量方法来鉴定。
在其他情况下,可以通过检测患者样品中由目标基因编码的一个或多个rna转录物或其片段的量或水平以评估至少一种pe生物标志物的水平,以获得核酸标志物表征(markerrepresentation)。可以使用任何方便的操作方案检测样品中的核酸水平。虽然检测核酸的多种不同方式是已知的,例如在差异基因表达分析领域中使用的那些,一种用于产生标志物表征的代表性和方便类型的操作方案是基于阵列的基因表达谱分析操作方案。这样的应用是杂交测定,其中使用针对要在待产生的标志物表征中待测定/分析的每种基因显示“探针”核酸的核酸。在这些测定中,首先从待测定的初始核酸样品制备靶核酸样品,其中制备可包括用标记(例如信号产生系统的成员)标记靶核酸。在靶核酸样品制备之后,使样品在杂交条件下与阵列接触,由此在与附着于阵列表面的探针序列互补的靶核酸之间形成复合物。然后定性或定量检测杂交复合物的存在。
可用于产生本发明方法中使用的标志物表征的特异性杂交技术包括美国专利号5,143,854;5,288,644;5,324,633;5,432,049;5,470,710;5,492,806;5,503,980;5,510,270;5,525,464;5,547,839;5,580,732;5,661,028;5,800,992;(其公开内容通过引用并入本文);以及wo95/21265;wo96/31622;wo97/10365;wo97/27317;ep373203;和ep785280中所述的技术。“探针”核酸阵列,其中包括用于其表达正被测定的每种表型决定性基因的探针可以与来自受试者样品的靶核酸接触。在杂交条件下,例如严格杂交条件下进行接触,然后除去未结合的核酸。本文使用的术语“严格测定条件”是指相容于产生具有足够互补性的核酸结合对(例如表面结合核酸和溶液相核酸)以在测定中提供所需水平的特异性的条件,同时与在不足的互补性的结合成员之间形成结合对以降低相容性以提供所需的特异性。严格测定条件是杂交和洗涤条件的总和或组合(总体)。
杂交核酸的所得模式提供了关于已经被探测的每个基因的表达的信息,其中表达信息是关于基因是否被表达的,并且通常是在什么水平,其中表达数据(例如,标志物表征(例如,以转录组的形式))可以是定性的和定量的。
或者,可以采用用于定量样品中一个或多个核酸水平的基于非阵列的方法,包括基于扩增操作方案的方法,例如基于聚合酶链反应(pcr)的测定,包括定量pcr、逆转录pcr(rt-pcr)、实时pcr、环介导dna等温扩增(lamp)、链置换扩增(sda)、基于序列的扩增(nasba)、自我维持序列复制(3sr)、线性扩增等。
或者,可以采用用于测定在样品中假定蛋白质的功能的功能测定、方法和操作方案,包括本领域普通技术人员已知的任何标准功能测定,其将确认或否定在样品中假定蛋白质的存在。在一些情况下,功能测定可包括酶测定、底物测定、切割测定、比色测定、ph测定等。也可以进行溶酶体测定。
当要检测蛋白质或肽水平时,在进行操作方案之前,可以测定样品中蛋白质的总量或蛋白质总量的一部分。这可以使用比色测定法实现,例如bca、lowry、bradford、考马斯、660nm等。
本文的任何测定可涉及使用标准曲线和/或质量对照,例如高质量对照、低质量对照和至少一个空白。
pe生物标志物标准品可以是与通过本文所述的方法测量的生物标志物相似或相同的纯化的重组蛋白质、纯化的蛋白质、合成的蛋白质、工程改造的蛋白质等。在示例性情况下,生物标志物标准品是与通过本文所述的方法测量的生物标志物相似或相同的纯化的重组蛋白质。空白可以是水、缓冲剂、多于一种缓冲剂、化学品、多于一种化学品、试剂、多于一种试剂、抗体、多于一种抗体或本文所述方法的任何组分。低质量对照可以是先前分析的样品纯化的重组蛋白质、纯化的蛋白质、合成的蛋白质、工程改造的蛋白质等,其具有通过本文所述的方法分析的低水平的生物标志物。高质量对照可以是先前分析的样品、纯化的重组蛋白质、纯化的蛋白质、合成的蛋白质、工程改造的蛋白质等,其具有通过本文所述的方法分析的高水平的生物标志物。曲线标准品可以是由用户或elisa的制造商提供的浓缩、稀释或纯化的蛋白质,其可用于分析总蛋白或总生物标志物水平的水平,以便计算本文中所述方法、通常是elisa方法的标准曲线。
单板的孔可以含有但不限于至少一个样品、至少一个生物标志物标准品、至少一种曲线标准品、高质量对照、低质量对照和至少一个空白。在一些情况下,单板的孔可以含有但不限于多于一个样品、多于一个生物标志物标准品、多于一个曲线标准品、高质量对照、低质量对照和多于一个空白。例如,单板的孔可以含有至少1、2、3、4、5、5、6、7、8、9或10个样品;至少1、2、3、4、5、5、6、7、8、9或10种生物标志物标准品;至少1、2、3、4、5、5、6、7、8、9或10个曲线标准品;至少1、2、3、4、5、5、6、7、8、9或10个高质量对照;至少1、2、3、4、5、5、6、7、8、9或10个低质量对照;和/或至少1、2、3、4、5、5、6、7、8、9或10个空白。样品可以是单个、一式两份、一式三份、一式四份,或任何进一步重复的延伸。
在一个实施例中,单个elisa测定板含有一式三份的八个标准曲线样品、六个高质量对照样品、六个低质量对照样品和一式三份在板上排列以避免变化的三个样品。通常,可以使用对照代替高质量对照和/或低质量对照。在一些情况下,对照可用作内部校准。在其他情况下,可以使用对照代替生物标志物标准品。在其他情况下,可以使用对照代替标准品。例如,对照可用于产生本文所述的标准曲线。
单克隆抗体
本公开进一步提供了用于确认受试者中先兆子痫的存在、不存在或严重性的方法,其包括:利用选择性结合纤连蛋白的单克隆抗体以确定来源于受试者的样品中纤连蛋白的水平,产生报告,其基于水平指示先兆子痫的存在、不存在或严重性并包含指数;和评估样品并基于指数建议用于先兆子痫的治疗,所选择的治疗涉及阿司匹林、早产或卧床休息。
在一些情况下,确认、诊断、预后、监测、表征或评估受试者中先兆子痫的严重性的方法包括:从受试者获得生物样品;将生物素化的血色素结合蛋白稀释两倍,将生物素化的血色素结合蛋白与受试者的生物样品混合,将该混合物加入免疫测定板中;在免疫测定测试中进行生物样品对血红素结合蛋白(hpx)的存在和量的分析,以及使用生物标志物水平以提供先兆子痫诊断、预后、确认、监测、表征或评估其严重性。在这种情况下,测定方法学例证竞争性elisa测定。生物素化的血色素结合蛋白与样品-血色素结合蛋白竞争抗体结合位点。随后在引入适当的缀合物形成配偶体例如抗生物素蛋白、链霉抗生物素蛋白、
elisa试剂盒可用于进行elisa测定。这些可以从标准商业制造商购买,例如来自mybiosource(sd,us)的含有解整联蛋白和金属蛋白酶结构域的蛋白12(adam12);来自abcaminc.(ma,us)的血色素结合蛋白(hpx);来自r&dsystemsinc.(mn,us)的胎盘生长因子(p1gf);和来自r&dsystemsinc.(mn,us)的可溶性fms样酪氨酸激酶(sflt)-1。
本领域普通技术人员已知的任何市售试剂盒可以用于通过elisa方法检测本文列出的生物标志物,并且可以与本发明方法组合使用。例如,市售试剂盒可以包括但不限于抗p1gf(由uscnlifescienceinc.,roche和r&dsystems分销)、抗sflt-1(由bosterbio.、r&dsystems、mybiosource.com、antibodies-online、biotrendchemikaliengmbh,和enzolifesciences分销)、抗papp-a(由r&dsystems、raybiotech、ibljapan、drginternational、abnova、uscnlifescience、novusbio、rapidtest、mybiosource、antibodies-online.com、fisherscientific、elabscience、sigmaaldrich、cusabio、anshlabs、demeditec、alpco、amsbio、novateinbio、creativebiomart、biorbyt、biomaticcorporation分销)、抗vegf(由amsbio、mybiosource、abnova、antibodies-online.com、unitedstatesbiological、biomatikcorporation、cloud-clonecorp、biovendor、bosterimmunoleader、enzolifesciences、fitzgerald、abnova、avivasystemsbiology和creativebiomart分销)、抗纤连蛋白(由biovendor、bosterimmunoleader、qedbioscience、ebioscience、biorbyt、fitzgerald、amsbio、mybiosource、novateinbio、abnova、avivasystemsbiology、creativebiomart、antibodies-online.com、abcam、novusbiologicals、unitedstatesbiological、eiaab(hongkong)companylimited、biomatikcorporation、cloud-clonecorp分销)、抗血纤蛋白原(molecularinnovations、fitzgerald、amsbio、biorbyt、mybiosource、novateinbio、abnova、creativebiomart、avivasystemsbiology、antibodies-online.com、abcam、novusbiologicals、unitedstatesbiological、eiaab(hongkong)companylimited、biomatikcorporation、cloud-clonecorp分销)和抗adam12(由bosterimmunoleader、amsbio、mybiosource、abnova、creativebiomart、antibodies-online.com、genetex、biorbyt、unitedstatesbiological、eiaab(hongkong)companylimited、r&dsystems和cloud-clonecorp分销)。
可以使用本文所述的方法(例如使用elisa方法、操作方案、测定等)对标准曲线样品来分析生物标志物的浓度。在对样品或一组标准曲线样品进行方法、操作方案和/或测定之前,每种市售或内部设计的elisa方法、操作方案和/或测定可提供包含标准曲线样品的推荐稀释度的说明书。在一些情况下,可以遵循市售的或内部设计的elisa方法、操作方案和/或测定的说明书,并且根据说明书稀释标准曲线样品。在一些情况下,标准曲线样品可以稀释至1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:150、1:200、1:250、1:300、1:350、1:400、1:450、1:500、1:550、1:600、1:650、1:700、1:750、1:800、1:850、1:900、1:950、1:1000、1:1500、1:2000、1:2500、1:3000、1:3500、1:4000、1:10000、1:15000、1:20000、1:25000、1:30000、1:35000、1:40000、1:45000、1:50000、1:55000、1:60000、1:65000、1:70000、1:75000、1:80000、1:85000、1:90000、1:95000或1:100000、1:4500、1:5000、1:5500、1:6000、1:6500、1:7000、1:7500、1:8000、1:8500、1:9000、1:9500或1:100000的比率。在一些情况下,标准曲线样品可以稀释至约1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:150、1:200、1:250、1:300、1:350、1:400、1:450、1:500、1:550、1:600、1:650、1:700、1:750、1:800、1:850、1:900、1:950、1:1000、1:1500、1:2000、1:2500、1:3000、1:3500、1:4000、1:10000、1:15000、1:20000、1:25000、1:30000、1:35000、1:40000、1:45000、1:50000、1:55000、1:60000、1:65000、1:70000、1:75000、1:80000、1:85000、1:90000、1:95000或1:100000、1:4500、1:5000、1:5500、1:6000、1:6500、1:7000、1:7500、1:8000、1:8500、1:9000、1:9500或约1:100000的比率。在一些情况下,可以将标准曲线样品稀释至小于1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:150、1:200、1:250、1:300、1:350、1:400、1:450、1:500、1:550、1:600、1:650、1:700、1:750、1:800、1:850、1:900、1:950、1:1000、1:1500、1:2000、1:2500、1:3000、1:3500、1:4000、1:10000、1:15000、1:20000、1:25000、1:30000、1:35000、1:40000、1:45000、1:50000、1:55000、1:60000、1:65000、1:70000、1:75000、1:80000、1:85000、1:90000、1:95000或1:100000、1:4500、1:5000、1:5500、1:6000、1:6500、1:7000、1:7500、1:8000、1:8500、1:9000、1:9500或小于1:100000的比率。在一些情况下,标准曲线样品可以稀释至大于1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:150、1:200、1:250、1:300、1:350、1:400、1:450、1:500、1:550、1:600、1:650、1:700、1:750、1:800、1:850、1:900、1:950、1:1000、1:1500、1:2000、1:2500、1:3000、1:3500、1:4000、1:10000、1:15000、1:20000、1:25000、1:30000、1:35000、1:40000、1:45000、1:50000、1:55000、1:60000、1:65000、1:70000、1:75000、1:80000、1:85000、1:90000、1:95000或1:100000、1:4500、1:5000、1:5500、1:6000、1:6500、1:7000、1:7500、1:8000、1:8500、1:9000、1:9500或大于1:100000的比率。对于上文所列的比率,1是样品的部分,而另一个值表示稀释剂,其中稀释剂可以由商业制造商提供,或稀释剂可以由用户提供。
数据加工和数据用途
所得数据提供了关于样品中已经探测的每个标志物的水平的信息,其中信息是关于标志物是否存在以及通常在什么水平,并且其中数据可以是定性和定量的。因此,当检测是定性的时,方法提供对靶标志物(例如核酸或蛋白质)是否存在于所测定的样品中的读数或评估,例如评价。在一些情况下,方法提供定量检测靶标志物是否存在于所测定的样品中,例如评估或评价所测定的样品中的靶分析物(例如核酸或蛋白质)的实际量或相对丰度进行测定。在这种情况下,定量检测可以是绝对的,或者如果该方法是在样品中检测多个不同分析物例如靶核酸或蛋白质的方法,则是相对的。
一旦已经测定了一个或多个先兆子痫标志物的水平,可以以多种方式中的任一种分析测量结果以获得先兆子痫标志物水平表征。“生物标志物水平表征”或“基因表征”是指(一个或多个先兆子痫标志物和/或目的蛋白质辅因子)水平(例如rna、dna或蛋白质水平)的表征。
例如,可以分析先兆子痫标志物测量值以产生先兆子痫评分或指数,其可以使用逻辑回归分析来计算。在一些情况下,可以计算至少两个生物标志物的比率,并与用于模型中的另外的解释变量组合。生物标志物的比率通常可以是sflt-1和p1gf的比率。在一些情况下,所生成的模型可以是惩罚模型。在其他情况下,所生成的模型可以是非惩罚的模型。样本可能导致不准确的模型,因此,可以评估样本外性能以确定样本是否导致不准确的模型。在一些情况下,可以使用任何数量的方法来评估样本外性能,包括但不限于交叉验证方法。在一些情况下,模型的准确性取决于多个参数,包括但不限于训练样本对于目标群体的代表性、包括在模型中的变量的数量、生物标志物测量不确定性等。通常评估模型的样本性能以估计未用于训练的样本集中的模型的误差。
作为实例,可将先兆子痫标志物测量作为生物标志物小组进行分析。可以通过统计特征选择过程来选择生物标志物小组的预测成员。例如,可以通过组合遗传算法(ga)和用于先兆子痫分类分析的所有配对(ap)支持向量机(svm)方法来选择分析物小组。预测特征被自动确定,例如。通过迭代ga/svm,得到具有最佳分类性能的非冗余先兆子痫相关分析物的非常紧凑的集合。这些不同的分类器集合可能仅具有适度的重叠基因、蛋白质片段或蛋白质特征,但具有类似水平的准确性。
作为实例,可以分析先兆子痫标志物测量值以产生先兆子痫特征。患者样品的先兆子痫特征可以通过本领域已知的用于计算生物标志物特征的多种方法中的任何一种来计算。例如,患者样品中的一个或多个先兆子痫标志物中的每一种的水平可以进行log2、loge或log10变换,并且例如如上文关于产生先兆子痫标志物谱进行标准化。然后通过将标准化水平乘以权重因子或权重来加权每个标志物的标准化表达水平,以获得一个或多个标志物中的每一个的加权表达水平。然后将加权水平总计并且在一些情况下平均以得到所分析的一个或多个先兆子痫标志物的单个加权水平。
在一些情况下,pe测试可以确认怀疑患有pe的受试者是否实际上确实患有pe。所分析的一个或多个先兆子痫标志物的单个加权水平可以确认pe的严重性。例如,单个加权水平可以产生高、中或低加权评分,其可以确认受试者中pe的高、中或低严重性。在一些情况下,高的单个加权水平确认受试者中pe的高度严重性。在一些情况下,中等单个加权水平确认了pe的高度严重性。在一些情况下,低的单个加权水平证实pe的高度严重性。在一些情况下,高的单个加权水平确认pe的中等严重性。在一些情况下,中等单个加权水平确认pe的中等严重性。在一些情况下,低的单个加权水平确认pe的中等严重性。在一些情况下,高的单个加权水平确认pe的低严重性。在一些情况下,中等单个加权水平确认pe的低严重性。在一些情况下,低的单个加权水平确认受试者中pe的低严重性。
所分析的一个或多个先兆子痫标志物的单个加权水平可以指示疑似患有pe的受试者患有或没有患有pe的可能性。例如,单个加权水平可以产生高、中和低加权评分,其可以指示受试者患有或没有患有pe的可能性。在一些情况下,高的单个加权水平指示受试者患有或没有患有pe的可能性高。在一些情况下,中等单个加权水平指示受试者患有或没有患有pe的可能性高。在一些情况下,低的单个加权水平指示受试者患有或没有患有pe的可能性高。在一些情况下,高的单个加权水平指示受试者患有或没有患有pe的中等可能性。在一些情况下,中等单个加权水平指示受试者患有或没有患有pe的中等可能性。在一些情况下,低的单个加权水平指示受试者患有或没有患有pe的中等可能性。在一些情况下,高的单个加权水平指示受试者患有或没有患有pe的可能性低。在一些情况下,中等单个加权水平指示受试者患有或没有患有pe的可能性低。在一些情况下,低的单个加权水平指示受试者患有或没有患有pe的可能性低。
所分析的一个或多个先兆子痫标志物的单个加权水平可以指示受试者发展先兆子痫的可能性。例如,单个加权水平可以产生高、中和低加权评分,其可以指示受试者在具有任何症状之前发展先兆子痫的可能性。在一些情况下,高的单个加权水平表示受试者发展先兆子痫的可能性高。在一些情况下,中等单个加权水平指示受试者发展先兆子痫的可能性高。在一些情况下,低的单个加权水平表示受试者发展先兆子痫的可能性高。在一些情况下,高的单个加权水平表示受试者发展先兆子痫的中等可能性。在一些情况下,中等单个加权水平表示受试者发展先兆子痫的中等可能性。在一些情况下,低的单个加权水平指示受试者发展先兆子痫的中等可能性。在一些情况下,高的单个加权水平表示受试者发展先兆子痫的可能性低。在一些情况下,中等单个加权水平表示受试者发展先兆子痫的可能性低。在一些情况下,低的单个加权水平表示受试者发展先兆子痫的可能性低。
权重因子或权重可以通过任何统计机器学习方法例如主成分分析(pca)、线性回归、支持向量机(svm)和/或数据集的随机森林来确定,其可以使用获得的样品。例如,每个先兆子痫标志物的分析物水平可以进行log2、loge或log10转换并加权为1(对于在先兆子痫中水平增加的那些标志物)或-1(对于先兆子痫中水平降低的那些标志物),以及测定与减少的标志物相比增加的标志物之和之间的比率以实现先兆子痫特征。先兆子痫特征是先兆子痫标志物水平表征的一个例子。
在某些情况下,多个标志物的相对权重用于确定生物标志物特征、生物标志物评分或生物标志物指数。可以比较其权重的标志物包括本文所述的任何标志物或选自包含hpx、sflt-1、papp-a、fn、fg、vegf(不包括vegf-r1)、p1gf和adam12的组的那些标志物。例如,在一些情况下,pe特征、pe评分或pe指数涉及比较sflt-1和p1gf结合至少一个其他生物标志物的水平,并确定它们的相对权重是否为至少1.5:1、2:1、2.5:1、3:1或3.5:1,其中这样的测定指示pe的pe或pe的可能性。
pe评分或pe指数可以进一步分类为确认受试者中pe的严重性的值。例如,pe评分或pe指数可以产生高、中或低值,其可以确认受试者中pe的严重性。在一些情况下,高pe评分或pe指数可以确认受试者中pe的严重性高。在一些情况下,中度pe评分或pe指数确认pe的严重性高。在一些情况下,低pe评分或pe指数确认pe的严重性高。在一些情况下,高pe评分或pe指数确认pe的严重性中等。在一些情况下,中度pe评分或pe指数确认pe的严重性中等。在一些情况下,低pe评分或pe指数确认pe的严重性中等。在一些情况下,高pe评分或pe指数确认pe的严重性低。在一些情况下,中度pe评分或pe指数确认pe的严重性低。在一些情况下,低pe评分或pe指数确认受试者中pe的严重性低。
pe评分或pe指数可进一步分类为指示怀疑患有pe的受试者患有或没有患有pe的可能性的值。例如,pe评分或pe指数可以产生高、中和低值,其可以指示受试者患有或没有患有pe的可能性。在一些情况下,高pe分数或pe指数指示受试者患有或没有患有pe的可能性高。在一些情况下,中等pe评分或pe指数指示受试者患有或没有患有pe的可能性高。在一些情况下,低pe分数或pe指数指示受试者患有或没有患有pe的可能性高。在一些情况下,高pe分数或pe指数指示受试者患有或没有患有pe的可能性中等。在一些情况下,中等pe评分或pe指数指示受试者患有或没有患有pe的可能性中等。在一些情况下,低pe分数或pe指数指示受试者患有或没有患有pe的可能性中等。在一些情况下,高pe分数或pe指数指示受试者患有或没有患有pe的可能性低。在一些情况下,中等pe评分或pe指数指示受试者患有或没有患有pe的可能性低。在一些情况下,低pe分数或pe指数指示受试者患有或没有患有pe的可能性低。
pe评分或pe指数可以进一步分类为可以预测受试者在症状发作之前发展先兆子痫的可能性的值(例如可能性高、中等或低)。在一些情况下,高pe分数或pe指数表示受试者发展先兆子痫的可能性高。在一些情况下,中等pe评分或pe指数表示受试者发展先兆子痫的可能性高。在一些情况下,低pe分数或pe指数指示受试者发展先兆子痫的可能性高。在一些情况下,高pe分数或pe指数指示受试者发展先兆子痫的可能性中等。在一些情况下,中等pe评分或pe指数表示受试者发展先兆子痫的可能性中等。在一些情况下,低pe分数或pe指数表示受试者发展先兆子痫的可能性中等。在一些情况下,高pe分数或pe指数表示受试者发展先兆子痫的可能性低。在一些情况下,中度pe评分或pe指数表示受试者发展先兆子痫的可能性低。在一些情况下,低pe分数或pe指数表示受试者发展先兆子痫的可能性低。
在一些情况下,可以使用任何数量的方法、算法和计算来加工和/或进一步分析数据,以便对单个数据点、数据集进行优先级排序并防止假阳性或假相关的结果的过拟合。如本文所描述和示出的,一些数据可能没有被校正,例如训练数据,其可能有时是数据的乐观估计。另外,一些数据可以被校正,例如,校正的数据,其可以有时是数据的保守估计。在一些情况下,校正的数据是值的交叉验证的估计,例如该值可以是曲线下面积(auc)。有时,对训练数据评估模型的性能,提供乐观估计。偶尔,针对不同性能度量计算对性能的乐观估计的校正。在一些情况下,使用交叉验证来计算校正的性能估计。在一些实例中,性能度量是曲线下面积(auc)或roc值。
数据可以用于制备模型。在一些情况下,模型被惩罚或优化。从使用惩罚数据得到的模型单独处理生物标志物,并防止每个单个生物标志物获得的数据或每个生物标志物的复制数据测量值控制先兆子痫指数、先兆子痫评分或先兆子痫谱。在一些情况下,在惩罚模型中使用的数据通过向一个方向或另一个方向不适当地加权先兆子痫指数、先兆子痫评分或先兆子痫谱来控制先兆子痫指数、先兆子痫评分或先兆子痫谱。在一些情况下,在惩罚模型中使用数据,使得先兆子痫指数、先兆子痫评分或先兆子痫谱没有被不适当地加权并且防止先兆子痫指数、先兆子痫评分或先兆子痫谱从不相关因子例如受损样品,不反映受试者的样品等确定。在一些情况下,从数据获得优化模型,使得校正可防止获得的个别标志物的数据值对方程的错误贡献。在一些情况下,与训练数相比,从数据获得的经校正和/或优化的模型可更好地预测先兆子痫指数、先兆子痫评分或先兆子痫谱。在示例性情况下,使用惩罚逻辑回归方法来构建模型,其中惩罚方法拟合回归模型,同时对本文所述的模型的系数的绝对值之和添加约束。约束可以防止可能与该样品集中的结果高度相关联的变量错误地影响模型。
在一些情况下,确定先兆子痫指数、先兆子痫评分或先兆子痫谱的数据计算包括sflt-1和p1gf的比率。该比率可以与或可以不与测定结果一起标准化。如本文所述,先兆子痫指数、先兆子痫评分或先兆子痫谱是可以使用本文所述的分析方法确定的生物标志物的组合。
数据可以拟合三个分开的类别,层(tier)i、层ii和层iii。层i对应于至少0.98或更大的roc值。层ii对应于0.92至0.98的roc值,而层iii对应于0.92或更小的roc值。在一些情况下,大于0.850的roc值可能在临床上是有价值的。在一些情况下,大于0.90或0.950的roc值可能在临床上是有价值的。在一些情况下,在层i和层ii之间没有统计学显著差异。在一些实例中,在层i和层ii之间存在统计学显著差异。在一些情况下,层值可以是roc值,其可以指示方法和/或具体生物标志物或生物标志物组的数据点的灵敏度和/或特异性。在一些情况下,可以使用至少一种算法、至少一个阈值、至少随时间的方向变化、单个受试者内的比较、受试者组内的比较或与参考标准的比较来分类数据输出。通常,至少一个算法可以是本文所描述的算法或本领域普通技术人员已知的至少一个算法。通常,至少一个阈值可以在本文中描述或者为本领域普通技术人员所知。在一些情况下,可以基于单个参数或一组参数来设置阈值;单个参数或一组参数可以由用户定义。通常,方向改变可以在本文中描述或者本领域普通技术人员已知。在一些情况下,方向改变可以基于单个参数或一组参数;单个参数或一组参数可以由用户定义。通常,单个受试者内的比较可以在本文中描述或本领域普通技术人员已知。在一些情况下,单个受试者其可以与被测试的受试者相同或不同)内的比较可以基于单个参数或一组参数;单个参数或一组参数可以由用户定义。通常,受试者组内的比较可以在本文中描述或本领域普通技术人员已知。在一些情况下,受试者组内的比较可以基于单个参数或一组参数;单个参数或一组参数可以由用户定义。通常,与参考标准的比较可以在本文中描述或本领域普通技术人员已知。在一些情况下,与参考标准的比较可以基于单个参数或一组参数;单个参数或一组参数可以由用户定义。参考标准可以基于实际的测试受试者、或其他实验值、或从模型导出的理论值、或其任何组合。
在一些情况下,本公开提供了用于确认受试者中存在或不存在先兆子痫的方法,包括:评估来源于受试者的样品中的多个生物标志物以确认受试者是否患有先兆子痫,其中该确认具有至少90、91、92、93、94、95、96、97、98、99%或更高的特异性,其用于计算指数。在一些情况下,该确认具有至少0.9、0.91、0.92、0.93、0.95、0.96、0.97、0.980、0.985、0.988、0.990、0.995、0.999或更大的auc,其用于计算指数。例如,评估来自超过一个受试者的样品,以本文所述的特异性,确认存在或不存在pe,例如评估来自超过5、10、50、100、130、135、138、150、200、220、247、250、300、350、400、450、500或多于1000个受试者,以本文所述的特异性确认存在或不存在pe。在一些情况下,使用传统方法将受试者评估为患有pe。在一些示例中,受试者实际上经历pe。传统方法包括测量蛋白尿、血压、体重增加、血糖、血小板计数和本领域已知的传统上用于评估pe的任何其他方法。
本公开还提供了用于区分患有先兆子痫的受试者与具有提示先兆子痫的症状但没有患有先兆子痫的受试者的方法,该方法将先兆子痫与妊娠症状的并发症、慢性高血压、妊娠高血压、自身免疫性疾病和/或妊娠糖尿病区分开,其中该方法具有至少95%的特异性或具有至少0.9的auc,该方法包括:评估来源于受试者的样品的多个不同生物标志物的水平,产生指示存在先兆子痫、不存在先兆子痫、先兆子痫的严重性的指数。在一些情况下,该方法进一步包括基于指数建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。在一些情况下,自身免疫性疾病是sle或狼疮。在一些情况下,该方法还包括对多个生物标志物中的每一个进行加权,其中加权包括将数字提供到多项式中,使得每个标志物具有不同的权重。
本公开提供了用于确认受试者中存在或不存在先兆子痫的方法,包括:评估来源于受试者的样品中的多个生物标志物以确认受试者是否患有先兆子痫,其中该确认具有大于95%的特异性,或具有大于0.9的auc并用于计算指数。
本公开进一步提供了用于诊断或确认受试者中先兆子痫的存在的方法,包括:(a)进行至少两个不同的测定,其测定来源于受试者的样品中纤连蛋白的水平;和(b)评估样品并使用来自两种不同测定的水平来诊断或确认先兆子痫的存在并计算指数。
在一些情况下,本公开提供了用于诊断或确认受试者中存在先兆子痫的方法,包括:(a)进行至少一个测定,其利用结合纤连蛋白的抗体或选择性结合纤连蛋白相同抗原的抗体作为抗体,其中抗体的结合决定来源于受试者的样品中纤连蛋白的水平;和(b)评估样品并使用来自至少一个测定的纤连蛋白的水平来诊断或确认先兆子痫的存在并计算指数。
本公开还描述了用于诊断或确认受试者存在先兆子痫或不存在先兆子痫的方法,包括:(a)评估sflt-1和plgf的比率的水平和多个不同生物标志物的水平,其中不同生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素;和(b)评估样品并使用来自步骤(a)的水平来确定诊断或确认存在先兆子痫的指数并计算指数。
本公开还提供了用于区分患有先兆子痫的受试者与具有提示先兆子痫的症状但没有患有先兆子痫的受试者的方法,该方法将先兆子痫与妊娠症状、慢性高血压、妊娠高血压、自身免疫疾病和/或妊娠糖尿病区分开,其中该方法具有至少90%的特异性或至少0.9的auc,该方法包括:评估来源于受试者的样品的多个不同生物标志物的水平,产生指示pe存在、缺乏pe、pe特征、pe的严重性、pe的诊断或pe的预后的指数。
在一些情况下,本公开进一步描述了用于分析受试者的先兆子痫的诊断、预后、特征、存在、不存在或严重性的方法,其包括:(a)利用选择性结合纤连蛋白的单克隆抗体,以确定来源于受试者的样品中纤连蛋白的水平,(b)基于水平产生报告,其指示先兆子痫的存在、不存在或严重性并且包含指数;和(c)评估样品并基于指数建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。
本公开还描述了用于分析来源于受试者的样品中的先兆子痫的诊断、预后、特征、存在、不存在或严重性的方法,包括:利用至少一种纤连蛋白elisa试剂盒中针对纤连蛋白抗体的抗原的抗体以分析和评估来自受试者的样品。
本公开还提供了用于诊断或确认受试者中存在先兆子痫的方法,其包括:(a)进行至少一个测定,其利用选择性结合纤连蛋白、纤连蛋白的一部分、纤连蛋白的一部分或纤连蛋白的片段的抗体,其中抗体的结合决定来源于受试者的样品中纤连蛋白的水平;和(b)评估样品并使用来自一个测定的纤连蛋白的水平来诊断或确认先兆子痫的存在并计算指数。
在一些情况下,本公开描述了用于确认受试者没有患有先兆子痫的方法,包括:评估来源于受试者的样品中的多个生物标志物,以确认受试者没有患有先兆子痫,其中该确认具有大于95%的特异性或具有0.9的auc,并用于计算指数。
在一些情况下,pe特征、pe评分或pe指数涉及比较fn、fg和选自以下的另一个生物标志物的水平:hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、p1gf和adam12;并确定它们的相对权重是否分别为至少3:1、5:1、10:1、20:1、30:1、50:1、50:1、100:1,其中这样的确定表明pe或pe的可能性。
其他目的组合包括比较sflt-1和选自以下的另一个生物标志物:hpx、fn、fg、papp-a、vegf(不包括vegf-r1)、p1gf和adam12,并确定它们的相对权重是否分别为至少2:1、2.5:1、3:1、5:1、10:1、20:1、30:1、50:1、50:1、100:1,其中这样的确定指示pe或pe的可能性。
其他目的组合包括比较p1gf和选自以下的另一个生物标志物:hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12,并确定它们的相对权重是否分别为至少2:1、2.5:1、3:1、5:1、10:1、20:1、30:1、50:1、50:1、100:1,其中这样的确定指示pe或pe的可能性。
其他目的组合包括比较vegf(不包括vegf-r1)和选自以下的另一个生物标志物:hpx、sflt-1、papp-a、p1gf、fn、fg和adam12;并确定它们的相对权重是否分别为至少2:1、2.5:1、3:1、5:1、10:1、20:1、30:1、50:1、50:1、100:1,其中这样的确定指示pe或pe的可能性。
作为实例,可以分析先兆子痫标志物测量值以产生先兆子痫评分。像先兆子痫特征一样,先兆子痫评分是表示患者样品中一个或多个先兆子痫标志物的加权水平之和的单个度量值。先兆子痫评分可以通过与上述用于先兆子痫特征的方法非常相似的方法来确定,例如患者样品中的一个或多个先兆子痫标志物中的每一种的水平可以例如如上关于产生先兆子痫谱的描述进行log2、loge或log10变换和标准化;然后通过将标准化水平乘以权重因子或权重来对每个标志物的标准化表达水平进行加权,以获得一个或多个标志物中的每一个的加权水平;然后对加权的水平进行求和,并且在一些情况下平均以得到所分析的一个或多个先兆子痫标志物的单个加权水平。偶尔,一个或多个先兆子痫标志物的加权水平可以随后例如使用对数样的反函数如双对数ln(ln(x))、超-4-对数(super-4-logarithm)(即四对数)、超对数-4-对数(hyper-4-logarithm)(即迭代幂次)、迭代对数、朗伯w函数或分对数。
与先兆子痫特征相反,加权水平由参考数据集或训练数据集定义。因此,先兆子痫评分由参考数据集定义。
先兆子痫指数是先兆子痫标记水平表征的实例。pe指数是指示pe的严重性或发展pe的可能性的程度的度量系统。它用于确定女性受试者在哪个类别中。使用分类算法从pe评分计算pe指数。分类算法的实例是本领域中众所周知的。这些算法可以使用任何合适的统计分类(或“学习”)方法形成,该方法试图基于数据中存在的客观参数将数据主体分离成类。分类方法可以是受监督的或不受监督的。受监督和不受监督的分类过程的示例在jain,"statisticalpatternrecognition:areview,"ieeetransactionsonpatternanalysisandmachineintelligence,vol.22,no.1,january2000中。在受监督的分类中,将包含已知类别的实例的训练数据提交给学习机制,学习机制学习定义每个已知类的一个或多个关系集合。然后可以将新数据应用于学习机制,其然后使用学习的关系对新数据进行分类。受监督的分类过程的实例包括线性回归过程(例如,多元线性回归(mlr)、偏最小二乘法(pls)回归和主成分回归法(pcr))、二元决策树(例如,递归分配过程例如cart分类和回归树)、诸如反向传播网络的人工神经网络、判别分析(例如,贝叶斯分类器或fischer分析)、逻辑分类器和支持向量分类器(支持向量机)。附加分类方法是递归分配过程。递归分配过程使用递归分配树来对从未知样本导出的谱进行分类。关于递归分配过程的进一步细节在paulse等人的美国专利申请号2002/0138208a1,“methodforanalyzingmassspectra”中提供。
在一些实施方案中,用于提供本文所述的先兆子痫指数的pe的分类不基于包括以下的组中的至少一个因素:血压、体重增加、水潴留、遗传因子、蛋白尿、头痛、水肿、蛋白质/肌酐比、血小板计数、应激、先前妊娠的pe、未经产、年龄,年龄小于20岁、年龄大于35岁、种族,非洲裔美国人和菲律宾人、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作、家族史、妊娠数、流产数、体重指数(bmi)、妊娠糖尿病、i型糖尿病、肥胖、葡萄糖水平、当前和过去的药物、应激、(受试者或其家庭成员的)妊娠前的pe、慢性高血压、肾病或血栓形成倾向。在一些实施方案中,用于提供本文所述的先兆子痫指数的pe的分类不基于本段中刚刚描述的任何特征。
在一些实例中,用于提供本文所述的先兆子痫指数的pe的分类基于包括以下的组中的至少一个因素:血压、体重增加、水潴留、遗传因子、蛋白尿、头痛、水肿、蛋白质/肌酐比、血小板计数、应激、先前妊娠的pe、未经产、年龄,年龄小于20岁、年龄大于35岁、种族,非洲裔美国人和菲律宾人、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作、家族史、妊娠数、流产数、体重指数(bmi)、妊娠糖尿病、i型糖尿病、肥胖、葡萄糖水平、当前和过去的药物、应激、(受试者或其家庭成员的)妊娠前的pe、慢性高血压、肾病或血栓形成倾向。
数据分析和表型的测定
在某些情况下,仅评估一个标志物的表达(例如多肽水平)以产生标志物水平表征。在一些情况下,评估多个标志物(例如,至少1、2、3、4、5、6、7、10、11、12、13、14、15个或更多个标志物)的表达。因此,在本发明的方法中,评估样品中至少一个标志物的表达。在某些情况下,所进行的评估可以被视为蛋白质组的评估,如该术语在本领域中使用的那样。
以这种方式达到的标志物水平表征在诊断、预后、表征、评估先兆子痫的严重性或确认存在或不存在先兆子痫方面找到许多用途。例如,标志物水平表征可用于预测受试者是否发展先兆子痫,诊断受试者的先兆子痫,表征诊断的先兆子痫或监测受试者对先兆子痫治疗的响应性。在一些情况下,本文公开的先兆子痫标志物的特定组合的测量提供了先兆子痫预后,其相对于使用本领域已知的标准方法(例如vegf-r1(例如sflt-1)和p1gf)进行的先兆子痫预后具有改进的准确度。
在一种情况下,标志物水平表征可以基于相对权重的生物标志物用于诊断、预后、监测、表征或评估先兆子痫的严重性或用于确认受试者中存在或不存在先兆子痫的方法。这样的方法包括:从受试者获得生物样品;对受试者的生物样品分析p1gf、hpx、sflt-1(即vegf-r1)、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的存在和量,使用生物标志物水平提供先兆子痫诊断或预后;其中fn与生物标志物的相对权重为至少1.5、2、2.5、3、3.5、4、4.5或至少5,并且使用生物标志物水平提供先兆子痫诊断或预后;其中加权包括:生成生物标志物谱,并确定生物标志物的单个加权水平;其中谱包括表达log2、loge或log10变换和标准化;其中权重水平包括将谱与权重因子相乘,并且其中权重因子通过包括统计机器学习方法的方法来计算,所述方法可以包括例如以下任一项:主成分分析(pca)、线性回归、支持向量机(svm)和随机森林分析。
在一些情况下,标志物水平表征可用于基于生物标志物的相对权重诊断、预后、监测、表征、评估先兆子痫的严重性或确认受试者中存在或不存在先兆子痫的方法。这样的方法包括:从受试者获得生物样品;对其生物样品分析p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)和adam12的存在和量;使用生物标志物水平提供先兆子痫诊断或预后;其中fn、fg相对于生物标志物的数量的相对水平为至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50个或更多。
本公开提供了用于确认受试者是否没有患有先兆子痫的方法,包括:评估来源于受试者的样品以确定样品中多个生物标志物的水平,使用多个生物标志物的水平计算代表的受试者没有患有先兆子痫的可能性的指数;并且基于指数,确认受试者是否没有患有先兆子痫。在一些情况下,评估不包括比较在第一时间点来源于受试者的样品和在第二时间点来自相同受试者的样品。在一些情况下,评估确实包括比较在第一时间点来源于受试者的样品和在第二时间点来自相同受试者的样品。在一些情况下,该方法进一步包括基于该指数,建议用于先兆子痫的治疗,该治疗涉及阿司匹林、早产或卧床休息。有时,多个生物标志物选自:sflt-1、p1gf、fn和papp-a;sflt-1、p1gf、fn、adam12和papp-a;sflt-1、p1gf、papp-a和fn;sflt-1、p1gf、hpx、fn和papp-a;p1gf、adam12、fn和papp-a;p1gf、fn和papp-a;sflt-1、p1gf和fn;p1gf、fn和papp-a;sflt-1、p1gf、fn和adam12;sflt-1、p1gf和fn;p1gf、sflt-1和fn;sflt-1、fn和adam12;或p1gf、fn和papp-a。在一些情况下,计算还包括确定sflt-1和p1gf的水平的比率。在一些情况下,水平是经调整的、经标准化的或原始水平,或其任何组合。
在一些情况下,使用标志物水平表征是通过将其与表型测定元件例如先兆子痫表型测定元件比较,以鉴定与表型测定元件的相似性或差异,其中然后所鉴定的相似性或差异用于预测受试者是否发展先兆子痫、诊断受试者的先兆子痫、表征诊断的先兆子痫、监测受试者对先兆子痫的治疗的反应性、评估先兆子痫的严重性等。例如,先兆子痫表型测定元件可以是来自患有或没有患有先兆子痫的个体的样品。这样的样品可以用作例如对于给定受试者的标志物表征的实验测定中的参考或对照。作为示例,先兆子痫表型测定元件可以是代表先兆子痫状态的标志物水平表征(例如,标志物谱、特征、评分或指数),并且可以用作参考或对照来解释给定受试者的标志物水平表征。表型测定元件可以是阳性参考或对照。阳性参考或对照可以是来自受试者的样品或标志物水平表征,所述受试者患有先兆子痫,或将发展先兆子痫,或患有可通过已知治疗控制的先兆子痫,或患有已被确定为仅对婴儿分娩有反应的先兆子痫。或者,表型测定元件可以是阴性参考或对照。阴性参考或对照可以是来自未发展先兆子痫的受试者或未怀孕的受试者的样品或标志物水平表征。在一些情况下,标志物表征从与用于产生被监测个体的标志物表征的样品的相同类型的样品获得。在此类情况下,表型测定元件从相同类型的样品获得。例如,如果正在评估个体的血清,则参考或对照优选为血清。
在某些情况下,将获得的标志物水平表征与单个表型测定元件进行比较,以获得关于正在测试先兆子痫的个体的信息。在某些情况下,将所获得的标志物水平表征与多个表型测定元件进行比较。例如,所获得的标志物水平表征可以与阴性参考和阳性参考进行比较,以获得关于个体是否将发展先兆子痫的确认信息。在一些实例中,可将获得的标志物水平表征与代表响应于治疗的先兆子痫的参考以及代表不响应于治疗的先兆子痫的参考进行比较,以便获得关于患者是否对治疗有反应的信息。
获得的标志物水平表征和一个或多个表型测定元件的比较可以使用本领域技术人员已知的任何方便的方法进行。例如,阵列领域的技术人员将知道,可以通过例如比较表达谱的数字图像、通过比较表达数据的数据库等来比较阵列谱。描述比较表达谱的方式的专利包括但不限于美国专利号6,308,170和6,228,575,其公开内容通过引用并入本文。上文也描述了比较标志物水平谱的方法。类似地,elisa领域的技术人员将知道,elisa数据可以通过例如标准化为标准曲线、比较标准化值等进行比较。比较步骤产生关于所获得的标志物水平谱与对照或参考谱相似或不相似的信息,以及采用相似性或不相似性信息来诊断、预后、监测、表征或评估先兆子痫的严重性、或确认存在或不存在先兆子痫以便预测先兆子痫的发病、诊断先兆子痫、监测先兆子痫患者、评估pe的严重性、表征pe、确认存在pe或确认pe不存在。相似性可以基于相对标志物水平、绝对标志物水平或两者的组合。在某些情况下,使用其上存储有程序的计算机进行相似性确定,计算机设计为接收从受试者获得的标志物水平结果(例如来自用户)的输入,确定与一个或多个参考谱的相似性,以及返回例如,对于用户(例如,实验室技术人员、医生、外行人、妊娠女性等)的先兆子痫预后。下面描述本公开的计算机实现的情况的进一步描述。
根据所获得的标志物水平谱与其进行比较的参考或对照谱的类型和性质,上述比较步骤产生关于所测定的细胞或体液的多种不同类型的信息。因此,上述比较步骤可以产生先兆子痫发作的阳性或阴性预测。或者,这样的比较步骤可产生先兆子痫的阳性或阴性诊断。或者,这样的比较步骤可以提供先兆子痫严重性的表征或评估。
在一些情况下,pe标记标志物水平表征可以基于阈值。该方法还可以涉及获得一个或多个生物标志物的水平并将水平与预定阈值(例如标准值)进行比较。这样的阈值可以根据生物标志物的浓度来确定。
在实例中,pe的预测和/或确认的阈值可以根据与对照(例如,妊娠前或在妊娠的较早阶段的相同受试者或在没有患有pe的相同或另一个妊娠期的另一个女性)相比,测试pe或患有pe的受试者中的生物标志物的相对浓度来确定。例如,pe的指示或pe的可能性或pe的严重性可以是fn,浓度可以是相对于对照增加至少100倍、至少500倍、至少1,000倍、至少2,000倍、至少3,000倍、至少4,000倍、至少5,000倍、至少10,000倍、至少12,000倍、至少15,000倍、至少20,000倍、至少30,000倍、至少40,000倍、至少50,000倍、至少100,000倍或至少20,000倍;和/或vegf浓度相对于对照增加至少2倍、至少4倍、至少、至少8倍、至少10倍、至少15倍、至少20倍、至少30倍、至少40倍或至少50倍的因子;和/或浓度降低至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍、至少110倍、至少120、至少130、至少140或至少150倍;和/或fms样酪氨酸激酶1(sflt1)浓度增加至少5倍、至少10倍、至少20倍、至少30倍、至少40倍、至少40倍、至少50倍、至少60倍、至少70倍或至少80倍;和/或胎盘生长因子(p1gf)浓度降低至少100倍、至少200倍、至少300倍、至少400倍、至少500倍、至少600倍、至少700倍、至少800倍、至少900倍,至少1000倍、至少1100倍、至少1200倍、至少1300倍、至少1400倍或至少1500倍;和/或adam金属蛋白酶结构域12(adam12)浓度增加至少2倍、至少5倍、至少10倍、至少15倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍或至少100倍。
在某些情况下,当诊断、预后、监测、表征或评估先兆子痫的严重性时,或当确认受试者中存在或不存在pe时,不考虑除了生物标志物水平之外的物理特征。在一些情况下,当确认、诊断、预后、表征或评估受试者中pe的严重性时,不考虑以下中的至少一种:妊娠期、血压、体重增加、水潴留、遗传因子、蛋白尿、头痛、水肿、蛋白质/肌酐比、血小板计数、应激、(受试者或其家庭成员的)先前妊娠的pe、未经产、年龄,年龄小于20岁、年龄大于35岁、种族,非洲裔美国人和菲律宾人、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作、家族史、妊娠数、流产数、体重指数(bmi)、妊娠糖尿病、i型糖尿病、肥胖、葡萄糖水平、当前和过去的药物、慢性高血压、肾病或血栓形成倾向。
在一些情况下,当确认、诊断、预后、表征或评估受试者中pe的严重性时,考虑以下中的至少一种:妊娠期、血压、体重增加、水潴留、遗传因子、蛋白尿、头痛、水肿、蛋白质/肌酐比、血小板计数、应激、(受试者或其家庭成员的)先前妊娠的pe、未经产、年龄,年龄小于20岁、年龄大于35岁、种族,非洲裔美国人和菲律宾人、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作、家族史、妊娠数、流产数、体重指数(bmi)、妊娠糖尿病、i型糖尿病、肥胖、葡萄糖水平、当前和过去的药物、慢性高血压、肾病或血栓形成倾向。
在一些情况下,在确认、诊断、预后、监测、表征或评估先兆子痫的严重性时考虑妊娠期。在一些情况下,妊娠期可分为早期和晚期妊娠期。在一些情况下,除了患者的妊娠期之外,可以考虑包括受试者的血压、家族史和尿蛋白指数的其他元素。
在一些情况下,可结合上述标志物水平表征使用其他分析以提供个体的先兆子痫预后。这样的分析是本领域众所周知的,并考虑例如血压、体重增加、水潴留、遗传因素、蛋白尿、头痛、水肿、蛋白质/肌酐比、血小板计数、应激、(受试者或其家庭成员的)先前妊娠的pe、未经产、年龄,年龄小于20岁、年龄大于35岁、种族,非洲裔美国人和菲律宾人、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作、家族史、妊娠数、流产数、体重指数(bmi)、妊娠糖尿病、i型糖尿病、肥胖、葡萄糖水平、当前和过去的药物、慢性高血压、肾病或血栓形成倾向以及妊娠的其他特征。
用于测量来自受试者生物样品的生物标志物的pe的测试可以提供每个生物标志物小组分析的预测性能,如通过roc曲线分析评价的(zweig等人,receiver-operatingcharacteristic(roc)plots:afundamentalevaluationtoolinclinicalmedicine.clinicalchemistry1993;39:561-77;sing等人rocr:visualizingclassifierperformanceinr.bioinformatics2005;21:3940-1)。在某些情况下,pe特征、评分或指数可具有至少0.8、0.85、0.9、0.95、0.96、0.97、0.980、0.985、0.988、0.990、0.995、0.998或更大的累积roc值。在某些情况下,pe特征、评分或指数可具有至多0.9、0.95、0.96、0.97、0.980、0.985、0.988、0.990、0.995、0.998或更小的累积roc值。或者或另外,pe阈值、特征、评分或指数可以具有至少60%、65%、70%、75%、80%、85%、90%、91%、92%93%、94%、95%、96%、97%、98%或99%的灵敏度;和/或至少60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%98%或99%的特异性。或者或另外,pe阈值、特征、评分或指数可以具有至多60%、65%、70%、75%、80%、85%、90%、91%、92%、93%94%、95%、96%、97%、98%或99%的灵敏度;和/或至多60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%98%或99%的特异性。这样的pe特征、评分或指数可以用于预后、诊断、监测、表征或评估pe的严重性、确认pe的不存在、或确认pe的存在、早期pe或晚期pe。这样的pe特征、评分或指数优选包含高达12、11、10、9、8、7、6、5、4、3、2或1个生物标志物。roc值可适用于生物标志物特征、评分、阈值或指数。
在一些情况下,可以通过提供例如生成书面报告来提供预测、诊断、预后、监测、表征、评估pe的严重性或确认存在或不存在pe,所述书面报告包括包括技术人员的监测评价,例如技术人员对先兆子痫发生的预测(“先兆子痫预测”)、技术人员对先兆子痫的诊断(“先兆子痫诊断”)、技术人员对存在先兆子痫的确认(“先兆子痫阳性确认”)、技术人员对不存在先兆子痫的确认(“先兆子痫阴性确认”)、技术人员对受试者先兆子痫的监测(“先兆子痫监测”)、技术人员对受试者先兆子痫的表征(“先兆子痫表征”)或技术人员测定受试者先兆子痫的严重性(“评估先兆子痫的严重性”)。因此,本发明的方法还可以包括生成或输出提供评估结果的报告的步骤,所述报告可以以电子介质(例如,计算机监视器上的电子显示或可传送的电子文件)的形式,或者以有形介质(例如,打印在纸或其他有形介质上的报告)的形式提供。
计算机系统和软件
这些分析方法可以由本领域普通技术人员通过采用基于计算机的系统容易地执行,例如使用本领域已知的任何硬件、软件和数据存储介质,并且采用任何方便的用于这样的分析的算法。例如,数据挖掘算法可以通过“云计算”、基于智能手机或基于客户端-服务器的平台等来应用。
本公开考虑使用计算机系统、计算机可读介质或软件,具有输入模块,其用于收集关于多个生物标志物的水平的输入;处理器,其用于执行用于执行生物标志物水平的log2、loge或log10变换的算法,从而获得对数变换水平;处理器,其用于执行用于将每个对数变换水平标准化为标准化水平的算法;处理器,其用于执行用于将每个标准化水平调整为加权标准化水平的算法;处理器,其用于对每个经调整的水平进行总计和任选地平均的算法;处理器,其用于基于总量提供pe评分的算法,以及处理器,其用于任选地执行用于基于先兆子痫评分提供pe指数的算法。计算机优选地生成可以提供给护理者和/或受试者女性(例如,妊娠女性)的报告。该报告中可以不包括以下任何内容、包括以下任意内容或包括所有内容:患者或受试者的姓名、测试时的妊娠期、所分析的标志物列表、样品中测量的每个标志物的水平、生物标志物水平直接与训练集中的那些进行比较、与训练集中的对数转换和标准化水平比较的生物标志物的对数转换和标准化水平、生物标志物的对数转换、标准化和加权数、pe评分、pe指数和推荐用于受试者的作用过程。
在一些情况下,本公开包括用于诊断、预后、监测、表征或评估先兆子痫的严重性、确认女性受试者中pe的存在或不存在的系统,包括:(a)输入模块,其用于接收作为一个或多个生物标志物,例如sflt-1,plgf和至少两个其他不同生物标志物的输入水平,(b)处理器,其任选地被配置为执行算法,例如(i)水平的log2、loge或log10变换以获得对数变换水平,(ii)将每个对数变换水平标准化为标准化水平,(iii)将每个标准化水平调整为加权标准化水平,(iv)合计每个经调整的水平,(v)平均每个经调整的水平;和(c)输出模块,其用于基于评分输出先兆子痫指数,其中指数评分包括sflt-1/plgf病加上另外两个其他不同的生物标志物。在一些情况下,处理器可以执行将一个或多个生物标志物的水平相对于训练集或对照值进行调整的算法,从而提供一个或多个经调整的生物标志物水平。处理器还可以执行使用经调整的生物标志物水平应用至少一个二元运算,加上或减去一个或多个经调整的生物标志物水平,计算两个经调整的生物标志物水平之间的比率和/或通过将一个或多个变量乘以一个或多个对应的权重因子操作一个或多个经调整的生物标志物,其中将一个或多个经调整的生物标志物水平中的每一个的水平输入到具体变量中,其中对应的权重因子对于每个具体变量是独特的,其中至少对应的权重因子之一不是一。在一些情况下,算法是实函数。
在一些情况下,本公开包括含有指令的计算机可读介质,当由计算机系统执行时,指令使得计算机系统接收关于来源于受试者的生物样品中pe生物标志物的水平的第一数据集,并对这些水平进行分析以获得受试者中pe的评估。在一些情况下,当由计算机系统执行时,指令可以使计算机系统第二次执行那些步骤(例如,接收关于pe生物标志物的水平的第二数据集,并且执行第二分析以获得第二评估)。在一些情况下,可以在不同的时间点执行那些步骤。在一些情况下,指令使计算机系统将第一评估与第二评估进行比较,并基于比较来确认pe或缺乏pe。
报告
报告可以包括关于测试设施的信息,所述信息与进行样本收集和/或数据生成的医院、诊所或实验室相关。样品收集可以包括从受试者获得流体样品,例如血液、唾液、尿液等;组织样品,例如组织活检等。数据生成可以包括测量在先兆子痫患者与健康个体(例如,没有患有和/或不发展先兆子痫的个体)中差异表达或以不同水平存在的一个或多个基因的多肽浓度水平。该信息可以包括与例如测试设施的名称和位置、进行测定和/或输入输入数据的实验室技术人员的身份、进行测定和/或分析的日期和时间、样品和/或结果数据存储的位置、或测定中使用的试剂(例如试剂盒等)的批号有关的一个或多个细节。具有此信息的报告字段可以使用用户提供的信息填充。
报告可以包括关于服务提供商的信息,服务提供商可以位于用户所在的保健设施之外,或者保健设施内。这样的信息的示例可以包括服务提供商的名称和位置、审阅者的名称,以及在必要或期望时进行样本收集和/或数据生成的个人的名称。具有此信息的报告字段可以使用用户输入的数据来填充,其可以从预编写的选择中选择(例如,使用下拉菜单)。报告中的其他服务提供商信息可以包括关于结果和/或关于解释报告的技术信息的联系信息。
报告可以包括患者数据部分。患者数据部分可以包括由以下组成的列表中的一个或多个项目:患者病史和症状(其可以包括例如,妊娠期、血压、蛋白尿、糖尿病、葡萄糖水平、体重指数、年龄、种族、血清型、巴氏测试结果(pap涂片)、先前先兆子痫发作、家族史、妊娠数、流产数、体重增加、水潴留、遗传因子、头痛、水肿、蛋白质/肌酐比、当前和过去的药物、应激、(受试者或其家庭成员的)先前妊娠的pe、未经产、慢性高血压、肾病或血栓形成倾向和妊娠的任何其他特征)、管理患者数据,例如识别患者的信息(例如,姓名、患者日期出生(dob)、性别、邮寄和/或居住地址、医疗记录号(mrn)、医疗设施中的房间和/或床号、保险信息等)、订购监测评估的患者的医生或其他健康专业人员的姓名,以及(其与订购医师不同)负责患者护理的职员医师(例如,初级保健医师)的姓名。
报告可以包括样品数据部分,其可以提供关于在监测评估中分析的生物样品的信息,例如来源于患者的生物样品的来源(例如,血液、唾液或组织类型等)、如何处理样品(例如,储存温度、预备操作方案)或收集的日期和时间。通常可以使用由用户输入的数据来填充具有该信息的报告字段,其中一些可以作为预编写的选择来提供(例如,使用下拉菜单)。
报告可以包括评估报告部分,其可以包括在如本文所述的数据加工之后生成的信息。解释性报告可以包括对受试者发展pe的可能性的预测、pe的诊断、受试者患有有pe的确认、受试者没有患有pe的确认、受试者的pe的监测(例如,生物标志物的水平保持稳定或改变)、pe的特征、pe的严重性水平或其任何组合。如果生物标志物水平改变,报告可以包括这种改变的程度,以及改变在pe发生、预测或严重性方面的意义。解释性报告可以包括例如蛋白质水平确定测定的结果(例如,“血清中1.5nmol/升adam12”);以及该生物标志物水平的解释,例如预测、诊断、监测、表征、评估pe的严重性或确认pe的存在或不存在。在一些示例中,报告的评估部分包括建议。例如,如果结果表明先兆子痫是可能的,建议包括建议改变饮食、施用血压药、建议卧床休息、建议早产、施用糖尿病药物等,如在本领域中所建议的那样。
报告可以包括诊断、预后、特征、监测、pe的严重性或pe的存在或不存在的确认中的至少一个;基于对来自怀孕受试者的生物样品中检测到的一个或多个生物标志物的分析的生物标志物指数值。报告可以包括每个生物标志物小组分析的预测性能。在一些情况下,通过roc曲线分析评估预测性能。
还容易理解的是,报告可以包括附加元素或经修饰的元素。例如,在电子报告的情况下,报告可以含有指向内部或外部数据库的超链接,其提供关于报告的所选元素的更详细信息。例如,报告的患者数据元素可以包括到电子患者记录的超链接或用于访问这样的患者记录的站点,该患者记录被保存在机密数据库中。在一些情况下,包括超链接可能在医院内系统或临床环境中感兴趣。在一些情况下,包含超链接可能在家庭或工作环境中感兴趣。当以电子格式时,报告被记录在合适的物理介质上,诸如计算机可读介质,例如在计算机存储器、zip驱动器、软盘、usb芯片、cd、dvd或能够存储可检索的磁或电子信息的任何其他存储介质。
容易理解的是,报告可以包括上述元素中的全部或一些,条件是报告通常至少包括足以提供用户请求的分析(例如预测、诊断、监测、表征、评估先兆子痫的严重性、或确认存在或不存在先兆子痫)的元素。
本公开还提供了商业方法,其包括确定受试者中先兆子痫的存在、不存在、预测、严重性、特征或确认受试者中存在或不存在先兆子痫的步骤。该方法包括以下步骤:评估来源于受试者的样品中sflt-1、plgf和多个生物标志物的水平,其中多个生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素,确定生物标志物指数值,该指数包括sflt-1/plgf和加上多个生物标志物,使用生物标志物指数以提供先兆子痫确定、确认、不存在、诊断、预后、严重性或特征,以及提供报告以换取费用,其中该报告基于生物标志物的分析指示指数值,以及指示的范围说明受试者是否处于pe的低风险、先兆子痫的高风险或正经历先兆子痫。在一些情况下,该商业方法还包括传送报告。在一些情况下,该报告含有关于受试者的信息,包括血压、年龄、体重、孕龄、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史、蛋白尿、体重指数、肿胀、腹压、子宫搏动指数、血小板减少、以前的先兆子痫史、以前的子痫史、首次分娩、多胎、循环游离dna、循环胎儿dna、游离dna、胎儿dna、吸烟史或相关并发因子的家族史。在一些情况下,多种生物标志物不包括内皮联蛋白、血纤肽a、抗凝血酶iii、igfals、flt4、igfbp-5、tgf-b1、血纤肽a:d-二聚体、纤胶凝蛋白-2、纤胶凝蛋白-3、肌酐、簇集素、h2松弛素、p1gf-2、p1gf-3和人绒毛膜促性腺激素。在某些情况下,该报告是电子的。在一些情况下,该指数不受以下中至少一个的影响:血压、年龄、体重、孕龄、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史和家族史。在一些情况下,该指数不受以下中所有的影响:血压、体重、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史和家族史。在某些情况下,该指数不受年龄影响。有时,该指数不受胎龄影响。
在一些情况下,本公开进一步提供了商业方法,其包括确定受试者中先兆子痫的存在、不存在、预测、严重性或特征或确认受试者中先兆子痫的不存在或存在的步骤。该方法可以包括以下步骤:(a)评估来源于受试者的样品中sflt-1、plgf和至少两个其他不同生物标志物的水平,其中至少两个其他生物标志物不是铁蛋白(ft)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、触珠蛋白(hp)、α-2-巨球蛋白(a2m)、载脂蛋白e(apoe)、载脂蛋白c-iii(apo-c3)、载脂蛋白a-1(apoa1)、视黄醇结合蛋白4(rbp4)、血红蛋白(hb)、血纤蛋白原α(fga)、皮卡丘素(egflam)、游离人绒毛膜促性腺激素(游离βhcg)或血红素,(b)确定生物标志物指数值,该指数包含sflt/plgf和加上至少两个其他不同生物标志物,(c)使用生物标志物指数来提供先兆子痫测定、确认、不存在、诊断、预后、严重性或特征,和(d)提供报告以换取费用,其中该报告基于生物标志物的分析指示指数值,以及以下中的至少一个:说明受试者是否处于先兆子痫的低风险,说明受试者是否处于先兆子痫的高风险,说明受试者是否患有先兆子痫,说明受试者是否没有患有先兆子痫,表征先兆子痫,和指示先兆子痫的严重性。
试剂、系统和试剂盒
还提供了用于实施一个或多个上述方法的试剂、系统和试剂盒。本发明的试剂、系统和试剂盒可以变化很大。变化可以包括孵育时间和温度的改变。目的试剂包括特别设计用于从样品(例如一个或多个检测元件)产生先兆子痫标志物的上述标志物水平表征的试剂。检测元件可以是用于检测蛋白质、蛋白质片段的抗体或肽。检测元件可以是用于检测核酸的寡核苷酸。在一些情况下,检测元件包括检测单个先兆子痫标志物的表达的试剂,例如,检测元件可以是包括一个或多个检测元件(例如一个或多个更多抗体、一个或多个寡核苷酸、一组或多组pcr引物、一组或多组等温多核苷酸扩增引物等)的试纸条、板、阵列或混合物,其可用于同时检测至少两个先兆子痫标志物的表达。
在一种情况下,提供了用于检测受试者中先兆子痫的存在、不存在、预测、严重性或特征的试剂盒。这样的试剂盒包括用于测量选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的多个生物标志物的多个检测元件(分析物)。在其他情况下,使用至少2、3、4、5、6、7、8、9、10、11、12、13或14种(或更多种)不同的试剂来测量至少2、3、4、5、6、7、8、9、10、11、12、13或14个(或更多个)不同生物标志物。当提及生物标志物(例如p1gf)时,除非明确说明,否则应当理解,已知或待发现的生物标志物(例如p1gf)的所有同种型均指该生物标志物术语,例如p1gf(例如hpa18788.6[152aa]、hpa18788.1[1017aa]、hpa18788.2[1009aa]、hpa18788.3[775aa]、hpa18788.4[403aa]、hpa18788.5[375aa]或hpa18788.9[463aa])。(本文使用的p1gf等同于plgf或plgf)。当提及血色素结合蛋白(hpx)时,应当理解血红素结合和血红素未结合形式的血色素结合蛋白均指该生物标志物术语。
在一个实施方案中,特别适合于产生标志物水平表征(例如先兆子痫标志物)的一类试剂是特异性结合该蛋白质标志物的抗体的集合。在一些实例中,这样的抗体可以用于elisa(例如竞争性或夹心elisa形式)。可以采用的其他分析方法学包括xmaptm微球形式、蛋白质组阵列、用于通过流式细胞术分析的悬浮液、蛋白质印迹、斑点印迹或免疫组织化学。使用它们的方法在本领域中是众所周知的。这些抗体可以在溶液中提供。或者,它们可以预先结合到固体基质上,例如多孔皿的孔或xmap微球的表面。
在一些实施方案中,可以使用其中代表目的基因的探针核酸阵列作为试剂。本领域中已知多种不同的阵列形式,具有各种不同的探针结构、底物组合物和附着技术(例如点印迹阵列、微阵列等)。目的代表性阵列结构包括在美国专利号5,143,854;5,288,644;5,324,633;5,432,049;5,470,710;5,492,806;5,503,980;5,510,270;5,525,464;5,547,839;5,580,732;5,661,028;5,800,992;其公开内容通过引用并入本文;以及wo95/21265;wo96/31622;wo97/10365;wo97/27317;ep373203;和ep785280中所述的那些。
一种特别适合于产生基因的标志物水平表征(例如,先兆子痫基因)的试剂是设计用于选择性扩增此类基因的基因特异性引物的集合(例如,使用基于pcr的技术,例如实时rt-pcr或等温扩增技术,例如环介导的dna等温扩增(lamp)、链置换扩增(sda)、基于序列的扩增(nasba)、自我维持序列复制(3sr)等)。基因特异性引物及其使用方法描述于美国专利5,994,076中,其公开内容通过引用并入本文。
在一些情况下,试剂盒可以包括选择性杂交编码所选生物标志物的多核苷酸序列的多核苷酸引物。在某些情况下,引物选择性杂交编码选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的蛋白质的至少两个多核苷酸序列。这样的引物可以是dna或rna引物。
感兴趣的还有包括特异性针对至少一个基因或蛋白质的探针、引物或抗体(也称为试剂)的探针、引物集合或抗体集合的阵列,基因或蛋白质选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12。在一些情况下,可以选择这些基因中的多个,例如至少2、3、4、8个或更多个。
在某些情况下,探针、引物或抗体的集合包括对p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12中的一个或多个具有特异性的试剂。本发明的探针、引物或抗体集合或试剂可以包括仅对上文列出的基因、蛋白质或辅因子特异的试剂,或者它们可以包括对上文未列出的其他基因、蛋白质或辅因子特异的试剂,例如对于基因、蛋白质或辅因子特异的探针、引物或抗体,其表达模式在本领域已知与先兆子痫相关,例如sflt-1(vegf-r1)和p1gf。
本公开的系统和试剂盒可以包括上述阵列、基因特异性引物集合或蛋白质特异性抗体集合。在蛋白质特异性抗体试剂盒的情况下,系统和试剂盒可以进一步包括一个或多个另外的试剂,例如牛血清白蛋白(bsa)、酪蛋白、奶粉溶液、牛γ-球蛋白(bgg)在磷酸盐缓冲盐水(pbs)/吐温或pbs/triton-x100、pbs/tween、pbs/triton-x100或硼酸盐缓冲剂中;选择的固体表面,优选显示蛋白质亲和力的表面,例如聚苯乙烯微量滴定板的孔;第二抗体将具有相关酶,例如脲酶、过氧化物酶或碱性磷酸酶,以及合适的显色底物。例如,可以使用脲酶或过氧化物酶缀合的抗人igg,含有pbs的溶液如pbs/吐温),显色底物例如尿素和溴甲酚紫(在脲酶标记的情况下)或2,2'-连氮基-二-(3-乙基-苯并噻唑啉)-6-磺酸(abts)和h2o2(在过氧化物酶标记的情况下)。然后通过测量颜色产生的程度来实现定量,例如使用可见光谱分光光度计。
系统和试剂盒可以进一步包括在各种方法中使用的一个或多个另外的试剂,例如用于产生靶核酸、dntp和/或rntp的引物,其可以是预先混合或分开的、一个或多个独特标记的dntp和/或rntp,例如生物素化或cy3或cy5标记的dntp、具有不同散射光谱的金或银颗粒、或其他合成后标记试剂,例如荧光染料的化学活性衍生物、酶,例如逆转录酶、dna聚合酶、rna聚合酶等,各种缓冲介质,例如,杂交和洗涤缓冲剂,预制探针阵列,标记的探针纯化试剂和组分,例如离心柱等,信号产生和检测试剂,例如标记的二抗,链霉抗生物素蛋白-碱性磷酸酶缀合物,化学荧光或化学发光底物等。
本发明的系统和试剂盒还可以包括先兆子痫表型测定元件,该元件在许多情况下是参考或对照样品或标志物表征,其可以例如通过合适的实验或计算手段使用以实现基于“输入”标志物水平谱的先兆子痫预后,例如,已经用上述标志物测定元件确定的。代表性的先兆子痫表型测定元件包括来自已知患有或没有患有先兆子痫的个体的样品、标志物水平表征的数据库,例如参考或对照谱等,如上所述。
除了上述组分之外,本发明的试剂盒还将包括用于实施本发明方法的说明书。这些说明书可以以各种形式存在于本发明试剂盒中,其中一个或多个可存在于试剂盒中。可以存在这些说明的一种形式是作为在合适的介质或基材上的打印信息,例如在其上印刷信息的一片或多片纸,在试剂盒的包装中,在包装插页等中。手段将是其上已记录了信息的计算机可读介质,例如软盘、软盘、usb设备、cd等。一些手段可以是可以经由因特网(即,经由云)使用以访问移除的站点处的信息的网站地址。任何方便的手段可以存在于试剂盒中。
在某些情况下,本公开提供了用于确定受试者中pe的存在、不存在、预测、严重性、监测或特征的商业方法。这样的方法包括:对受试者的生物样品进行分析,以确定选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的一个或多个生物标志物的存在和量;确定生物标志物的权重、特征、评分或指数值;使用生物标志物权重、特征、评分或指数值来提供pe的诊断、预后、严重性、确认存在、确认不存在或特征,以及提供报告以换取费用。
在其他情况下,本公开提供了用于确定受试者中确定存在、确定不存在、确定预测、监测、确定严重性、确认存在、确认不存在或表征pe的商业方法。这样的方法包括:对受试者的生物样品进行分析,以确定选自p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12的一个或多个生物标志物的存在和量。在某些情况下,探针、引物或抗体的集合包括对p1gf、hpx、sflt-1、papp-a、vegf(不包括vegf-r1)、fn、fg和adam12具有特异性的试剂;确定生物标志物的权重、特征、评分或指数值;使用生物标志物权重、特征、评分或指数值来提供pe的诊断、预后、特征、确认存在、确认不存在或确定pe的严重性,并提供报告以换取费用。
在某些情况下,指数值基于生物标志物的分析。在一些实例中,提供范围或阈值的指示以说明受试者是处于pe的低风险、pe的高风险还是正经历pe。在其他情况下,指数值基于生物标志物的分析以及说明受试者是否患有轻度pe、中度pe或重度pe的范围的指示。在一些情况下,提供确认的可靠性或确定性的指示(女性受试者是否患有pe)。
本文公开的任何方法、试剂盒、组合物、商业方法、计算机系统可以与样品一起使用,其中样品是血清样品。在一些情况下,样品来源于血液、血浆、血清、尿液、细胞或体液。在一些情况下,样品来源于母亲或胎儿。在一些情况下,样品是阴道拭子。在一些情况下,样品不是尿液样品。在一些情况下,生物标志物是肽。在一些情况下,样品中的生物标志物是肽、肽的一部分、肽的片段、含有抗原的肽、肽的一部分(其中肽的一部分含有抗原)、肽的片段(其中肽的片段含有抗原)。在一些情况下,评估包括测量至少一种rna分子的水平。在一些情况下,评估包括进行至少一个测序反应。在一些情况下,该指数不受血压、年龄、体重、胎龄、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史或家族史的影响。在一些情况下,评估不包括比较在第一时间点来源于受试者的样品和在第二时间点来源于相同受试者的样品。在一些情况下,评估包括比较在第一时间点来源于受试者的样品和在第二时间点来源于相同受试者的样品。在一些情况下,评估步骤包括测定选自sflt-1、p1gf、vegf(不包括vegf-r1)、adam12、hpx、papp-a和fn的生物标志物的水平。在一些情况下,多个生物标志物不包括内皮联蛋白、血纤肽a、抗凝血酶iii、igfals、flt4、igfbp-5、tgf-b1、血纤肽a:d-二聚体、纤胶凝蛋白-2、纤胶凝蛋白-3、肌酐、簇集素、h2松弛素、p1gf-2、p1gf-3和人绒毛膜促性腺激素。在一些情况下,使用识别选自sflt-1、p1gf、vegf(不包括vegf-r1)、adam12、hpx、papp-a和fn的生物标志的至少一种抗体进行测量。在一些情况下,该方法不包括预测在先兆子痫无症状的受试者中的先兆子痫。在一些情况下,评估不包括多普勒筛查。在一些情况下,该方法不包括检测样品中微泡或外来体的存在。在一些情况下,该方法准确度大于85%。在一些情况下,该方法灵敏度大于85%。在一些情况下,该方法特异性大于85%。在一些情况下,该方法准确度大于85%。在一些情况下,该方法具有大于85%的阳性预测值。在一些情况下,该方法具有大于85%的阴性预测值。在一些情况下,生物标志物与血压、年龄、体重、妊娠期、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史、蛋白尿、体重指数、肿胀、腹压、子宫搏动指数、血小板减少、以前的先兆子痫史、以前的子痫史、受试者的先前的分娩次数、循环游离dna、循环的胎儿dna、游离dna、胎儿dna、吸烟史或相关并发因子的家族史相关。在一些情况下,生物标志物与血压、年龄、体重、妊娠期、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史、蛋白尿、体重指数、肿胀、腹压、子宫搏动指数、血小板减少、以前的先兆子痫史、以前的子痫史、受试者的先前的分娩次数、循环游离dna、循环的胎儿dna、游离dna、胎儿dna、吸烟史或相关并发因子的家族史不相关。
本公开还提供了不包括先兆子痫诊断的测试,其中所述测试从来源于受试者的样品测量一个或多个生物标志物,并且具有至少0.8、0.85、0.9、0.95、0.980、0.981、0.982、0.983、0.984、0.985、0.986、0.987、0.989、0.990、0.991、0.992、0.993、0.994、0.995、0.996、0.997、0.998、0.999或更大的总体roc值。在一些情况下,测定至少2、3、4、5、6、7、8、9、10、11、12、13或14个生物标志物。在一些情况下,测定至多2、3、4、5、6、7、8、9、10、11、12、13或14个生物标志物。在一些情况下,总体roc值不受血压、年龄、体重、妊娠期、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史或家族史的影响。在一些情况下,样品是血清样品。在一些情况下,样品来源于血液、血浆、血清、尿液、细胞或体液。在一些情况下,样品来源于母亲或胎儿。在一些情况下,样品是阴道拭子。在一些情况下,样品不是尿液样品。在一些情况下,生物标志物是肽。在一些情况下,样品中的生物标志物是肽、肽的一部分、肽的片段、含有抗原的肽、肽的一部分(其中肽的一部分含有抗原)、肽的片段(其中肽的片段含有抗原)。在一些情况下,测试的结果不受血压、年龄、体重、妊娠期、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史或家族史的影响。在一些情况下,测试不包括比较在第一时间点来源于受试者的样品和在第二时间点来源于同一受试者的样品。在一些情况下,测试由比较来源于第一时间点的受试者的样品和来源于第二时间点的相同受试者的样品组成。在一些情况下,测试包括测定选自sflt-1、p1gf、vegf(不包括vegf-r1)、adam12、hpx、papp-a和fn的生物标志物的水平。在一些情况下,生物标志物不包括内皮联蛋白、血纤肽a、抗凝血酶iii、igfals、flt4、igfbp-5、tgf-b1、血纤肽a:d-二聚体、纤胶凝蛋白-2、纤胶凝蛋白-3、肌酐、簇集素、h2松弛素、p1gf-2、p1gf-3和人绒毛膜促性腺激素。在一些情况下,使用识别选自sflt-1、p1gf、vegf(不包括vegf-r1)、adam12、hpx、papp-a和fn的生物标志的至少一种抗体进行测试。在一些情况下,测试不包括在无症状的受试者中预测先兆子痫。在一些情况下,测试不包括多普勒筛查。在一些情况下,测试不包括检测样品中微泡或外来体的存在。在一些情况下,测试为至少85、90、95%或更高的准确度。在一些情况下,测试为至少85、90、95%或更高的灵敏度。在一些情况下,测试为至少85、90、95%或更高的特异性。在一些情况下,测试具有至少85、90、95%的阳性预测值。在一些情况下,测试具有至少85、90、95%或更多的阴性预测值。在一些情况下,生物标志物与血压、年龄、体重、妊娠期、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史、蛋白尿、体重指数、肿胀、腹压、子宫搏动指数、血小板减少、以前的先兆子痫史、以前的子痫史、受试者的先前的分娩次数、循环游离dna、循环的胎儿dna、游离dna、胎儿dna、吸烟史或相关并发因子的家族史相关。在一些情况下,生物标志物与血压、年龄、体重、妊娠期、民族性、糖尿病、肾病、自身免疫疾病、孕产妇史、蛋白尿、体重指数、肿胀、腹压、子宫搏动指数、血小板减少、以前的先兆子痫史、以前的子痫史、受试者的先前的分娩次数、循环游离dna、循环的胎儿dna、游离dna、胎儿dna、吸烟史或相关并发因子的家族史不相关。在一些情况下,测试包括进行生物测定、功能测定、elisa、免疫测定、质谱、色谱、比浊法、辐射状免疫扩散或单向辐射状免疫扩散。在一些情况下,测试包括消化和测量生物标志物。在一些情况下,测试包括衍生化和测量生物标志物。在一些情况下,测试包括从样品中的至少一个细胞分离肽。在一些情况下,测试还包括检测多态性或对生物标志物的修饰。在一些情况下,测试还包括检测rna和/或dna。在一些情况下,测试还包括检测与生物标志物相关的rna和/或dna。在一些情况下,测试还包括检测转录因子和/或转录因子辅因子。在一些情况下,测试还包括检测与生物标志物相关的转录因子和/或转录因子辅因子。在一些情况下,测试还包括使用算法、阈值、随时间的方向变化、将指数与单个患者进行比较、将指数与对照组比较或将指数与参考标准进行比较。在一些情况下,该测试用于确认受试者中先兆子痫的存在,其中受试者具有至少一种与先兆子痫相关的症状。在一些情况下,该测试用于在受试者中提供先兆子痫的诊断,其中受试者患有高血压和蛋白尿。在一些情况下,该测试用于在受试者中提供先兆子痫的诊断,其中受试者患有高血压。
在一些情况下,该测试用于在受试者中提供先兆子痫的诊断,其中受试者具有与先兆子痫相关的一个危险因素。在一些情况下,该测试用于确定受试者是否处于先兆子痫的风险中。在一些情况下,该测试用于量化受试者发展先兆子痫的风险。在一些情况下,该测试用于预测受试者发展先兆子痫的时间。在一些情况下,该测试用于预测先兆子痫的孕产妇和/或胎儿结果。在一些情况下,该测试用于区分轻度、中度和重度先兆子痫。在一些情况下,该测试用于确定是否hellp综合征、早产、宫内生长限制、胎盘早剥、胎盘累积、胎儿出生体重低、胎龄低、妊娠高血压、慢性高血压、妊娠糖尿病、i型糖尿病、ii型糖尿病或自发流产的风险是否是受试者患有先兆子痫的结果。在一些情况下,测试还包括在非电子报告上创建电子报告。
在一些实施方案中,本公开包括排除先兆子痫诊断的测试,其中所述测试从取自受试者的样品测量一个或多个生物标志物,并且具有至少0.8的总体roc值。在一些实施例中,该测试具有至少为0.8、0.85、0.9、0.95、0.980、0.9、0.982、0.983、0.984、0.985、0.986、0.987、0.989、0.990、0.991、0.992、0.993、0.994、0.995、0.996、0.997、0.998、0.999或更大的总体roc值。
本公开进一步提供了用于确认pe的存在、确认pe不存在、诊断、预后、监测、表征或确定受试者中先兆子痫的严重性的试剂盒,所述试剂盒包含用于测定来源于受试者的样品中纤连蛋白的水平的至少两种特异性试剂。在一些情况下,至少两种试剂包含选择性结合纤连蛋白的两种不同抗体。在一些情况下,试剂盒还包含特异性用于测定样品中sflt-1和plgf水平的试剂。在一些情况下,样品是血清样品。在一些情况下,样品是血液样品。在一些情况下,样品不是尿液样品。在一些情况下,试剂盒不包括检测igfals、flt4、p1gf、p1gf-2、p1gf-3或sflt-1的试剂。
本公开还提供了用于诊断、预后、监测、表征、确定先兆子痫的严重性或确认受试者中存在或不存在先兆子痫的试剂盒,所述试剂盒包含特异性用于测定papp-a水平的第一试剂和特异性用于测定adam12的第二试剂。在一些情况下,试剂盒不包括检测igfals、flt4、p1gf、p1gf-2、p1gf-3或sflt-1的试剂。在一些情况下,试剂盒不能用于预后、诊断、筛选、确定或确认唐氏综合征。在一些情况下,试剂盒不能用于预后、诊断、筛查、确定或确认心血管疾病。在一些情况下,生物标志物不是p1gf-2或p1gf-3。
通常,本公开进一步提供用于确认pe的存在、确认pe不存在、诊断、预后、监测、表征或确定受试者中pe的严重性的试剂盒,所述试剂盒包含特异性用于测定来自孕妇的样品中纤连蛋白的水平的至少两种试剂。
在一些情况下,评估包括进行生物测定、功能测定、elisa、免疫测定、质谱、色谱、比浊法、辐射状免疫扩散或单向辐射状免疫扩散。在一些情况下,评估包括消化和测量生物标志物。在一些情况下,评估包括衍生化和测量生物标志物。在一些情况下,评估包括从样品中的至少一个细胞分离肽。在一些情况下,方法还包括检测多态性或对生物标志物的修饰。在一些情况下,方法还包括检测rna和/或dna。在一些情况下,方法还包括检测与生物标志物相关的rna和/或dna。在一些情况下,方法还包括检测转录因子和/或转录因子辅因子。在一些情况下,方法还包括检测与生物标志物相关的转录因子和/或转录因子辅因子。在一些情况下,方法还包括使用算法、阈值、阈值范围、随时间的方向变化、将指数与单个患者进行比较、将指数与对照组比较或将指数与参考标准。在一些情况下,该方法用于确认受试者中先兆子痫的诊断,其中受试者具有至少一种与先兆子痫相关的症状。在一些情况下,该方法用于在受试者中提供先兆子痫的诊断,其中受试者患有高血压和蛋白尿。在一些情况下,该方法用于在受试者中提供先兆子痫的诊断,其中受试者患有高血压。在一些情况下,该方法用于在受试者中提供先兆子痫的诊断,其中受试者具有与先兆子痫相关的一个危险因素。在一些情况下,该方法用于确定受试者是否处于先兆子痫的风险中。在一些情况下,该方法用于量化受试者发展先兆子痫的风险。在一些情况下,该方法用于预测受试者发展先兆子痫的时间。在一些情况下,该方法用于预测先兆子痫的孕产妇和/或胎儿结果。在一些情况下,该方法用于区分轻度、中度和重度先兆子痫。在一些情况下,该方法用于确定是否hellp综合征、早产、宫内生长限制、胎盘早剥、胎盘累积、胎儿出生体重低、胎龄低、妊娠高血压、慢性高血压、妊娠糖尿病、i型糖尿病、ii型糖尿病或自发流产的风险是否是患有先兆子痫的受试者的结果。在一些情况下,该方法还包括创建电子报告。
本公开还提供了用于确认受试者中先兆子痫的存在、确认pe不存在、诊断、预后、监测、表征或确定其严重性的试剂盒,所述试剂盒包含特异性用于测定水平的第一试剂的papp-a和特异性用于测定adam12水平的第二试剂。在一些情况下,试剂盒不包括检测igfals、flt4、p1gf、p1gf-2、p1gf-3或sflt-1的试剂。在一些情况下,试剂盒不能用于预后、诊断、筛查、确定或确认唐氏综合征。在一些情况下,试剂盒不能用于预后、诊断、筛查、确定或确认心血管疾病。在一些情况下,生物标志物不是p1gf-2或p1gf-3。
应用
本文提供的方法、组合物和试剂可用于诊断、分析、区分或确认女性受试者中先兆子痫(pe)的存在或不存在。另外,本文提供的方法、组合物和试剂可用于诊断、分析、区分或确认女性受试者中的先兆子痫(pe),其中女性受试者还具有本文所述的其他症状。方法、组合物和试剂可用于多种应用,包括例如预测个体是否发展先兆子痫、诊断先兆子痫、确认先兆子痫的存在、不存在或严重性、以及监测患有先兆子痫的个体。
另外,方法、组合物和试剂可用于多种应用,包括例如预测个体是否发展先兆子痫,其具有如本文所述的其他症状,诊断具有如本文所述的其他症状的个体的先兆子痫,确认患有本文所述的其他症状的个体中先兆子痫的存在、不存在或严重性,以及监测患有先兆子痫的个体中患有本文所述的其他症状的个体。在一些情况下,其他症状可包括高血压和蛋白尿。在其他情况下,其他症状可包括高血压。
方法、组合物和试剂还可用于鉴定处于先兆子痫风险中的个体并且量化个体中先兆子痫的风险。通常,方法、组合物和试剂可用于预测先兆子痫发作的时间。在一些情况下,方法、组合物和试剂可用于预测先兆子痫进展的时间线。本文提供的方法、组合物和试剂可用于预测先兆子痫的结果,其中结果影响胎儿或其中结果影响受试者,通常是母亲。在一些情况下,本文提供的方法、组合物和试剂可用于区分先兆子痫一个阶段与先兆子痫另一阶段。例如,先兆子痫的阶段可以是轻度或严重的。在一些情况下,本文提供的方法、组合物和试剂可用于区分先兆子痫和子痫。通常,本文提供的方法、组合物和试剂可用于确定受试者患有先兆子痫的结果是否是hellp综合征、早产的风险或进展、宫内生长限制的风险或进展、自发流产的风险、胎盘早剥落的风险或进展、胎盘增生的风险或进展、相对于胎龄而言具有低或高胎儿出生体重的风险和小或大尺寸的风险。本文提供的方法、组合物和试剂可进一步用于区分患有先兆子痫的患者与没有患有先兆子痫但具有与先兆子痫相关的症状的患者,此类症状包括怀孕症状的并发症、妊娠高血压、慢性高血压、妊娠糖尿病、i型糖尿病和/或ii型糖尿病。
本文提供的方法、组合物和试剂还可用于产生报告(通常是电子报告)以传达本文的方法、组合物和试剂的结果。在一些情况下,报告可以传达受试者的先兆子痫评分、先兆子痫指数和/或先兆子痫谱。
通过说明而非限制的方式提供以下实施例。
实施例
提出以下实施例以便为本领域普通技术人员提供如何制备和使用本公开的完全公开和描述,并且不旨在限制本公开的范围,也不是它们旨在表示以下实验是所进行的全部或独特的实验。已经做出努力以确保关于使用的数字(例如量、温度等)的准确性,但是应该考虑一些实验误差和偏差。除非另有说明,否则份数是重量份,分子量是重均分子量,温度是摄氏度,压力是大气压或接近大气压。
实施例1-通过elisa分析来自正常受试者和患有先兆子痫的受试者的样品
本实施例说明了本文所述的公开内容用于使用elisa方法进行来源于妊娠女性的一组样品的分析的用途,其中一些样品没有患有先兆子痫并且其中一些样品患有先兆子痫。本文所示的生物标志物的使用是用于诊断、预后、监测、表征、预测先兆子痫或确认女性受试者中存在或不存在先兆子痫。
设备
用于进行elisa测定的设备包括eppendorf
材料
执行方法所需的材料和试剂包括0.5ml和2ml深孔聚丙烯稀释单元(block)、15ml和50ml聚丙烯管、5ml、10ml和25ml一次性移液管和试剂槽。将10xpbst(即具有
临床样品
来源于患有或没有患有先兆子痫和/或患有多种合并症的妊娠患者的血清样品获自包括
模板
可以使用含有临床样品、qc对照和标准品的多个不同的96孔板模板(参见图3和图4)。在所有情况下,列1和2含有具有2倍稀释度的一式两份的8点标准曲线。列12含有反向的8点标准曲线或反向一式两份的4点标准曲线,以解决从右到左和从上到下的变异。将20份(一式三份)或32份(一式两份)临床血清样品以随机方式排列在板上。对于一式三份,样品通过列在板上交错,而对于一式两份,样品通过行沿板向下交错。每个板含有4或6个重复的hiqc和loqc对照样品,其策略性地排列在板上以评估从上到下和从左到右的变异。
实验步骤
主要单元的制备。用模板编号(例如“t1master”)标记0.5ml或2ml深孔单元的正面。用移液器将每个解冻的临床样品混合,并且将足够用于所有运行的测定的样品(通常为30-500微升(μl),包括20%的平均值)加入到主要单元中。hi和loqc不添加到主要单元(仅添加到稀释单元),因此这些孔在主要单元中保持为空的。将主要单元用板密封件密封,并在不用于制备稀释单元时储存在4℃。
稀释单元的制备。所有必需的试剂和样品在使用前在室温下温热30分钟。将2ml深孔块的前面标记为“tx-marker”作为用于跟踪的人可阅读条形码,其中“x”是被制备的模板,“marker”是被测定的蛋白质标志物。将冻干的标志物标准品用1-2ml去离子水或校准稀释剂重构,通过搅拌轻轻混合,并允许重构至少5分钟但至多15分钟以制备10x或1x浓缩储液。根据样品中目的生物标志物的浓度范围,使用未稀释的血清样品或用测定稀释剂稀释为1:2至1:1,000(通常为1:4、1:10、1:15、1:20或1:1000)的血清样品(基于历史结果)。例如,对于1:2稀释,将120μl来自主要单元的血清加入到稀释单元中的120μl测定稀释剂中。如果第一浓度需要,标准溶液以1:10稀释,然后通过在校准稀释剂中进行1:2系列稀释制备标准曲线。通常,对于低浓度标志物,标准曲线以50、20、10、5、2或1纳克/毫升(ng/ml)开始,但是如果标志物在血清中是高浓度的,可以高达0.8、2.5或5微克/毫升(μg/ml)开始。hi和loqc对照与血清样品相似地稀释,或者有时由于qc对照的储液浓度而接受较低的稀释。通过将纯化的蛋白质掺入正常或合成血清来建立qc对照,使得qc对照的od处于或接近标准曲线上的第二或第五点。
elisa操作方案。将用针对目的标志物的捕获抗体预包被的测定板用模板编号标记,标志物标记为“tx-marker”用于跟踪。在加入样品之前,用50或100μl测定稀释剂填充测定板。如上述模板所示,将样品和标准曲线样品加入板中。用胶条覆盖板,并在室温或37℃(取决于测试的标志物)孵育1、2或3小时。然后在板洗涤器上洗涤板,用每次300-400μl洗涤缓冲剂洗涤3-6次,然后在纸巾上吸干。将50至200μl针对测定稀释剂中的目的抗原的hrp缀合的二抗加入到整个板中,用胶条覆盖,并且取决于测试的标志物在室温或37℃下孵育30分钟至2小时。再次用每次300-400μl洗涤缓冲剂洗涤3-6次,然后在纸巾上吸干。在洗涤的同时,将双组分tmb试剂(即3,3',5,5'-四甲基联苯胺)混合在一起(等体积的两种试剂),并将100至200μl的该试剂加入板中。取决于测试的标志物,将平板在黑暗中孵育5至28分钟。在该孵育结束时,向整个平板中加入50μl1n硫酸以终止hrp(即辣根过氧化物酶)酶促反应。在分光光度计上在450nm读取平板(减去570nm读数)。
数据计算、接受和重新测试
标志物浓度的计算。使用预格式化操作方案在
测定接受标准。标准曲线的决定系数可以为r2≥0.95。使用3s控制图随时间跟踪hi和loqc对照值。qc对照结果可用于警告技术团队,额外的审查可能是适当的。标准曲线或qc对照中的任何其他变异性(边缘效应、从左至右的变异等)由统计学家评估并在研究报告中报告。
样品接受标准。在将其用于计算重复的总标准偏差之前,将对数转换应用于所有标准曲线测量。去除超过4个标准偏差(sd)的任何个体测量,并且使用未排除的点计算每个浓度的平均值。
样品再测试。如果样品平均浓度不在标准曲线的可定量范围内,则用必要的稀释度变化重新测试样品。示例性数据参见图1和图2。
前述内容仅仅示出了本公开的原理。应当理解,本领域技术人员将能够设计出尽管在本文中没有明确描述或示出但体现本公开的原理并且包括在其精神和范围内的各种布置。此外,本文的所有实例和条件语言主要旨在帮助读者理解本公开的原理,并且应被解释为不限于这些具体叙述的实例和条件。此外,本文中记载原理、情况和本公开的情况以及其具体实例的所有陈述旨在包括其结构和功能等同物。另外,这样的等同物包括当前已知的等同物和将来开发的等同物,即,开发的执行相同功能的任何元件,而不管结构如何。因此,本公开的范围不旨在限于本文示出和描述的示例性情况。相反,本公开的范围和精神由所附权利要求体现。
尽管本文已经示出和描述了本公开的优选情况,但是对于本领域技术人员来说显而易见的是,这些情况仅以示例的方式提供。在不脱离本公开的情况下,本领域技术人员将想到许多变异、变化和替换。应当理解,在实践本公开时可以采用对本文所述的本公开的情况的各种替代。意图是所附权利要求限定本公开的范围,并且由此涵盖这些权利要求及其等同物的范围内的方法和结构。
表2:各种pe生物标志物的列表。
肾素(ren)、人绒毛膜促性腺激素(hcg)、甲胎蛋白(afp)、抑制素a(inha)、激活蛋白a(inhba)、性激素结合球蛋白(shbg)、脂连蛋白(adipoq)、抗凝血酶iii(serpinc1)纤溶酶原激活物抑制剂-1(pai-1/serpine1)、纤溶酶原激活物抑制剂-2(pai-2/serpinb2)、载脂蛋白a-i(apoa1)、载脂蛋白b-100(apo)、载脂蛋白c-ii(apoc2)、载脂蛋白ciii(apoc3)、载脂蛋白e(apoe)、内皮肽(edn)、前列环素、血栓烷、胎盘生长因子-1(plgf-1)、胎盘生长因子-2(plgf-2)、胎盘生长因子-3(plgf-3)、血管内皮生长因子(vegf)、fms样酪氨酸激酶(flt1)、可溶性fms样酪氨酸激酶(sflt1)、血管内皮生长因子受体3(flt4)、内皮联蛋白(eng)、可溶内皮联蛋白(seng)、含有内皮pas结构域蛋白1(epas1)、神经激肽b、金属肽酶抑制剂1(timp1)、金属肽酶抑制剂(timp2)、金属肽酶抑制剂3(timp3)、血管生成素2(angpt2)、饰胶蛋白聚糖(dcn)、肝宁结合egf样生长因子(hbegf)、阿米洛利结合蛋白-1(abp1)、溶质载体家族21(前列腺素转运蛋白)成员2(slc21a2)、palladin(kiaa0992)、脂蛋白脂肪酶(lpl)、胰岛素样生长因子结合蛋白复合酸不稳定亚基(igfals)、含硒蛋白质p(sepp1)、巯基氧化酶1(qsox1)、过氧化物氧还蛋白-1(prdx1)、过氧化物氧还蛋白-2(prdx2)、溶酶体原x羧肽酶(prcp)、亮氨酰-半胱氨酰氨肽酶(lnpep)、生腱蛋白-x(tnxb)、基底膜特异性硫酸乙酰肝素蛋白聚糖核心蛋白(hspg2)、细胞表面糖蛋白muc18(mcam)、磷脂酰肌醇-聚糖特异性磷脂酶d(gpld1)、kunitz型丝氨酸蛋白酶抑制剂1(spint1)、g蛋白偶联受体126(gpr126)、c反应蛋白(crp)、磷脂酰胆碱-固醇酰基转移酶(lcat)、robo同源物4(robo4)、胞外核苷酸焦磷酸酶/磷酸二酯酶家族成员2(enpp2)、蛋白s100-a9(s100-a9)、脂肪酸结合蛋白4(fabp4)、烯脂酰辅酶a水合酶(echs1)、δ3,5-δ2,4-二烯脂酰辅酶a异构酶(ech1)、过氧化物酶6(per6)、热休克蛋白β-1(hsp27)、抑微管装配蛋白(stmn)、膜联蛋白a1(anxa)、膜联蛋白a2(anxa2)、膜联蛋白a4(anxa4)、前列腺素脱氢酶1(hpgd)、增殖相关蛋白2g4(pa2g4)、雌二醇17-β-脱氢酶(hsd17)、巨噬细胞加帽蛋白(capg)、缺氧诱导因子1-α(hif1a)、伴侣蛋白(cpn)、er-60蛋白酶、异柠檬酸脱氢酶1(idh1)、醛还原酶1(akr1b1)、结合至人醛糖还原酶的fidaresta链b、电压依赖性阴离子选择性通道蛋白1(vdac1)、核氯通道(nuclearcholoridechannel)、磷酸甘油酸变位酶1(pgam1)、内质网蛋白、蛋白酶体亚基α2型(psma2)、谷胱甘肽-s-转移酶(gst)、ig重链v区、平滑肌肌球蛋白碱性轻链、肿瘤坏死因子α(tnf)、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、成纤维细胞生长因子(fgf)、松弛素h2(rln2)、含有ferm和pdz结构域的蛋白4(frmpd4)、生长抑素(sst)、光感受器间基质蛋白聚糖1(impg1)、c-x-c基序趋化因子9(cxcl9)、c-x-c基序趋化因子11(cxcl11)、羟基-δ-5类固醇脱氢酶3-β和类固醇δ-异构酶2(hsd3b2)、分配缺陷6同源物β(pard6b)、胆汁盐输出泵(abcb11)、穿膜4-结构域亚家族a成员3(ms4a3)、loc196993、bestrophin(best1)、糖基-磷脂酰肌醇锚定分子样蛋白(gml)、细胞分裂周期2样5(cdc2l5)、甘氨酸受体α1(glra1)、二氢嘧啶酶相关蛋白4(dpysl4)、κ型类阿片受体(oprk1)、二甲基精氨酸二甲基氨基水解酶1(ddah1)、同源异型框蛋白hox-a4(hoxa4)、同源异型框蛋白hox-a7(hoxa7)、同源异型框蛋白hox-b5(hoxb5)、促甲状腺素释放激素受体(trhr)、核转换蛋白2(tnp2)、血管加压素、胎盘蛋白13(pp13)、嗜中性粒细胞明胶酶相关脂质运载蛋白(lcn2)、干扰素γ诱导蛋白-10(ip-10)、单核细胞趋化蛋白-1(mcp-1)、细胞内粘附分子-1(icam-1)、细胞内粘附分子-3(icam-3)、血管细胞粘附分子-1(vcam-1)、白细胞介素-1(il-1)、白细胞介素-2(il-2)、白细胞介素-3(il-3)、白细胞介素-4(il-4)、白细胞介素-5(il-5)、白细胞介素-6(il-6)、白细胞介素-7(il-7)、白细胞介素-8(il-8)、白细胞介素-9(il-9)、白细胞介素-10(il-10)、白细胞介素-11(il-11)、白细胞介素-12(il-12)、白细胞介素13(il-13)、白细胞介素-27亚基β(ebi3)、凝集素、血小板衍生生长因子(pdgf)、基质金属蛋白酶-2(mmp-2)、基质金属蛋白酶-9(mmp-9)、基质金属蛋白酶-12(mmp12)、基质金属蛋白酶-23a(mifr)、基质金属蛋白酶-23b(mifr-2)、血纤蛋白原、血纤蛋白原α(fga)、纤连蛋白-1(fn1)、蛋白s(pros1)、蛋白c(proc)、皮卡丘素(egflam)、血色素结合蛋白(hpx)、adam金属肽酶结构域2(adam2)、adamts3、adam金属肽酶结构域12(adam12)、adam金属肽酶结构域12短同种型(adam12-s)、adam金属肽酶结构域12长同种型(adam12-l)、触珠蛋白(hp)、血清-α2-巨球蛋白(a2m)、视黄醇结合蛋白4、小诱导型细胞因子a2(ccl2)、c-c基序趋化因子5(ccl5)、组织蛋白酶b(ctsb)、组织蛋白酶c(ctsc)、组织蛋白酶d链h(ctsd)、血红素加氧酶-1(hmox1)、胰岛素样生长因子结合蛋白1(igfbp1)、胰岛素样生长因子结合蛋白2(igfbp2)、胰岛素样生长因子结合蛋白-3(igfbp3)、胰岛素样生长因子结合蛋白-5(igfbp5)、胰岛素样生长因子结合蛋白-7(igfbp7)、胰岛素样生长因子-1(igf-1)、角蛋白4(krt4)、角蛋白16(krt16)、角蛋白19(krt19)、角蛋白33a(krt33a)、角蛋白40(krt40)、原血小板碱性蛋白(ppbp)、脂滴包被蛋白2(plin2)、激肽原-1(kng1)、绒毛膜促性腺激素亚基β(cgb)、半胱氨酸蛋白酶抑制剂c(cst3)、pappalysin-1(pappa1)、pappalysin-2(pappa2)、α-1b-糖蛋白(a1bg)、肌动蛋白(actb)、c4b结合蛋白β链(c4bp)、胆碱酯酶(bche)、绒毛膜生长催乳素激素(csh1)、凝血因子vii(f7)、凝血因子xi(f11)、细丝蛋白a(flna)、细丝蛋白b(flnb)、肝素辅因子2(hcii)、肝细胞生长因子样蛋白(mst1)、富含组氨酸的糖蛋白(hrg)、层粘连蛋白亚基β-1(lamb1)、脂多糖结合蛋白(lbp)、丝束蛋白-2(lcp1)、组装抑制蛋白-1(pfn1)、妊娠特异性β-1-糖蛋白(psg1)、妊娠特异性β-4-糖蛋白(psg4)、妊娠特异性β-11-糖蛋白(psg11)、受体型酪氨酸蛋白磷酸酶γ前体(ptprg)、妊娠区蛋白(pzp)、sh3结构域结合富含谷氨酸样蛋白3(sh3bgrl3)、转胶蛋白-2(tagln2)、踝蛋白-1(tln-1)、原肌球蛋白α-4链(tpm4)、vasorin(vsn)、黏着斑蛋白(vcl)、冯·维勒布兰德因子(vwf)、铁蛋白(ft)、铁蛋白轻链、血红蛋白(hb)、血红素、podocin(nphs2)、nephrin(nphs1)、足萼糖蛋白(podxl)、synaptopodin(synpo)、瘦蛋白(lep)、促卵泡激素抑释素样3蛋白(fstl3)、β致育蛋白(ftnb)、cd33l、中性营养(neutrotrophic)酪氨酸激酶受体2(trkb)、β葡糖苷酶(bgl)、血管生成蛋白(ang)、白细胞相关ig样受体分泌蛋白(lair)、红细胞分化蛋白、脂肪形成抑制因子(il-11)、促肾上腺皮质激素释放因子结合蛋白(crhbp)、α1-抗胰凝乳蛋白酶(serpina3)、细胞因子受体样因子1(crlf1)、赖氨酰羟化酶同种型2(lh2)、斯坦尼钙调节蛋白前体(stc)、分泌型卷曲相关蛋白(sfrp)、半乳凝素-3(lgals3)、α中性粒细胞防御素1(defa1)、胆囊收缩素前体(cck)、干扰素刺激的t细胞α化学引诱物(i-tac)、azurocidin(hbp)、精胺氧化酶(smox)、udp糖基转移酶2家族多肽b28(ugt2b28)、中性内肽酶(nep)、cdc28蛋白激酶调节亚基2(ckshs2)、羊毛甾醇合酶(lss)、钙/钙调蛋白依赖性丝氨酸蛋白激酶(cask)、趋化因子(cx3c基序)受体1(cx3cr1)、酪氨酸酶相关蛋白1(tyrp1)、羟基-δ-5-类固醇脱氢酶(hsd3)、细胞色素p450家族11(cyp11)、细胞色素p450家族11亚家族a多肽1(cyp11a1)、细胞色素p450家族11亚家族b多肽1(cyp11b1)、细胞色素p4501a1(cyp1a1)、冠蛋白-2a(coro2a)、细胞色素p4502j2(cyp2j2)、paralemmin(palm)、甘油醛-3-磷酸脱氢酶(gapd)、atp结合盒亚家族a成员12(abca12)、转录因子eb(tfeb)、转录因子iie(tfiie)、突触融合蛋白结合蛋白5样(stxbp5l)、鸟苷肽(guca2a)、核糖体蛋白s6激酶α-2(rps6ka2)、蛋白磷酸酶1调节亚基16b(ppp1r16b)、b类碱性螺旋环螺旋蛋白2(bhlhb2)、血型糖蛋白e(gype)、星云状小体(nebl)、富含亮氨酸的重复和免疫球蛋白样结构域蛋白1(lrig1)、葡糖转运蛋白3(glut3)、udp-葡糖醛酸基转移酶2b28(ugt2b28)、核受体亚家族5组a成员2(nr5a2)、neuronatin(nnat)、钠依赖性和氯依赖性肌酸转运蛋白1(slc6a8)、受体酪氨酸蛋白激酶erbb-2(erbb2)、受体酪氨酸蛋白激酶erbb-3(erbb3)、唾液酸结合ig样凝集素6(siglec6)、shc转化蛋白3(shc3)、neurexophilin4(nxph4)、淋巴细胞抗原6d(ly6d)、前列环素合酶(ptgis)、atp依赖性rna解旋酶ddx51(ddx51)、traf3相互作用蛋白1(traf3ip1)、滋养层糖蛋白(tpbg)、转化生长因子β3(tgfb3)、细胞周期蛋白b1(ccnb1)、驱动蛋白家族成员17(kif17)、n-myc下游介导基因1(ndrg1)、染色质的swi/snf相关的基质相关的肌动蛋白依赖调节子亚家族d成员3(smarcd3)、丝氨酸/苏氨酸蛋白激酶chk2(chek2)、双调蛋白(areg)、次要组织相容性抗原ha-1(ha-1)、pou结构域4类转录因子1(pou4f1)、前列腺干细胞抗原(psca)、胶原α-1(x)链(col10a1)、胶原α-3(vi)链(col6a3)、胶原α-3(ix)链(col9a3)、配对盒基因2(pax2)、配对盒基因4(pax4)、配对盒基因7(pax7)、蛛毒素受体(latrophilin)3(lphn3)、胆汁酸受体(nr1h4)、空的气门(emptyspiracles)同源物1(emx1)、桥粒黏蛋白3(dsg3)、dna结合蛋白ikaros(znfn1a1)、黑素瘤相关抗原5(magea5)、黑色素瘤相关抗原3(magea3)、afadin和α-辅肌动蛋白结合蛋白(ssx2ip)、含有wd重复的蛋白21(wdr21)、2型食欲肽受体(hcrtr2)、nkg2-d型ii膜内在蛋白(klrk1)、hlaii类组织相容性抗原dpα1链(hla-dpa1)、hlaii类组织相容性抗原dpβ1链(hla-dpb1)、hlaii类组织相容性抗原drα链(hla-dra)、hlai类组织相容性抗原α链g(hla-g)、外周髓鞘型蛋白质2(pmp2)、鸟嘌呤核苷酸结合蛋白g(o)亚基α(gnao1)、电压依赖性l型钙通道亚基β-2(cacnb2)、c-jun-氨基末端激酶相互作用蛋白2(mapk8ip2)、p抗原家族成员1(page1)、gaba受体亚基β-1(gabrb1)、钠和氯依赖性甜菜碱转运蛋白(slc6a12)、乳凝集素(mfge8)、整合素α-l(itgal)、桥粒胶蛋白1a/1b(dsc1)、绒毛蛋白2(vil2)、网蛋白1(plec)、锚蛋白1(ank1)、波形蛋白(vim)、骨桥蛋白(spp1)、发动蛋白2(dnm2)、肌钙黏着蛋白(cdh15)、驱动蛋白重链、脂肪酸合酶(fasn)、α内收蛋白(add1)、nadh-细胞色素b5还原酶(cyb5r)、二氢叶酸还原酶(dhfr)、adp-核糖基化因子样蛋白3(arl3)、二
精氨酸血管加压素;
和肽素;
干扰素-γ;
tnf-α;
il-10;
il-4;
β淀粉样蛋白;
干扰素诱导型蛋白6-16;
白蛋白;
serpina1;
血浆铜蓝蛋白;和
免疫球蛋白游离轻链
上述生物实体的同种型也被认为是生物标志物。
此类同种型包括例如sflt-2、sflt-4和sflt-5。
其他同种型包括fngenbank登录号nm_212474.1)、fggenbank登录号nm_000508.3(fga)和genbank登录号nm_005141.4(fgb)、papp-a例如genbank登录号nm_002581.3)、hpxgenbank登录号nm_000613.2);adam12genbank登录号nm_003474.4(同种型1)、nm_021641.3(同种型2);sflt-1例如genbank登录号nm_001159920.1(同种型2)、nm_00160030.1(同种型3)和nm_001160031.1(同种型4));p1gf例如genbank登录号nm_002632.5(同种型1)和nm_001207012.1(同种型2))。
在本文中被检测试剂(例如抗体)识别的pe生物标志物的片段或部分也被认为是pe生物标志物。
- 还没有人留言评论。精彩留言会获得点赞!