防晒功能材料筛选方法及防晒效果评价方法与流程
本发明涉及一种通过皮肤细胞中特定基因的表达变化来测量防晒功能的方法,具体涉及一种防晒功能材料的筛选方法或一种防晒效果评价方法。
背景技术:
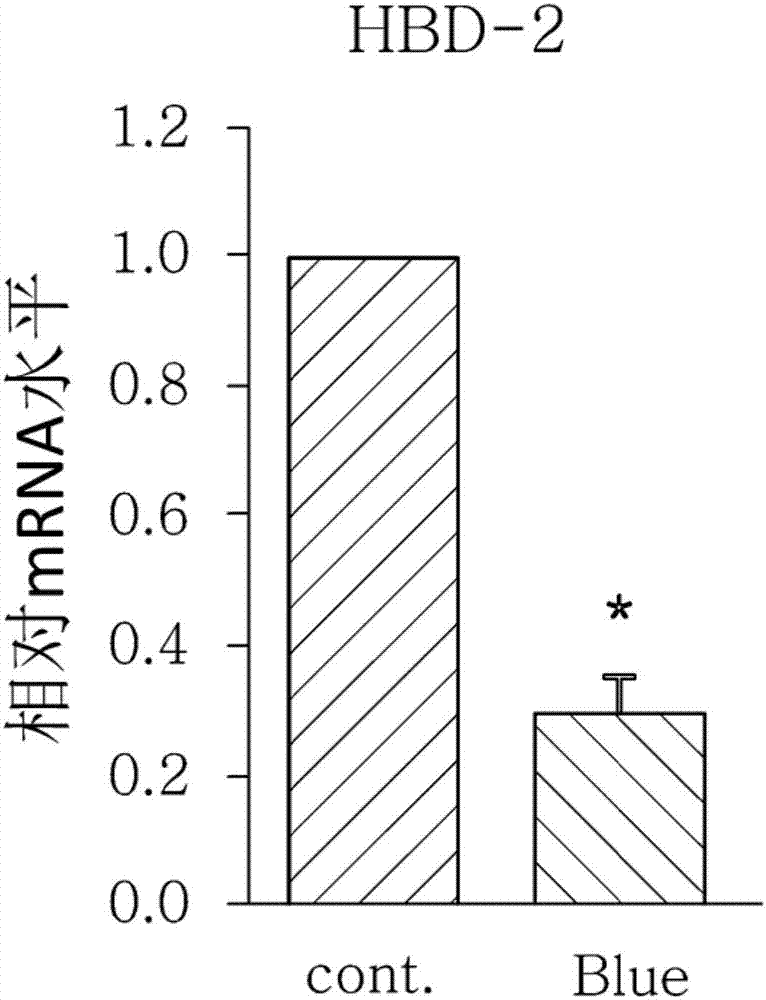
:太阳光(太阳能)由无线电波、微波、红外线、可见光、紫外线(ultraviolet,uv)、x-射线、γ-射线和其他波长更短的光组成。此外,由于太阳光对皮肤的负面影响是已知的,许多用于保护皮肤免受阳光照射的产品已被开发出来。然而,尽管太阳光包括如上所述的各种波长的电磁波,目前防晒效果的测量大多仅基于阻挡uv的有效性。因此,防晒产品效果是根据评价uv防护的指标而评价,即防晒系数(sunprotectionfactor,spf)和uva(pa)防护,该防晒系数表示防止由uvb范围(290-320nm)的光引起红斑,该uva防护表示防止uva范围(320-400nm)的光引起评价人目测的黑色素持续沉着。换言之,虽然uv在太阳光中占很小的比例,而其他波长范围的电磁波在太阳光中占很大比例,但是除了根据spf和pa评价的uv防护效果之外,依然无法验证其他波长的防晒效果。大多数市售的防晒产品致力于uv防护指数,例如spf和pa。因此,有关太阳光中可见光的防护少有研究和开发工作。此外,虽然防晒产品不足以防护可见光,包括在可见光范围内能引起皮肤损伤的波长在400到500nm范围内的蓝/紫光,但是,由于缺少能够评价蓝/紫光防护效果的防护指数,仍然不能验证蓝/紫光的防护效果。[引用列表][专利文献][专利文献1]韩国注册专利:编号10-0151635.技术实现要素:技术问题本发明的一个方面提供了一种通过测量防晒功能(更具体地是蓝/紫光防护功能)来筛选防晒功能材料的方法,,或一种用于评估防晒效果的防晒效果评价方法。此外,本发明的另一个方面提供了一种通过所述方法防护蓝/紫光的组合物。技术方案基于上述目的,本发明的一个实施例提供了一种测量防晒功能的方法,所述方法包括测量由测试材料引起的变化的步骤,所述变化为皮肤细胞中抗微生物肽的表达和s-亚硝基化蛋白的合成中的至少一种,所述抗微生物肽(amps)的表达和s-亚硝基化蛋白的合成因太阳辐射而减少。本发明的一个实施例提供了一种测量防晒功能的方法,还包括筛选防晒功能材料的步骤,其中,如果所述变化的测量显示测试材料对皮肤细胞中amps表达和s-亚硝基化蛋白的合成中的至少一种的减少具有抑制效果,那么确定这种测试材料具有防晒功能。本发明的另一个实施例提供了一种测量防晒功能的方法,还包括评价防晒效果的步骤,其中,如果所述变化的测量显示测试材料对皮肤细胞中amps表达和s-亚硝基化蛋白的合成中的至少一种的减少具有更大的抑制效果,那么确定这种测试材料具有更好的防晒功能。此外,本发明的一个实施例提供了一种防晒组合物,包括,一种作为活性成分的材料,所述材料抑制由于太阳光中的波长在400~500nm范围内的蓝/紫光引起的皮肤细胞中抗微生物肽的表达和s-亚硝基化蛋白的合成中的至少一种的减少。本发明的有益效果与传统的通过目测评价紫外线防护程度不同,本发明的测量方法通过研究由于太阳光照射皮肤导致的皮肤细胞中amps表达的减少和s-亚硝基化蛋白的合成,并利用测量值作为评价测试材料的防晒功能的参数,能够精确客观地评价防晒程度。与传统的只提供紫外线防护指数的防晒效果评价方法不同,本发明的测量方法的是,本发明的测量方法可以确定在可见光中导致最严重的皮肤损伤的波长在400~500nm范围内的蓝/紫光的防护效果,提供更为具体的防晒效果评价结果,且可基于评价结果制作防晒指数。此外,与传统用于uv防护的组合物不同,本发明提供一种组合物,其通过包含以上述方法确定为具有防晒功能的材料作为有效成分,从而防护波长在400~500nm范围内的蓝/紫光。附图说明图1a至1g为本发明的其中一个实施例中所用amps中的hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7在蓝/紫光辐射前(cont.)和辐射后(blue)的表达水平的变化比较图。图2a至2f为本发明的其中一个实施例中所用amps中的hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7在uv辐射前(cont.)和辐射后(uv)的各自表达水平(相对mrna水平)的变化比较图,以及基于辐射强度的变化图。图3a至3g为当用polyi:c和鞭毛蛋白处理以诱导在人表皮新生角质形成细胞中的病毒和细菌感染情况时,hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7在蓝/紫光辐射前(cont.)和辐射后(blue)的各自表达水平的变化比较图。图4a至4g为当用polyi:c处理以诱导人表皮新生角质形成细胞中的病毒和细菌感染情况时,还用一氧化氮清除剂ptio和活性氧(ros)清除剂nac处理时,hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7在蓝/紫光辐射前(-)和辐射后(blue)的各自表达水平的变化比较图。图5为当用蓝/紫光辐射人表皮新生角质形成细胞后s-亚硝基化蛋白(sno)的合成的变化(sds-page胶)比较。图6为uv辐射人表皮新生角质形成细胞后s-亚硝基化蛋白(sno)的合成的变化(sds-page胶)比较图。图7a至7g为蓝/紫光辐射后实施例1至3中hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的各自表达水平比较图。图8为蓝/紫光辐射后实施例1至3中s-亚硝基化蛋白(sno)的合成的变化(sds-page胶)比较图。具体实施方式这里所用的术语“太阳光”是指包括所有波长的太阳光的最宽范围的概念,不仅包括uv,还包括无线电波,微波,红外线,可见光,x射线和γ射线。此外,这里所用的术语“皮肤细胞”是指包括覆盖在动物身体表面的组织的所有细胞的最宽范围的概念,不仅包括覆盖脸部和身体的身体表面的组织,还包括存在于头皮和头发中的细胞。下面将详细描述本发明。本发明的一个实施例提供一种测量防晒功能的方法,所述方法包括测量由测试材料引起的变化的步骤,所述变化为皮肤细胞中抗微生物肽的表达和s-亚硝基化蛋白的合成中的至少一种,所述抗微生物肽的表达和s-亚硝基化蛋白的合成因太阳辐射而减少。此外,本发明的一个实施例提供一种测量防晒功能的方法,还包括筛选防晒功能材料的步骤,其中,其中,如果所述变化的测量显示测试材料对皮肤细胞中amps表达和s-亚硝基化蛋白的合成中的至少一种的减少具有抑制效果,那么确定这种测试材料具有防晒功能。本发明的另一个实施例提供一种测量防晒功能的方法,还包括评价防晒效果的步骤,其中,其中,如果所述变化的测量显示测试材料对皮肤细胞中amps表达和s-亚硝基化蛋白的合成中的至少一种的减少具有更大的抑制效果,那么确定这种测试材料具有更好的防晒功能。根据本发明的一个实施例的用于测量防晒功能的方法中辐射的太阳光包括波长为400~500nm的蓝/紫光。此外,太阳光还可包括波长为290~400nm范围内的uv。根据本发明的一个实施例,太阳光,特别是波长为400~500nm的蓝/紫光,减少amps的表达。此外,蓝/紫光可以减少各种细胞因子和相关基因以及蛋白质的表达水平,例如rantes(人ccl5),ccl2(趋化因子配体2),il-6(白细胞介素-6),il-8(白细胞介素-8)、tnf-α(肿瘤坏死因子-α)和cox-2(环氧合酶-2)。具体地,amps是具有抗菌活性以防止如细菌、病毒和真菌等病原体感染的小分子量蛋白。有报道指出amps能诱导血管生成、伤口愈合和具有趋化性,并且具有正电荷和同时拥有亲水位点和疏水位点的结构特性。在本发明的一个实施例中,amps可以包括hbd-1(humanbeta-defensin-1,编号np_005209,版本np_005029.1gi:4885181)、hbd-2(humanbeta-defensin-2,编号np_004933,版本np_004933.1gi:4826692)、hbd-3(humanbeta-defensin-3,编号aag02237,版本aag02237.1gi:49931627)、ll-37(cathelicidin-37,编号np_004336,版本np_004336.3gi:348041314)、银屑素(编号aaa60210,版本aaa60210.1gi:190668)、皮离蛋白(编号np_444513,版本np_444513.1gi:16751921)和核糖核酸酶7(编号cac84458,版本cac84458.1gi:40643235)中的至少一种。根据本发明的一个实施例的用于测量防晒功能的方法中所用的hbd(humanbeta-defensin)-1、hbd-2、hbd-3、ll(抗菌肽)-37、银屑素、皮离蛋白和核糖核苷酸酶7作为先天免疫因子存在于皮肤、消化器官、呼吸器官和眼结膜中,杀死或抑制革兰氏阳性/阴性细菌和真菌病毒的生长。除了角质形成细胞,这些amps也存在于皮肤汗腺和皮脂腺的分泌物质中,并通过汗液和皮脂分泌沉积在皮肤表面上,有助于形成抗菌屏障。此外,amps的特征在于,与蓝/紫光辐射相反,它们的表达受uv辐射而增加。glaserr.等描述了amp表达相对于uv辐射的特征。jallergyclinimmunol.2009may;123(5):1117-23报道了uv-b辐射在体外和体内诱导人角质形成细胞中抗微生物肽的表达。整个文件通过参考并入本说明书中。虽然s-亚硝基化蛋白的表达水平受紫外线辐射而增加,但是根据本发明的另一个实施例,太阳光,特别是波长为400~500nm的蓝/紫光减少s-亚硝基化蛋白的合成。具体地,与体内许多功能相关的一氧化氮可与活性半胱氨酸残基反应合成s-亚硝基化蛋白,s-亚硝基化蛋白可以控制如蛋白质活性等细胞信号转导,如蛋白质磷酸化。此外,蓝/紫光可以诱导去亚硝基化,以通过亚硝基化从身体中合成的s-亚硝基化蛋白中分离一氧化氮。此外,当s-亚硝基化蛋白因蓝/紫光而减少,amps也会减少。amp基因或s-亚硝基化蛋白的表达水平可以通过选自下列方法测定,例如,实时聚合酶链反应(rt-pcr),印迹杂交,酶联免疫吸附测定(elisa),放射免疫测定(ria),夹心法分析,蛋白质印迹,免疫印迹,免疫组织化学染色,生物素转换方法及其组合。此外,根据本发明的一个实施例的方法还包括测量变化前执行以下步骤:将测试材料涂覆在太阳光透射材料上;将皮肤细胞放置在太阳光透射材料下方,然后在太阳光透射材料上方辐射太阳光。所述太阳光透射材料可以为任何一种透射uv或蓝/紫光的材料,且具有可涂覆测试材料的性质。例如,可以使用仅透射测试光带的石英板或带通滤波器,但不限于此。在本文中,所述测试材料是指可以用于评价防晒效果的材料,且可以是应用至人体皮肤的任何材料,包括含有该材料的所有产品(不用考虑剂型),例如化妆品、药品和纤维。根据本发明的一个实施例的用于测量防晒功能的方法中所用的皮肤细胞可以为任一种从人或动物来源的皮肤细胞。例如,可以选用角质形成细胞、成纤维细胞和黑素细胞(如merkel细胞)中的至少一种,但不限于此。当皮肤细胞中的amps的表达水平和/或s-亚硝基化蛋白的合成减少,皮肤免疫力下降。这将导致各种皮肤问题和疾病,且由于其降低了皮肤保湿能力和加速皮肤老化,而不利于皮肤护理。然而,本发明的用于测量防晒功能的方法可以筛选开发防晒功能材料,所述材料可以阻挡蓝/紫光并防止蓝/紫光带来的不利影响。基于本发明,因为能够客观评价防护蓝/紫光效果的程度,所以也可以对程度进行指数化。进一步地,本发明的用于筛选和评估效果的方法可用于发现防护蓝/紫光材料,当所述材料应用于皮肤上时,可阻断amps的减少以及阻断皮肤免疫力下降,从而提高免疫力。此外,本发明的另一实施例还提供了一种防晒组合物,所述组合物用于防止由蓝/紫光导致的amps的减少,所述组合物包括一种防护波长在400~500nm范围内的蓝/紫光的活性成分,具体地,包括一种作为活性成分的材料,该材料抑制由于蓝/紫光导致的皮肤细胞中amps的表达水平和s-亚硝基化蛋白的合成的变化中的至少一种。具体地,所述amp为hbd(humanbeta-defensin)-1、hbd-2、hbd-3、ll(cathelicidin,抗菌肽)-37、银屑素、皮离蛋白和核糖核酸酶7中的至少一种。组合物的活性成分可以为一种测试材料,所述测试材料的防晒功能是根据本发明的实施例的用于测量防晒功能的方法而测得。所述活性成分可以包括以下材料中的至少一种,例如,二氧化钛(tio2)、氧化锌(zno)、tinosorb以及包含在防晒品中的任何防晒组合物。以下将参照实验实施例、实施例和比较例进一步详述本发明的构成和效果。明显地,这些实验实施例、实施例和比较例仅用于说明本发明,而不应被解释为对本发明范畴和范围的限制。实验实施例1以下描述本发明的一个实施例,当波长为400~500nm范围内的蓝/紫光辐射在皮肤细胞上时,测量amps的表达水平的变化。首先,本发明所用的人表皮新生角质形成细胞通过商业上有保障和推荐的途径购自lonza,inc.(walkersville,马里兰,美国)。将其传代培养,然后在37℃和5%co2条件下在co2培养箱中培养。根据lonza,inc.kgm-2项目试剂盒提供的指导制备培养基:将bpe(牛垂体抽取物)2ml,hegf(人表皮生长因子)0.5ml,胰岛素0.5ml,氢化可的松0.5ml,铁传递蛋白0.5ml,肾上腺素0.5ml和硫酸庆大霉素溶液+两性霉素-b(ga-1000)0.5ml加入到500mlkbm-2(clonetics,cc-3103)培养基中。然后向培养有人表皮新生角质形成细胞的培养基辐射波长在400~500nm的蓝/紫光(10j/cm2)。移除人表皮新生角质形成细胞的培养基后,用2ml磷酸盐缓冲溶液(pbs)清洗细胞,然后用trizol试剂(invitrogen,carlsbad,ca,美国)分离细胞中的rna。用rna试剂盒(qiagenrneasykt,qiagen,valencia,ca)再次纯化分离后的rna,用agilent2100bioanalyzer(agilenttechnologies,santaclara,ca,美国)检测rna的质量。用superscript逆转录酶(rt)试剂盒(invitrogen,carlsbad,ca)从rna合成cdna,通过实时-逆转录聚合酶链式反应(realtime-reversetranscriptionpolymerasechainreaction,q-rt-pcr)定量分析cdna。图1a至1g在hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的各自表达图中,展示了利用基因表达分析试剂盒(appliedbiosystems,fostercity,ca)测量的,由蓝/紫光诱导的皮肤基因的变化的rt-pcr评价结果。用于扩增单个基因的引物如下表1所示。表1基因名引物hbd-1hs00608345_m1hbd-2hs00175474_m1hbd-3hs00218678_m1ll-37hs00189038_m1银屑素hs00161488_m1皮离蛋白hs00364976_m1核糖核苷酸酶7hs00922963_s1结果如图1a至1g所示,与蓝/紫光辐射前(cont.)的表达水平相比,先天免疫基因(即amps)hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的各自表达水平(相对mrna水平)在蓝/紫光辐射后(blue)减少。这与保持其他条件不变,用uv辐射(10、30mj)代替蓝/紫光的实验结果相反,其中,当用uv辐射时,hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的体内表达水平随辐射强度增强而提高(参见图2a至2f)。这表明了太阳光对皮肤的影响取决于波长,amps的表达水平可作为用于测量蓝/紫光防护功能和评价效果的指数。实验实施例2作为本发明的一个实施例,进行以下实验,当波长为400~500nm范围内的蓝/紫光辐射在皮肤细胞上时,测量amps的表达水平的变化。首先,本发明所用的人表皮新生角质形成细胞通过商业上有保障和推荐的途径购自lonza,inc.(walkersville,马里兰,美国),将其传代培养,然后在37℃和5%co2条件下在co2培养箱中培养。根据lonza,inc.kgm-2项目试剂盒提供的指导制备培养基:将bpe(牛垂体抽取物)2ml,hegf(人表皮生长因子)0.5ml,胰岛素0.5ml,氢化可的松0.5ml,铁传递蛋白0.5ml,肾上腺素0.5ml和硫酸庆大霉素溶液+两性霉素-b(ga-1000)0.5ml加入到500mlkbm-2(clonetics,cc-3103)培养基中。然后向培养有人表皮新生角质形成细胞的培养基辐射波长在400~500nm的蓝/紫光(10j/cm2)。移除人表皮新生角质形成细胞的培养基后,用2ml磷酸盐缓冲溶液(phosphatebufferedsaline,pbs)清洗细胞,然后用trizol试剂(invitrogen,carlsbad,ca,美国)分离细胞中的rna.此时,在蓝/紫光辐射前后(10j/cm2)用polyi:c和鞭毛蛋白(invivogen,sandiego,california,美国)处理以诱导病毒和细菌感染的情况。用rna试剂盒(qiagenrneasykt,qiagen,valencia,ca)再次纯化分离后的rna,用agilent2100bioanalyzer(agilenttechnologies,santaclara,ca,美国)测试rna的质量。用superscript逆转录酶(rt)试剂盒(invitrogen,carlsbad,ca)从rna合成cdna,通过实时-逆转录聚合酶链式反应(q-rt-pcr)定量分析cdna。图3a至3g在hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的各自表达图中,展示了利用基因表达分析试剂盒(appliedbiosystems,fostercity,ca)测量的,由蓝/紫光诱导的皮肤基因的变化的rt-pcr评价结果。用于扩增单个基因的引物如表1所示。图3a至3g为当用polyi:c和鞭毛蛋白处理以诱导在人表皮新生角质形成细胞中的病毒和细菌感染情况时,hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7在蓝/紫光辐射前(cont.)和辐射后(blue)的各自表达水平的变化比较图。如图3所示,当通过polyi:c和鞭毛蛋白处理使hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7增加时,通过蓝/紫光的辐射减少各基因的表达水平。这种增加和减少具有统计显著性。数据通过双尾学生t检验法检验后,如果p值为0.05或更少,则认为有显著性差异。这表明了amps的表达水平可作为用于测量蓝/紫光防护功能和评价效果的指数。实验实施例3作为本发明的一个实施例,进行以下实验,当波长为400~500nm范围内的蓝/紫光辐射在皮肤细胞上时,测量amps的表达水平的变化。首先,本发明所用的人表皮新生角质形成细胞通过商业上有保障和推荐的途径购自lonza,inc.(walkersville,马里兰,美国),将其传代培养,然后在37℃和5%co2条件下培养。根据lonza,inc.kgm-2项目试剂盒制备培养基:将bpe(bovinepituitaryextract,牛垂体抽取物)2ml,hegf(humanepidermalgrowthfactor,人表皮生长因子)0.5ml,胰岛素0.5ml,铁传递蛋白0.5ml,肾上腺素0.5ml和硫酸庆大霉素溶液+两性霉素-b(ga-1000)0.5ml加入到500mlkbm-2(clonetics,cc-3103)溶液中。然后向培养有人表皮新生角质形成细胞的培养基(10j/cm2)辐射波长在400~500nm的蓝/紫光。移除人表皮新生角质形成细胞的培养基后,用2ml磷酸盐缓冲溶液(phosphatebufferedsaline,pbs)清洗细胞,然后用trizol试剂(invitrogen,carlsbad,ca,美国)分离细胞中的rna。此时,在蓝/紫光辐射前后(10j/cm2)用polyi:c处理以诱导病毒和细菌感染。此外,分别用一氧化氮清除剂ptio(2-(4-羧苯基)-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化钾盐)和ros清除剂nac(n-乙酰基-l-半胱氨酸)(sigma,st.louis,mo,美国)处理rna。用rna试剂盒(qiagenrneasykt,qiagen,valencia,ca)再次纯化分离后的rna,用agilent2100bioanalyzer(agilenttechnologies,santaclara,ca,美国)检测rna的质量。用superscript逆转录酶(rt)试剂盒(invitrogen,carlsbad,ca)从rna合成cdna,通过实时-逆转录聚合酶链式反应(realtime-reversetranscriptionpolymerasechainreaction,q-rt-pcr)定量分析cdna。图4a至4g展示了利用基因表达分析试剂盒(appliedbiosystems,fostercity,ca)测量的在hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的各自表达图中,由蓝/紫光诱导的皮肤基因的变化的rt-pcr评价结果。用于扩增单个基因的引物如表1所示。如图4a至4g所示的结果表明,在使用两种清洁剂处理的情况中,通过polyi:c处理增加的hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的表达水平在受蓝/紫光辐射后减少,而用一氧化氮清除剂ptio处理的组中,即使用蓝/紫光辐射,amps的表达水平也没有减少。这表明了蓝/紫光与s-亚硝基化蛋白的合成和amps表达水平的调节有关。实验实施例4作为本发明的一个实施例,进行以下实验,当波长为400~500nm范围内的蓝/紫光辐射在皮肤细胞上时,测量s-亚硝基化蛋白的表达水平的变化。首先,本发明所用的人表皮新生角质形成细胞通过商业上有保障和推荐的途径购自lonza,inc.(walkersville,马里兰,美国),将其传代培养,然后在37℃和5%co2条件下在co2培养箱中培养。根据lonza,inc.kgm-2项目试剂盒制备培养基:将bpe(牛垂体抽取物)2ml,hegf(人表皮生长因子)0.5ml,胰岛素0.5ml,氢化可的松0.5ml,铁传递蛋白0.5ml,肾上腺素0.5ml和硫酸庆大霉素溶液+两性霉素-b(ga-1000)0.5ml加入到500mlkbm-2(clonetics,cc-3103)培养基中。向培养的细胞辐射10、30、60j/cm2的波长在400~500nm范围内的蓝/紫光,移除人表皮新生角质形成细胞的培养基后,用2ml磷酸盐缓冲溶液(phosphatebufferedsaline,pbs)清洗细胞。然后用生物素转换方法检测s-亚硝基化蛋白的合成。具体地,将清洗的细胞在hents溶液(hepes,tritonx100,sds,蛋白酶抑制剂,edta)中裂解10分钟,仅取上清液。定量蛋白后,用hen溶液(hepes,蛋白酶抑制剂,edta)将浓度调节至600ug/200ul。为了阻止半胱氨酸的非s-亚硝基化反应,加入mmts(sigma)至浓度为10mm,在50℃下反应15分钟。用丙酮沉淀蛋白后,将蛋白溶解于含有1mm的hpdp-生物素(pierce)的抗坏血酸(sigma)的hens溶液(hepes,十二烷基磺酸钠、蛋白酶抑制剂、乙二胺四乙酸)中,在37℃下反应1小时使生物素与s-亚硝基化半胱氨酸共轭结合。用丙酮沉淀蛋白后,将蛋白溶于hens溶液中。取出5%输入物用于校正,分别加入20μl抗生素蛋白-琼脂糖小珠(avidin-agarosebeads)(pierce),在4℃下反应12小时。用中和液(hepes,edta,nacl,tritonx100)清洗小珠5次,然后加入样品缓冲液。将所得混合物煮沸后和输入物进行sds-page。随后,通过银染法用sds-page鉴定s-亚硝基化蛋白。结果如图5所示。如图5所示,与没有经蓝/紫光辐射的对照样品相比,结果表明实验样品的s-亚硝基化蛋白(sno-proteins)的体内合成随着蓝/紫光辐射强度的增加而减少。这与保持其他条件不变,用uv辐射(20mj)代替蓝/紫光的实验结果相反,其中,当用uv辐射时,s-亚硝基化蛋白(sno-proteins)的体内合成增加(参见图6)。这表明了太阳光对皮肤的影响取决于波长,s-亚硝基化蛋白的合成可作为用于测量蓝/紫光防护功能和评价效果的指数。实验实施例5根据本发明的一个实施例,在测量测试材料对皮肤细胞的防晒功能前,先用下述方法测量测试材料的紫外线和蓝/紫光透射率。实验前,通过本领域通常使用的方法,按下面所示的组成制备作为测试材料的实施例1-3的防晒制剂(单位:重量%)。表2然后分别测量实施例1至3的临床spf值和pa值以及蓝/紫光透射率。结果如表3所示。分别在带通滤波器上涂覆2mg/cm2的实施例1至3的防晒制剂,辐射包括蓝/紫光带的光源并测量蓝/紫光带(400~500nm),用分光光度计spf-290ssunscreenanalyzersystem测量透射的蓝/紫光带。根据韩国食品药品监督管理局(koreafood&drugadministration,kfda)的防晒分析实验,通过uv验证实验测量spf(红斑)和pa(黑色素持续沉着)。表3测试材料spfpa蓝/紫光防护率(%)实施例130+++51.3%实施例230++15.4%实施例330+++56.4%表3表明实施例1至3的防晒制剂对于uv有几乎相同的spf值和pa值,但蓝/紫光透射率有显著差异。这表明了具有相同uv防护效果的防晒产品可能有不同的防护可见光中波长在400~500nm范围内的蓝/紫光的效果。因此,spf值和pa值不能完全代表整体太阳光防晒功能或防晒效果的程度。实验实施例6作为本发明的一个实施例,进行以下实验,当波长为400~500nm范围内的蓝/紫光辐射在皮肤细胞上时,测量依赖于材料具有的防晒功能,amps的表达水平的变化。首先,本发明所用的人表皮新生角质形成细胞通过商业上有保障和推荐的途径购自lonza,inc.(walkersville,马里兰,美国),将其传代培养,然后在37℃和5%co2条件下培养。根据lonza,inc.kgm-2项目试剂盒提供的指导制备培养基:将bpe(bovinepituitaryextract,牛垂体抽取物)2ml,hegf(humanepidermalgrowthfactor,人表皮生长因子)0.5ml,胰岛素0.5ml,氢化可的松0.5ml,铁传递蛋白0.5ml,肾上腺素0.5ml和硫酸庆大霉素溶液+两性霉素-b(ga-1000)0.5ml加入到500mlkbm-2(clonetics,cc-3103)溶液中。在带通滤波器上涂覆2mg/cm2的实施例1至3的防晒制剂,在带通滤波器下放置人表皮新生角质形成细胞。然后,在涂覆有防晒制剂的区域上方辐射强度为0和30j/cm2的波长在400~500nm范围内的蓝/紫光。移除人表皮新生角质形成细胞的培养基后,用2ml磷酸盐缓冲溶液(pbs)清洗细胞,然后用trizol试剂(invitrogen,carlsbad,ca,美国)分离细胞中的rna。用rna试剂盒(qiagenrneasykt,qiagen,valencia,ca)再次纯化分离后的rna,用agilent2100bioanalyzer(agilenttechnologies,santaclara,ca,美国)测试rna的质量。用superscript逆转录酶(rt)试剂盒(invitrogen,carlsbad,ca)从rna合成cdna,通过实时-逆转录聚合酶链式反应(realtime-reversetranscriptionpolymerasechainreaction,q-rt-pcr)定量分析cdna。图7展示了利用基因表达分析试剂盒(appliedbiosystems,fostercity,ca)测量的在hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的各自表达图中,由蓝/紫光诱导的皮肤基因的变化的rt-pcr评价结果。用于扩增单个基因的引物如表1所示。如图7a至7q所示,结果表明,当辐射蓝/紫光时,在实施例1至3中,hbd-1、hbd-2、hbd-3、ll-37、银屑素、皮离蛋白和核糖核苷酸酶7的表达水平减少,且减少程度取决于实施例1至3的蓝/紫光防护效果。这表明了amps的表达水平可作为用于评价蓝/紫光防护功能的指数。实验实施例7作为本发明的一个实施例,进行以下实验,当波长为400~500nm范围内的蓝/紫光辐射在皮肤细胞上时,测量依赖于材料具有的防晒功能,s-亚硝基化蛋白的合成的变化。首先,本发明所用的人表皮新生角质形成细胞通过商业上有保障和推荐的途径购自lonza,inc.(walkersville,马里兰,美国)。将其传代培养,然后在37℃和5%co2条件下在co2培养箱中培养。根据lonza,inc.kgm-2项目试剂盒提供的指导制备培养基:将bpe(牛垂体抽取物)2ml,hegf(人表皮生长因子)0.5ml,胰岛素0.5ml,氢化可的松0.5ml,铁传递蛋白0.5ml,肾上腺素0.5ml和硫酸庆大霉素溶液+两性霉素-b(ga-1000)0.5ml加入到500mlkbm-2(clonetics,cc-3103)溶液中。在带通滤波器上涂覆2mg/cm2的实施例1至3的防晒制剂,在带通滤波器下放置人表皮新生角质形成细胞。然后,在涂覆有防晒制剂的区域上方辐射强度为30j/cm2的波长在400~500nm范围内的蓝/紫光。接下来,移除人表皮新生角质形成细胞的培养基,用2ml磷酸盐缓冲溶液(pbs)清洗细胞。然后用生物素转换方法检测s-亚硝基化蛋白的合成。具体地,将清洗的细胞在hents溶液(hepes,tritonx100,sds,蛋白酶抑制剂,edta)中裂解10分钟,仅取上清液。定量蛋白后,用hen溶液(hepes,蛋白酶抑制剂,edta)将浓度调节至600ug/200ul。为了阻止半胱氨酸的非s-亚硝基化反应,加入mmts(sigma)至浓度为10mm,在50℃下反应15分钟。用丙酮沉淀蛋白后,将蛋白溶解于于含有1mm的hpdp-生物素(pierce)的抗坏血酸(sigma)的hens溶液(hepes,十二烷基磺酸钠、蛋白酶抑制剂、乙二胺四乙酸)中,在37℃下反应1小时使生物素与s-亚硝基化半胱氨酸共轭结合。用丙酮沉淀蛋白后,将蛋白溶解于hens溶液中。取出5%输入物用于校正,分别加入20μl抗生素蛋白-琼脂糖小珠(avidin-agarosebeads)(pierce),在4℃下反应12小时。用中和液(hepes,乙二胺四乙酸,氯化钠,tritonx100)清洗小珠5次,然后加入样品缓冲液。将所得混合物煮沸后和输入物进行sds-page。随后,通过银染法用sds-page鉴定s-亚硝基化蛋白。sds-page结果如图8所示。如图8所示,结果表明与没有经蓝/紫光辐射的对照样品相比,实验样品的s-亚硝基化蛋白(sno-proteins)的体内合成取决于实施例1至3的防晒效果。这表明了s-亚硝基化蛋白的合成可作为用于评价蓝/紫光防护功能的指数。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1