单一粒子解析方法及用于该解析的系统与流程
本发明涉及以对来自包括人在内的动物的es细胞、ips细胞等的分化细胞以避免其损伤的方式进行纯化浓缩的方法。进而涉及以一个单位分取并解析细胞、细胞块(细胞球形体)的方法。
背景技术:
在再生医疗领域,对于使用多能干细胞的面向再生医疗、药物设计的应用而言,虽然已掌握了使目标细胞分化的技术关键,但是因该情况下,若在移植的分化细胞群中混入了未分化细胞则会导致肿瘤。因此,将未分化细胞完全除去的技术非常重要。而且该除去处理必须无菌。特定细胞的浓缩通常使用下述所说明的细胞分选仪,但是由于不是无菌处理、细胞损伤大等的原因,并不适于再生医疗技术。因此,当前需要适于实用化的新装置。
首先,对分取细胞的细胞分选仪的现有技术进行说明。细胞分选仪是对目标细胞进行分取并浓缩的装置,具有作为识别目标细胞的流式细胞仪的解析功能。该流式细胞仪通常被用于解析各种类型的细胞及液体中包含的粒子。现有的流式细胞仪通常由石英制作并具备光学透明的流动室,所述流动室形成有流路以使包含需要通过该流式细胞仪而被逐个识别的细胞的液体流通。通过该流路的细胞流通常因同心地包围该细胞的流动的鞘(sheath)液体而集中于流路的中央部流动。该流路的中央部被激光束照射,当细胞通过该照射区域时会产生依存于细胞的尺寸、形状、折射率的光散射。为了用荧光检测经荧光色素特异性染色的细胞,按照与荧光色素种类的组合来决定该激光的波长。这样,利用多个光检测器以不同波长对每个细胞检测荧光(除散射光外),从而能够多方面地解析细胞。上述的流式细胞仪的技术已被专利文献1记载。
专利文献1及专利文献2中记载了通常的细胞分选仪产品中使用的细胞或微粒的分离方法。该方法为通过将试样液作为液滴从液滴形成用喷嘴中向空气中吐出并对包含分离对象的细胞的液滴施加电荷、从而利用电场进行分离的方法。专利文献3公开了一种分离测量的方法,其通过使鞘流在流经流动室的试样液的周围流动,并对试样液施加电场,由此使带电的粒子从试样流向鞘流侧偏移而进行分离测量。专利文献4中记载了如下方法:对流经流动室的粒子施予压力脉冲,将粒子分离到流动室内的非平稳流动的流路中。专利文献5中记载了下述技术:对在流动室内周围被鞘流挤压流动的微粒施加场,使微粒流偏移从而进行分离。专利文献6中公开了下述方法:利用设置于流动室内的流路两侧的凝胶电极,将液体中带电的细胞用电场进行分离。专利文献7中公开下述方式:通过垂直形成弯液面的气泡对粒子流施加压力脉冲,从而使粒子流偏移并分离。专利文献8描述了以水滴单位射出并回收至容器,所述水滴单位含有以同专利文献5一样施加压力脉冲为目的的粒子。专利文献9中记载了下述方法:测量被鞘流挤压的试样液流中的粒子,在判断为靶标粒子的情况下,通过脉冲流将其导入其它流路来进行分离。该技术是固定型微流路内的分选技术,不是一次性交换型流路内的分选技术。利用涂覆了抗体的磁性粒子,使磁性粒子吸附于特定的细胞,利用梯度磁场进行分离的方法是已知的(专利文献10)。专利文献11记载了最适于再生医疗的实现无污染的使用一次性交换型的微流路筒的流式细胞仪技术。另外,专利文献12中记载了在一次性交换型的微流路筒内进行分离的方式。另外,专利文献13为改进降低了微流路内流动影响的方式。作为在一次性交换型微流路片内进行细胞分离的技术,专利文献14和专利文献1中记载了通过在流路内设置用磁力进行驱动的阀门从而分取细胞的技术。
接着,对以一个单位分注细胞的技术进行说明。在专利文献16中记载了利用中空移液管吸上细胞并在不同的位置移动地吐出从而进行分注的技术。专利文献17中记载了通过图像识别确认细胞的有无后,利用基于压电元件的压力脉冲驱动以液滴单位滴下从而进行分注的技术。此外,专利文献23中记载了为了以无菌处理进行分注,分注头可交换的分注方法。
接着,对能够以一个单位分析细胞的基因的技术进行说明。在1999年由vogelstein和kinzler提出了被称作数字pcr的技术。该技术作为在夹杂物中高敏感度地检测目标基因序列的方法而优异。该技术已被记载于非专利文献1中。该技术通过将pcr反应空间微小地进行细分,从而排除夹杂物的影响,使得可高敏感度检测。
专利文献19中描述了:为了形成油中液滴的乳液,使用氟系油来形成的技术;在油中液滴的乳液粒子内进行数字pcr的技术;以及,利用以一对一的方式使不同的乳液粒子融合的方法,向乳液粒子内追加不同的pcr反应试剂的方法。
专利文献20中描述了对通过流路内的粒子的流速进行测量的技术。该方法记载了:将同一光源分支成2个,沿流路中的流动照射隔开了方向的一定距离的两点,利用两点间的时间差评价流速的方法。
专利文献21中记载了下述方法:在微粒在大气中流下来时从喷嘴吹送脉冲式风,从而不需要的微粒吹跑,使必要的微粒向下落下而进行回收。
专利文献22中记载了以收入细胞的状态形成油中液滴的技术。还描述了利用以一对一的方式使不同的乳液粒子融合的方法,向乳液粒子内追加不同的pcr反应试剂的方法。
现有技术文献
专利文献
专利文献1:美国专利第3710933号;
专利文献2:美国专利第3826364号;
专利文献3:专利公开昭和64-3541号公报;
专利文献4:特开平1-170853号公报;
专利文献5:国际公开第98/10267号;
专利文献6:国际公开第2004/101731号;
专利文献7:美国专利第6808075号;
专利文献8:国际公开第2006/076195号;
专利文献9:美国专利第4756427号;
专利文献10:国际公开第96/28732号;
专利文献11:美国专利第8248604号;
专利文献12:专利第5382852号;
专利文献13:国际公开第2011/086990号;
专利文献14:美国专利第8822207号;
专利文献15:美国专利第8993311号;
专利文献16:美国专利申请公开第2005/0136528号;
专利文献17:美国专利第8834793号;
专利文献18:专利第4927719号;
专利文献19:美国专利第7968287号;
专利文献20:特开2006-300565号公报;
专利文献21:美国专利第6657713号;
专利文献22:美国公开专利us20150057163。
非专利文献
非专利文献1:bertvogelsteinandkennethw.kinzler“digitalpcr”proc.natl.acad.sci.usavol.96,pp.9236-9241,august1999;
非专利文献2:whiteetal.“digitalpcrprovidessensitiveandabsolutecalibrationforhighthroughputsequencing”bmcgenomics2009;10:116;
非专利文献3:jimf.huggettetal.“thedigitalmiqeguidelines:minimuminformationforpublicationofquantitativedigitalpcr”clinicalchemistry2013jun;59(6):892-902.;
非专利文献4:naohirataetal.“achemicalprobethatlabelshumanpluripotentstemcells”cellreports6,1165-1174,march27,2014;
非专利文献5:richardwilliamsetal.“amplificationofcomplexgenelibrariesbyemulsionpcr”naturemethodsvol.3no.72006545-550;
非专利文献6:sigma-aldrichproductinformationseqplexdnaamplificationkitcatalognumber:seqxe;
非专利文献7:sigma-aldrichproductinformationseqplexrnaamplificationkitcatalognumber:seqr。
技术实现要素:
(一)要解决的技术问题
本发明如下所述地描述了再生医疗用的细胞分析中的多个课题。
1)分选中的课题
作为适合再生医疗的分选,以适合于无污染、无损伤、及无菌处理的分选的一次性交换型微流路筒内的分选技术中的课题为中心进行说明。
1-1)用于无菌处理的分选的课题
作为再生医疗用,必须不对分选处理所分取得到的细胞施予损伤,并且必须为无菌处理。作为用于满足以上的条件的分选仪,根据进行大气中的分选的方式,利用一次性流路筒内进行分选的方法是适合的。作为一次性流路筒内的分选方式,专利文献13中记载了利用空气压控制流路筒内的细胞流从而进行分取的方法。该方法中,流路筒上的容器内的空气与流路筒外部的空气泵内的空气介由过滤器而连接。该过滤器具有防止漂浮在空气中的细菌或异物混入流路筒内的液体中的作用。然而,由于该过滤器的孔径小时、空气的电导变小,因此存在引起分选力降低的问题。
专利文献14和专利文献15中记载了下述技术:在一次性交换型流路筒的流路内设置可利用磁力可移动的阀门,通过基于来自外部的电磁石的on-off的阀门驱动,从而分选细胞。该情况下,由于分选力是与空气力无关的磁力,引出密闭空间下的分选成为可能,实现了无菌分选。然而,由于一次性流路筒自体将不适于量产的复杂的可移动部结构编入内部,因此存在价格昂贵的问题。
1-2)样本浓度调整的课题
专利文献11中记载了使用了一次性交换型流路筒的流式细胞仪的技术。该技术为下述方法:通过对鞘液容器和样本液容器施加相同的空气压,能够以样本流的细化保持不变的方式使流速变化。与之相对地,向一次性交换型流路筒内加入样本粒子液,如果粒子液的浓度过高、或者过薄的情况下,存在必须回收该样本并再次进行浓度调整的问题。
1-3)分选巨大的细胞或细胞块的技术课题
在再生医疗中可进行细胞的大量培养,但细胞不是以散乱的状态个别地进行培养,而是多以细胞块(细胞球形体)的状态培养。其尺寸多为100微米以上。与之相对,专利文献1和专利文献15中记载的细胞分选仪的原理以在大气中将包含一个细胞的液滴从喷嘴中呈液滴状地一个一个进行分取为目的,难以稳定地形成包含100μm以上的细胞块的液滴。与之相对,专利文献21中公开了不受该限制的技术。该方式为下述方式:不是以从喷嘴吐出而在大气中呈液滴状态而是以连续的丝状流动的状态,从一边吹送脉冲式空气的风,从而将不必要的细胞除去,并使必要的细胞落下而进行回收。然而,该方式不是封闭空间中的细胞分取,因此,由于漂浮于大气中的细菌的污染或流路整体不是交换型的,所以不适于无菌处理。专利文献13中记载的一次性交换型流路筒内的细胞回收分选技术中,流路截面的尺寸为宽80μm和深80μm的情况下,虽然确认了可分选40μm大小为止的细胞球形体,但是100μm以上的细胞球形体不能在流路中流动。因此,尚未实现在适于再生医疗用途的一次性筒内无菌分选大的细胞块(细胞球形体)的技术。
1-4)与再生医疗中的分化细胞的纯化有关的课题
再生医疗中,将包含分化细胞的细胞鞘等移植给患者时,必须除去导致肿瘤的未分化细胞。通常的分化诱导中,分化诱导率不是100%左右,至少混合存在有1%左右的未分化细胞。作为将其除去的方法,存在下述方法:利用细胞分选仪仅分取分化细胞的所谓的通常细胞分选方法(专利文献1和2);以及,专利文献10中记载的利用抗体磁珠将未分化细胞除去的方法。大气中的液滴分离方式的通常细胞分选中,存在以高速流动而进行回收时的液面冲突等导致细胞损伤变大的课题,抗体磁珠的情况下,存在不能将在细胞块中未在表面出现的未分化细胞除去的课题。
1-5)乳液分选的必要性和课题
已经认识到病理组织是多种细胞的混合,在集体平均的数据中无法解析。因此,正在关注通过将pcr反应空间微小地细分,从而不易受到夹杂物的影响的数字pcr(digitalpcr)。该方式大致分为乳液方式和多腔室方式两种方式。乳液方式对于10万个以上的解析有利,多腔室方式对1万个左右以下的解析有利。另一方面,过去十年中,已实现了提高四位数的性能/性价比的奇迹的下一代dna测序仪正在创造今后新的市场。该下一代测序仪中,正在寻求高纯度样本精制(非专利文献2、3)。作为用于该精制的工具,正在寻求数字pcr后的乳液液滴的分选。因此,以下对乳液液滴的分选的课题进行说明。
本发明中,将细胞收入乳液的微小反应空间内,利用以细胞内的基因的一部分序列为靶标的数字pcr,进行包含具有目标的一部分序列的基因的乳液液滴的特异性荧光标记。并且,提供用于下述过程的前处理装置和技术:以该荧光为指标,分取具有目标基因的乳液粒子,然后,将该粒子内所包含的单一细胞的全基因扩增,进行基于测序仪的详细解析。由于从一开始就不可能存在dna的污染,因此应当为在一次性交换型片内进行处理的技术。作为该方法的课题存在以下的内容。
关于使用了油中液滴的乳液的数字pcr技术,在专利文献19中记载了使用了氟类油的方法。作为该氟类油,氟化液等是已知的,但比重大,而且氟类油中的液滴具有浮在油的上部的特性。在一次性交换型流路筒中分选该乳液粒子时,乳液为浮在一次性流路筒上的容器的上部的状态,油从容器底面流出至流路从而油上表面变低时,乳液的水滴附着于容器内壁,从而存在乳液总量中的80%左右附着、损失大的问题。
1-6)与流速有关的课题
细胞分选仪等细胞分取装置中,将可控制流速为一定作为前提。其理由在于:在液体中检测微粒、进行识别判定,如果是目标粒子时,在比检测位置更靠近下游侧分取该粒子。由于从检测位置到达分取位置的时间根据流速而变化,因此为了在检测后一定的时间后进行分取,流速必须一定。
流路内的流速虽然能够通过所施加的压力进行调整,压力与流速的关系会因使试样悬浊的缓冲液的粘性、为了使试样液细化而一起流动的鞘液的粘性而变化。因此,关于缓冲液的种类、鞘液,就市售的细胞分选仪而言通常限定了制造者。
上述的现状中,为了根据细胞的种类以有生命的状态进行测量,多数情况下必须为特定的培养基。因此,不仅需要特定的缓冲液,而且需要包含培养基等、且与不同粘性的各种缓冲液对应的流速调整技术。
2)解析单一细胞的方法的课题
再生医疗中,移植分化细胞群时,其中不能包含导致肿瘤的未分化细胞。因此,必须检测除去乃至以每1,000,000个分化细胞中1个左右的低密度混入的未分化细胞,进行用于此的分化细胞的品质管理是重要的。为此,需要一个细胞的分析或以细胞块单位的分析。为了该分析,如非专利文献1所描述地那样利用微小空间内的检测反应排除夹杂细胞的影响的数字pcr是合适的。专利文献22中描述了下述方法:将细胞以一个单位收入至乳液液滴,利用其微小空间内的检测反应进行分析。因此,使乳液内的细胞溶解后进行pcr反应。通常的pcr的检测敏感度为可检测非靶标基因的1/1000左右的浓度的靶标基因的水平。与之相对,数字pcr的情况下无夹杂物的影响,因此特异性的界限为:若反应空间的细分个数为100万个,则可检测1/100万左右的靶标。利用该方法,可将具有特定的基因序列的比率进行定量。与之相对,由于具有一部分的作为目标的基因序列,因而其它序列是否共通不得而知。因此,在以一个单位分取具有作为目标的基因序列的基因后,必须将全基因扩增,并利用下一代测序仪决定全序列。为了执行该方法,在pcr反应后必须向利用荧光信号而挑选的乳液液滴中追加全基因扩增用的试剂。作为该方法,专利文献19和22描述了在任意流路内以一对一的方式使不同的液滴融合的方法。根据这些方法,若使融合的另一方的乳液的液滴中包含下一反应的试剂,则可在融合后实施其它全基因扩增反应。然而,上述的方法由于没有控制各个液滴的位置,因此准确性低。
另一方面,作为以不利用乳液的方式进行单一细胞的详细解析的方法,考虑了下述方法:在一次性交换型流路筒内分取细胞后,直接将单一细胞向多孔板分注,然后利用pcr反应等进行解析。该情况下,存在如专利文献17中记载的那样利用压电将分注液从分注喷嘴中吐出的方法。该方法的课题在于压电导致的压力脉冲对细胞施予损伤。因受到损伤乃至死亡的细胞例如不可进行rna的解析,因此与细胞分选同样地,细胞的分注中也要求低损伤性。
(二)技术方案
本发明本申请的发明人鉴于上述情况,对再生医疗中最适的解析单一细胞或细胞球形体的方法、从分化细胞中除去未分化细胞的方法、及关于其的装置进行了深入研究,结果出奇地发现了利用以下的装置或方法能够解决所述的技术问题。
本发明是基于上述的知识完成的。
因此,本发明涉及以下内容。
[1]一种解析及分离微粒的装置,其特征在于,其包括:
流路筒,其在透明基板上形成流路而成;
光照射单元,其对流经所述流路的试样液中的微粒照射光;
检测单元,其检测照射所述光时由所述微粒产生的散射光或荧光,并基于它们的信号强度对所述微粒进行识别,检测目标微粒;以及
力产生单元,其基于来自所述检测单元的信号,对流经所述筒的所述流路的所述微粒作用使流动的方向变化的力,
于所述筒形成有:试样液用的容器即样本容器,其与第一流路连接;第四分支流路和第五分支流路,其与所述第一流路的两侧相对地连接;第3a容器,其与所述第四分支流路连接,并用于送出脉冲流;第3b容器,其与第五分支流路连接,并用于利用由所述力产生单元产生的从第四分支流路向第五分支流路的方向流动的脉冲流,使微粒的流动向第五分支流路方向变化,从而分取进而回收微粒;以及,第四容器,其与第一流路的下游侧连接并储存未被分取的微粒,所述各容器被用于密闭的盖覆盖,从而将各容器内部从外部密闭。
[2]根据[1]所述的解析及分离微粒的装置,其特征在于,包括:
流路筒,其在透明基板上形成流路而成;
光照射单元,其对流经所述流路的试样液中的微粒照射光;
检测单元,其检测照射所述光时由所述微粒产生的散射光或荧光,并基于它们的信号强度对所述微粒进行识别,检测目标微粒;以及
力产生单元,其基于来自所述检测单元的信号,对流经所述筒的所述流路的所述微粒作用使流动的方向变化的力,
于所述筒形成有:试样液用的容器即样本容器,其与第一流路连接;第四分支流路和第五分支流路,其与所述第一流路的两侧相对地连接;第3a容器,其与所述第四分支流路连接,并用于送出脉冲流;第3b容器,其与第五分支流路连接,并用于利用由所述力产生单元产生的从第四分支流路向第五分支流路的方向流动的脉冲流,使微粒的流动向第五分支流路方向变化,分取进而回收微粒;以及,第四容器,其与第一流路的下游侧连接并储存未被分取的微粒,所述各容器被用于密闭的盖覆盖,从而将各容器内部从外部密闭,且具有使各容器内的空气压与各个装置内空气压控制系统的空气压相同的单元,通过利用各个装置内空气压控制系统控制各容器内的空气压,从而控制筒内的流路的流动。
[3]根据[1]所述的解析及分离微粒的装置,其特征在于,包括:
流路筒,其在透明基板上形成流路而成;
光照射单元,其对流经所述流路的试样液中的微粒照射光;
检测单元,其检测照射所述光时由所述微粒产生的散射光或荧光,并基于它们的信号强度对所述微粒进行识别,检测目标微粒;以及
力产生单元,其基于来自所述检测单元的信号,对流经所述筒的所述流路的所述微粒作用使流动的方向变化的力,于所述筒形成有:试样液用的容器即样本容器,其与第一流路连接;第四分支流路和第五分支流路,其与所述第一流路的两侧相对地连接;第3a容器,其与所述第四分支流路连接,并用于送出脉冲流;第3b容器,其与第五分支流路连接,并用于利用由所述力产生单元产生的从第四分支流路向第五分支流路的方向流动的脉冲流,使微粒的流动向第五分支流路方向变化,分取进而回收微粒;以及,第四容器,其与第一流路的下游侧连接并储存未被分取的微粒,
所述各容器被用于密闭的盖覆盖,从而将各容器内部从外部密闭,送出所述脉冲流的第3a容器及用于回收微粒的第3b容器的密闭盖为可伸缩变形的膜,具有从外部对所述密闭盖膜作用机械力使其位移的促动器,并具有在微粒通过分取区域时,通过利用所述促动器高速地按压第3a容器的密闭盖膜的动作、和提起第3b容器的密闭盖的动作,从而在分支流路内产生脉冲流,来分取微粒的单元。
[4]一种解析和/或分离微粒的装置,其特征在于,具备:
流路筒,所述流路筒具备:第一流路,其在基板上形成,并导入包含微粒的试样液;第二及第三流路,其配置于第一流路的两侧,并导入鞘液;合流第一流路,其合流第一~第三流路;第一容器,其为样本液的容器;以及,作为鞘液的容器的第二容器、储存废液的容器即第四容器;
光照射单元,其将光照射于流经所述合流第一流路的微粒;以及
检测及解析的单元,其检测及解析由所述微粒产生的散射光或荧光,
所述流路筒在合流第一流路的上游侧具有第一~第三流路,第一流路与第一容器连接,第二及第三流路与第二容器连接,合流第一流路包括与下游侧的第四容器连接的流路样式(日文:パターン),具有通过调整第一容器、第二容器、第四容器的各压力从而调整样本流的节流宽度和样本流速的功能。
[5]一种解析及分离粒子的装置,其特征在于,包括:
流路筒,其在透明基板上形成流路而成;
光照射单元,其对流经所述流路的试样液中的粒子照射光;
检测单元,其检测照射所述光时由所述粒子产生的散射光或荧光,并基于它们的信号强度对所述粒子进行识别,检测目标粒子;以及
力产生单元,基于来自所述检测单元的信号,对流经所述筒的所述流路的所述粒子作用使流动的方向变化的力,
于所述筒形成有:试样液用的容器即样本容器,其与第一流路连接;第四分支流路和第五分支流路,其与所述第一流路的两侧相对地连接;第3a容器,其与所述第四分支流路连接,并用于送出脉冲流;第3b容器,其与第五分支流路连接,并用于利用从由所述力产生单元产生的第四分支流路向第五分支流路的方向流动的脉冲流,使微粒的流动向第五分支流路方向变化,分取进而回收微粒;以及,第四容器,其与第一流路的下游侧连接并储存未被分取的微粒,所述各容器被用于密闭的盖覆盖,从而将各容器内部从外部密闭,所述流路的流路宽度及流路深度为150微米以上,照射激光的流路宽度方向的光束尺寸为100微米以上。
[6]一种分化细胞纯化方法,其特征在于,使用了[1]~[5]中任一项所述的装置,在由未分化细胞分化成的分化细胞群中将相较于分化细胞以密度低混在的未分化细胞除去,通过基于来自检测单元的信号,对未分化细胞作用使流动方向变化的力,进行流路变更处理,对分化细胞不作用使流动方向变化的力,不进行流路变更处理,由此从贯穿的第四容器中包含的分化细胞中除去未分化细胞,从而回收细胞液,并提高分化细胞的回收速度。
[7]根据[6]所述的分化细胞纯化方法,其特征在于,对所述回收的细胞液反复进行相同的未分化细胞的除去处理。
[8]一种分注装置,其特征在于,在以一个单位分注试样液中包含的微粒的装置中,分注喷嘴为可自动交换的透明的中空移液管,分注液量为0.3μl以下,通过每次分注时中空移液管的分注液量整体的图像识别,从而检测10μm以上的粒子的有无和个数,并以指定的个数将粒子向多孔板分注。
[9]一种解析及分离粒子的装置,其特征在于,包括:
流路筒,其在透明基板上形成流路而成;
光照射单元,其对流经所述流路的试样液中的粒子照射光;
检测单元,其检测照射所述光时由所述粒子产生的散射光或荧光,并基于它们的信号强度对所述粒子进行识别,检测目标粒子;以及
力产生单元,其基于来自所述检测单元的信号,对流经所述筒的所述流路的所述粒子作用使流动的方向变化的力,
所述筒具备与流路连接的试样液用的容器即样本容器、以及用于通过所述力产生单元使流动的方向变化而从流路分取并回收粒子的与流路连接的容器,所述样本容器或回收经分取的粒子的容器的内壁为由防水性原料覆盖而成的结构、或者是防水性原料制造的转接器覆盖而成的结构。
[10]根据[9]所述的解析及分离粒子的装置,其特征在于,所述防水性原料为氟树脂。
[11]一种油中液滴形成方法,其特征在于,在流动有试样液体的流路中,经由从左右合流的流路使油合流,由此形成油中液滴,在该方法中,通过在试样液体中混入比重高的成分,从而使液滴的比重比油大。
[12]根据[11]所述的油中液滴形成方法,其中,所述比重高的成分为聚钨(polytungsten)、三溴甲烷、或碘甲烷(iodomethane)。
[13]一种微粒测量或微粒分取装置,其包括:
流路筒,其在透明基板上形成流路而成;
光照射单元,其对使试样液中的微粒流通的所述流路的一部分照射光;
检测单元,其检测各所述微粒通过所述光照射区域时产生的散射光或荧光;以及,
识别单元,其基于各光信号识别目标微粒,
所述微粒测量或微粒分取装置包括:基于所述光信号测量各个微粒的流速的单元、以及将微粒的流速调整为一定的单元。
[14]根据[13]所述的微粒测量或微粒分取装置,其特征在于,测量所述流速的单元是将波长不同的两种照射光分别向流路中的流动方向的间隔一定距离的位置照射的照射光学系统,将微粒的流速调整为一定的单元是测量微粒通过时产生的各波长的散射光强度的脉冲波形的时间变化,并基于各脉冲波形的峰值的时间差来计算各个微粒的流速,并且以使微粒的平均流速一定的方式来调整流速的单元。
[15]一种微粒测量或微粒分取方法,其特征在于,使用了所述[13]或[14]所述的微粒测量或微粒分取装置,在任意的缓冲液中悬浊微粒。
[16]根据[15]所述的微粒测量或微粒分取方法,其特征在于,所述缓冲液为水性液或油性液。
[17]一种细胞的基因解析系统,其包括:
形成包含细胞、细胞溶解试剂以及pcr反应试剂的油中的液滴的单元;
在细胞溶解反应后进行pcr反应的单元;
在pcr反应后利用荧光标识来分取油中的液滴的单元;以及
以一个单位分注经分取的油中的液滴的单元。
[18]根据[17]所述的基因解析系统,其特征在于,所述细胞为一个细胞或一个细胞球形体。
[19]根据[17]或[18]所述的基因解析系统,其特征在于,所述形成油中的液滴的单元为一次性流路筒,就该一次性流路筒而言,所述一次性流路筒的流通细胞的流路宽度至少为100μm以上,且能够将形成的油中的液滴的尺寸调整至40μm~100μm。
[20]根据[17]~[19]中任一项所述的基因解析系统,其特征在于,所述分注单元为向多孔板的分注单元,从分注喷嘴吐出的液体以与存在于多孔板的内壁或多孔板内的液体接触的状态挤出。
[21]根据[17]~[20]中任一项所述的基因解析系统,其特征在于,所述分注单元中的分注喷嘴为可自动交换的透明的中空移液管,分注液量为0.3μl以下,并且每次分注时进行中空移液管的分注液量整体的图像识别,在有一个10μm以上的粒子时进行吐出。
[22]一种基因解析方法,其包括:
形成包含细胞、细胞溶解试剂以及pcr反应试剂的油中的液滴的工序;
在细胞溶解反应后进行pcr反应的工序;
利用pcr反应后的荧光标识来分取油中的液滴的工序;以及
以一个单位分注经分取的油中的液滴的工序。
[23]根据[22]所述的基因解析方法,其特征在于,所述细胞为一个细胞或一个细胞球形体。
[24]根据[22]或[23]所述的基因解析方法,其特征在于,所述形成油中的液滴的工序使用了一次性流路筒,流通细胞的流路的宽度尺寸至少为110μm以上,形成的油中液滴的尺寸为40μm至100μm。
[25]根据[22]~[24]中任一项所述的基因解析方法,其特征在于,所述油中的液滴的分注工序为向多孔板的分注,从分注喷嘴吐出的液体以与存在于多孔板的内壁或多孔板内的液体接触的状态挤出。
[26]根据[22]~[25]中任一项所述的基因解析方法,其特征在于,所述油中的液滴的分注工序中的分注喷嘴为可自动交换的透明的中空移液管,分注液量为0.3μl以下,每次分注时进行中空移液管的分注液量整体的图像识别,仅在有一个10μm以上的粒子时进行吐出。
[27]一种乳液液滴形成装置,其特征在于,在形成包含细胞的油中液滴的装置中,形成油中液滴的流路位于一次性流路筒内,在该筒中形成有与流路连接的多个容器,流通细胞的流路宽度尺寸至少为110μm以上,通过控制各容器的液体上部的空气压,从而可将形成的油中液滴的尺寸在40μm至100μm的范围内调整。
(三)有益效果
本发明根据本发明,再生医疗中所必要的密闭空间的无菌分选成为可能。进而实现了混合存在于由ips细胞或es细胞分化诱导而成的分化细胞群中的未分化细胞的有效除去,实现了每106个分化细胞中,未分化细胞为0个。此外,尺寸100μm以上的细胞块(细胞球形体)的分选成为可能,以块单位除去细胞块所包含的未分化细胞成为可能。进而,以1个细胞单位、或以细胞球形体单位的基因解析成为可能。
附图说明
图1中,(a)表示将一次性交换型流路筒内的容器盖上后的封闭系统的状态。(b)表示以将一次性交换型流路筒内的容器盖上后状态从外部控制筒内部的流路的液体的流动的方法。(c)表示对上述(b)中流路内的粒子进行解析的测定系统。
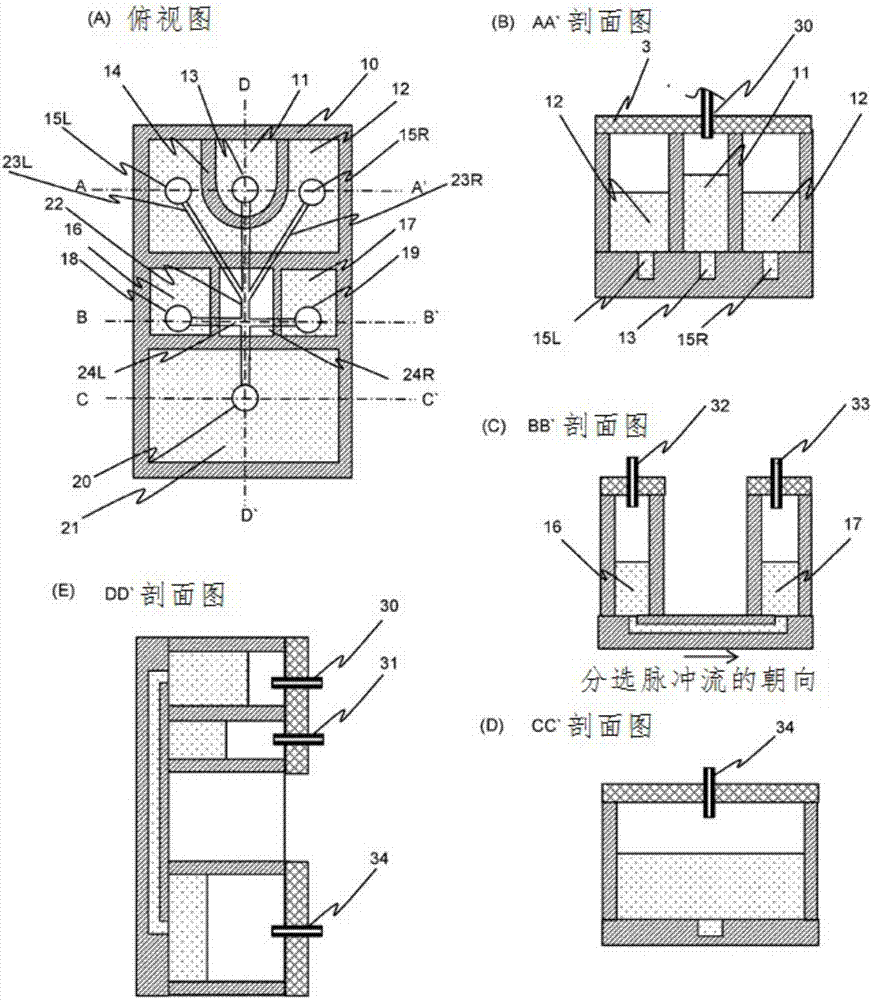
图2中,(a)表示分选用一次性交换型流路筒的俯视图。(b)表示分选用一次性交换型流路筒的aa’剖面图。(c)表示分选用一次性交换型流路筒的bb’剖面图。(d)表示分选用一次性交换型流路筒的cc’剖面图。(e)表示分选用一次性交换型流路筒的dd’剖面图。
图3表示分选用一次性交换型流路筒内的流路样式。
图4中,(a)表示将图2的分选用一次性交换型流路筒用于乳液液滴的分取用时的结构的俯视图。(b)表示(a)的aa’剖面图。
图5中,(a)表示在分选用一次性交换型流路筒中,用于流速评价的2种激光照射位置。(b)表示用于评价流速的信号测量方法。
图6表示用于形成包含细胞的油中液滴的一次性交换型流路筒。
图7为图6的流路样式的说明图。
图8为同时形成4种包含细胞的油中液滴的一次性交换型流路筒的俯视图。
图9中,(a)为分注油中液滴的方法的模式图。(b)表示从分注移液管中排出油中液滴的情形。(c)为装置外观图。
图10表示利用基于注射泵与电磁阀的串联连接的脉冲空气压作为分选力的情况。
图11表示利用电磁执行器使按压弹性盖膜的力变化从而产生分选力的情况。
图12中,(a)为表示使一次性交换型流路筒内的试样液容器的压力变化从而调整流速时的流速的实测例。(b)为表示使一次性交换型流路筒内的试样液容器的压力变化从而调整样本流的宽度(velocity)时的实测例。
图13中,(a)表示利用波长不同的2种激光的侧面散射信号来测定流速时的一次性交换型流路筒结构的例子。(b)利用波长不同的2种激光的侧面散射信号来测定流速时的装置光学系统的例子。
图14表示粒子的流速分布的实测例。
图15中,(a)表示再生医疗中的未分化细胞除去处理效率的评价例(未分化细胞比率20%时)。(b)表示再生医疗中的未分化细胞除去处理效率的评价例(未分化细胞比率<0.3%时)。
图16表示分注移液管内的10μm粒子的摄像机图像。
图17为概括了单一细胞的解析的步骤(情形1)、单一细胞块的解析的步骤(情形2)、包含单一细胞的乳液液滴的解析的步骤(情形3)、包含单一细胞块的乳液液滴的解析的步骤(情形4)流程图。
图18中,(a)为表示使用了用于将图2的样本液用容器、鞘液用容器、废液用容器的平稳流动的流速保持不变的定压泵控制的压力控制的图。(b)为将进一步连接电磁阀与压缩机或真空泵和电动气动调节器和缓冲罐的系统作为图2的分选液容器16及回收容器17用的压力控制的图。
图19为表示使空气压控制系统的空气压与容器内的空气压相同的单元之一的实施方式的图。
具体实施方式
1)用于解决分选中的课题的单元的实施方式
将细胞分取装置适用于再生医疗时,在一次性交换型流路筒内的封闭系统进行细胞分取的方法是合适的。另外,在用于利用数字pcr的单一细胞的基因解析的无样本间的dna污染的、一次性交换型流路筒内的乳液液滴的分取技术是合适的。然而,存在几个课题,必须解决这些课题。对解决这些课题的实施方式进行说明。
1-1)用于解决无菌处理所用的分选的课题的实施方式
本发明的解析及分离微粒的装置包括:流路筒,在透明基板上形成流路而成;光照射单元,对流经所述流路的试样液中的微粒照射光;检测单元,检测照射所述光时由所述微粒产生的散射光或荧光,基于它们的信号强度对所述微粒进行识别,检测目标微粒;以及,力产生单元,基于来自所述检测单元的信号,对流经所述筒的所述流路的所述微粒作用使流动的方向变化的力。其特征在于,所述流路筒中形成有:试样液用的容器(样本容器),其与第一流路连接;第四分支流路和第五分支流路,其与所述第一流路的两侧相对地连接;第3a容器,其与所述第四分支流路连接,并用于送出脉冲流;与第五分支流路连接的第3b容器,其用于利用从由所述力产生单元产生的第四分支流路向第五分支流路的方向流动的脉冲流,使微粒的流动向第五分支流路方向变化,从而分取并回收微粒;以及,第四容器,其与第一流路的下游侧连接,并储存未被分取的微粒,所述各容器被用于密闭的盖覆盖,从而将各容器内部从外部密闭。
使用图1(a)及(b)对本发明的解析及分离微粒的装置进行说明。图1(a)表示用具有单纯的两个容器的流路筒气密性地控制筒内的流路的流动的方法。容器2a和容器2b形成在基板1上,并与形成于基板1内的流路4连接。各个容器为被盖3a和盖3b气密性地盖上的结构。这些盖为可变形的橡胶。筒的原材料为透明树脂,为cop、coc、pmma的任一者的原材料即可。作为该盖的原材料,优选作为防水性原料的伸缩性树脂的teflon(注册商标)类的弹性体,但为通常的硅橡胶也可。即,本发明的解析及分离微粒的装置通过利用盖覆盖各容器,各容器内部从外部被密闭,例如能够无菌地解析和/或分离细胞。此外,利用盖覆盖容器的特征可适用于本说明书记载的所有方式的装置。
对于本发明中使用的流路筒而言,如上所述为用盖覆盖容器的流路筒,使用时,通过使中空的针状的管气密性地贯通盖,能够以连通装置内的空气压控制系统与容器内的方式使用。该中空的针状的管为使容器内的空气压与各个装置内空气压控制系统的空气压相同的单元之一的例子。
例如,图1(b)表示分别使中空的针8a和8b气密性地贯通盖3a和盖3b的状态。中空的针优选为不锈钢制。中空的针8a和8b各自连接有注射泵9a和9b。该状态下,按压注射泵9a作为正压、拉拽注射泵9b作为负压时,筒内的试样液5a流经流路4内,向废液4移动。通过使用中空的针状的管气密性地贯通各容器的盖,并且将筒设置于装置中,能够使装置内的空气压控制系统的空气压与容器内的空气压相同。即,作为使空气压控制系统的空气压与容器内的空气压相同的单元之一,通过使与多个装置内空气压控制系统连接的多个中空的针状的管气密性地贯通各容器的盖,并将筒设置于装置中,能够调整空气压。使该空气压相同的单元可适用于本说明书中记载的所有的方式的装置。
作为除上述方法以外的使空气压控制系统的空气压与容器内的空气压相同的单元,可使用图19记载的结构。如图19(a)所示,覆盖容器的盖为由打开孔的盖401及堵住该孔的盖402形成的两层结构,为通过两层的接触保持气密的结构。如图19(b)所示,通过该两层结构的盖的孔的部分例如被棒403从上部押压,两层的盖的一部分分离而破坏气密,容器内与盖上部的空间的空气压变得相同。利用这样的方法使空气压控制系统的空气压与容器内分空气压相同时,为了将容器内空间404例如保持为无菌,将空气压控制系统及容器空间从外部的环境中隔绝是重要的。因此,如图19b所示地将棒的周围用可变形的橡胶等原材料的侧璧405包围,通过使该侧壁与打开孔的盖401接触,能够将空气压控制系统及容器空间从外部的环境中隔绝。使该空气压相同的单元可适用于本说明书中记载的所有方式的装置。
本说明书中,作为装置内的空气压控制系统,可列举出基于大气压的控制系统、或基于泵和阀门的控制系统。此外,利用空气压控制系统进行控制的空气压可以是负压、正压、或常压的任一者,可根据需要进行调整。此外,使用中空的针状的管气密性地贯通各容器的盖的特征及装置内的空气压控制系统的特征可适用于本说明书中记载的所有方式的装置。
采用监控正压侧和负压侧的压力,并根据其值之差来控制流速的方法。
图1(c)图示了用于对流经上述的流路筒和筒内的流路的细胞等的粒子进行光照射,并检测来自粒子的光信号的光学系统和控制系统。从激光源35-1射出的激光对流路4照射。在粒子通过照射区域的瞬间,脉冲式地产生散射光和荧光。所述激光利用物镜151进行集光,为平行光。利用物镜的下游侧的光学系统每个波长地检测多个散射光和荧光。散射光利用二向色镜154和带通滤波器157选择与照射激光相同的波长,并利用检测器161进行检测。在检测器161的前侧设置遮光板160,从而将激光透过光除去。荧光利用二向色镜155、156和带通滤波器158,159以比照射激光长的波长分割成多个波长区域的方式利用各自不同的检测器162、163进行检测。检测器输出的光信号为模拟信号,因此利用ad转换器164转换成数字量,并输送至控制用计算机169,控制用计算机记录及显示结果。控制用计算机通过控制驱动与上游侧的容器连接的空气泵9a的促动器170和驱动与下游侧的容器连接的空气泵9b的促动器171,从而控制流经流路4内的粒子的速度。此外,照射激光35的光强度的控制通过由控制用计算机169控制激光源35-1的驱动电路35-2来进行。
使用图2(a)、(b)、(c)、(d)、及(e),对在分选用的一次性交换型流路筒中、从外部控制筒内部的液体流的方法进行说明。试样液的容器(样本容器:第一容器)11、鞘液的容器(第二容器)12和废液的容器(储存未被分取的粒子的容器:第四容器)21中的空气压目的在于控制细胞等粒子从上游向下游流动的流速,因此施加平稳的空气压即可。这些施加于试样液容器、鞘液容器及废液容器的“空气压”为本发明中的“空气压控制系统”之一。与之相对,分选力必须将短时间的脉冲式压力仅对流经主流路22的特定的粒子施予。即,本发明中,可使用基于来自检测单元的信号作用使流动的方向变化的力的力产生单元。图3为将图2的流路样式扩大而成的图,通过调整时机使得在粒子(根据来自在激光的照射区域35(检测区域)产生的粒子的信号光而判定为分选对象粒子)通过作为主流路22与分选流路(24l,24r)的交叉点的分选区域时产生分选力,从而仅分取目标粒子。将产生用于该分选的脉冲式空气压的力产生单元的例子示于图10。该图对应于图2(a)的bb’截面。如图10所记载的那样,产生脉冲式空气压力的方法中,通过将定压空气泵与高速电磁阀串联地连接,从而将定压空气泵90作为正压(本说明书中,压力全部以大气压为基准,用与大气压差压值表示),将定压空气泵91作为负压,使阀门92和93仅短时间打开时,脉冲式空气压力作用于容器16和17的内部,产生分选脉冲流。另外,所述“定压空气泵及高速电磁阀”也是本发明中的“空气压控制系统”之一。此外,“定压空气泵及高速电磁阀”也是施加用于分选的脉冲式压力的“力产生单元”之一。
接着,将与图10不同的产生脉冲式空气压的“力产生单元”的例子示于图11。该方法中,用有弹性的可伸缩的膜将容器16和17的上部盖上并密闭。分别固定已将该膜110和111设置在装置侧的电磁执行器(100、101)。在已将分选区域判断为分选对象的粒子通过时,使电磁执行器100和101仅短时间地位移。此时,电磁执行器100的力向按压膜的方向移动,相反地,电磁执行器101的力向上方的方向移动。以上的电磁执行器的脉冲时动作时,产生脉冲式的分选流。即,通过利用促动器而高速按压第3a容器的密闭盖膜的动作、以及提起第3b容器的密闭盖的动作,可产生分选流。电磁执行器的移动结束时,经分选脉冲流分取的微粒被收入回收容器17。此处,重要的是在脉冲流消失时,不产生使微粒逆流的流动。通过仅分选次数为使促动器的移动量增大的方式,从而防止逆流。理想的是在容器16和17的内部不进入空气的状态。这是由于未进入空气时,因为没有空气的压缩膨胀的过程,所以对容器内的液体产生影响的压力的时间应答速度快。另外,作为用于分选的力产生单元,为对第3a容器及第3b容器使用“电磁执行器”的情况下,对试样液容器、鞘液容器、及废液容器施加比“空气压控制系统”更平稳的空气压等而使用的力产生单元。
例如,图2的样本液用容器、鞘液用容器、废液用容器的压力控制是用于将平稳流动的流速保持为一定的控制,为压泵控制。作为该定压泵控制,有如图1所示那样的注射泵。作为其它的例子,有如图18(a)所示那样使用压缩机204和电动气动调节器202的方法。虽然在注射泵的情况下可无视压力变动,但在电动气动调节器中通常存在压力变动。为了使该变动缓和而与缓冲罐203连接。通过以此方式将压缩机、电动气动调节器和缓冲罐组合,能够以±0.025kpa的精度控制0.1kpa以下的一定压力。流路截面尺寸为宽80μm深80μm的流路中,为了使液体流动,通常将0.1kpa至30kpa的范围的一定压力用于平稳流动控制。因此,压力调整的精度为±0.025kpa是充分的性能。
图18(b)表示将电磁阀进一步与压缩机或真空泵、电动气动调节器以及缓冲罐连接的系统作为图2的分选液容器16和回收容器17用的压力控制。作为用于分选液容器16的压力控制系统,压缩机的压力在100kpa的范围内进行设定,电动气动调节器的控制压力设定为50kpa。另一方面,对于用于回收容器17的压力控制系统而言,若真空泵的设定在-100kpa的范围内进行设定,电动气动调节器的控制压力设定为-50kpa,则能够产生充分的脉冲流作为分选力,并分取微粒。
1-2)用于解决样本浓度调整的课题的单元的实施方式
使用图2,对在分选用的一次性交换型流路筒中进行样本浓度调整功能的方法进行说明。图2(a)表示分选用的一次性交换型流路筒的俯视图。该流路筒具有:包含细胞等粒子的试样液的容器(样本容器:第一容器)11与鞘液的容器(第二容器)12、废液的容器(储存未被分取的粒子的容器:第四容器)21、储存用于分选脉冲流的液体的容器(第3a容器)16、以及回收粒子的容器(第3b容器)17。各容器经由容器底面的端口部而与流路连接。试样液经由容器11的底面的端口13而与流路22连接,鞘液经由容器12的底面的左侧的端口15l而与流路23l连接,并经由右侧的端口15r而与流路23r连接。如图3所示,对容器11和容器12的液面的上部施加空气压时,试样液与鞘液合流从而汇聚于流路中心部而流动。对于试样液的宽度而言,若试样液的容器11的内部压力大于鞘液的容器12的压力,则合流以后的试样液的流幅w增大,相反地,若容器11的压力小于容器12的压力,则w变小。也就是说,通过施加于容器11和容器12的压力的比率,可调整试样液的宽度。对于试样液的流速而言,通过以施加于容器11和容器12的压力的比率一定不变的方式,使各自施加的压力变化,能够以流幅一定不变的方式使流速变化。在作为试样液中的测定对象的粒子、细胞的浓度高的情况下,以流速一定不变的方式进行减小w的宽度的调整,在浓度的情况下,以流速一定不变的方式进行增大w的宽度的调整即可,通过对容器11和容器12的施加压力的调整可以执行该调整。
图12(a)和(b)表示:在图2(a)的片中,将鞘液容器内的空气压设为1.8kpa(大气压基准)、将废液容器内的空气压设为-0.7kpa(大气压基准),使试样液容器内的空气压变化的情况下的流速与样本流宽度的相对变化。表示了该试样液的缓冲液是粘度为3.6cp的粘性液体、以及鞘液是粘度为1.07cp的液体时的实测例。获知了:使试样液容器的空气压增大至鞘液容器的空气压1.8kpa的2倍左右时,流速几乎一定不变,流路宽度扩大至2.6倍左右。与之相对,已经明确了:试样液容器的空气压小于鞘液容器的空气压1.8kpa时,流速增大,同时流路宽度变窄。因此,获知了为了调整流速和流路宽度,只要按压述步骤进行调整即可。采用下述步骤:最初根据试样液容器的压力与鞘液容器的压力的比率调整为目标样本流宽度,接着,利用废液容器的压力的调整以样本流宽度一定不变的方式仅调整流速。如上所述,为了以不使样本流宽度变化的方式仅调整流速,废液容器的压力控制是重要的。此外,该调整中需要流速评价。关于流速评价的内容,在下文叙述。
为了无菌地进行对各容器的空气压的施加,适用1-1)中所说明的力产生单元即可。图2(b)、(c)、(d)、及(e)中表示了图2(a)的各截面的图。各容器被盖3气密性地覆盖。为了对容器11内的试样液的上部的空气施加压力,如图2(b)及(e)所示,使中空的针30贯通容器11的盖。该针的内部的空气与经装置侧的容器11的压力调整后的装置内空气压控制系统连接。如图2(e)所示,为了对容器12内的鞘液上部的空气施加压力,使中空的针31贯通容器12的盖。该针的内部的空气与经装置侧的容器12的压力调整后的空气压控制系统连接。使中空的针34贯通下游侧的废液容器21内的盖。该针的内部的空气与经装置侧的容器21的压力调整后的空气压控制系统连接。施加于容器21的压力必须为大气压以下的负压侧。接着,容器16内和容器17内的空气压控制为用于分取试样液的粒子的脉冲压力的控制,与上述利用定压的空气压的流速控制不同。如图10所述,利用脉冲压分取粒子的方法是在定压泵与常闭型电磁阀的串联连接而成的系统中,利用以电磁阀短时间的开启状态产生的脉冲压。利用通过作为激光照射区域的检测区域35时产生的散射光、荧光等信号光,识别是否是目标粒子,如果判断为目标粒子的情况下,在通过下游侧的流路24l与流路24r的交叉的区域时,以使得从流路24l产生push流、从流路24r产生pull流的方式对容器16内施予正压空气脉冲以及对容器17内施予负压空气脉冲。如图2(c)所示,分别使中空的针32与33贯通已用盖密闭的容器16和容器17的内部。
由于该中空的针的内径小的情况下,空气压的应对变差,因此内径必须为一定以上。若内径为1mm以上,则即使阀门开启(open)时间为毫秒级的程度的短时间,也能介由容器内的空气对流路内的液体传导粒子的分取所必需的压力。
1-3)解决用于分选巨大的细胞或细胞块(细胞球形体)的技术课题的单元的实施方式
为了分选100μm以上的细胞块,必须解决以下的课题。已知细胞或细胞块的尺寸越大,重力沉降速度越快。因此,在容器的底部的端口部,尺寸大的细胞块因重力沉降速度以短时间堆积,若细胞的堆积高度达到流路的深度以上,则会堵塞流路。因此,细胞块的分选中必须防止重力沉降。通过使比重高的成分混入细胞悬浊用缓冲液,提高缓冲液的比重,能够防止细胞的重力沉降。作为用于提高该比重的成分,可利用聚乙烯吡咯烷酮或结冷胶。使培养基混入这些成分,从而可细胞培养,可无视对细胞的损伤。没有必要使缓冲液的比重为细胞的比重以上,通过减缓重力沉降速度,也能防止细胞的阻塞。根据此前的实验,通过使缓冲液的比重为1.01以上,可防止通常的细胞的自然沉降。
接着,对一次性交换型流路筒的流路截面的尺寸进行说明。已经明确了:为了以无流路阻塞的方式使尺寸为100μm的细胞块稳定地流动,必须使流路宽度为150μm以上且流路深度为150μm以上,另外,在流路宽度80μm流路深度80μm的流路截面尺寸中,无阻塞地流动的细胞块尺寸为40μm。因此,必需比流动的细胞块的最大尺寸至少大40μm以上的流路截面的流路。
此外,作为用于分选巨大的细胞或细胞块的技术课题,考虑了分选力的不足。如图11所表示地,为了弥补该分选力,可以不经由空气,将直接产生电磁力的促动器100和101产生的力作为分选脉冲流施予至流动的液体。该情况下,时间性应答性变快,而且力也增大,因此适于分选巨大的细胞、细胞块。
1-4)解决与再生医疗中的分化细胞的纯化有关的技术课题的单元的实施方式
再生医疗中,已经研究了将包含由ips细胞、es细胞分化而成的分化细胞的细胞鞘等移植给患者。该情况下,问题在于导致肿瘤的些许混合存在的未分化细胞。分化诱导率不是100%左右,至少混合存在有1%左右的未分化细胞。以下对无菌地以无细胞损伤的方式除去该未分化细胞、并有效地纯化分化细胞的方法进行说明。
考虑了适用于除去在分化细胞群中例如以1%的密度混入的未分化细胞的过程的情况。作为对未分化细胞特异性荧光标记(label)的方法,有利用未分化细胞的表面标记的荧光抗体标记的方法,或者,利用非专利文献4中记载的可被未分化细胞特异性收入的、发出荧光的化合物的方法。荧光抗体标记可在细胞散乱的状态下对未分化细胞染色。与之相对,由于已知可被未分化细胞特异性收入的荧光化合物能够对组织内的未分化细胞特异性染色,因此能够对细胞块内的未分化细胞特异性染色。
将进行了上述的特异性荧光染色的细胞群的悬浊液作为试样,考虑了适用下述细胞分取的单元的情况。
若在形成有下述部件的流路筒内适用分取分化细胞的方法,则通过检测区域的每单位时间的细胞数是分化细胞为未分化细胞的99倍,因此以300个/秒的处理速度除去未分化细胞时,作为分化细胞的回收速度,为未分化细胞的99倍即约30000个/秒。所述部件为:流路筒,在透明基板上形成流路而成;光照射单元,对流经所述流路的试样液中的细胞照射光;单元,检测照射所述光时由未分化细胞产生的荧光,基于它们的信号强度对未分化细胞进行识别;力产生单元,基于来自所述检测单元的信号,对流经所述筒的所述流路的未分化细胞作用使流动的方向变化的力;容器,通过该力的作用结果产生的流动的方向的变化,与流入未分化细胞的流路连接;以及,容器,基于来自所述检测单元的信号,与不使流动的方向变更时的分化流通细胞的流路连接。通常,若未分化细胞的混在比率为a%,则分化细胞的回收效率相当于装置的分选速度的(100-a)倍。a的值越小,处理能力提高的价值越大。这样的分选方法称为否定分选。图15(a)表示总细胞数为2×106个、未分化比率为20%时的处理效率的实测结果和模拟实验结果。是以分选处理速度为100个/秒而进行得到的结果。由于未分化比率大,因此除去处理为4次能够完全除去未分化细胞,实测与模拟实验一致。总需要时间为150分钟,由于未分化比率高为20%,因此为效率差的结果。与之相对,对总细胞数为107个、未分化细胞比率为0.3%以下时进行模拟实验得到的结果为图15(b)。未分化细胞进行2次的处理,可完全除去未分化细胞。在20分钟以内的短时间内结束。结果为:未分化细胞的比率越高,效率越高。
1-5)用于解决乳液分选的课题的单元的实施方式
作为乳液,以油中的液滴为前提进行说明。若乳液中液滴附着于一次性流路筒上的容器的内壁,则导致流路阻塞。以下对为了预防乳液中液滴附着于容器内壁,使容器的内壁为防水性的方法、以及使得即使液滴附着也因自重而自然地沉降的方法的两种方法进行说明。
通过使容器的内壁为防水性从而防止附着的单元的说明
图4(a)为与图2(a)相同的一次性交换型流路筒。问题在于对包含该筒的分选对象的粒子的试样液的容器(样本容器:第一容器)11的内壁、以及回收分选后的乳液液滴的容器(第3b容器)17的内壁的液滴附着。将为了防止该附着而用防水性原料分别覆盖容器11和容器17而成的结构示于图4(a)与图4(b)。此处,利用在容器内插入有中空的teflon(注册商标)制造的转接器的结构,使得乳液不与容器的内壁接触。
由于流路筒为利用透明树脂的注塑成型,无法使流路整体为teflon(注册商标)性,因此可以采用上述的对策。此外,也可以对容器11和容器17各个内壁进行防水性涂覆。作为防水性涂覆,可以为由氟树脂覆盖而成的结构。
通过增大乳液中的液滴的比重从而防止附着的单元的实施方式
由于氟化液等氟类油的比重比液滴重,因此液滴会浮在油中。其理由在于,由于氟化液的密度为约1.8g/cm3左右,是水的约1.8倍,所以水滴漂浮。因此,通过使比重为1以上的液体混入,能够使比重增大。作为这样的液体,有聚钨酸钠溶液、或三溴甲烷溶液、或碘甲烷溶液。若使比重为约1.8g/cm3以上,则能够使液滴在氟系油中沉降。聚钨酸钠的饱和水溶液的密度为3.1g/cm3,三溴甲烷的饱和水溶液为2.89g/cm3,碘甲烷的饱和水溶液的密度为3.31g/cm3。为了使得这些成分不在氟化液中漂浮,使密度为1.8g/cm3以上即可。为了防止乳液中液滴向容器的内壁附着,没有必要使密度为1.8g/cm3以上,只要使密度高为随着油的減少导致的油表面向下方移动,已附着于内壁的液滴在来自油的浮力消失时因重力向下方落下的程度即可。作为该密度,为1.2g/cm3至1.8g/cm3的范围即可。
1-6)用于解决与流速有关的课题的单元的实施方式
细胞分选仪等细胞分取装置中,将可控制流速为一定作为前提。其理由在于:在液体中检测微粒、进行识别判定,如果是目标粒子时,在比检测位置更靠近下游侧分取该粒子。由于从检测位置到达分取位置的时间根据流速而变化,因此为了在检测后一定的时间后进行分取,流速必须一定。
流路内的流速可根据施加的压力进行调整,压力与流速的关系根据使试样悬浊的缓冲液的粘性或用于使试样液细化而一起流动的鞘液的粘性而变化。因此,缓冲液的种类或鞘液为常见的(限定市售的细胞分选仪的制造者)。
上述的现状中,为了根据细胞的种类以有生命的状态进行测量,多数情况下必须为特定的培养基。因此,不仅需要特定的缓冲液,而且需要包含培养基等、且与不同粘性的各种缓冲液对应的流速调整技术。
因此,在再生医疗中期望的无细胞损伤的细胞分选中,为了根据各种缓冲液为改变流速,评价流速的功能变得重要。
因此,为了评价流速,采用以下的单元。
如图5(a)的35和36所图示地,在一次性交换型流路筒内进行细胞分选的方法中,将不同的2个波长的激光沿着粒子流经的流路22的流动照射于不同的位置。如图5(b)所示,粒子通过2个照射区域时,对于一个粒子产生源于2个激光照射的2个光信号(35-a和36-a)。对于该光信号的检测而言,从检测到信号35-a已由检测条件所设定的阈值(th)以上的信号的瞬间开始,测量开始。该情况下,35-a信号的ad转换与36-a信号的ad转换同时开始,并记录它们的光信号达到最大的时刻的时间差。该时间差为2个照射位置的距离(δl)除以粒子流的速度v而得到的值。即,若对各个粒子测量时间差δt,则能够测量各个粒子的速度v。
作为光信号的ad转换的性能,采样频率为5mhz时,每隔0.2微秒地将模拟时间波形的信号数字化,因此能够利用0.2微秒的分辨率评价2个信号的时间差。2个激光的照射位置的间隔δl为100μm、流速v为1m/秒的情况下,时间差为100μ秒,0.2微秒的分辨率足够。
该速度评价可对各个粒子进行。例如,产生荧光的粒子的情况下,使一方的信号为散射光、并使另一方为荧光即可。不产生荧光的粒子的情况下,检测2个散射光信号作为2个光信号即可。该情况下,必须用于检测2种散射光的光学系统。作为适于一次性交换型流路筒用途的2种激光的各个散射光检测光学系统,适用专利文献12中记载的利用流路基板端面使侧面散射全反射而进行检测的光学系统。该情况下,将基板的两侧的反射面用作源于2个激光波长的侧面散射检测光学系统即可。
如上所述,若明确了各个粒子的流速,则可采用下述方法:导出从检测时刻至细胞分取区域的时间差,在通过细胞分取区域时,对细胞施予分选力从而进行分取。
此外,针对改变了使粒子悬浊的缓冲液的种类的情况、或者缓冲液的粘性因温度而变化从而流速改变的现象,对空气压进行调整使得粒子的平均流速一定。该情况下,提前利用所使用的缓冲液进行各容器的压力条件的初期设定使得成为目标流路宽度和流速,在该条件下开始粒子的解析、分取。即使为初期设定的条件,有时也因环境温度而流速不同,因此监控各个粒子的流速,并介由控制pc控制废液容器的压力使得每一定数的流速的平均值为目标值。
图13(a)为与图2(a)相同的一次性交换型流路筒,透明的流路基板的两端为反射面(180和181),图13(a)为搭载了波长不同的多个激光时,用于评价细胞的流速的测定系统。反射面(180和181)为与垂直方向呈45度的角度的斜面,表面为镜面精加工。图13(b)图示了图13(a)的激光照射区域35的位置的d1d1’截面和激光照射区域36的d2d2’截面的部分的二者。波长不同的2种激光的照射区域(35和36)照射合流部至分选流路之间。细胞通过照射区域时产生的侧方散射光在反射面(180和181)中因内部反射而向下侧反射。因内部反射而从基板内出现在外部的散射光,在透明的树脂制集光板182和183上集光,并用光导向件(184、185)引导至光检测器(188、189)进行检测。该情况下,在光检测器(188)的前方设置仅使第一激光源35-1的波长透过的波长域的带通滤波器,在光检测器(189)的前方设置仅使第二激光源36-1的波长透过的波长域的带通滤波器,由此除去各个波长的散射光以外的光。如图5(b)所示,对流经流路内的粒子评价2种侧面散射信号的时间波形的极大时间差,通过照射区域35和36的距离除以时间差,测量各粒子的流速。图14为测定各个细胞的流速,并表示其矩形图分布的图表。
2)用于解决解析单一细胞的基因的方法的课题的单元的实施方式
作为用于解决解析单一细胞的基因的方法的课题的单元,对下述方法进行说明:形成收入有细胞的乳液液滴的方法、在乳液液滴内部使细胞溶解的方法、在乳液液滴内进行pcr反应分方法、分取浓缩具有荧光的乳液液滴的方法、将已分取的乳液液滴以1个单位分注至多孔板中的方法、将已被分注的多孔板内的乳液液滴破坏并与其它反应试剂液混合的方法、以及进行全基因扩增反应并用下一代测序仪进行解析的方法。
图6为用于形成收入有细胞的乳液液滴的一次性交换型流路筒。虽然大致为与图2的筒相同的结构,但各容器的作用不同。该筒中形成有:包含用于收入液滴内的细胞的试样液用容器(第一容器)11-e、包含pcr反应试剂与细胞溶解用试剂的反应试剂液用容器(第二容器)12-e、左右的乳液油用容器(第3a容器)16-e与(第3b容器)17-e、以及已形成的乳液液滴用容器(第四容器)21-e。各个容器上部施加经控制的空气压,油中液滴的尺寸可根据各容器的空气压进行调整。容器内的空气压的调整机构适用如图18所示地利用了压缩机和电动气动调节器的组合的调整机构。该压力调整范围可以为0.1kpa至30kpa。对于施加于第一容器和第二容器的压力而言,通过使对油用容器(第3a及b)施加的压力变化,能够将油中液滴的直径尺寸调整为20μm至100μm。其中,由于粘性根据油的种类而不同,因此必须根据油的种类设定目标尺寸的空气压。此外,为了将约10μm的细胞收入乳液液滴内,液滴尺寸为40μm以上是理想的。对于最大液滴尺寸而言,根据流路尺寸决定上限。
图7为用于形成乳液液滴的微流路筒内的流路。通过使包含细胞50的试样液在反应试剂液(pcr反应试剂和细胞溶解用试剂)流经的流路23l-e与流路23l-e处合流,从而在细胞50沿一列对齐后,使油从流路24l-e与流路24r-e开始合流。虽然在合流后形成油中液滴,但形成包含细胞的液滴51和不包含细胞的液滴52的两种类。
图8为形成有四个试样液容器63、四个试剂容器62和四个油容器的乳液形成用筒。通过对各容器施加空气压力,可形成乳液粒子,在该流路筒中,可同时形成针对四种试样的乳液。作为油的种类,即使为氟系油、矿物质油,也能形成油中液滴的乳液。液滴的直径尺寸由与油的合流部处液体的流量同油的流量的比率决定。形成以一个单位包含尺寸为10μm左右的细胞的乳液液滴时,液滴的尺寸至少为40μm以上是理想的。另外,该情况下,流路22-e的截面尺寸可以为宽100μm深100μm以下,形成收入有尺寸为100μm左右的细胞的块的球形体的乳液液滴时,流路22-e的截面尺寸必须为宽200μm深200μm以上。
作为细胞溶解用试剂,将蛋白酶(proteinase)k等分解细胞膜的酶作为成分而加入。此外,作为pcr反应试剂,除了加入与检测的基因序列对应的引物以外,将聚合酶、taqman探针或sybrgreen等荧光试剂作为成分而加入。使用蛋白酶k进行溶解时,细胞溶解反应在摄氏36度放置12小时进行溶解反应。
接着,对于pcr反应而言,例如使用热循环仪(thermalcycler),反复进行40次左右摄氏60度与摄氏95度的温度之间的热循环,进行pcr反应。在pcr反应后,具有目标基因序列的液滴具有荧光。
下一个阶段进行在前述的流路筒内仅分选具有荧光的液滴。该单元为已在1-5)中说明的内容。该分选的结果得到了具有目标基因序列的乳液液滴为95%以上的乳液。
接着,对以1个单位将该乳液液滴分注至多孔板的单元进行说明。图9(a)示意性地表示分注乳液液滴的单元。
在分注处的多孔板70中预先分注有与分注后的液滴反应的试剂液。作为该试剂液,例如为包含用于全基因扩增的试剂的水溶液。分注前的乳液液滴装入管71中。将作为已安装于控制空气压的注射泵74的前端的透明中空管的分注移液管73的前端沿z轴下方移动,从而进入至该管71中的乳液中。接着,提起注射器的活塞,将仅分注量份的乳液吸引至移液管73中。吸引后将移液管73向z轴的上方提起,利用摄像机捕获移液管内的分注量总量的图像,并判定液滴是否一个存在,如果一个存在,则移动至多孔板的规定的位置(address)的孔。如图9(b)所示,向z轴下方移动,将分注移液管73下降至比已经分注反应试剂液的上表面81更靠近下侧,按压注射泵的活塞75从而排出移液管内的液滴。在排出后,也一边按压活塞75,一边将分注移液管向上方提起。分注移液管内的图像识别的结果,液滴的个数为0或2个以上的情况下,回到管71,排出分注移液管73内的乳液,再次吸引,由此仅分注液滴仅1个存在的情况。
作为分注量为0.3μl时,若移液管的内径为400μm,则移液管内仅吸引2.4mm即可。接着,考察可否用摄像机的1个镜头的图像在存在焦点的状态下对液量0.3μl整体进行拍摄,作为物镜使用1倍物镜时,被摄界深度为440μm,存在焦点的状态下可对移液管内的内径400μm整体进行拍摄。考虑到视野的范围,为1/2型摄像机的情况下,由于盖住6.4mm,因此可拍摄移液管内的长度2.4mm整体。因而,能够判断可以以图像1个镜头拍摄分注量0.3μl的整体。其中,图像的分辨率为11μm,因此能够识别一个细胞的有无和个数。作为乳液液滴尺寸,由于收入一个细胞的最适尺寸为40μm,因此可充分识别乳液液滴的有无和个数。图16是用1倍的物镜和1/2型摄像机捕获前述的内径400μm的透明树脂制的中空移液管内的粒径为10μm的标准粒子的图像而得到的图像。各个粒子可识别,吸引的液体的长度为2.4mm以上。
在如上所述的乳液液滴的分注中,为了防止液滴吸附于分注移液管的内壁,优选预先用防水性涂覆溶液对分注移液管内进行涂覆。此外,也可将上述分注机用于水溶液中的细胞的分注。在该情况下,为了防止细胞吸附于分注移液管的内壁,优选用亲水性涂覆溶液对分注移液管内进行涂覆。
为了对多孔板中一个液滴中包含的一个细胞的dna进行详细解析,可利用下一代测序仪确定全序列。为了该序列解析,需要进行全基因组扩增。因此,以下对下述方法进行说明:将已分注的各个乳液液滴破坏,并对已取出的dna与全基因组扩增反应试剂液进行混合,实施全基因组扩增反应。首先,为了将各个乳液破坏并提取内部的dna,适用了非专利文献5中记载的使用离心分离和二乙醚的方法。其中,为了对一个单位的乳液液滴适用该方法,将以一个单位分注至多孔板中的乳液液转移至离心管中来进行适用。接着,为了对已提取的dna进行全基因组扩增反应,例如使用sigma-aldrichco.llc.的下一代测序仪用的全基因组扩增试剂盒(seqplexdnaamplificationkit)。在非专利文献6中记载了其操作步骤。此外,在rna的解析中例如使用sigma-aldrichco.llc.的下一代测序仪用的全rna扩增试剂盒(seqplexdnaamplificationkit)。其操作步骤已被记载于非专利文献7。
图17中总结了本发明的有关解析内容步骤。包括:单一细胞解析(情形1)、单一细胞块解析(情形2)、包含单一细胞的乳液液滴解析(情形3)、包含单一细胞块的乳液液滴解析(情形4)。各情形的处理步骤中,均需本发明的单元。在以上的扩增后,利用下一代测序仪进行序列解析。
工业实用性
本发明的解析及分离微粒的装置能够将适于再生医疗的细胞无菌地分离。此外,由于能够容易地调节样本浓度,因此可调整样本中的细胞浓度。另外,解析及分离粒子的装置可容易地分选细胞球形体、或乳液。此外,通过使用本发明的装置,能够简单地将分化细胞纯化。根据本发明,由于能够测定细胞或细胞块的流速,因此不使用特定的缓冲液即能够分选细胞或细胞块。另外,根据本发明的基因解析系统、或基因解析方法,可无污染地解析单一细胞、或一个细胞块(细胞球形体)的基因。
以上,虽然以特定的实施方式对本发明进行了说明,但是对于本领域技术人员不言自明的变形、改良也包含在本发明的范围内。
附图标记说明
1…流路基板;
2a…容器;
2b…容器;
3a…容器盖;
3b…容器盖;
4…流路;
5a…试样液;
5b…试样液;
6a…空气;
6b…空气;
8a…中空的针;
8b…中空的针;
9a…注射泵;
9b…注射泵;
10…一次性交换型流路筒的外框;
11…储存试样液的容器(样本容器:第一容器);
11-e…包含收入至乳液液滴中的粒子的试样液;
12…储存鞘液的容器(第二容器);
12-e…包含溶解细胞的试剂和pcr反应试剂的试剂液;
13…与试样液的主流路连接的端口;
14…试样液与鞘液的隔壁;
15l…与左侧的鞘液的鞘流路连接的端口;
15r…与右侧的鞘液的鞘流路连接的端口;
16…分选液容器(第3a容器);
16-e…乳液油用容器(第3a容器);
17…回收容器(第3b容器);
17-e…乳液油用容器(第3b容器);
18…与分选液容器的分选流路连接的端口;
19…与回收容器的分选流路连接的端口;
20…与废液的主流路连接的端口;
21…储存废液的容器(第四容器);
21-e…乳液液滴用容器(第四容器);
22…主流路(第一流路);
22-e…主流路(第一流路);
23l…左侧的鞘流路(第二流路);
23l-e…左侧的试剂流路(第二流路);
23r…右侧的鞘流路(第三流路);
23r-e…右侧的试剂流路(第三流路);
24l…脉冲流push侧的分选流路(第四流路);
24l-e…液滴形成用油流路(第四流路);
24r…脉冲流pull侧的分选流路(第五流路);
24r-e…液滴形成用油流路(第五流路);
30…贯通试样液容器的盖的中空的针;
31…贯通鞘液容器的盖的中空的针;
32…贯通分选液容器的盖的中空的针;
33…贯通回收容器的盖的中空的针;
34…贯通废液容器的盖的中空的针;
35…第一激光或其照射区域;
35-a…通过35的激光照射区域时产生的散射光信号;
36…与第一激光波长不同的第二激光或其照射区域;
36-a…通过36的激光照射区域时产生的散射光信号;
35-1…第一激光源;
35-2…激光的驱动电路;
36-1…第二激光源;
40…试样液容器的teflon(注册商标)转接器;
41…回收容器的teflon(注册商标)转接器;
50…细胞;
51…包含细胞的液滴;
52…不包含细胞的液滴;
60…乳液液滴形成用流路筒;
61…乳液液滴形成用油容器;
62…试剂容器;
63…试样液容器;
64…乳液液滴形成油用流路;
65…试剂用流路;
65…乳液液滴容器;
70…乳液液滴的分注处的多孔板;
71…包含分注前的液滴的乳液;
72…洗净用油液;
73…分注移液管(透明的中空管);
74…空气压注射泵;
75…空气压注射泵的活塞部分;
76…摄像机;
77…分注机控制pc;
78…单一粒子分注机;
80…多孔板内的孔;
90…正压的注射泵;
91…负压的注射泵;
92…高速电磁阀;
93…高速电磁阀;
100…电磁执行器;
101…电磁执行器;
110…弹性盖;
111…弹性盖;
151…物镜;
152…激光;
153…由分选流路4-1和4-2夹持的区域;
154、155、156…二向色镜;
157、158、159…带通滤波器;
160…透过激光隔绝用空间过滤器;
161…光电二极管;
162、163…光电倍增管;
164…ad转换器;
169…控制用计算机;
170…空气泵9a用驱动电路;
171…空气泵9b用驱动电路;
172…照射激光源35-1的驱动电路;
180、181…反射面;
182、183…透明树脂制集光板;
184、185…透明树脂制光导向件;
186…仅使第一激光35的波长透过的波长域的带通滤波器;
187…仅使第二激光36的波长透过的波长域的带通滤波器;
188、189…光检测器;
200…电磁阀;
201…电磁阀的驱动电路;
202…电动气动调节器;
203…空气缓冲罐;
204…压缩机;
205…气体用异物除去过滤器;
206…压缩机的大气吸引管;
301…电磁执行器用驱动电路;
401…打开孔的盖;
402…堵住孔的盖;
403…棒403;
404…容器内空间;
405…侧璧。
- 还没有人留言评论。精彩留言会获得点赞!