生物样本的多路复用分析中的串扰校正的制作方法
本发明涉及生物多路复用分析,特别是涉及基于检测生物样本中的多个生物标志物的复杂疾病的诊断。
背景技术:
复杂疾病的诊断和治疗的响应经常与多个生物分子,而不是单个的可识别的生物标志物相关。与一次测量一个分析物的传统技术相反,多路复用技术可以在单个测定中使用相同的条件从单个生物样品中测量数十种至上千种不同的生物分子,例如蛋白质或核酸。基本地,不同类型的捕获分子,例如抗体、靶蛋白、肽或核酸,被设置于填充了样品的测定装置中,每种捕获分子被设计为与样品中待检测的生物标志物一起形成特定的荧光标记的配合物(被称为“靶向荧光标记的生物标志物”)。多路复用技术的一个主要难题在于在单次测定中确定源自单个类型的荧光标记的生物标志物与其互补的捕获分子的荧光(后文称为“单独荧光”)。
现有技术存在各种多路复用技术,各技术通常通过解决上述问题的特定的编码策略来分类。市面上使用最多的可行的多路复用技术是基于阵列或基于珠的。在基于阵列的技术中,捕获分子以已知的布置连接在平板上以形成一个“捕获点”的2D阵列,各捕获点用于捕获一种特定的生物标志物。因此,这样的平面布置依靠捕获点的x-y坐标来确定各生物标志物的荧光。基于珠的技术是基于光谱编码,其中颜色和强度使得各珠群体可以区分。这些技术已经被证明有高度的灵活性和扩展性。然而,现有的可行的基于珠的系统被设计为节省成本地分批运行,并且需要等待足够的样本以填充平板,使得常规临床检验的周转时间变慢。另外,因为主要是由扩散作用驱动,该两项技术都受较慢的结合动力学的影响。即使使用搅拌加快该过程,通常这也会延长样品孵育时间。另外,由扩散限制的结合机制也会导致测定批内和批间的变化。
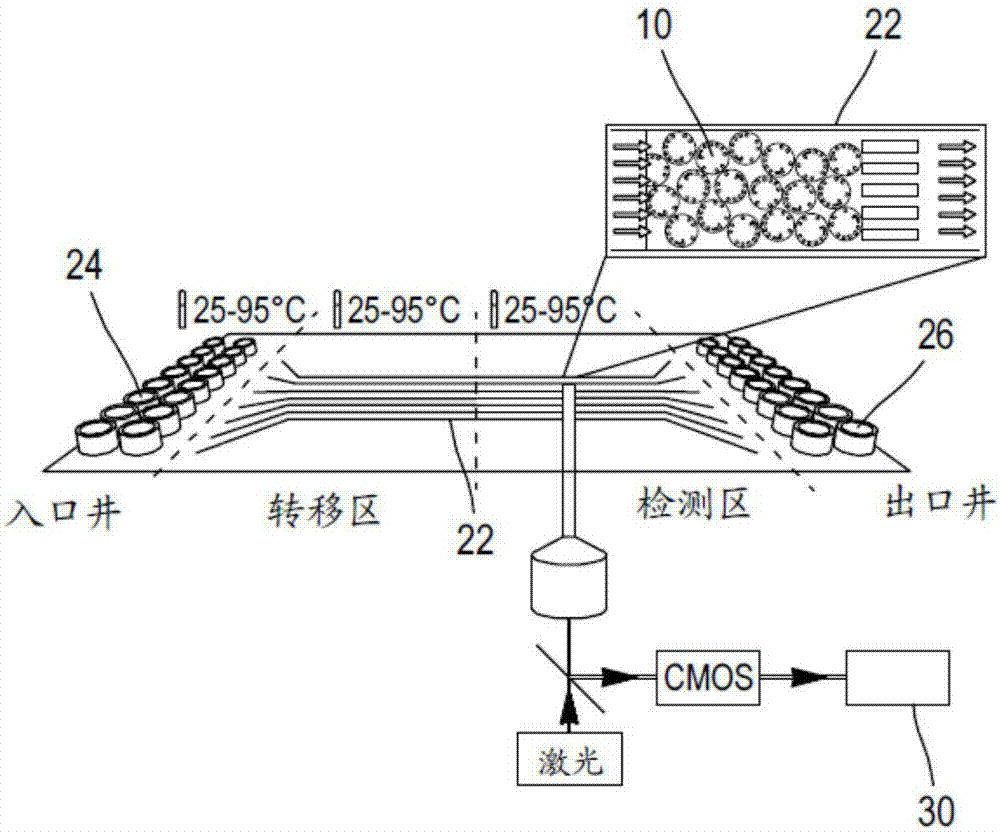
为了解决上述限制,本申请设计了一种基于编码微粒和微流体通道的多路复用技术。例如,Didier Falconnet等人在Anal.Chem.(2015,87,1582-1589)的“用于分析蛋白质和核酸生物标志物的快速、灵敏和实时的多路复用平台”中描述了该技术,并且该文章的支持信息可以从http://pubs.acs.org下载。实施该技术的一种设备,被称为“EvaluationTM”,由比利时Ghent市的MyCartis所出售。现在结合图1,简要地描述该技术的主要组件(编码微粒,微流体通道盒和仪器设备)。
参见图1A,编码微粒10,或“载体”,为盘状,直径为40μm,高度为10μm,并且由硅片制成,如使用MEMS加工技术制成。每个微粒10的边缘使用存在或不存在孔14而形成的10位二进制编码Idm12,或“标识符”,明确地进行编码。捕获分子被连接在微粒10的两面,因此后者可以作为多种可能的捕获分子的固体支持物,可能的捕获分子包括抗体、靶蛋白、肽、核酸或其他生物分子。更具体地,单个类型的捕获分子(即,用于捕获一种特定生物标志物的捕获分子)被束缚在共享同样的编码Idm的微粒上。
参见图1B,盒20,或“测定盘”,具有多个能容纳编码微粒混合物的微型通道22,并且因此使得可以同时地或顺序地(即在不同的日期)运行多种样品。每个通道22由透明壁组成并且连接入口井24和出口井26,使得通道22在大气压之上增压,使得通道能够微流体操作。通道22比微粒的直径宽至少5倍,例如10倍,并且各自地包括过滤器结构以限制通道的检测区域内的微粒。通道的高度为了有效地装载和平铺微粒进行了优化。浅的通道高度防止微粒彼此重叠,因此微粒在通道内单层布置,微粒的其中一个面可以完全地用于成像目的。微粒在通道中的单层布置使得能使用高分辨率成像来解码和荧光量化。每个通道都可以装载上千的微粒,一个满装载的通道能够多路复用分析多于一百个不同的生物标志物,其中数十个微粒用于一种要被搜寻的生物标志物。为了多路复用分析的目的,装载与通道内的微粒温和无包括多个共享同样编码的微粒,以此形成能给统计置信提供测量冗余的群。
仪器设备的目的在于获取通道的图像,控制通道中的流体驱动和分析获取的图像。更具体地,仪器设备包括:
-光学系统28,例如具有长工作距离物镜和高灵敏度CMOS相机,用于获取盒的检测区域的亮视场和落射荧光图像(如在640nm激发,使用激光)。物镜安装于自动的x-y-z平台上,用于在实时读数的测定中或在结束点扫描每个通道;
-照明系统(未示出),用于均一地照明检测区域,以获得微粒在明亮背景中的高对比度图像,用于解码目的;
-控制单元(未示出),用于控制盒的微流体操作(入口/出口井、增压、温度等),和光学系统的操作;
-计算单元30(如个人电脑、服务器、或更通常地,任何被配置为从相机接收数据并且根据储存在处理器中的指示处理数据的计算硬件),可能是控制单元的部分或与之独立,耦合到相机用于接收其图像,并且运行多路复用分析计算程序以自动地基于光学系统获取的荧光和亮光图像量化测试的样品中的生物标志物。
参见图2,因此,由上述的多路复用技术实施的多路复用分析包括:
-制造微粒的悬浮混合物32,微粒10基于测试样品中需要搜寻的生物标志物选择,并且在盒20中装载液体的微粒混合物32以填充一个或多个通道22,以提供微粒的平面布置用于优化读数的目的(图2A);
-在通道22中装载测试的液体样品,如有必要,与试剂一起装载(例如用于夹心反应),由此在测试样品中的生物标志物34和连接在微粒10的捕获分子36之间的微流体环境中启动温育和/或结合反应(图2B);
-获取通道22的检测区域的图像(如实时或在过程结束时)。由于微粒10由于增压和过滤元件被固定在通道22中,图像获取的循环优选地在于连续地获取亮视场图像38和荧光图像40,或反之亦然,因此每个微粒的位置在这两个图像中是相同的;
-对于每个通道22和通道的一组亮视场图像和荧光图像38和40:
○分析亮视场图像38以识别每个微粒10在通道22中的位置Xi,并且以读取每个微粒10的编码Idm12;
○分析荧光图像40以确定荧光图像中每个微粒10的荧光(例如,对应于对应微粒中心部分的图像部分的像素所拟合的核密度的最大值);
-对于每个通道22和每个通道中共享同样的编码Idm的微粒10的群:
○计算群的荧光聚合值例如:在荧光应用Tukey的箱图滤波器以滤除异常荧光值然后计算聚合值作为剩余荧光值的算数平均值(图2D);
○基于聚合值使用预先确定的用于生物标记物且存储于计算单元30的数字存储器的荧光与浓度的关系(如表格、解析数学模型等),确定测试样品(或“滴定”)中的生物标志物浓度[b](图2E)。
之后,计算出的浓度被显示给用户和/或存储于数字存储器(如计算单元中的存储器)。
该多路复用技术使得:(i)由于反应限制的结合机制,测定时间短,再现性高;(ii)动力控制测定条件和实时结合监测使得在单次的测定运行中优化多个参数;(iii)与每个种免疫测定形式的兼容性,例如同时合并样品和检测抗体,从而简化工作流程;(iv)基于初始结合率的分析物量化导致系统动态范围增加;(v)通过增强荧光收集的高敏感性;(vi)如有需要,也可以运行单路测定(即只提供一个类型的捕获分子用于量化地测量特定的生物标志物)。
然而,在一些情况中,从多路复用测定数据计算出的生物标志物浓度[b]和从单路测定数据计算出的生物标志物浓度[b]有所区别。
技术实现要素:
本发明的主要目的是在多路复用分析中提出用于校正多路复用和单路测定之间的差的微粒荧光的计算。
为此,本发明的一个目的是一种确定多路复用分析中I个荧光编码微粒集{μPi}i∈{1,2,…,I}的荧光的方法,微粒在单层布置中,该方法包括:
-获取该荧光微粒集{μPi}i∈{1,2,…,I}的数字荧光图像;和
-仅基于对应于荧光微粒μPi的所获取的数字荧光图像的像素,为荧光微粒集{μPi}i∈{1,2,…,I}的每个所述荧光微粒μPi计算第一荧光
根据本发明,该方法包括通过由荧光微粒集中的其他微粒{μPj}j≠i的第一荧光中的串扰荧光贡献校正荧光微粒μPi的第一荧光以计算荧光微粒μPi的荧光
换言之,获取的图像中对应于一个微粒μPj的部分并不严格对应于该微粒所产生的光。每个微粒产生散射的光,从而叠加在其他微粒的光上。与图像并行绘制,微粒间存在“串扰”效应。具体地,当至少两群不同荧光的微粒(例如暗的群和亮的群)混合在一起时,可能会出现串扰效应。例如,当两个群之间荧光的差足够大时,较暗的群内临近于较亮的群的一些微粒会出现荧光的增加。在单路测定中,也可能出现串扰。
根据一个实施例,荧光值的计算包括:
-计算荧光微粒集{μPi}i∈{1,2,…,I}中的每个荧光微粒μPi在数字荧光图像中的位置Xi;
-将第一荧光值建模为所有荧光微粒{μPi}i∈{1,2,…,I}的位置{Xi}i∈{1,…,I}和荧光值的函数;和
-计算函数的逆以获得荧光值
根据一个实施例,荧光值的计算是基于以下关系而执行:
其中为第j个荧光微粒μPj的荧光,并且αij为第一荧光中第j个荧光微粒μPj的单一串扰荧光贡献,该单一串扰荧光贡献αij仅取决于荧光编码微粒μPi和μPj之间的距离。
换言之,对于给定的微粒,其他微粒产生的光不会减少到可以测量的均匀的背景噪声(例如,通过计算图像的平均亮度)和从微粒的荧光中减去。发明人进一步地注意到,来自其他微粒的干扰是可变的,取决于微粒具体的布置。因此为了校正对一个微粒的串扰效应,本发明计算每个其他微粒的贡献。考虑到每个上述贡献,即使对于微粒之间的高对比度条件,得出的多路复用测量也近似于单路测量。
另外,发明人注意到串扰效应可以用各向同性衰减分布的和来建模。这意味着可以考虑独立于其他的微粒来计算它的贡献,并且被微粒散射的荧光仅取决于到微粒的距离和微粒上的荧光。单一串扰荧光贡献αij对应于例如微粒生成的归一化的荧光,并且基于提前确定的恒定参数计算,例如由多路复用分析仪的制造商所确定,并且存储于分析仪的存储器中。
具体地,方法包括:
-计算数字荧光图像中第i个和第j个荧光微粒之间的距离di,j;
-对于所述I个的荧光微粒集中的每对微粒(μPi,μPj),基于距离di,j计算该对(μPi,μPj)的单一串扰荧光贡献αij;
-基于以下关系,计算荧光微粒集{μPi}i∈{1,2,…,I}的荧光值
换言之,该计算是基于两个特定的减少,如后文将会讨论的,这使得串扰效应能被简单、精确地校正。
具体地,第i个荧光微粒的第一荧光中的第j个编码微粒的单一串扰荧光贡献基于以下关系计算:
其中N为大于或等于2的整数,θn、kn和βn为预定的参数。
指数函数的和是建模单一串扰荧光贡献αij的有效方法,且同时为计算参数θn、kn和βn提供了凸优化的灵活性。具体地,三个指数足够计算出αij。
在一个实施例中,荧光微粒集{μPi}i∈{1,2,…,I}中的每个荧光微粒μPi包括M个不同的独特的标识符集{idm}m∈{1,2,…,M}的标识符Idm(i),该标识符IdM(i)通过荧光微粒μPi的数字图像的处理而可读取,并且该方法还包括:
-获取荧光微粒集{μPi}i∈{1,2,…,I}的数字图像;
-读取数字图像中每个微粒μPi的标识符Idm(i);和
-对于M个不同的独特的标识符集{idm}m∈{1,2,…,M}中的每个标识符Idm,基于包括该标识符的荧光微粒的荧光计算聚合荧光
具体地,荧光微粒集{μPi}i∈{1,2,…,I}的每个荧光微粒μPi包括由荧光配合物涂覆的表面,配合物与荧光微粒μPi的标识符Idm(i)独特地相关联,该配合物包括固定到所述编码微粒的第一非荧光分子和结合到所述第一非荧光分子的第二荧光分子。
更具体地,微粒具有相等尺寸。
在一个变体中,该方法包括:
-在获取荧光微粒集{μPi}i∈{1,2,…,I}的数字图像之前:
○在没有任何第二荧光分子结合到第一非荧光分子的情况下,在通道中设置微粒,,以便将微粒布置在单层中;和
○用液体样品填充通道,
-基于聚合荧光计算样品中第二荧光分子的浓度。
本发明的另一个目的是实施前述方法的系统,特别是一个确定I个荧光微粒集{μPi}i∈{1,2,…,I}的荧光的系统,包括:
-至少一个通道,用于接收单层布置的I个荧光微粒集{μPi}i∈{1,2,…,I};
-获取单元,用于获取通道中的单层布置的荧光微粒集{μPi}i∈{1,2,…,I}的数字荧光图像;
-计算单元,用于基于所获取的数字荧光图像来计算荧光计算单元仅基于对应于荧光编码微粒μPi的获取的数字荧光图像的像素来计算第一荧光
其特征在于,对于荧光微粒集{μPi}i∈{1,2,…,I}中的每个荧光微粒,该计算单元:
-计算来自荧光微粒集{μPi}i∈{1,2,…,I}中其他荧光编码微粒{μPj}j≠i的微粒μPi的第一荧光的串扰荧光贡献该计算基于其他微粒的第一荧光和
-通过由串扰荧光贡献校正荧光微粒μPi的第一荧光来计算荧光编码微粒μPi的荧光
附图说明
通过结合附图,阅读作为示例的详细说明,将会更好地理解本发明,其中相同的附图标记表示相同或相似的元件,其中:
图1为编码微粒和使用这样的目前技术水平的微粒的多路复用分析仪的示意图;
图2显示了使用图1所示的微粒和分析仪的样品的多路复用分析;
图3显示了单路测定和多路复用测定中荧光的不同;
图4显示了根据本发明的用于确定荧光衰减分布的微粒的布置;
图5和图6分别显示了根据本发明的荧光衰减分布和相对荧光衰减分布;
图7显示了拟合到相对荧光衰减分布的模型;
图8显示了具有亮和暗微粒的双路复用测定;
图9和图10显示了在测量的双路复用测定荧光中串扰效应的影响;和
图11和图12分别显示了根据本发明串扰校正前后的暗微粒的荧光。
具体实施方式
现在基于上述的EvalutionTM系统,描述本发明的实施例。该实施例由于根据本发明的补充处理,与EvalutionTM系统有着不同。具体地,计算机指令和参数存储于EvalutionTM系统的存储器中,以处理所获取的通道的数字荧光图像从而校正系统计算出的荧光中的串扰效应。之后校正后的荧光被用于计算群的荧光的聚合值和测试样品中生物标志物的浓度[b]。
特别地,在盒20的通道22中的微粒集{μPi}i∈{1,2,…,I}中,一个特定的微粒μPi的荧光等于:
其中微粒μPi的荧光只对应于微粒μPi所产生的荧光,并且为来自其他微粒{μPj}j≠i的与荧光叠加的荧光,即来自其他微粒{μPj}j≠i的串扰贡献。
根据本发明,串扰贡献被建模为单独贡献的和,每单独贡献都具有各向同性衰减分布,也就是说:
其中αij为第一荧光中第j个荧光微粒μPj的单一串扰荧光贡献,仅取决于微粒μPi和μPj之间的距离di,j,例如微粒各自的中心的距离。
对于串扰效应校正,荧光无法获得,它们由所近似估计,得出的关系为:
在第一个变体中,因此基于以下关系计算:
尽管该变体显示了良好的串扰效应校正结果,由以下的计算可以得到更好的校正。
具体地,通过设αii=1并且在矩阵A中存储αij,可以得出:
因此所有的荧光可以一起基于以下关系计算出:
如后文所详细讨论的,单一串扰荧光贡献αij由以下关系计算:
其中N为大于或等于2的整数,θn、kn和βn为预定的参数,对任何大小的微粒都是相同的,被存储于计算单元30的存储器上。
具体地,对于EvalutionTM系统的微粒,N=3在近似估计αij中有着良好的结果。
基于上文,根据本发明的一个实施例,因此计算单元30计算:
a)每个微粒中心(例如盘状微粒的中心)在获取的通道的数字荧光图像中的位置,然后计算该图像中每对微粒(μPi,μPj)的距离(μPi,μPj);
b)基于关系(7)的统一荧光贡献αij;
c)基于关系(5)的矩阵A及其反矩阵A-1;
d)基于关系(6)的荧光
参照图4至图7描述统一荧光贡献的确定。第一步骤包括创建至少一个只包含一个亮微粒的大视场。为了考虑多路复用环境和微粒属性的可能影响,运行一个亮微粒(如全亮RPE生物素)数量低,暗微粒(如COOH微粒)数量高的双路复用测定,并获得微粒的亮视场图像和数字荧光图像。通过这种做法,可以从图像上孤立的亮微粒周围的COOH微粒所对应的像素(“像素”)测量串扰的衰减分布。如果一个亮微粒离其最近的亮微粒在至少1000像素之外,那么该亮微粒就被认为是孤立的。另外,为了增加计算的精确度,只保留具有最小荧光且表面上具有均匀分布的荧光(例如根据亮微粒的像素的变化系数)的微粒。图4A显示了一个被暗微粒包围的亮微粒的荧光图像。图4B显示了过曝光后处理后的相同图像,以显示出COOH微粒。
在第二步骤中,为了测量离亮微粒中心一定距离处像素受到的影响,所有对应于位于d和d+p(其中p为预定的步长,例如p=1)之间的距离的暗微粒的像素被汇集入一个区域,并计算它们的平均荧光和到亮微粒中心的平均距离。暗微粒的像素用亮视场图像选择。
在图5中,计算出的平均荧光绘制在计算出的平均距离上。图像的每个点对应着在离一个孤立的亮微粒的给定的距离上像素的平均荧光。x轴右边的平台部分对应着以黑色垂直线表示其半径的亮微粒的荧光。因此,这条线之后的荧光对应着围绕该亮微粒的荧光光环,该光环具有荧光衰减分布。
为了在不同的条件下能比较每个曲线,通过区域内的平均荧光除以亮微粒的荧光而计算出相对荧光。图6显示了与图5中曲线相对应的相对荧光衰减分布。图6中Y轴上的值可以被解释为在给定的距离亮微粒的距离处,亮微粒的荧光串扰的比例。
针对不同的曝光时间、不同的缓冲剂、仪器和微粒确定相对荧光衰减分布,以评估变化性的潜在来源。该研究显示了衰减分布基本上与亮微粒的荧光、使用的缓冲剂和曝光条件无关。
在另外的步骤中,选择的模型被拟合到相对荧光衰减分布。更具体地,选择关系(7)的指数的和作为模型,特别是三个指数的和。该模型虽然灵活,但依然能提供相对串扰荧光和到亮微粒中心的距离之间的解析表达式。相对荧光衰减的曲线具有复杂的形状,可能无法与三个指数的和拟合(0至50像素的平台区之后至85的尖锐坡度)。因此,为了增加模型的拟合优度,舍弃了尖锐坡度处的数据。这是通过尖锐坡度处所对应的距离不会填充任何其他微粒这一事实而验证的。例如,在EvalutionTM系统中,微粒的半径大致为56像素,因此两个微粒之间的最小距离预计不会小于85像素。因此,用于拟合数据的模型在EvalutionTM中:
图7显示了图6的相对荧光衰减的细节,其中红线对应于拟合的模型。明显地,可以使用任何合适的模型。
参见图8至图12,示出了串扰校正的示例。这个示例对应于双路复用测定,因此对于两种微粒或群,第一群微粒(RPE生物素微粒)与第二群微粒(COOH微粒)相比十分明亮。图8示出了容纳这两个群的通道的亮视场图像。如图8所示,对于标准图像获取条件(例如激发功率=10mW,图像获取曝光=40ms),亮微粒的群荧光等于112A.U.(“任意单位”)。仔细观察图8B,RPE生物素微粒是尖锐的,周围没有环绕光环,因此难以弄清楚串扰现象的发生。然而,通过增加荧光图像8B的对比度到最大(例如,假设图像为8位编码,每个原始荧光大于或等于的像素设置为值255,原来为0的像素依然为0),串扰效应变得明显(图8C)。叠加图8A和图8C(图8D),注意到RPE生物素微粒的光环溢出了COOH微粒。图9示出了基于测量出的图9左上部示出的250像素半径圈中的COOH微粒的荧光计算出的COOH群聚合荧光在这里聚合荧光被示出为圈中RPE生物素微粒的数字的函数。COOH微粒群的荧光与RPE生物素微粒的数量正相关,这显示了串扰现象。
特别地,串扰效应导致的值的增加,如对应于相同获取条件下的单路测定中的COOH微粒的群荧光的水平虚线所示(0.07A.U.)。例如,具有一个RPE生物素微粒时,COOH群的群荧光等于0.44A.U.,即比单路的值增加了六倍。在多路复用分析中的群荧光对于其他群的荧光的这种依赖关系对于测定精确度是不利的,并且尤其可能导致假阳性结果。例如,在细胞因子测定中,INF-g的群荧光0.07A.U.被认为不显著高于空白荧光,因此被称为阴性。然而0.44A.U.的群荧光远高于检测的极限,并且对应估计浓度10.3pg/ml。图10显示了IFN-g实验中增加了六倍的荧光的外推及其使用用于将群荧光转化为INF-g浓度的校准曲线对于估计浓度的影响。
在应用根据本发明的串扰校正后,COOH微粒的荧光的测量不会被存在与同一视场角的亮微粒的荧光所影响。为了验证这一独立性,将多路复用测定中的COOH微粒的群荧光与参照值进行比较。参照值与COOH在同样的实验条件下的单路测定中所测得的群荧光相对应。
用于比较单路测定和多路复用测定中的COOH的统计数据为以下比值:
如果COOH微粒的信号强度没有受到亮微粒的存在的影响,那么比值ρ应等于1。在荧光和COOH微粒之间的串扰的情况下,该比值应该大于1。比值ρ需要在去串扰的之前和之后计算出来以评估串扰效应校正引起的对于多路复用级别的信号健壮性的改善。
图11和图12显示了分别在串扰效应校正之前和之后测量的COOH微粒荧光。图左部的前两个箱形图表示在单路测定中的荧光值。图右部接下来的箱形图表示在多个双路复用条件中的COOH荧光值(不同的亮微粒/COOH微粒比值)。x轴上的标签包含通道中亮微粒的近似百分比的信息和存在于双路复用分析中的亮微粒的编码类型(对于100%RPE生物素耦合的微粒为276,对于500%RPE生物素耦合的微粒为436)。
从图11可以观察到,未校对的COOH荧光表示出与通道中亮微粒的百分比强烈的关联性。通道中80%的微粒为100%-RPE生物素时的COOH群荧光比单路通道中的群的值高40倍以上。如图12所示,在应用去串扰算法后,该关联性显著降低。例如,具有80%亮微粒的通道的比值分别降低到0.87和1.71。量化地,其他实验条件(曝光时间、缓冲剂类型或失焦配置)下的箱形图表现出相同的行为。
- 还没有人留言评论。精彩留言会获得点赞!