成像质谱分析装置的制作方法
本发明涉及如下一种成像质谱分析装置:对试样上的二维区域内的多个测定点(微小区域)分别进行质谱分析,基于由此得到的信息来制作反映了上述二维区域内的物质的分布等的图像。
背景技术:
质谱分析成像法是如下一种方法:通过对生物体组织切片等试样的二维区域内的多个测定点分别进行质谱分析,来研究具有特定质量的物质的分布,该质谱分析成像法正不断应用于药物发现(drugdiscovery)、生物标记探索、各种疾病/疾患的原因探明等。用于实施质谱分析成像法的质谱分析装置一般被称为成像质谱分析装置(参照非专利文献1、专利文献1等)。另外,通常利用光学显微镜对试样上的任意的二维区域进行观察,基于该光学图像来决定测定对象区域并执行针对该区域的成像质谱分析,因此有时也被称为显微质谱分析装置、质谱显微镜等,但在本说明书中决定称为“成像质谱分析装置”。
成像质谱分析装置一般利用离子化法,在该离子化法中,通过对放置在试样台上的试样照射收敛为细径的激光、电子线、离子线、中性原子线等粒子线、含有带电液滴的气体流、或者等离子气体流等,来将该试样中含有的物质进行离子化。向试样照射的细径的激光、粒子线等经常被统称为探针或离子化探针,因此在此决定称为离子化探针。一般地,在这种离子化法中,通过对试样照射一次脉冲形式的离子化探针而生成的离子的量少。因此,为了使作为检测对象的离子的信号强度增加,一般将对试样上的某一个测定点照射离子化探针并获取质谱数据这样的测定重复进行多次,通过对所得到的多个质谱数据进行累计来获得与该测定点对应的质谱。
关于如上所述的离子化法,虽然根据离子化探针的种类不同,离子化的机理不同,但由于在使试样中的目标成分解吸之后进行离子化,因此基本上是有损分析。因此,当对相同的测定点重复进行离子化探针的照射也就是重复进行测定时,该测定点处的试样中的目标成分逐渐地减少,质谱的品质下降。特别是在基质辅助激光解吸离子化(maldi)法的情况下,通过对试样照射激光,不仅消耗试样中的目标成分,还消耗为了辅助离子化而对试样添加的基质,因此重复测定同一测定点时的质谱的品质下降明显。基于这样的理由,通常预先决定针对同一测定点的测定的重复次数(离子化探针的照射总次数)、离子化探针的总照射时间的上限,使得所获得的质谱的品质下降收敛于允许范围,以不超过该上限的方式设定每个测定点的离子化探针的照射次数、照射时间之类的分析条件。
另外,一般地,在质谱分析装置中尤其对成分的种类、量未知的试样进行测定的情况下,为了获得尽可能高的信号强度,需要通过预备的测定,来将离子化条件(例如在maldi法中为激光功率、激光脉冲照射次数等)、对离子输送光学系统施加的施加电压等ms分析条件、例如包括碰撞诱导裂解时的碰撞能量、碰撞气体压力等的msn分析条件等各种参数值调整为最佳值。这种所谓的测定方法的调整在成像质谱分析装置中也是重要的。
在成像质谱分析装置中,通常根据试样上的测定位置的不同,所含有的成分不同,对于每个用户来说,想要观测的试样上的关注区域(roi=regionofinterest)不同。因此,原本期望通过在用户想要观测的试样上的关注区域内一边变更离子化条件等参数值一边实施预备测定来进行测定方法的调整。然而,为了适当地调整测定方法,需要重复进行多次测定,但如上所述,随着重复测定,消耗了试样成分和基质。因此,一般对试样上的与关注区域不同的其它区域进行预备测定,基于其结果来进行测定方法的调整,但这样的话存在以下问题:由于所检测的成分未必与关注区域的成分相同,因此难以进行准确的调整。
对此,也考虑以下方法:以在关注区域内不超过每个测定点的测定次数的总数的上限值的方式分别对参数值不同的测定方法分配测定次数,对关注区域内的各测定点进行多个测定方法下的测定。即,该方法是以下方法:在每一个测定点的测定次数的总数的上限值为n且测定方法的数量为p的情况下,按每一个测定方法对一个测定点执行n/p以下的次数的测定。然而,在这样的方法中,每一个测定方法的测定次数少,因此所获得的信号强度易于变低,难以进行不同的测定方法下的质谱的准确的比较。特别是在maldi法等中,每次测定的信号强度的偏差比较大,因此当每一个测定方法的测定次数少时,易于出现每次测定的信号强度的偏差的影响,测定方法的调整的可靠性降低。另外,也存在以下问题:由于决定了针对一个测定点的测定次数的总数的上限值,因此能够设定的测定方法的数量本身也受到制约,难以细微地变更一个分析条件的参数值。
另外,在进行测定方法的调整的情况以外的情况中也存在以下情况:想要对关注区域内的各测定点进行多个测定方法下的测定。该情况例如是以下情况:想要通过对关注区域内的各测定点进行质荷比范围不同的多个质谱分析、普通的质谱分析及msn分析或者前体离子的质荷比值不同的多个msn分析等,来从一个关注区域收集更多的质谱分析信息或者对各个结果进行比较。在这样的情况下,也能够与测定方法的调整时同样地,采用以在关注区域内不超过每个测定点的测定次数的总数的上限值的方式分别对分析条件等不同的多个测定方法分配测定次数的方法,但如上所述那样存在以下问题:由于每一个测定方法的测定次数少,因此所获得的信号强度易于变低,难以获得准确的质谱分析信息。
专利文献1:国际公开第2014/175211号
非专利文献1:“imscopetrioイメージング質量顕微鏡”,[线上],株式会社岛津制作所,[平成28年8月8日检索],因特网<url:http://www.an.shimadzu.co.jp/bio/imscope/msn.htm>
技术实现要素:
发明要解决的问题
本发明是鉴于上述问题而完成的,其主要目的在于提供如下一种成像质谱分析装置:以能够在用户想要观测的试样上的关注区域的附近获得足够的信号强度那样的测定次数分别执行不同的测定方法下的测定,从而能够获得该不同的测定方法下的高品质的质谱分析成像图像。
用于解决问题的方案
为了解决上述问题而完成的本发明是一种成像质谱分析装置,对在试样上的二维区域内设定的多个微小区域分别照射离子化探针并执行质谱分析,该成像质谱分析装置具备:
a)关注区域设定部,其决定试样上的关注区域以及离散地位于该关注区域内的多个微小区域;
b)测定区域设定部,其决定与所述关注区域部分重叠的一个以上的测定区域、以及离散地位于该测定区域内并位于与所述关注区域内的多个微小区域及其它测定区域内的多个微小区域完全不重叠的位置的多个微小区域;
c)测定方法设定部,其对所述关注区域和一个以上的所述测定区域分别设定包括执行质谱分析时的分析条件的测定方法,或者对多个所述测定区域分别设定包括执行质谱分析时的分析条件的测定方法;以及
d)分析执行部,其按照在所述测定方法设定部中对所述关注区域和所述测定区域设定的测定方法,对所述关注区域和一个以上的所述测定区域中分别包括的多个微小区域执行质谱分析,或者对多个所述测定区域中分别包括的多个微小区域执行质谱分析。
在本发明所涉及的成像质谱分析装置中,上述离子化探针例如是被收敛为细径的激光、电子线、离子线、中性原子线等粒子线、含有带电液滴的气体流、或者等离子气体流等。在利用激光来作为离子化探针的情况下,离子化法除了是上述的maldi法以外,也是不使用基质的激光解吸离子化(ldi)法、表面辅助激光解吸离子化(saldi)法等。
在本发明所涉及的成像质谱分析装置中,例如当用户指定试样上的想要观测成分的空间分布等的关注区域,并且指定空间分辨率、一个微小区域(测定点)的尺寸即离子化探针的照射直径等时,关注区域设定部按照这些指定决定试样上的多个微小区域离散地分布的关注区域。在能够获取试样的光学图像的成像质谱分析装置中,用户能够参照所显示的光学图像来指定关注区域。另外,也可以通过按照预先决定的条件的图像识别等来自动地指定关注区域。
例如,当指定关注区域、以及空间分辨率或质谱分析成像图像的像素数等时,决定对关注区域内栅格状地划分出的、各自与质谱分析成像图像的像素对应的矩形的小区域的大小和位置。因此,将在该各小区域的中心位置处由用户指定的大小的微小区域决定为微小区域即可。此外,空间分辨率、微小区域的大小等参数也可以不由用户指定,而是对装置预先决定的默认值。
当决定关注区域以及该区域内的微小区域时,测定区域设定部在与关注区域内的多个微小区域完全不重叠的位置、即完全不重叠或者虽然部分重叠但完全不一致的位置处决定与关注区域内的微小区域分别对应的不同的微小区域,并且决定包括所述多个不同的微小区域的与关注区域部分重叠的测定区域。关注区域内的微小区域同与之对应的测定区域内的微小区域之间的位置的偏差的大小、方向既可以由用户设定,例如也可以根据关注区域内的各微小区域的大小、相邻微小区域间的间隔等来自动地决定。总之,在使关注区域适当地错开的位置处设定测定区域。此外,能够根据需要设定两个以上的测定区域。在该情况下,某个测定区域内的各微小区域与其它测定区域内的各微小区域也完全不重叠。
测定方法设定部对关注区域和一个以上的测定区域各区域或者对多个测定区域各区域个别地设定包括执行质谱分析时的分析条件的测定方法。在此,分析条件能够包括应该事先在执行质谱分析时决定的各种参数值,例如在搭载有基于maldi法的离子源的情况下,能够在测定方法中包括向试样照射的激光的功率、激光脉冲照射次数等。另外,在测定方法中能够还包括对离子输送光学系统等的质谱分析装置的各部施加的电压的值(在交流电压的情况下为振幅值),在施加交流电压的情况下,在测定方法中能够还包括交流电压的频率,在通过切换对前级的离子输送光学系统和下一级的离子输送光学系统分别施加的电压来从前级的离子输送光学系统向下一级的离子输送光学系统交接离子的情况下,在测定方法中能够还包括该电压切换的定时(时间差等)。并且,在作为质谱分析进行msn分析的情况下,在测定方法中能够还包括前体离子的质荷比值、碰撞诱导裂解时的碰撞能量、碰撞气体压力等msn分析条件。此外,虽然对关注区域、测定区域个别地设定测定方法,但不限制其测定方法的内容,因此内容也可以完全相同。
分析执行部通过对关注区域或一个以上的测定区域中分别包括的多个微小区域按照对该区域个别地设定的测定方法执行质谱分析,来按每个微小区域获取质谱数据。此外,如上所述,通过将每当对一个微小区域照射一次或多次离子化探针时得到的质谱数据进行累计,能够获得针对一个微小区域的质谱数据。
通常,在试样上以从关注区域偏离了离子化探针的照射直径的至多几倍左右的方式设定测定区域。因此,虽然也依赖于试样,但在大多情况下,能够视为测定区域内的成分的空间分布与关注区域内的成分的空间分布大致相同。另一方面,测定区域内的各微小区域与关注区域内的各微小区域完全没有重叠,因此即使在对关注区域内的各微小区域执行了质谱分析之后对测定区域内的各微小区域执行质谱分析的情况下,也在被照射离子化探针的范围内仍然残留试样中的目标成分(在maldi法的情况下还残留基质)的可能性高,能够获得充足的信号强度的质谱数据。因此,通过事先设为使对关注区域和一个以上的测定区域分别设定的测定方法或者对多个测定区域分别设定的测定方法的参数值不同、也就是说事先设定不同的内容的测定方法,能够分别高品质地获取与针对一个关注区域改变了测定方法并执行了质谱分析的情况下得到的质谱数据实质上相同的质谱数据。
由此,能够高精度地进行针对关注区域的在不同的测定方法下的特定的质荷比的质谱分析成像图像的比较,或者能够一并获取如果不在互不相同的测定方法下则无法以充足的强度进行检测那样的与多个成分有关的分布信息。
作为测定方法中包括的分析条件的参数值也可以由用户个别地输入,但在想要进行测定方法的调整的情况下,期望尽量减少用户制作想要优化的参数值不同的测定方法所需要的劳力和时间。
因此,在本发明所涉及的成像质谱分析装置中,优选设为以下结构:
所述测定方法设定部按照对作为测定方法中包括的至少一个分析条件的参数值进行变更的条件,来制作该参数值不同的多个测定方法,对所述关注区域和一个以上的所述测定区域分别设定所述多个测定方法,或者对多个所述测定区域分别设定所述多个测定方法。
在此,对作为一个分析条件的参数值进行变更的条件例如是指使该参数值变更的范围(上限值和下限值)及其变更的步长。当然,并非使参数值以固定的步长变化,例如也能够考虑随着值本身变大而使步长也增大之类的变化方式。
根据该结构,只要事先指定想要优化的参数值的变更条件,就能够自动地制作该参数值各不相同的多个测定方法,因此不需要用户一个个地手动地制作测定方法,能够实现节约用户的劳力和时间并改善分析的效率。
另外,在上述结构的成像质谱分析装置中,优选设为以下结构:还具备最佳测定方法决定部,该最佳测定方法决定部基于通过在不同的多个测定方法下分别对不同的测定区域中包括的微小区域进行质谱分析所得到的质谱分析结果,来在所述多个测定方法中决定最佳的测定方法。
为了决定最佳测定方法而考虑各种算法,但例如能够使用以下方法:在关注区域和测定区域各区域中求出将所有微小区域中的tic值相加所得到的总tic值,将对总tic值最大的关注区域或测定区域设定的测定方法设为最佳的测定方法。另外,也可以不使用关注区域内或测定区域内的所有微小区域中的数据,而仅利用特定的一部分微小区域中的数据来决定最佳的测定方法。另外,也可以利用并非tic值的特定的质荷比值或质荷比范围内的信号强度值来决定最佳的测定方法。
如上所述,在大多情况下,能够视为测定区域内的成分的空间分布与关注区域内的成分的空间分布大致相同,并且无论在哪一个测定区域的微小区域中,都能够几乎不受由在此之前执行分析所产生的试样成分或基质的消耗的影响地获得充足的信号强度的质谱数据。由此,能够良好地进行不同的测定区域中的质谱分析结果的比较,可靠地选择最佳的测定方法。
此外,上述结构的成像质谱分析装置能够设为以下结构:还具备测定方法条件设定部,该测定方法条件设定部用于用户指定对作为测定方法中包括的至少一个分析条件的参数值进行变更的条件。
根据该结构,用户能够根据试样的种类、分析的目的或者所要求的分析的准确性/可靠性等,适当地指定参数值的变更条件。由此,也可以粗略地进行测定方法的调整,因此即使在想要缩短分析时间、或者反之即使延长分析时间也想要提高测定方法的调整的精度等情况下,能够进行与目的或状况相应的适当的测定方法的调整。
另外,本发明所涉及的成像质谱分析装置也可以设为以下结构:
还具备前体离子选择部,该前体离子选择部基于通过对所述关注区域中包括的微小区域进行msn-1分析(n为2以上的整数)所得到的msn-1分析结果,来选择用于msn分析的前体离子,
所述测定方法设定部对一个以上的测定区域分别设定测定方法,该测定方法包括用于执行以由所述前体离子选择部选择出的一个或多个前体离子为目标的msn分析的分析条件,
作为对一个以上的所述测定区域中分别包括的多个微小区域进行的质谱分析,所述分析执行部按照对该测定区域分别设定的测定方法执行msn分析。
根据该结构,能够对视为成分的空间分布实质上与关注区域内的成分的空间分布相同的、各不相同的测定区域执行以不同的前体离子为目标的msn分析。因而,也能够高精度且简便地进行根据不同的前体离子获得的msn成像图像之间的比较等。此外,期望事先设为使用户能够指定用于msn分析的前体离子选择条件。
另外,本发明所涉及的成像质谱分析装置优选设为以下结构:能够基于通过对关注区域或测定区域中包括的微小区域进行质谱分析所得到的质谱分析结果来制作并显示质谱分析成像图像,但还具备:摄像部,其获取试样的光学图像;以及图像叠加处理部,其使质谱分析成像图像和由所述摄像部得到的针对关注区域或测定区域的光学图像叠加地显示,其中,该质谱分析成像图像是基于通过对所述关注区域或所述测定区域中包括的微小区域进行质谱分析所得到的质谱分析结果来制作的图像。
根据该结构,能够容易地掌握在试样上观测到的生物体组织的形状或图案与成分分布的关系。此外,图像叠加处理部当然也可以对针对测定区域的质谱分析成像图像叠加相同的测定区域的光学图像,但由于关注区域与测定区域的位置的偏移小,因此即使对针对测定区域的质谱分析成像图像叠加关注区域的光学图像,实质上也没有问题。
发明的效果
根据本发明所涉及的成像质谱分析装置,能够针对用户想要观测的试样上的关注区域、以及处于与该关注区域大致相同的位置且以被照射离子化探针的微小区域与关注区域内的微小区域完全不重叠的方式决定的测定区域,或者针对处于与关注区域大致相同的位置的多个测定区域,分别执行不同的测定方法下的质谱分析。由此,能够分别获得在不同的测定方法下的针对关注区域的高品质的质谱分析成像图像。另外,也能够利用在不同的测定方法下得到的良好的质谱分析信息来可靠地进行测定方法的优化,或者通过自动msn分析来获取前体离子不同的高品质的msn成像图像。
附图说明
图1是作为本发明的一个实施例的成像质谱分析装置的概要结构图。
图2是作为本实施例的成像质谱分析装置的关注区域与测定区域的关系的一例的说明图。
图3是作为本实施例的成像质谱分析装置的关注区域与测定区域的关系的另一例的说明图。
图4是表示本实施例的成像质谱分析装置的多个测定方法下的数据收集时的操作以及处理过程的流程图。
图5是表示本实施例的成像质谱分析装置的测定方法调整时的操作以及处理过程的流程图。
图6是表示本实施例的成像质谱分析装置的执行自动msn分析时的操作以及处理过程的流程图。
具体实施方式
以下,参照所附附图对本发明所涉及的成像质谱分析装置的一个实施例进行说明。
图1是本实施例的成像质谱分析装置的概要结构图。
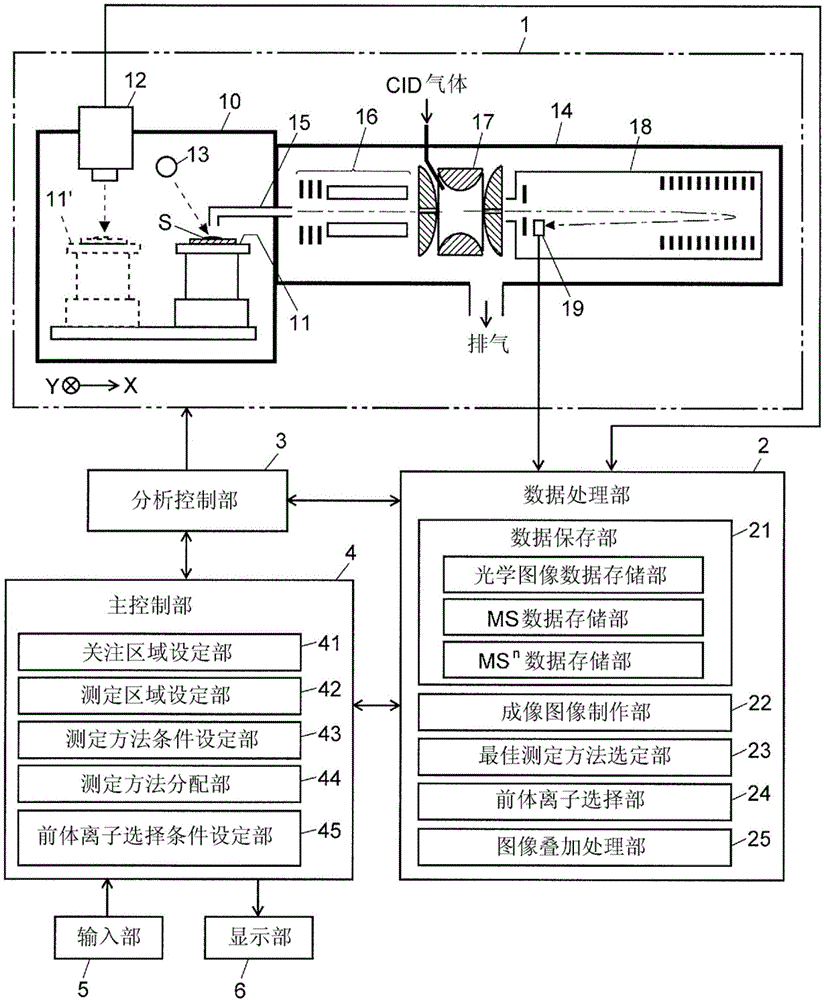
本实施例的成像质谱分析装置具备:测定部1,其能够对试样s上的二维区域内的多个测定点(微小区域)分别执行质谱分析并按每个测定点获取质谱数据(包括n为2以上的msn谱数据);数据处理部2,其将由该测定部1得到的数据保存并进行处理;分析控制部3,其控制测定部1中包括的各部的动作;主控制部4,其管理系统整体的控制和用户接口等;以及附设于该主控制部4的输入部5及显示部6。
测定部1是能够进行msn分析的maldi离子化离子阱飞行时间质谱分析装置(maldi-it-tofms)。即,测定部1包括:试样台11,其被配置在大气压环境下的离子化室10内,能够沿着互相正交的x轴、y轴这两个轴方向移动;摄像部12,其在试样台11处于图1中的用附图标记11’表示的位置(以下称为“光学观察位置”)时拍摄载置在该试样台11上的试样s的光学图像;激光照射部13,其在试样台11处于图1中的用实线表示的位置(以下称为“分析位置”)时向试样s照射收敛为微小直径的激光来将该试样s中的成分进行离子化;离子导入部15,其收集从试样s产生的离子并向维持真空环境的真空腔室14内输送;离子导向器16,其一边会聚源自试样s的离子一边引导这些离子;离子阱17,其通过高频四极电场暂时捕捉离子,并且根据需要进行前体离子的选择以及该前体离子的裂解(碰撞诱导裂解=cid);飞行管18,其在内部形成用于使从该离子阱17射出的离子根据质荷比进行分离的飞行空间;以及检测器19,其检测离子。但是,如后述那样,测定部1的结构并不限于此,能够进行各种变形。
数据处理部2具备数据保存部21、成像图像制作部22、最佳测定方法选定部23、前体离子选择部24、图像叠加处理部25等,来作为本实施例的成像质谱分析装置的特征性的功能块。数据保存部21用于保存由测定部1得到的各种数据,且具有光学图像数据存储部、ms数据存储部以及msn数据存储部。主控制部4具备关注区域设定部41、测定区域设定部42、测定方法条件设定部43、测定方法分配部44、前体离子选择条件设定部45等功能块,来作为本实施例的成像质谱分析装置的特征性的功能块。此外,数据处理部2、主控制部4以及分析控制部3中的至少一部分能够设为以下结构:将包括cpu、ram、rom等的个人计算机(或者更高性能的工作站)设为硬件资源,通过使安装于该计算机的专用的控制/处理软件在该计算机上运行来实现各个功能。
在本实施例的成像质谱分析装置中,在执行测定时,向载置在试样台11上的试样s照射从激光照射部13射出的微小直径的激光。于是,存在于试样s中的被激光照到的部位(测定点)的成分被离子化。当利用未图示的驱动部使试样台11沿x轴方向、y轴方向适当移动时,试样s上的被激光照射的位置发生变化,因此通过反复进行试样台11的移动以及脉冲状的激光照射,能够针对试样s上的二维区域内的多个测定点执行质谱分析。
在本实施例的成像质谱分析装置中能够进行如上述那样的普通的测定,但除此以外也能够进行几个特征性的测定动作。以下,参照图2~图6对该测定动作进行说明。
[多个测定方法下的针对关注区域的测定]
图4是表示本实施例的成像质谱分析装置的第一特征性的测定动作的操作以及处理过程的流程图。
作为测定对象的试样被放置在maldi用样品板上,通过向该试样的表面涂布(或喷射)适当的基质来对试样s进行调制。作为测定对象的试样例如是生物体组织切片等。用户(分析者)将调制完成的试样s放置在试样台11上,用输入部5进行规定的操作。于是,在接收到来自主控制部4的指示的分析控制部3的控制下,试样台11移动到光学观察位置,摄像部12获取试样s的光学图像并将其图像数据发送到数据处理部2。该图像数据被保存于数据保存部21。另外,基于该图像数据的试样s的光学图像通过主控制部4显示在显示部6的画面上。
用户参照显示部6中显示的光学图像,利用输入部5指定想要在试样s上观测的关注区域(步骤s1)。例如通过对光学图像上的包围任意范围的矩形形状的框的大小、位置进行变更,能够将由该框围成的范围指定为关注区域。另外,也能够通过在光学图像上进行拖拽操作,指定任意形状的关注区域。
另外,用户为了决定在被指定的关注区域内实际被执行质谱分析的测定点,从输入部5指定激光照射直径、空间分辨率(例如x轴方向和y轴方向的测定点间隔)或测定点总数等参数值(步骤s1)。此外,在将预先对装置决定的默认值用作这些参数值的情况下,能够省略由用户进行的指定。在主控制部4中,关注区域设定部41根据来自输入部5的指示来决定关注区域的范围,并且在关注区域内决定进行激光照射的多个测定点的位置(步骤s2)。
图2的(a)以及图3是关注区域与测定区域的关系的一例的说明图。当前,关注区域是矩形形状,在指定了激光照射直径
另外,用户从输入部5指定对关注区域100新设定的测定区域及其区域内的测定点的设定条件(步骤s3)。具体地说,例如,既可以将使关注区域100内的各测定点(属于第一测定点群的测定点)101偏移的量、偏移的方向等指定为设定条件,也可以将在x轴方向或y轴方向上相邻的测定点101之间新设定的测定点的个数指定为设定条件。在此,优选的是,预先设置限制以使得能够使关注区域100内的各测定点101偏移的范围收敛于该测定点101所在的小区域102的范围。此外,也可以基于关注区域100内的测定点的大小或间隔来自动地决定在决定测定区域时使测定点从原始的(也就是关注区域100内的)测定点的位置偏移的量、偏移的方向。在该情况下,能够省略由用户进行的设定条件的指定。
测定区域设定部42按照在步骤s3中指定的设定条件来决定与关注区域内的各测定点完全不重叠的不同的测定点以及包围该测定点的测定区域200(步骤s4)。图2的(a)是使关注区域100内的各测定点101向x轴的正向(右方)偏移
在图2的(a)的例子的情况下,关注区域100中的测定点101与测定区域200中的测定点完全不重叠。另一方面,也存在以下情况:当激光照射直径、也就是测定点101大时,难以(或者不可能)以与关注区域100内的测定点101完全不重叠的方式决定新的测定区域200内的测定点201。图3是这种情况下的例子,关注区域100内的测定点101与新的测定区域200内的测定点201部分重叠。优选的是,虽然最好如图2的(a)所示那样测定区域200内的测定点201与关注区域100内的测定点101完全不重叠,但也可以允许如图3所示那样部分地重叠。
接着,用户从输入部5对关注区域和测定区域分别指定测定方法(步骤s5)。测定方法包括激光功率等离子化条件、向离子导向器16等各部施加的施加电压之类的分析条件等各种参数值。能够通过选择预先保存有各种参数值的测定方法文件的文件名等来进行测定方法的指定。一般情况下,对关注区域和测定区域指定不同的测定方法,但也能够指定相同的测定方法。测定方法分配部44根据上述用户的指定来针对关注区域和测定区域分别存储测定方法的分配。
此外,上述步骤s1~s5的操作以及处理能够适当更换其顺序。例如,也可以是,首先,事先针对关注区域和测定区域指定测定方法,之后设定关注区域、测定区域。另外,也可以是,在决定关注区域之后针对该关注区域指定测定方法,之后决定测定区域,接着针对该测定区域指定测定方法。
当用户从输入部5指示分析开始时,分析控制部3控制测定部1,使得对关注区域100内的各测定点101执行按照对该关注区域100分配的测定方法的质谱分析,接着,控制测定部1,使得对测定区域200内的各测定点201执行按照对该测定区域200分配的测定方法的质谱分析。由此,执行针对各测定点101、201的质谱分析(步骤s6)。
即,在测定部1中,当从maldi用激光照射部13向试样s上的测定点100(或者201)照射脉冲状的激光时,存在于该照射部位附近的试样s中的成分被离子化。产生的离子通过离子导入部15被输送到真空腔室14内,在利用离子导向器16将这些离子会聚后导入到离子阱17内,通过四极电场的作用来暂时保持这些离子。该各种离子在规定的定时从离子阱17射出并被导入到飞行管18内的飞行空间,在该飞行空间飞行而到达检测器19。在飞行空间飞行的期间,各种离子根据质荷比分离,按质荷比从小到大的顺序到达检测器19。由检测器19得到的模拟检测信号在通过未图示的模拟数字转换器被转换为数字数据之后,被输入到数据处理部2,飞行时间被换算为质荷比并作为质谱数据被保存于数据保存部21。
这样,当与关注区域100或测定区域200内的某一个测定点对应的质谱数据被保存于数据保存部21时,试样台11进行移动以使得接着要测定的测定点来到激光照射位置。通过反复进行该操作,收集与关注区域100及测定区域200内的所有测定点101、201对应的质谱数据(步骤s7)。此外,在步骤s6、s7中,既可以使针对关注区域100内的一个测定点101进行的质谱分析与针对测定区域200内的一个测定点201进行的质谱分析交替地执行,也可以在针对关注区域100内(或测定区域200内)的所有测定点101(或测定点201)实施了质谱分析之后针对测定区域200内(或关注区域100内)的所有测定点201(或测定点101)执行质谱分析。
在数据收集之后,成像图像制作部22基于数据保存部21中保存的数据来制作针对关注区域100和测定区域200的表示指定质荷比下的信号强度的二维分布的ms成像图像,通过主控制部4使该ms成像图像显示在显示部6的画面上(步骤s8)。
当向试样s照射激光时,该试样s中的成分和基质飞散,因此每当向同一位置反复照射激光时,所获得的信号强度逐渐地降低。与此相对地,关注区域100内的各测定点101与测定区域200内的各测定点201完全没有重叠,因此在针对关注区域100内的各测定点101执行了质谱分析之后执行测定区域200内的各测定点201的质谱分析时,向在关注区域100的质谱分析时没有被照射激光的部分照射至少一部分激光。这情形不仅在与例如图2的(a)所示那样关注区域100内的测定点101与测定区域200内的测定点201完全不重叠的情况下,还在如图3所示那样关注区域100内的测定点101与测定区域200内的测定点201部分重叠的情况下也是相同的。因此,在与对关注区域100进行质谱分析时的测定方法不同的测定方法下对测定区域200进行质谱分析时,也能够获得充足的强度的信号。
另外,虽然测定区域200不是与由用户指定的关注区域100完全相同的位置,但以视为与关注区域100大致相同的位置的程度叠加在试样s上。因此,视为在关注区域100内的测定点101处以及与该测定点101对应的测定点201处存在的成分大致相同。因而,能够理解为,例如在对关注区域100和测定区域200设定了不同的测定方法的情况下,在相同的质荷比下的针对关注区域100的ms成像图像以及针对测定区域200的ms成像图像中仅反映了测定方法的差异,能够从这些ms成像图像收集与试样s上的关注区域100有关的更多的信息。另外,通过将这些ms成像图像的各像素的信号强度相加或相减或相除、或者进一步选择强度值大的信号强度,能够制作更加可靠地表示存在于关注区域100的特定成分的二维分布的ms成像图像。另外,也能够对这些ms成像图像之间进行比较来研究测定方法的可靠性等。
另外,当用户根据需要从输入部5进行规定的操作时,图像叠加处理部25获取数据保存部21中保存的光学图像数据,以在与关注区域100或测定区域200对应的任意质荷比下(或者多个质荷比的组合下)的ms成像图像中叠加有同区域的光学图像的方式显示在显示部6的画面上(步骤s9)。优选设为例如能够通过在显示有ms成像图像和光学图像这双方的画面上进行使光学图像在ms成像图像上移动的拖放操作来实施这样的图像的叠加。如上所述那样视为测定区域200是与关注区域100大致相同的位置,因此也可以在针对测定区域200的ms成像图像上直接(也就是不偏移关注区域与测定区域的位置偏移的量地)叠加与关注区域对应的光学图像。通过像这样使ms成像图像和光学图像叠加地显示,具有易于从视觉上将光学图像上出现的生物体组织的形状或图案与成分的二维分布相关联的优点。
此外,在上述说明中,对关注区域100决定了仅一个测定区域200,但也能够决定多个测定区域200。在该情况下,不同的测定区域200中分别包括的测定点201被设定在完全不重叠的位置,使得同上述的关注区域100内的测定点101与测定区域200内的测定点201之间的关系相同。由此,能够在对某个测定区域200实施质谱分析时向仍没有被实施分析的试样s上的部位至少照射激光的一部分。另外,特别是在决定多个测定区域200的情况下,通过在此之前进行测定方法的指定来与被指定的该测定方法的数量相应地决定测定区域的个数即可。
[测定方法的自动调整]
图5是表示本实施例的成像质谱分析装置的第二特征性的测定动作的操作以及处理过程的流程图。该测定动作是用于自动地优化测定方法的自动调整的动作。
在图5中,步骤s11~s13的操作及处理与已经说明过的步骤s1~s3的操作及处理完全相同,因此省略说明。在步骤s13结束后,用户从输入部5指定对测定方法中的各种分析条件的参数值进行变更的变更条件(步骤s14)。
例如,在想要优化对离子导向器16施加的施加电压等参数值的情况下,将该参数值的变化的范围(也就是上限值和下限值)和变化的步长指定为变更条件即可。另外,也可以是,在步长不固定的情况下,能够利用参数值的计算式、参数值表来指定变更条件。另外,如上所述,测定方法中包括的分析条件并非仅为一个而是多个,因此某一个分析条件的参数值也有时对其它分析条件的参数值造成影响。因此,也可以设为能够多维地变更多个参数值。另外,也可以设为用户能够仅选择想要优化的分析条件的种类(例如激光功率、激光照射次数、离子导向器16的施加电压、对离子导向器16施加的高频电压的频率、对离子阱17施加用于捕捉离子的电压的定时等),事先默认地决定各个参数值的变更条件。另外,也可以不依赖于用户的指定而事先默认地决定所有参数值的变更条件。
接着,测定方法条件设定部43基于上述测定方法的参数值的变更条件来制作各不相同的测定方法(步骤s15)。要变更参数值的分析条件越多,另外,参数值的步长越细,则所要制作的测定方法的数量越多。
测定区域设定部42以与上述步骤s4同样的过程决定与在步骤s15中制作出的测定方法的个数相应的个数的测定区域200,该测定区域200包括与关注区域100内的测定点101完全不重叠且与其它测定区域200内的测定点201也完全不重叠的测定点201(步骤s16)。在此,为了利用最终被优化后的测定方法对关注区域100内的各测定点101进行质谱分析,事先使关注区域100以外的测定区域200的个数与测定方法的个数一致。测定方法分配部44对已设定的多个测定区域200分别分配不同的测定方法并进行存储(步骤s17)。
当用户从输入部5指示开始执行自动调整时,分析控制部3控制测定部1,使得对一个测定区域200内的各测定点201执行按照对该测定区域200分配的测定方法的质谱分析,接着,控制测定部1,使得对另一测定区域200中的各测定点201执行按照对该测定区域200分配的测定方法的质谱分析。通过反复进行该操作,对所有的测定区域200中的各测定点201执行质谱分析(步骤s18)。由此收集到的质谱数据被暂时保存于数据保存部21(步骤s19)。
最佳测定方法选定部23基于按每个测定区域200得到的数据从多个测定方法中选定最佳的测定方法(步骤s20)。
例如按一个测定区域200内的每个测定点201求出将所有质荷比的信号强度相加所得到的tic(总离子电流)值,并且,计算将该测定区域200内的所有测定点的tic值相加所得到的总tic值。针对在各不相同的测定方法下得到的不同的测定区域200比较该总tic值,将使总tic值最大的测定方法选定为最佳的测定方法。另外,在决定了目标成分的情况下,将使源自该目标成分的离子的质荷比下的信号强度的相加值最大的测定方法选定为最佳的测定方法即可。从多个测定方法中选定最佳的测定方法的算法并不限于这些方法。
如果像上述那样选定了最佳的测定方法,则在该最佳的测定方法下对关注区域100内的各测定点101实施质谱分析,并针对该关注区域100收集质谱数据即可。
在上述说明中,按照在步骤s14中指定的参数值的变更条件制作多个测定方法,在决定了与制作出的测定方法对应的个数的测定区域之后执行了质谱分析,但也可以每当设定一个测定方法以及测定区域时执行质谱分析,在基于该质谱分析结果发现了被估计为最佳的测定方法的时间点中止处理。通过像这样逐次地执行测定方法及测定区域的设定、质谱分析的执行以及最佳测定方法的判定,能够避免执行无用的质谱分析。
[自动msn分析]
图6是本实施例的成像质谱分析装置的第三特征性的测定动作的流程图。该测定动作是用于基于通常的质谱分析的结果自动地选择前体离子并执行msn分析(在本例中n为2)的自动msn分析的动作。
在图6中,步骤s31~s33的操作及处理与已经说明过的步骤s1~s3的操作及处理完全相同,因此省略说明。在步骤s33的处理结束后,前体离子选择条件设定部45根据用户从输入部5进行的输入来设定前体离子的选择条件并进行存储(步骤s34)。在前体离子选择条件中包括为了选择前体离子而要使用通过质谱分析得到的结果中的哪一个结果的选择。即,能够选择利用针对关注区域100内的测定点101中的特定的一个测定点得到的质谱数据、将针对特定的多个测定点得到的质谱数据进行累计或平均所得到的值、或者将针对关注区域100内的所有测定点101得到的质谱数据进行累计或平均所得到的值等中的哪一个值来进行前体离子选择的判断。另外,作为前体离子选择的判定条件,例如能够进行以下等指定:在质谱中按信号强度从大到小的顺序选择规定个数的峰、按该质荷比值从大到小的顺序选择最大规定个数的信号强度值为规定值以上的峰、在存在预先决定的质荷比值的峰的情况下选择规定个数的该峰。
之后,当用户从输入部5指示开始执行自动msn分析时,分析控制部3控制测定部1,使得对关注区域100内的各测定点101执行按照规定的测定方法的质谱分析。由此,对关注区域100内的各测定点101执行质谱分析,由此收集到的质谱数据被暂时保存于数据保存部21(步骤s35、s36)。此外,在进行了在判定中仅使用特定的一个或多个测定点处的质谱数据的意思的选择来作为前体离子选择条件的情况下,不对所有测定点101执行质谱分析,仅对其特定的一个或多个测定点101执行质谱分析即可。
在数据收集后,前体离子选择部24按照所设定的前体离子选择条件,基于得到的质谱数据选择一个或多个峰来作为前体离子,并求出该峰的质荷比值(步骤s37)。此外,也可能有完全不存在适合前体离子选择条件的峰的情况,因此在该情况下,不执行ms2分析就结束处理。在选择了一个或多个前体离子的情况下,测定区域设定部42以与上述步骤s4同样的过程决定与在步骤s37中选择出的前体离子的个数相应的个数的测定区域200,该测定区域200包括与关注区域100内的测定点101完全不重叠且与其它测定区域200内的测定点201也完全不重叠的测定点201(步骤s38)。另外,测定方法分配部44制作用于以选择出的前体离子为目标的ms2分析的测定方法,并对在步骤s38中设定的测定区域200分别分配这些测定方法(步骤s39)。
当决定测定方法和测定区域时,分析控制部3控制测定部1,使得对一个测定区域200内的各测定点201执行按照所设定的测定方法的ms2分析、也就是以在步骤s37中选择出的前体离子中的一个前体离子为目标的ms2分析。即,测定部1在将通过向试样s照射激光而生成的各种离子捕捉到离子阱17之后,从离子阱17内排除具有前体离子的质荷比的离子以外的离子。之后,向离子阱17内导入碰撞气体,通过对离子进行激励来促进该离子的裂解。然后,通过该裂解而生成的产物离子从离子阱17一齐朝向飞行管18射出并被进行质谱分析。
这样,对一个测定区域200内的各测定点201执行以相同的前体离子为目标的ms2分析,由此收集到的ms2谱数据被暂时保存于数据保存部21。通过重复进行该操作,对在步骤s38中设定的所有的测定区域20内的各测定点201执行ms2分析,由此收集到的质谱数据被保存于数据保存部21(步骤s40、s41)。
在数据收集后,成像图像制作部22基于数据保存部21中保存的ms2谱数据来制作表示源自被指定的前体离子的具有特定质荷比的产物离子的二维强度分布的ms2成像图像,通过主控制部4将该ms2成像图像显示在显示部6的画面上(步骤s42)。如上所述那样视为测定区域200与关注区域100大致相同。因此,能够视为与不同的前体离子对应的ms2成像图像均反映了关注区域100内的成分分布,能够从视觉上可靠地比较源自不同的前体离子的产物离子的二维强度分布。
另外,当用户根据需要从输入部5进行规定的操作时,图像叠加处理部25获取数据保存部21中保存的光学图像数据,以对与任意的测定区域对应的ms2成像图像叠加区域的光学图像的方式在显示部6的画面上进行显示(步骤s43)。
此外,在离子阱17中不仅能够进行ms2分析,还能够进行n为3以上的msn分析,因此也能够以同样的过程进行n为3以上的自动msn分析。另外,也能够在显示部6的画面上进行显示使得能够对ms3成像图像与ms4成像图像进行比较。
在上述实施例的成像质谱分析装置中,离子源是maldi离子源,但也可以是基于ldi法、saldi法的离子源。另外,作为离子化探针,也可以是利用了除激光以外的电子线、离子线、中性原子线、气体流、等离子气体流等的离子源。即,是以下方法即可:向试样照射收敛为细径的离子化探针,来将被照射了该离子化探针的范围的试样成分进行离子化。
另外,在测定部1中,离子源以外的结构、即根据质荷比使离子分离的质谱分析器和使离子裂解的离子裂解部的结构也不限于上述记载的结构。例如在进行msn分析的情况下,测定部1除了是离子阱飞行时间质谱分析装置以外,也可以是离子阱型质谱分析装置、串联四极杆质谱分析装置、q-tof型质谱分析装置等。另外,在该情况下,用于msn分析的离子裂解操作的方法并不限于碰撞诱导裂解,也可以是红外多光子吸收裂解、电子捕获裂解、电子转移裂解等中的任一种裂解。
另外,上述实施例是本发明的一例,即使在本发明的宗旨的范围内适当进行变更、修改、追加,也当然包含于本申请权利要求的保护范围中。
附图标记的说明
1:测定部;10:离子化室;11(11’):试样台;12:摄像部;13:maldi用激光照射部;14:真空腔室;15:离子导入部;16:离子导向器;17:离子阱;18:飞行管;19:检测器;2:数据处理部;21:数据保存部;22:成像图像制作部;23:最佳测定方法选定部;24:前体离子选择部;25:图像叠加处理部;3:分析控制部;4:主控制部;41:关注区域设定部;42:测定区域设定部;43:测定方法条件设定部;44:测定方法分配部;45:前体离子选择条件设定部;5:输入部;6:显示部;s:试样。
- 还没有人留言评论。精彩留言会获得点赞!