一种定量检测血清中神经胶质纤维酸性蛋白的方法与流程
本发明属纳米材料、荧光免疫技术和生物分析检测领域,具体涉及基于碳点为荧光标记物的双抗体夹心定量测定血清中神经胶质纤维酸性蛋白(gfap)的方法。
背景技术:
外伤性脑损伤(traumaticbraininjury,tbi)是导致青少年和儿童死亡的主要因素。外伤性脑损伤包括不同等级的初始伤害和随时间以初始损伤点为核心的细胞死亡向周围组织传递损伤的过程。因此,需要建立一个检测外伤性脑损伤的合适方法。目前,诊断外伤性脑损伤的主要方法如下:核磁共振成像(mrt)、计算机断层扫描(ct)、弥散张量成像(dti)和住院观察。然而现有的这些诊断手段都需要昂贵的仪器,在资源缺乏的地区难以实现,且在诊断过程中的辐射可能会损害病人的健康。研究表明外伤性脑损伤导致的脑细胞死亡会使各种脑内蛋白进入体液中,根据后创伤性脑损伤诱导释放各种生物标志物的模式和时间可以推测损伤的程度和结果。在各种创伤性脑损伤的生物标志物中,神经胶质原纤维酸性蛋白(gfap)仅在星形胶质细胞死亡后才释放,是脑组织中特殊的蛋白。papa等的研究结果证实,随着脑损伤的加重,病人血清中的gfap含量呈上升趋势。有研究表明,外伤性脑损伤患者血清中的gfap含量与脑损伤的程度和后果具有明显的相关关系,是一个可以有效显示各种类型脑损伤的蛋白标志物。因此,很有必要发展一个准确及时、操作简便的测定血清中gfap含量的方法用以诊断tbi。
血清gfap定量检测方法主要有液相色谱法、电化学检测和酶联免疫吸附(elisa)测定。elisa方法是将检测抗体与辣根过氧化物酶(hrp)连接,通过hrp与其显色底物和过氧化氢的反应来间接测定gfap的含量。随着研究进展,逐渐出现一些用荧光材料标记抗体替代hrp与底物反应的定量测定gfap的方法。
目前应用的荧光材料主要是有机荧光材料、半导体量子点和荧光蛋白等。有机荧光染料因其粒径小、量子产率高在商业中得到广泛应用,但它的荧光不稳定,半导体量子点的重金属毒性限制了其在生物领域的应用,而荧光蛋白耐光漂白性差。近期发展的碳点(carbondots,cds)则弥补了这一缺憾,碳点不仅具有优越的荧光性能,荧光发射光谱窄而对称,具有激发光可调的特性,且量子产率高,耐光漂白,其良好的水溶性和生物相容性显示了其在生物检测方面的潜力。
cds的合成路径主要分为两大类:自上而下和自下而上法。水热法是一种自下而上合成cds的方法,操作简便,产率较高。cds作为一个全新的荧光标记材料,已经成功应用在细胞内成像。在cds成功应用于检测体外各金属离子之后,其在免疫分析方面的应用研究也有了很大进展。wang等用适配体标记cds检测沙门氏菌,zhu等成功将igg与cds连接用于检测甲胎蛋白。
由于cds稳定的荧光性能,其在替代传统荧光材料作为生物检测标记物方面具有很大的潜力。目前研究主要集中在碳点与适配体结合用于检测体系,与抗体结合用于检测的工作尚处在起步阶段,还未见有应用cds结合抗体检测gfap的报道。
技术实现要素:
本发明的目的在于针对上面所述的问题,提供一种基于cds为荧光标记物的双抗体夹心定量测定血清中神经胶质纤维酸性蛋白(gfap)的方法,具有灵敏度高、检测简便的优点和免疫反应的高选择性、高亲和力的特点,可以直接应用于血清中gfap的测定。
为了实现上述发明目的,本发明采用的技术方案为:
一种定量检测血清中神经胶质纤维酸性蛋白的方法,步骤如下:
(1)、制备蛋白a/g琼脂糖纯化树脂连接抗体ab1的复合物pa/g-ab1;
(2)、制备碳点标记荧光探针cds-ab2:以柠檬酸为碳源,二乙烯三胺修饰合成碳点,将cds在edc、nhs的作用下,与多克隆抗体ab2通过酰胺键共价结合,形成cds-ab2;
(3)、将步骤(1)所得pa/g-ab1与血清内的gfap特异性反应,将其从复杂基质中分离富集,形成pa/g-ab1-gfap;
(4)、将pa/g-ab1-gfap与cds-ab2相结合形成夹心结构pa/g-ab1-gfap-ab2-cds,用pbs溶液清洗至上清液无荧光后测试荧光强度,根据标准曲线,得到血清中gfap的含量。
具体而言,各步骤具体如下:
(1)蛋白a/g琼脂糖纯化树脂连接抗体(pa/g-ab1)制备:
取蛋白a/g琼脂糖纯化树脂加入到离心管中,离心弃上清;加入0.5ml结合缓冲液重悬树脂,离心弃上清,重复两次;平衡过的pa/g内加入鼠抗人gfap单克隆igg(ab1),25℃震荡混匀1h;1%bsa反应1h,封闭抗体上非特异性位点;将反应所得产物pa/g-ab1用结合缓冲液清洗,去除未反应的ab1和杂质,产物4℃保存待用。
pa/g与ab1体积比为1:5,ab1所用浓度为20μg/ml。结合缓冲液配置为:0.15mnacl,20mmna2hpo4,ph为7.0。
(2)碳点标记荧光探针(cds-ab2)的制备:
取一水合柠檬酸、二乙烯三胺和超纯水于30ml高压反应釜内,充分超声溶解,200℃高温反应6h,将反应釜取出放置至室温,所得产物即为碳点(cds);为纯化cds,将ph调节至7左右,1000da透析袋透析过夜,去除未反应的杂质;将透析过后的cds减压悬蒸,浓缩后低温干燥待用;所得cds粒径在5nm左右。
将上述步骤所得cds溶解在10mmpbs内,加入edc、nhs,调节溶液ph至7.5,超声30min,加入兔抗人gfap多克隆igg(ab2),25℃震荡反应2.5h;反应体系用1%bsa封闭抗体非特异性位点,25℃反应1h;产物取出,4℃保存待用。
所制备cds时一水合柠檬酸与二乙烯三胺的摩尔比为1:2,超纯水补足使总体积为20ml;所用碳点、edc、nhs的质量浓度比为1:1000:1000;cds与ab2所用质量浓度比为15:1。
(3)血清内gfap的定量检测
取步骤(1)中制备的pa/g-ab1加入待测gfap血清内,25℃震荡混匀1h,反应后离心弃上清,得到pa/g-ab1-gfap,用pbs溶液复溶;取步骤(2)所制备的cds-ab2加入pa/g-ab1-gfap内,25℃震荡反应1h,形成夹心结构pa/g-ab1-gfap-ab2-cds;将所得夹心免疫复合物物用pbs溶液充分清洗,至上清液无荧光,充分分散在pbs内测试荧光强度,用以标识gfap的含量。
pa/g-ab1与血清体积比为1:10,清洗后复溶所用pbs体积为20μl;cds-ab2所用体积为100μl,测量荧光强度时体系终体积为200μl。
本发明所涉及的定量检测gfap的原理是:将gfap的单克隆抗体ab1与pa/g结合,形成pa/g-ab1复合物。柠檬酸为碳源,二乙烯三胺修饰合成碳点,将cds在edc、nhs的作用下,与多克隆抗体ab2通过酰胺键共价结合,形成cds-ab2复合物;pa/g-ab1与血清内的gfap特异性反应,将其从复杂基质中分离富集,形成pa/g-ab1-gfap复合物,再与cds-ab2相结合,测试荧光强度,以此测定血清中gfap的含量。
本发明与传统的酶联免疫检测方法不同,传统的酶联免疫方法测定以辣根过氧化物酶催化底物显色,是一个间接测定目标物的过程,测定结果受到酶催化反应的影响,在本实验中用碳点替代辣根过氧化物酶,是一个直接测定的过程,用碳点作为荧光标记物,用以检测gfap,通过荧光信号直接反应目标物含量,测定结果更加稳定可信。将被测物与固定在微珠上的捕捉抗体相结合,使其与复杂生物环境脱离,再与荧光标记的检测抗体相结合,多次洗脱未结合抗体,形成稳定的抗体-抗原-荧光抗体复合物,而结合荧光抗体的量与荧光强度呈线性相关,根据荧光强度的变化量可实现对分析对象的含量测定。由于双抗体夹心的试验设计,该方法具有良好的选择性,很强的抗干扰能力。
有益效果
本发明采用琼脂糖凝胶微珠与抗体相结合的方法,将目标物从复杂的生物环境中捕捉分离,可以大大降低干扰。同时采用荧光量子产率很高的cds作为荧光标记物,与抗体相结合形成荧光检测抗体,直接测定被捕捉的目标物,比传统的酶联免疫法测定更高效、稳定、快速。且cds固有的低毒,良好的水溶性和较高的单粒子亮度特性使整个检测过程环保、安全、方便。
附图说明
图1a是实施例2制备得到的cds的透射电子显微镜图;如图所示,cds粒径约在3~5nm,均匀分散,高倍透射电镜结果显示其晶格为0.29nm。
图1b是实施例2制备得到的cds的紫外吸收和荧光发射图;如图所示,其在360nm处有特征紫外吸收峰,以此波长的激发光激发后,发射波长在445nm左右。
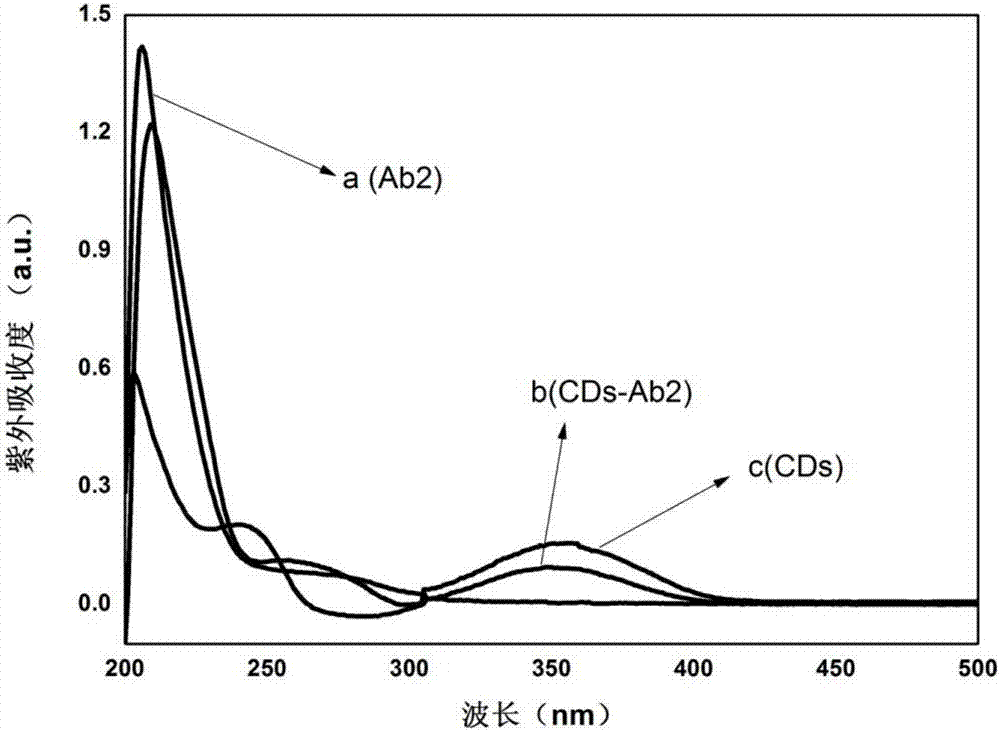
图2是实施例3制备得到的cds-ab2的紫外吸收图;抗体ab2(曲线a)在260~280nm之间有一个紫外吸收峰;cds-ab2(曲线b)在260~280nm之间也有同样的吸收峰,除此之外,在360nm处也有一个吸收峰,对应cds在此的特征吸收峰(曲线c),证实了cds和ab2的成功连接。
图3a是实施例4制备得到的pa/g-ab1-gfap-ab2-cds的荧光图;由图3a可以看出gfap的浓度与荧光强度呈正相关,荧光发射位置(470nm)与cds(447nm)相比有一个20nm的红移。
图3b是实施例3制备得到的gfap浓度与荧光强度的线性相关图;由图可知,在一定范围内gfap的浓度与荧光强度呈线性,线性回归方程为y=511.4x+69.55,相关系数r=0.9969。由此可以说明,该方法可以很好的检测gfap的含量。
具体实施方式
神经胶质酸性纤维蛋白gfap(95%)、鼠抗人gfap单克隆抗体、兔抗人gfap多克隆抗体(博士德生物有限公司);蛋白a/g琼脂糖纯化树脂(上海圣诩生物有限公司);一水合柠檬酸、二乙烯三胺、edta、nhs(国药集团化学试剂有限公司);本文中所用碳点采用水热法制备。
实施例1蛋白a/g琼脂糖纯化树脂连接抗体(pa/g-ab1)制备,步骤如下:
取蛋白a/g琼脂糖纯化树脂10μl加入到离心管中,加入0.5ml结合缓冲液重悬树脂,3000rpm离心3min弃上清,重复两次;在平衡过的pa/g内加入鼠抗人gfap单克隆igg45μl(20μg/ml),100rpm,25℃震荡混匀1h;反应结束后,加入1%bsa反应1h,封闭抗体上非特异性位点;将反应所得产物pa/g-ab1用结合缓冲液清洗,3000rpm离心3min弃上清,重复两次,去除未反应的ab1和杂质,产物4℃保存待用。
实施例2.碳点(cds)的制备,步骤如下:
取一水合柠檬酸1.2g、二乙烯三胺1.2ml和超纯水20ml于30ml高压反应釜内,充分超声15min溶解,200℃高温反应6h;将反应釜取出放置至室温,得到棕褐色溶液,即为cds溶液;为纯化cds,加磷酸将ph调节至7左右,1000da透析袋透析过夜,去除未反应的杂质;将透析过后的cds溶液收集,减压悬蒸,浓缩后低温干燥;所得到的cds为浅黄色粉末。其透射电镜图(图1a)紫外吸收和荧光发射图(图1b)。
实施例3荧光标记检测抗体(cds-ab2)的制备,步骤如下:
将cds溶解在10mmpbs内,配置成200μg/ml的溶液;将edc、nhs(200mg/ml)各30μl加入150μlcds,加入naoh调节溶液ph至7.5左右,超声反应30min;加入兔抗人gfap多克隆igg,200rpm,25℃震荡反应2.5h;反应体系用1%bsa封闭抗体非特异性位点,25℃反应1h;所得产物用0.5ml10kda超滤管滤过,多次清洗至下清液无荧光;将所得产物cds-ab2(b)与ab2(a)、cds(c)分别测定紫外,其结果如图2所示。
实施例4定量检测
取空白血清加入gfap配置不同浓度溶液,gfap浓度分别为0、0.1、0.2、0.5、1.0、2.0、4.0、8.0ng/ml;取20μl实施例1制备的pa/g-ab1加入待测200μlgfap血清内,200rpm,25℃震荡混匀1h,反应后3000rpm离心5min弃上清,重复两次,得到pa/g-ab1-gfap用20μlpbs溶液复溶。
取实施例3所制备的cds-ab2100μl加入pa/g-ab1-gfap内,200rpm,25℃反应1h,形成夹心结构pa/g-ab1-gfap-ab2-cds;将所得最终产物用pbs溶液充分清洗,至上清液无荧光,用200μlpbs复溶,使产物充分分散测试荧光强度,用以标识gfap的含量。所得荧光图如图3a所示,与浓度计算相关性,结果如图3b所示。
- 还没有人留言评论。精彩留言会获得点赞!