加马光子侦测成像装置与方法与流程
本发明为一种加马光子侦测装置与方法,特别是指一种侦测瞬发加马光子(promptgammaray)以及正子互毁加马(positronannihilationgammaray)的加马光子侦测成像装置与方法。
背景技术:
如图1所示,放射治疗(radiotherapy,rt)就是用高能量的光子(如x光射线)或带电粒子来照射病灶处,以达到“杀死恶性肿瘤”或“抑制恶性肿瘤增生”为目的的一种治疗方式。其中,曲线90代表x光剂量和组织深度关系,由于x光射线与物质作用的物理特性,随射线进入组织深度的增加,相对剂量也随深度逐渐衰减,因此单一x光射束进入体内的路径上有较多的剂量释放在肿瘤前后的正常组织,致使x光射线尚未破坏肿瘤癌细胞前就已经影响正常组织,甚至让肿瘤后的正常组织区域也有剂量沉积。相对于x光治疗的方式,曲线91则为带电粒子,例如,质子或重离子,剂量和深度关系,由于物质作用因质子速度越快行进单位距离损失的能量越少,所以进入病患体表最初释放的动能相当低,直到一定的射程深度,质子或重离子动能大幅下降后产生最大剂量沉积,此称为布拉格峰910(braggpeak),在布拉格峰之后几乎完全没有剂量。
由于质子或重离子治疗具有剂量集中在布拉格峰的特性,因此质子或重离子射程的不确定性影响远较x光更为敏感。若质子或重离子射程预测具有不确定性,其剂量高度集中的布拉格峰所在深度与预期有差异,将造成高剂量区未涵盖到整个肿瘤或高剂量区涵盖到肿瘤周围的重要器官等风险。因此质子或重离子治疗在临床应用上必须要能精准确认质子或重离子射程范围,将其布拉格峰限制在肿瘤区域才能达到最佳的治疗效果。
然质子或重离子治疗过程仍有一些因素影响其不准确性,说明如下:
(1)治疗计划所造成的不确定性:这是由于目前治疗计划主要来自x光ct影像的hounsfieldunit(hu)为组织与电子密度的对应关系,然质子或重离子与生物组织作用主要考虑是组织的原子核及其阻挡本领(stoppingpower),因此将ct影像的hu信息转换为生物组织的阻挡本领,将有其不确定性。除此之外,ct影像假影、x光射束硬化(beamhardening)现象等等也是现行评估质子或重离子射程的不确定来源;
(2)实际治疗位置与治疗计划有差异:主要来自病患摆位误差、呼吸或心跳等造成的治疗标的移动等;
(3)治疗过程的肿瘤尺寸改变、病患体型改变等;以及
(4)来自于产生质子或重离子射束的设施所造成的误差,例如降能器(energydegrader)、射束形成(beamdelivery)相关装置等误差。
由于上述射程不准确性,临床治疗时通常在欲治疗的临床靶体积(clinicaltargetvolume,ctv)外加大治疗安全范围(safetymargin)。因射程不确定性而增加的治疗范围,随肿瘤深度y增加(30cm深度肿瘤可增加约14mm治疗安全范围)。在ctv外增加1cm安全范围则有~80cm3的正常健康组织接受与肿瘤相同的辐射剂量,因而增加附近正常组织受损伤及致癌的风险。若ctv附近有辐射耐受度较低的重要器官,也将影响治疗剂量的给予及恶性肿瘤的控制率。为了降低治疗过程的不准确性,提升质子或重离子治疗可信赖度,如果可以在治疗过程中对患者的质子或重离子照射区进行监测,确认质子束在病患体内的路径是否需要修正,这将可缩小治疗安全范围的扩增,提高剂量给予,进而提升肿瘤控制率与治疗效果。因此如何确认与监控质子或重离子束在病患体内的路径是非常重要的研究议题。
现有技术中,有数种发展中的验证质子射程技术,符合实时及非侵入性的技术有质子穿透(protontransmission)造影、瞬发加马光子造影及pet(positronemissiontomography)造影。质子穿透造影需占用额外质子设备时间且会产生额外辐射剂量,也有多库伦散射(multiplecoulombscattering)效应等问题待克服,短期实际应用于临床的机会不高。瞬发加马光子(pg)造影及pet造影是利用质子与病患组织作用产生的二次粒子—正子发射核及瞬发加马光子做侦测造影。正子互毁加马光子及瞬发加马光子都可穿透病患身体被侦测,可做活体(invivo)的非侵入性质子射程的量测成像。
质子和重离子与生物组织作用机制雷同,下文以质子治疗论述为代表,不再区分质子和重离子。质子照射时,质子与组织原子核的非弹性碰撞产生加马光子,这些加马光子依诱发产生机制可分成两类。一是当质子与人体组织原子核发生非弹性碰撞,靶核被激发至激态,在纳秒(ns)时间内产生瞬发加马光子(promptgamma)。另一是靶核被质子撞击碎片化(nuclearfragmentation)而产生正子发射核(positron-emittingnuclei),如o-15(半衰期:2.037min)、c-11(半衰期:20.385min)、n-13(半衰期:9.965min)等(newhauserandzhang,2015)。正子发射核衰变产生的正子(positron)与组织中的电子互毁生成511kev能量的正子互毁加马(positronannihilationgammas)光子对。瞬发加马光子和正子互毁加马光子,它们的能量都可穿透病患身体而被侦测与成像,分析活度分布影像,可获得质子在人体内的路径,故可应用于质子或重离子治疗的射程验证。
正子互毁加马光子对一般利用pet造影来侦测,是目前较成熟且已应用于临床的活体质子射程验证技术。不过正子发射核在病患体内的生物代谢(biologicalwashout)效应、正子发射核产量有限、半衰期短以及治疗系统与pet影像的空间对位(co-registration)误差(病患在治疗室与pet造影仪间的移动所造成)等,这些限制了pet对质子射程评估精准度。
至于瞬发加马光子,因生成瞬发加马光子所需质子动能较产生正子发射核所需动能低,所以瞬发加马光子分布的位置和质子沉积最大剂量的位置较为一致,因此利用瞬发加马成像活度评估布拉格峰的准确度较利用pet方法来得高。另外,瞬发加马光子产量较正子互毁加马光子多60~80倍,这表示理论上在相同侦检几何状况,瞬发加马光子造影可以有较强信号,统计误差较pet来得小。现有技术中有利用核子医学领域常见的准直器式加马相机(collimator-basedgammacamera)技术,通过针孔改良版的slit准直器或edge-knife准直器结合加马侦检器做瞬发加马射线侦测造影。不过这种技术侦检效率差,因准直器阻挡大部分光子及探头对高能量瞬发加马光子的侦测能力有限。更重要的是因准直器的存在而产生大量的中子(质子诱发的二次辐射粒子之一),这些中子将干扰侦测探头的信号侦测,造成信杂比(signal-to-noiseratio,s/n)降低,致影响活度影像清晰度及应用其判断质子射程布拉格峰的准确度。此外,因放射治疗诱发的瞬发加马光子能量高,所以准直器设计相当厚重(尺寸达80cm半人高),占用治疗室有限空间。上述因素导致准直器式加马相机应用在质子临床治疗的实用性受限。
此时另一种于医学影像领域较为少见的康普吞散射成像技术因适用于高能量光子侦测成像,从而成为研究质子或重离子治疗用瞬发加马光子造影的新选择。康普吞散射成像技术主要是应用于天文宇宙射线、核能电厂、国土安全的敏感核种加马光子侦测等。目前国际上有些质子或重离子治疗团队直接采用之前的侦检设计进行康普吞散射成像,例如美国肿瘤治疗中心(peggyandcharlesstephensoncancercenter)利用双边硅带型探头(double-sidedsiliconstripdetector,dssd)侦检器技术、韩国汉阳大学团队利用加马电子锥顶造影(gammaelectronverteximaging,gevi)侦检技术、日本京都大学团队利用电子追迹康普吞造影(electrontrackingcomptoncamera,etcc)侦检技术及美国马里兰大学团队的碲锌镉(cdznte,czt)侦检康普吞相机技术。这些团队的侦测探头或是采用游离腔(ionizationchamber)技术或是采用半导体侦检器技术。尤其是半导体侦检器其能量分辨率相当高(<1%),适合应用于康普吞散射成像。但对高能量加马光子而言,其侦检效率差且侦检器信号响应时间长(μs等级)。信号响应时间长也拉长侦测探头的死寂时间(deadtime),使得侦测探头的单位时间侦检计数效率不彰。这类侦检器可使用于非医学应用,因为非医用造影可容忍数小时甚至数天的长时间数据撷取,以取得足够的侦检计数,但若实施于医用病患身上,长时间造影是不可行的。于是为取得足够的侦检计数,要用相当高的质子剂量照射,瞬发加马成像的计数统计误差才达可被接受程度。
根据美国马里兰大学dr.j.c.polf实务经验,即使利用上述最高侦检效率的cdznte侦测探头进行质子治疗瞬发加马造影,其所需剂量仍较临床高100倍以上。为弥补侦检器效率不足,也有用上数十层侦检器的设计,然侦检器加上电子系统整体尺寸相当可观,这种设计较不利于空间有限的质子治疗室应用。另外,因为侦检器信号响应时间长达微秒(μs),所以散射侦检器及吸收侦检器的时间分辨率也在微秒等级。微秒级的时间分辨率的造影仪器应用在质子治疗瞬发加马光子监测上,可能导致80%以上侦测计数为相互无关联的非真时讯符合事件(non-truecoincidentevents),这将会导致瞬发加马光子射源位置误判。由于过去康普吞散射成像探头应用于天文、机场海关的违禁辐射源侦测,因为宇宙射线到达地球的通量有限及违禁辐射源有屏蔽防护,不会有高强度背景干扰,所以微秒级时间分辨率已足以应付非医用的需求。总之,直接应用现有为天文、国土及核能安全需求所设计的dssd型、czt型探头对质子治疗的瞬发加马光子造影应用有侦检效率低、时间解析差和非真时讯符合事件比率过高等缺点,这将影响系统信杂比、影像清晰度与质子射程布拉格峰估算准确度,所以为质子治疗需求量身射计康普吞散射成像侦测探头有其必要性。
此外,现有技术例如美国公告专利us6,484,051号,该技术公开了一种可以同时侦测同位素所产生的正子互毁加马光子以及瞬发加马光子的装置,由于需要同时量测,因此同时至少需要三个侦检器要工作。另外,瞬发加马光子的信号为正子互毁加马光子的数十倍,同时量测的话,侦测计数率(countingrate)将被低产生率(yieldrate)的正子互毁加马光子数量主导,进而影响到侦测信号的信杂比,从而降低影像重建的质量。此外美国公告专利us9,069,089则公开了一种可以同时侦测正子互毁以及瞬发加马光子的技术,在此技术中,在正子互毁加马光子传感器的外围设置感测瞬发加马光子的传感器,通过两种不同的传感器来感测加马光子。
技术实现要素:
本发明提供一种加马光子侦测装置与方法,其利用快速闪烁侦检器(例如以lso、lyso、labr3等闪烁晶体为材料者),结合pet及康普吞散射侦检技术,制造具有量测正子互毁光子对和瞬发加马光子的二合一(2-in-1)侦检系统,再利用时序式数据撷取进行造影及pet嵌入式康普吞成像演算方法进行影像重建和影像融合。二合一侦检系统具有量测正子互毁光子对和瞬发加马光子的造影功能,一机双用途,便利性高,pet/pg双功能成像融合造影所得的信息更可提高影像质量与质子/重离子射程验证精准度。
本发明提供的加马光子侦测装置与方法采取共享探头以及时序式数据撷取,其优点除了节省成本之外,更可以提升影像信杂比,其原因在于瞬发加马光子的信号为正子互毁光子对的数十倍,本发明通过单独量测瞬发加马光子信号以及正子互毁加马光子对,可以让这两种光子不相互影响,因此可以兼顾正子互毁加马光子以及瞬发加马光子对于重建活度分布影像的优点。
本发明提供的加马光子侦测装置与方法,可于质子/重离子放射治疗时或核子医学的双同位素(混合正子同位素与加马光子同位素)或特殊同位素(可发射正子与加马光子的同位素(isotope),如124i,86y,89zr等)衰变时,侦测瞬发加马光子以及正子互毁加马光子对。因为上述辐射源其正子发射核与瞬发加马光子分布有相关性。故以pet活度分布为基础经剂量关联处理后可做为康普吞影像重建的先前信息(priorinformation)。影像重建过程中,利用正子发射核和瞬发加马光子空间分布相关性,以pet嵌入式康普吞成像演算方法进行影像重建,可使得瞬发加马射源所在可能位置分布范围由原本的康普吞角锥面缩小至最大可能机率分布区域,此方法可提高pg影像信杂比并加快康普吞影像重建速度。pet/pg双功能成像可兼顾pet及瞬发加马光子成像优点,可更为提高质子或重离子射程验证及剂量施予的精准度或核医双同位素或特殊同位素造影的质量。
本发明提供一种加马光子侦测装置,其是使用由闪烁晶体所构成的探头。通过闪烁侦检器具有快速时间响应(timeresponse)特性,选用响应快的闪烁晶体(如lso、lyso、labr3等)搭配快速光电传感器与前置放大电路,系统的侦检信号响应时间及时间分辨率可达纳秒等级。本发明通过相同探头达到侦测正子互毁所产生的加马光子对以及因为质子与组织原子核的非弹性碰撞,激发原子核至激态,在纳秒时间产生高能量的瞬发加马光子。本发明的侦测探头相较半导体侦测探头如双边硅带型探头(dssd)、镉锌碲型侦测探头(cdznte,czt)的微秒响应,纳秒级闪烁侦检系统的信号响应时间快、同符时间窗口可缩短数百倍,可提升侦检计数率并大幅度减少非真符合侦测计数的影响,进而提升质子射程影像清晰度与布拉格峰(braggpeak)估算准确度。
本发明提供一种加马光子侦测方法,利用具有一机双功能设计的加马光子侦测装置,以相同探头达到正子发射核分布和瞬发加马光子的双造影功能。本案采用快速闪烁侦检器为基底组制成像探头,两时段的瞬发加马光子造影(promptgammaimaging,pgi)模式与正子互毁造影(positronannihilationimaging,pai)模式数据撷取,使得二合一侦检系统具有侦测正子互毁光子对和瞬发加马光子的功能。利用此系统,质子/重离子治疗用in-roompet也可以具有瞬发加马光子侦测成像用途。在质子/重离子射束治疗时段(t0~t1)该侦测探头以瞬发加马成像pgi模式进行数据撷取,射束停止后t1~t2时段,探头采正子互毁成像pai模式进行数据撷取。所获得的原始数据经pet影像重建及pet嵌入式影像重建分别获得pet影像及pg影像。相较先前技术单机单功能及双机双功能,本发明的一机双用途设计,可兼具in-roompet及瞬发加马光子分布成像的功能,不仅经济便利,也因充分利用瞬发加马光子以及正子互毁加马光子空间分布关联性,以pet嵌入式康普吞影像重建融合pet/pg双影像,更提高射程评估精准度。
在一实施例中,本发明提供一种加马光子侦检装置,包括有多个侦测探头以及一信号处理电路。该多个侦测探头,每一个侦测探头具有多层闪烁晶体侦检器,沿着对应的侦测探头的轴向排列,相邻闪烁晶体侦检器具有一距离,每一个侦测探头用以撷取加马光子以产生相应的电信号。该信号处理电路与该多个侦测探头电性连接,用以取得关于一第一时间段中每一个侦测探头所产生的电信号,并对每一个侦测探头所具有的多个闪烁晶体侦检器所产生的电信号进行第一时讯符合演算,以得到对应多个侦测探头的多个第一时讯相关数据,以及取得关于一第二时间段中该每一个侦测探头的第一层闪烁晶体侦检器所产生的电信号,并对进行一第二时讯符合演算,以得到多对第二时讯相关数据。
在另一实施例中,本发明提供一种加马光子侦测方法,其包括有下列步骤,首先提供一加马光子侦检装置,其具有多个侦测探头以及与该多个侦测探头电性连接的一信号处理电路,每一个侦测探头具有多层闪烁晶体侦检器,多层闪烁晶体侦检器沿着对应的侦测探头的轴向排列,相邻闪烁晶体侦检器具有一距离。接着,使该多个侦测探头侦测一目标物所产生的加马光子。接着在一第一时间段中独立的撷取每一个侦测探头所产生的电信号形成多个第一电信号组。然后,以该信号处理电路取得关于至少一第一时间段中每一个侦测探头所产生的电信号,并对每一个侦测探头所具有的多个闪烁晶体侦检器所产生的电信号进行第一时讯符合演算,以得到对应多个侦测探头的多个第一时讯符合相关数据,并进行储存;以及在一第二时间段中撷取每一个侦测探头的第一层闪烁晶体侦检器所产生的电信号,形成多个第二电信号组并进行储存。然后,再以该信号处理电路以及取得关于至少一第二时间段中该每一个侦测探头的第一层闪烁晶体侦检器所产生的电信号,并对进行一第二时讯符合演算,以得到多对第二时讯符合相关数据。
附图说明
图1为带电粒子与传统光子的剂量强度与深度关系曲线图;
图2a为本发明提供的加马光子侦测装置的实施例架构示意图;
图2b至2d为本发明的侦测探头不同实施例示意图;
图2e至图2h为本发明的侦测探头与弧形轨道组合的不同实施状态示意图;
图2i至2k为本发明的侦测探头不同实施例示意图;
图3a为本发明的加马光子侦测方法流程示意图;
图3b为本发明撷取侦测探头电信号与时讯符合演算流程示意图;
图3c为本发明的活度分布重建实施例流程示意图;
图4a至4c为利用图2a的加马光子侦测装置侦测瞬发加马光子以及正子互毁加马光子实施例示意图;
图5为本发明在不同时间段撷取康普吞散射信号以及pet加马光子信号示意图;
图6与图7分别为时讯符合演算不同实施例示意图;
图8a为康普吞圆锥示意图;
图8b则为利用pet影像为基础的剂量分布做为康普吞影像重建先前信息的示意图;
图9为多个探头之间的康普吞圆锥和pet影像为基础的剂量分布交集关联示意图。
附图标记说明:2-加马光子侦测装置;20a,20b,20c,20d,20e-侦测探头;200a,200b,200c,200d,200e,200f,200g,200h-闪烁晶体侦检器;201-闪烁晶体阵列;202-光电传感器;203-读出电路;204-模拟与数字转换电路;205-光纤;21-信号处理电路;22-重建单元;220-pet重建模块;221-康普吞重建模块;222-第一活度分布信息;223-剂量分布信息;224-第二活度分布信息;23-验证单元;24-带电粒子产生装置;25-承载台;26-弧形轨道;3-加马光子侦测方法;30~35-步骤;340~343-步骤;350~352-步骤;8-带电粒子束;80、80’-康普吞圆锥;81-活度分布;82a、82b-区域;9-目标物;90、91-曲线;910布拉格峰;92-反应位置。
具体实施方式
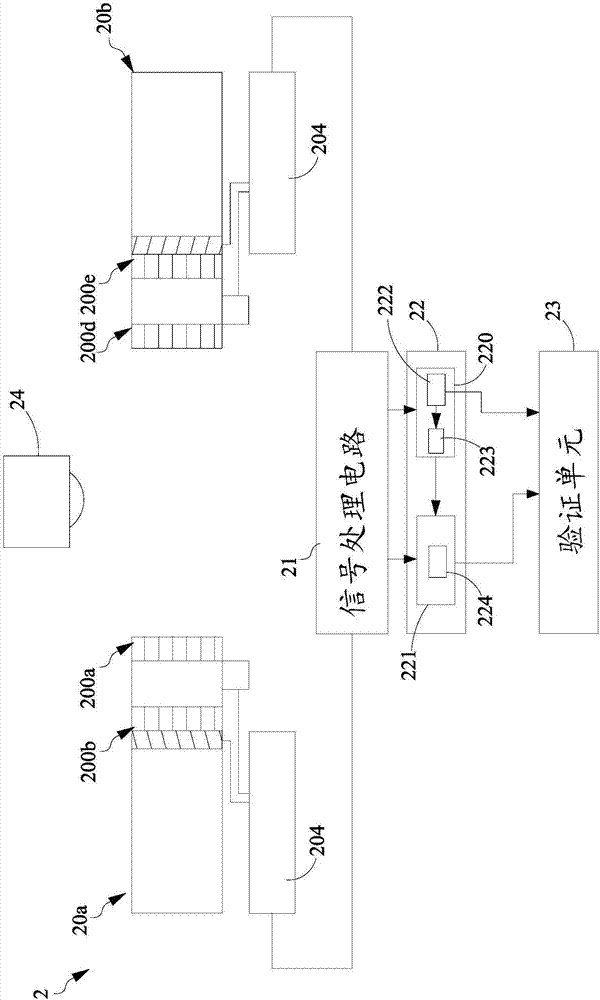
请参阅图2a所示,该图为本发明提供的加马光子侦测装置的实施例架构示意图。在本实施例中,该加马光子侦测装置2包括有多个侦测探头20a与20b、一信号处理电路21、一重建单元22以及一验证单元23。每一个侦测探头20a与20b为具有纳秒反应等级的探头,其侦测面相互对应,且相互平行。每一个侦测探头20a与20b具有多层闪烁晶体侦检器200a~200b与200d~200e,沿着对应的侦测探头的轴向排列,相邻闪烁晶体侦检器200a~200b与200d~200e具有一距离。在一实施例中,每一个侦测探头20a与20b用以撷取沿一行进方向的一带电粒子束所产生的加马光子以产生相应的电信号。每一层闪烁晶体侦检器200a~200b的材料为硅酸镥(lso)或硅酸钇镥(lyso)或溴化镧(labr3)等快速闪烁晶体,但不以此为限制。该带电粒子束为质子束或者是重离子束,其产生的方式为利用回旋加速器(cyclotron)或同步加速器(synchrotron)产生连续式或脉冲式的带电粒子束,用以照射恶性肿瘤,通过其布拉格峰最大的剂量来消灭肿瘤。此外,在另一实施例中,该侦测探头20a与20b也可以用在特殊同位素(可发射正子与加马光子的同位素,如124i,86y,89zr等)衰变时,侦测其所产生的正子互毁加马光子对及加马光子。在一实施例中,该侦测探头20a与20b,为康普吞探头的架构。
在一实施例中,如图2b所示,每一层闪烁晶体侦检器200a~200b分别具有一闪烁晶体阵列201连接至一光电传感器202与具有前置放大电路的读出电路203,使得系统的侦检信号响应时间及时间分辨率可达纳秒等级。在一实施例中,闪烁晶体阵列201由多个闪烁晶体201a所构成,该光电传感器202为多阳级的位敏式光电倍增管(position-sensitivephotomultipliertube,pspmt)设计,用以将闪烁晶体阵列201所接收的光信号转换成模拟电信号。此外,光电传感器202也可以为光电倍增管(photomultipliertube,pmt)或者是硅光电倍增元件(siliconphotomultiplier,si-pm)阵列。该读出电路203用以将光电传感器202所输出的电流信号分流、放大并转换为模拟电压信号。
此外,如图2c所示,其为闪烁晶体侦检器另一实施例示意图。闪烁晶体阵列201和光电传感器202之间是通过光纤205传导,闪烁晶体阵列201和光电传感器202之间会有夹角存在。如图2d所示,其为三层侦检器示意图,通过光纤传导可减少以下原因造成的假信号—光电倍增管产生的额外康普吞散射光子、闪烁晶体产生的散射光子在到达下一层侦检器前与光电倍增管发生作用。另外,也可以尽可能地减少侦检层与侦检层之间的距离,提升几何效率。再回到图2a所示,各个侦测探头20a与20b所输出的模拟电信号再经过一积分和模拟转数字电路204,用以将输出的模拟电信号转换成数字电信号。该信号处理电路21,其与该积分和模拟转数字电路204电性连接,用以接收该数字电信号。在一实施例中,该信号处理电路21内有一fpga(fieldprogrammablegatearray)可程序化电路,其可以通过程序对所接收到的电信号进行演算,例如:时讯符合演算,之后将电路21输出数据传输储存于计算机硬盘或内存,以作为后续重建单元22运用。本实施例中,信号处理电路21取得关于一第一时间段中每一个侦测探头所产生的电信号,并对每一个侦测探头所具有的多层闪烁晶体侦检器所产生的电信号进行第一时讯符合演算,以得到对应多个侦测探头的多个第一时讯相关数据,以及取得关于一第二时间段中该每一个侦测探头的第一层闪烁晶体侦检器所产生的电信号,并对进行一第二时讯符合演算,以得到多对第二时讯相关数据。其中,所谓第一时讯符合演算,是指对每一层闪烁晶体侦检器所得到信号做时讯符合演算,用以判断每一个侦测探头的各层闪烁晶体侦检器所侦测到的电信号是否来自于同一加马光子,亦即瞬发加马光子。本实施例中,以侦测探头20a为例,某一个加马光子先与第一层闪烁晶体侦检器200a作用后,产生的散射光子再与第二层闪烁晶体侦检器200b作用,两者有稍许的时间先后差异,因此,第一时讯符合演算,就是指对每一层闪烁晶体侦检器200a,200b或200d,200e所得到信号做时讯符合演算,进而判对通过每一层闪烁晶体侦检器200a,200b的电信号是否是属于同一加马光子的事件,以及每一层闪烁晶体侦检器200d,200e是否属于同一加马光子的事件。而第二时讯符合演算,则是指对正子与电子互毁产生的成对加马光子分别与相对侦检探头的第一层侦检器作用所产生的电信号进行演算,以判断每一个侦测探头的第一层闪烁晶体侦检器所侦测到的电信号是否来自于同一对的加马光子,亦即成对的正子与电子互毁产生的加马光子。例如,本实施例中,成对的加马光子分别与成对的侦测探头20a与20b的第一层闪烁晶体侦检器200a,200d作用所产生的电信号,再经过第二时讯符合运算之后,可以判别200a,200d是否为同一组正子与电子互毁产生的一对加马光子作用所产生的电信号。
前述的侦测探头都是属于顶面照射式(top-on)的侦检器的组合,在另一实施例中,该侦测探头也可以为侧面照射式(sideon)与顶面照射式的组合。例如,图2i所示,侦测探头20c具有两个闪烁晶体侦检器200a与200f,其中闪烁晶体侦检器200a为顶面照射式(top-on)的侦检器,而闪烁晶体侦检器200f为侧面照射式的侦检器。此外,如图2j所示,侦测探头20d具有两个闪烁晶体侦检器200f与200g,都是属于侧面照射式的侦检器。另外,要说明的是,侧面照射式的侦检器两端的光电传感器202可以设置在闪烁晶体的两端,如图2i所示,或者是单一端,如图2k所示,其可以根据使用者的需求而定。
重建单元22,在一实施例中,设置在一计算机或具有运算处理能力的系统内,其包括有pet重建模块220和康普吞重建模块221,用以从储存于计算机硬盘的储存装置或内存取出第一与第二时讯相关数据。其中,该康普吞重建模块221处理来自pgi模式下,侦测探头20a与20b在质子/重粒子射束治疗时段(t0~t1)感测瞬发加马光子而产生的数据。至于pet重建220模块则处理来自pai模式下,侦测探头20a与20b在治疗射束停止后t1~t2时段所撷取的成对511kev能量的加马光子产生的数据。pet重建220模块重建所得的第一活度分布信息222进一步进行一反折积(deconvolution)处理,从而得到一剂量分布信息223后,再传给康普吞重建模块221,使得康普吞重建模块221可以将第一剂量分布作为先前信息,而重建获得关于瞬发加马光子的第二活度分布信息224,进而评估出带电粒子在生物体内的实际射程。pet/pg双功能成像可兼顾pet及瞬发加马光子成像优点,可更为提高质子或重粒子射程验证及剂量施予的精准度。在一放射治疗应用实施例中,该重建单元22可与一验证单元23连接,该验证单元23接收重建单元22所输出的活度分布之后,该验证单元23通过pet和pg的活度分布,建立并显示带电粒子在生物体内的实际剂量射程分布,以提供医疗从业人员进行实际射程结果与治疗计划预测射程的比较与确认,进而将该差异作为下一次带电粒子照射参数修正的依据。此外,在一实施例中,该加马光子侦测成像装置2更具有一带电粒子产生装置24,以形成可以治疗以及同步进行活体治疗监测用的加马光子侦测装置,该带电粒子产生装置24用以产生治疗所需的带电粒子。
如图2e所示,在一实施例中,该多个侦测探头20a与20b设置在一弧形的轨道26上,可以在该弧形轨道26上进行位移运动,使得侦测探头20a或20b可以一中心进行转动,以调整其侦测的位置,本实施例以弧形轨道26的中心为转轴来转动。要说明的是,由于本发明具有pet和pg侦测成像的功能,因此在pet造影模式下,各个侦测探头20a与20b必须是相对180度配置,而在pg造影模式下,侦测探头20a或20b方可为任意夹角。在另一实施例中,如图2f所示,当该带电粒子产生装置24产生带电粒子8时,侦测探头20a与20b间具有一夹角,其大于0度,本实施例为90度左右,以增加瞬发加马光子影像三向分辨率的均匀性。此外要说明的是,虽然图2a、2e与2f中的侦测探头为一对,但不以此为限制,其可以根据使用的需求,例如:分辨率、成本等考虑,设置所需要的数量,例如:在图2g中,具有两组侦测模块,每一个侦测模块具有多个侦测探头20a,20c,20e以及20b,20d,20f。此外,如图2h所示,每一个侦测探头20a与20b也可以自身为轴进行转动及朝向或远离圆心的平移移动。
请参阅图3a所示,该图为本发明的加马光子侦测方法流程示意图。在本实施例中,该方法3包括有下列步骤:首先进行步骤30,根据一光子检测决定一目标物内所具有的一反应位置。在本步骤中,该光子检测的一实施例为了进行治疗计划所实施的计算机断层扫描(computedtomography,ct),其主要通过x光对生物体,例如:人体,进行扫描,该人体即为该目标物,该反应位置,在一实施例为肿瘤。通过计算机断层决定出肿瘤的位置。找到了反应位置之后,进行步骤31,根据生物体的状况,例如:周围的软组织分布,以及该反应位置信息,转换成带电粒子束的一照射参数,其包括有照射的能量、剂量以及行进方向与深度。因为反应位置在目标物内是属于三维度的空间分布,因此随着带电粒子束投射至目标物的行进深度不同,其所需的能量也会有所差异。要说明的是,带电粒子束的行进方向与深度,并不以单一个为限制,可以根据治疗的需求而有多个行进方向与深度,亦即,从多的方向与多个射程深度照射至该反应位置上。
本实施例中的带电粒子为质子,由于质子进入病患体表最初释放的剂量相当低,直到一定的射程深度,质子动能大幅下降后产生最大剂量沉积,而这个射程深度所对应的释放剂量称为布拉格峰,在布拉格峰之后几乎完全没有剂量(如图1所示)。而步骤31所根据反应位置决定的能量或剂量,即是利用此特性,通过质子能量与质子射程的调控将剂量最高的布拉格峰落在目标位置区,使反应位置后方的正常组织则可避开辐射照射风险。
步骤31之后,接着进行步骤32,在本步骤中,提供如图4所示的加马光子侦测装置2。为了确保步骤31所决定的剂量或能量可以集中在布拉格峰所对应的位置,因此在治疗的过程中,可以通过本发明提供的加马光子侦测装置2来进行实时性的同步活体监控,以确保治疗的效率以及降低误差,进而可以保护正常组织免于辐射的伤害。如图4a所示,目标物9为一生物体,平躺在承载台25上,目标物9内具有反应位置92,本实施例为肿瘤。多个侦测探头20则环设在目标物9的外围,本实施例虽有两个侦测探头20a与20b,但其数量可以根据需求而定。之后再进行步骤33,使该带电粒子产生装置24产生一带电粒子束8。当治疗过程中,根据步骤31所产生的照射信息,投射带电粒子束8朝向目标物9投射之后,进入到目标物内,质子与组织原子核的非弹性碰撞后,主要会产生两种加马光子,一种是质子与病患组织作用产生的二次粒子—正子发射核衰变产生的正子与组织中的电子互毁生成一对511kev能量的加马光子。另一种是当质子与人体组织原子核发生非弹性碰撞,靶核被激发至激态,在纳秒时间内产生瞬发加马光子。
为了侦测这两种加马光子,通过步骤34在一期间以第一时间段与第二时间段来侦测撷取电信号。以产生带电粒子的本实施而言,该第一时间段代表带电粒子启动的时间段,该第二时间段则代表该带电粒子关闭的时间段。如图4a所示,在带电粒子束8启动的第一时间段里,每一个侦测探头20a与20b的各层闪烁晶体侦检器200a与200b以及200d与200e,会侦测到瞬发加马光子入射的信号,以侦测探头20a为例,亦即某一个加马光子先与第一层烁晶体侦检器200a作用后,产生的散射光子再与第二层烁晶体侦检器200b作用,两者有稍许的时间先后差异,同理,侦测探头20b也是如此。反之,如图4b所示,在带电粒子束8关闭的第二时间段里,每一个侦测探头20a与20b的第一层闪烁晶体侦检器200a与200d,会侦测到因为正子互毁所产生的成对加马光子入射的信号,亦即,正子与电子互毁所产生的成对加马光子会分别与相对侦检探头20a与20b的第一层闪烁晶体侦检器200a与200d作用。要分段侦测的主因是因为瞬发加马光子只会在带电粒子启动的时期产生,而且存在时间相当短暂,反之正子互毁加马光子则反应时间长,因此两种加马光子的特性不同。另外,量测正子互毁加马光子对以pet活度影像估算带电粒子射程已具临床应用成熟度,分开量测瞬发加马光子信号以及正子互毁加马光子对,可以通过较为成熟的pet技术提升瞬发加马光子影像重建的准确性,且瞬发加马光子的信号为正子互毁加马光子的数十倍,瞬发加马光子造影可提升影像的信杂比,进而强化带电粒子射程验证应用的精准度。要说明的是,虽然图4b的正子对是由第一层闪烁晶体侦检器200a与200d所感测,在另一实施例中,如图4c所示,根据该正子对亦可以通过第二层的闪烁晶体侦检器200b与200e来进行感测。
请参阅图3b所示,在步骤34中,更包括有步骤340在第一时间段中独立的撷取每一个侦测探头20a与20b所产生的电信号,形成两组对应侦测探头20a与20b的第一电信号组。在本步骤中,以侦测探头20a为例,主要是使该信号处理电路21分别记录相应的加马光子e0与第一层闪烁晶体侦检器200a发生康普吞散射(comptonscattering)作用的第一位置、第一时间与第一沉积能量δe以及散射加马光子能量e1与第二层闪烁晶体侦检器200b作用的第二位置、第二沉积能量δe2与第二时间,以构成前述的第一电信号组。理想上第二层闪烁晶体侦检器200b完全吸收散射加马光子能量e1,所以第二沉积能量δe2=e1。之后,再以步骤341取得步骤340中的关于该第一时间段中每一个侦测探头所产生的多个第一电信号组,并对每一个侦测探头所具有的多个闪烁晶体侦检器所产生的电信号进行第一时讯符合演算,过滤非真的无关联信号,以得到对应多个侦测探头的多个瞬发加马光子第一时讯相关数据。以图6来说明步骤340,其为第一时讯符合演算示意图。以侦测探头20a为例,将其所具有的第一至第二层闪烁晶体侦检器200a~200b,分别侦测的事件所对应的信号取出,图6所示为三个事件i1,i2,i3。每一个事件具有两个电信号,分别对应每一层的闪烁晶体侦检器200a~200b,每一组电信号含有位置、时间与能量的信息。再通过比较第一与第二时间信号,如落在设定的符合时间窗口内,则表示该第二层闪烁晶体侦检器测量所得电信号来自与第一层闪烁晶体侦检器作用的加马光子的机会大。在本实施例中,有三个相同时间窗口宽度的时段w1,w2以及w3,要说明的是,时间窗口的大小可以根据需求来决定时间窗口的长度。从图6可以看出,w2的时段内,只有闪烁晶体侦检器200a有信号,闪烁晶体侦检器200b则无,而时段w1以及w3内则闪烁晶体侦检器200a与200b同时有信号,因此代表w1和w3时段撷取的信号属于时讯符合的信号,亦即认定是否为同一组入射瞬发加马光子及其散射加马光子所产生的电信号。如是,则予以储存记录,如否则不予以储存记录。
接着进行步骤342,亦即在第二时间段中撷取每一个侦测探头20a与20b的第一层闪烁晶体侦检器200a与200d所产生的电信号,形成多个第二电信号组。在本步骤342中,主要是使该信号处理电路21处理并数字化加马光子在侦测探头20a所得代表第一层闪烁晶体侦检器200a作用的第一位置、第一时间与第一沉积能量以及加马光子在侦测探头20b的第一层闪烁晶体侦检器200d作用的第二位置、第二沉积能量与第二时间,以构成前述的第二电信号组。如图5所示,其中侦测期间从t0~t2,在该侦测期间的t0~t1的第一时间段内,步骤340中会获得关于侦测探头20a的多个电信号组a1以及侦测探头20b的多个电信号组b1,同理在t1~t2的第二时间段中,执行步骤341则会获得关于各侦测探头20a与20b中所具有的第一层闪烁晶体侦检器200a与200d所得的多组电信号c1。根据现有的核医pet闪烁侦检器设计,由侦检器侦测电路信号,则可以得知加马光子是与哪一个闪烁晶体作用,进而得知作用位置与发生时间,再将侦测到信号的时间记录下来,沉积在侦检器的能量同样可以由相应的电信号强度得知。因此,每一个信号pa1~pan,pb1~pbn,pd1~pdn与pe1~pen含有位置、时间以及沉积能量的信息。
之后,再进行步骤343取得步骤342中关于该第二时间段中该每一个侦测探头的第一层闪烁晶体侦检器所产生的多个第二电信号组,并对进行一第二时讯符合演算,过滤非真的无关联信号,以得到多对第二时讯相关数据。在本步骤中,时讯符合演算的对象是每一个侦测探头的第一层闪烁晶体侦检器,以图4a为例,即是侦测探头20a与20b的闪烁晶体侦检器200a和200d。请参阅图7所示,在图7中显示的是闪烁晶体侦检器200a和200d所产生对应有三个事件i4~i6的多个第二电信号组,本实施例中,通过三个相同时间窗口宽度的时段w4~w6以及能量来确认这些信号是否属于同一个正子互毁所产生的一对511kev的加马光子所产生的一对电信号。如是,则予以储存记录,如否则不予以储存记录。要说明的是,在另一实施例中,步骤340~341以及步骤342~343可以独立同步进行。
再回到图3a所示,步骤34之后,可以进一步利用图4a所示的重建单元22来进行步骤35活度分布重建,进而将最后活度分布的结果转换成影像。本步骤重建的基础在于利用pet活度分布做为康普吞成像的先前信息,进而再进行康普吞影像重建。因为病患体内的质子或重离子射程途径除产生正子发射核外,也产生瞬发加马光子,所以正子发射核与质子或重离子剂量分布有关,也与瞬发加马光子分布具相关性。故以pet活度分布为基础经剂量关联处理后可做为康普吞影像重建的先前信息。如图3c所示,首先进行步骤350,先将步骤343所得到的第二时讯符合数据先进行前置处理,包括有侦检器校正、侦检器输出的位置信号与晶体位置产生关联,转换成位置与能量数据进行pet重建,得到关于正子互毁加马光子的第一活度分布。正子互毁加马光子的活度分布配合病患体内的质子或重离子射程途径在空间中大致呈直线束的分布状态,其代表着根据正子互毁加马光子所得到的带电粒子束的入射射程状况。接着进行步骤351将步骤350中的正子互毁加马光子的第一活度分布再转换为由pet估算获得的剂量分布信息。最后进行步骤352将步骤351所得到的正子互毁加马光子的剂量分布信息进行关联,也就是以步骤351的剂量分布信息作为步骤352的先前信息,进行pet嵌入式康普吞影像重建,亦即将康普吞圆锥面与前述步骤351由正子互毁加马光子的活度分布转换估算获得的剂量分布
以下说明采用步骤352的原理,如图8a与图8b所示,图8a为单纯将代表瞬发加马光子与侦检器的作用位置与沉积能量的电信号,例如,若以步骤343所得的单一事件的电信号,例如:图6中的pa1与pb1,进行前置处理,例如:包括有侦检器校正、侦检器输出的位置信号与晶体位置产生关联,之后再进行重建以得到活度分布图。根据康普吞散射原理,可以从入射闪烁侦检器的加马光子以及散射加马光子之间所具有的散射角来估算出产生加马光子的可能起源位置。这中间的演算,可以利用时讯符合演算来进行入射和散射加马光子的配对。从第一层以及第二层闪烁晶体侦检器通过步骤341时讯符合演算处理而被相互关连在一起的加马光子,根据侦测到的能量以及方程式(1)即可以得知产生加马光子起源的可能区域。
wheree0=e1+δe1
其中,原始能量为e0的高能加马光子与第一层闪烁侦检器200a及200d产生康普吞散射作用,释放部分能量δe1于第一层闪烁侦检器后为e1能量的康普吞散射光子。对被量测到单一的瞬发加马射线而言,此起源点的可能位置分布在一康普吞圆锥(comptoncone)80表面。然而,由于康普吞圆锥80,只能知道作用位置(顶点)与散射角θ,因此只要是在锥面上的任何一个位置都有可能是目标物所在的位置,因此单纯只有利用康普吞圆锥来推断目标所在的位置,其不确定性仍高不利于治疗射程的监控。为了解决这个问题,采用了步骤351结合步骤352的方式,亦即利用质子或重离子在病患体内射程途径产生二次粒子—正子发射核和瞬发加马光子,所以正子发射核与瞬发加马光子分布均与质子/重离子射程与剂量有关联的特性,以pet活度分布为基础经剂量关联处理后转换成剂量分布,来做为康普吞成像的先前信息来重建活度分布。在此实施例,经过步骤351之后pet影像所构成的正子发射核活度分布
于是在步骤352,经过交集之后,单一瞬发加马光子起源可能位置分布范围可由原本的康普吞圆锥80表面缩小至区域82a与82b。在pet嵌入式康普吞影像重建过程中,射源可能位置分布范围缩小将可大大提高重建后影像的信杂比质量,这不仅可加速瞬发加马光子影像重建收敛速度,更重要的是提升射程评估的精准度。
在图8b中为步骤343的第二时讯相关数据经步骤350~351的pet影像重建及剂量转换后的分布与步骤341的第一时讯相关数据经步骤352所形成的活度分布所交集而成的结果。由于图4a的实施例有两个侦测探头20a与20b,因此对于各个侦测探头20a与20b在步骤353之后形成如图9所示的活度分布交集。通过侦测探头20a与侦测探头20b的康普吞圆锥80和80’以及侦测探头20a和侦测探头20b的第一层闪烁晶体侦检器200a与200d所构成的pet架构,其所得的活度分布及剂量转换后的分布81交集可以将加马光子可能位置缩小至交集的区域,进而提升后续射程评估精准度。
以肿瘤治疗为例,因为在治疗之前会进行治疗计划评估,评估肿瘤的位置、带电粒子束应照射的角度及施予的剂量等。为了确认治疗过程中,带电粒子束在生物体内的实际射程与产生布拉格峰的位置与治疗计划预估射程的差异,因此,本发明的装置以及方法可以在每次治疗实时得到带电粒子束的实际射程,通过验证单元23提供显示的信息,可以让用户验证比较治疗计划评估的射程与由步骤352产生的活度分布所决定出的实际射程的差异,进而做为后续治疗调整该带电粒子束照射参数的依据,进而可以达到活体治疗监控与调整建议的双重效果,提升治疗的有效性并降低因射程不确定造成伤害健康组织的副作用。
前述的实施例为具有两层闪烁晶体的实施例,在另一实施例中,可以具有三层的闪烁晶体,如图2d所示的结构,其中设置第三层闪烁晶体侦检器的目的在于考虑康普吞散射成像的两层闪烁晶体侦检器侦检器设计过于理想,因为第二层侦检器(亦称为吸收侦检器)必须补获散射光子的所有能量,才能获得方程式(1)或方程式(2)所需的加马光子初始能量e0。然因质子治疗诱发的瞬发加马光子能量分布范围广且能量高,一般能量在数个kev到10mev,甚至可达15mev。因此,实际侦测时的初始加马光子能量未知,而散射加马光子能量e1全部被吸收侦检器阻挡的机率有限,想通过e1及沉积于第一层侦检器的能量δe1的总和获知初始加马光子全能量e0的机会不高。为了强化这个部分,在本实施例中,将侦测探头改用三层的闪烁侦检器设计,第三层的侦检器仅需量测到第二个散射光子的作用位置但无需记录第三层侦检器的沉积能量。θ2的计算可通过三个闪烁晶体侦检器各自记录到的入射加马光子与散射加马光子位置获得,之后将所有已知能量记录代入即可计算出入射光子源可能位置(亦即为质子与组织作用产生的瞬发加马光子的起始位置)所在的康普吞圆锥角θ1,如方程式(3)所示。至于步骤361的pet嵌入式影像重建,在此三层闪烁侦检器状况下,最有可能的瞬发加马光子起源位置
e0=e1+δe1
e1=e2+δe2
此外,要说明的是,前述的实施例中,为侦测带电粒子束所产生的瞬发加马光子以及成对的正子互毁加马光子。在另一实施例中,本发明的侦测装置也可以应用在核子医学的双同位素(混合正子同位素与加马光子同位素)或特殊同位素(可发射正子与加马光子的同位素,如124i,86y,89zr等)的造影等。因此,并不以侦测带电粒子束所产生的加马光子为限制。在本实施例中,同样地,第一时间段侦测加马光子,第二时间段则侦测正子互毁的加马光子,如此第一与第二时间段交替进行,取得的电信号在根据图3b与图3c的步骤进行处理,进而重建出对应的活度分布与影像。
以上所述仅记载本发明为呈现解决问题所采用的技术手段的较佳实施方式或实施例而已,并非用来限定本发明专利实施的范围。即凡与本发明专利申请范围文义相符,或依本发明专利范围所做的均等变化与修饰,皆为本发明的保护范围所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!