成分分析装置、药效分析装置和分析方法与流程
本申请是原申请、申请日为2014年11月26日,申请号为201480040060.4,发明名称为“成分分析装置、药效分析装置和分析方法”的中国专利申请的分案申请。
本发明涉及对新药开发有用的、对于药物的摄取、代谢、排泄这样的药物动力学的整体情况的体外(invitro)评价。
背景技术:
在新药开发工序中,在药剂法上必须要进行对人体的体内给药、验证效能的临床试验(“人体临床试验”),但是人体临床试验、动物实验试验需要庞大的开发费。近年来,这些开发费成为最大的原因,新药开发整体的成本在增加。作为其中的一个原因大多是因为,针对在开发工序前期的非临床动物实验中无法检测到药效不良、毒性的药剂候选物,在开发工序后期的人体临床试验中首次发现药效不良、毒性,而至此为止的开发成本、人体临床试验所花费的成本变得白费。
从这样的背景出发,为了提高人体临床试验的通过率、试图削减新药开发成本,在早期就缩小能呈现药效且没有发现毒性的新药候选物质的范围变得重要。对此,许多制药企业期望能有一种体外(invitro)评价系统,该评价系统在药物研发的初期阶段,不是只采用与人体细胞的特性相关性低的动物实验来缩小药剂候选物的范围,而是能够使用人体细胞来良好地预测给药药物在人体体内的药物动力学。然而,还没有确立利用细胞来对被给药的药品候选化合物的摄取、代谢、胆管和血管排泄这样的药物动力学的整体情况进行把握、解析的方法。
药剂为了在体内发挥药效,已经被摄取到肝脏中的药剂需要成为代谢产物、或者不被代谢而是作为原来的化合物(母体化合物)而排出到血管侧,然后再次随着血液流而进行再循环,到达目标脏器、器官。因此,在体外试验系统中也是这样,如果能测定在给药后排出到血管侧的药品候选化合物的再循环部分,对于在新药开发中最重要的指标之一的药效进行评价,则能够成为非常有用的药物动力学评价方法。此外,通过探明药物动力学整体情况(药物动力学整体情况包括在胆管排泄后作为尿、便排泄到体外的、从细胞排泄到胆管的部分(消失部分)、细胞内残留部分),则能够求得向各组分的分配比率。
专利文献1和专利文献2中,公开了迄今为止向培养细胞给予药剂,对从细胞的胆管排泄的部分(消失部分)进行评价的方法。该评价方法是对药剂消失部分进行评价的方法,上述药剂消失部分为,给药药剂不发挥毒性、药效而排泄到胆管中,之后作为尿、便排泄到体外的部分。
现有技术文献
专利文献
专利文献1:日本特开2012-65659
专利文献2:日本特开平8-503610
技术实现要素:
发明要解决的问题
现有技术只是对于胆管排泄量、即没有药效的成分的量进行评价的方法,是对体外消失部分进行评价的方法。但是,为了获取具有药效的成分的信息,希望直接评价排泄到血管侧的成分的量,然而现有技术中还没有确立对于排泄到血管的成分的量进行解析的方法。进一步,不只是对于药物动力学的一部分进行评价,而是对于给药药剂的血管(基部/基侧)侧排出组分、管腔(顶部)侧排出组分、细胞内残留组分这样的、给药药剂从细胞的何处被排泄出、存积在何处,进行细分定量,从而能在体外提供药物动力学整体情况,进行更高精度的药效评价,但是还没有确立这样的评价方法。
解决问题的方法
例如为一种成分分析装置,其特征在于,具备:调整上述多个容器内的温度的温度调整部,以及测定上述多个容器内的成分、并且对该测定的上述成分进行解析的分析部;上述多个容器为至少第1容器、第2容器;上述第1容器内和上述第2容器分别保持第1缓冲液;上述温度调整部进行调整以使得上述第1容器内的温度与上述第2容器内的温度成为不同温度;
上述分析部测定从上述第1容器内的细胞向上述第1容器内的上述第1缓冲液排出的成分的量、以及从上述第2容器内的细胞向上述第1容器内的上述第1缓冲液排出的成分的量,并且对于通过上述细胞的转运蛋白而排出的上述成分的量进行解析。
发明效果
通过应用本发明,能够直接地评价排泄到细胞的血管侧的药剂等成分。进一步,通过对药品候选化合物(母体化合物和代谢产物)在转运蛋白途径和扩散途径中的血管(基部/基侧)侧排出组分和管腔(顶部)侧排出组分、以及细胞内残留组分进行定量,并且判定被给药的药品候选化合物的总量和向各组分的分配比率,从而对被给药的药品候选化合物的动力学进行评价成为可能,能够提高从庞大数量的药品候选化合物中体外筛选出发挥药效的药剂候选物的筛选精度。其结果是,能够在早期缩小药品候选化合物的范围,减少无用的动物实验、无用的人体临床试验。对于降低对制药企业来说成为沉重负担的新药开发成本做出贡献。
附图说明
图1为培养板;
图2为样品调制流程;
图3为工序4、5、6的定量对象和药物分布示意图;
图4为各组分的定义和cdf的结果;
图5为cdf的分配比率;
图6为罗丹明123的分配比率;
图7为自动测量装置构成图;
图8为样品调制部的上表面图;
图9为样品调制部的正面图;
图10(a)为自动测量装置的运作流程图;
图10(b)为自动测量装置的运作流程图;
图11为吸头端和吸头。
具体实施方式
实施例1
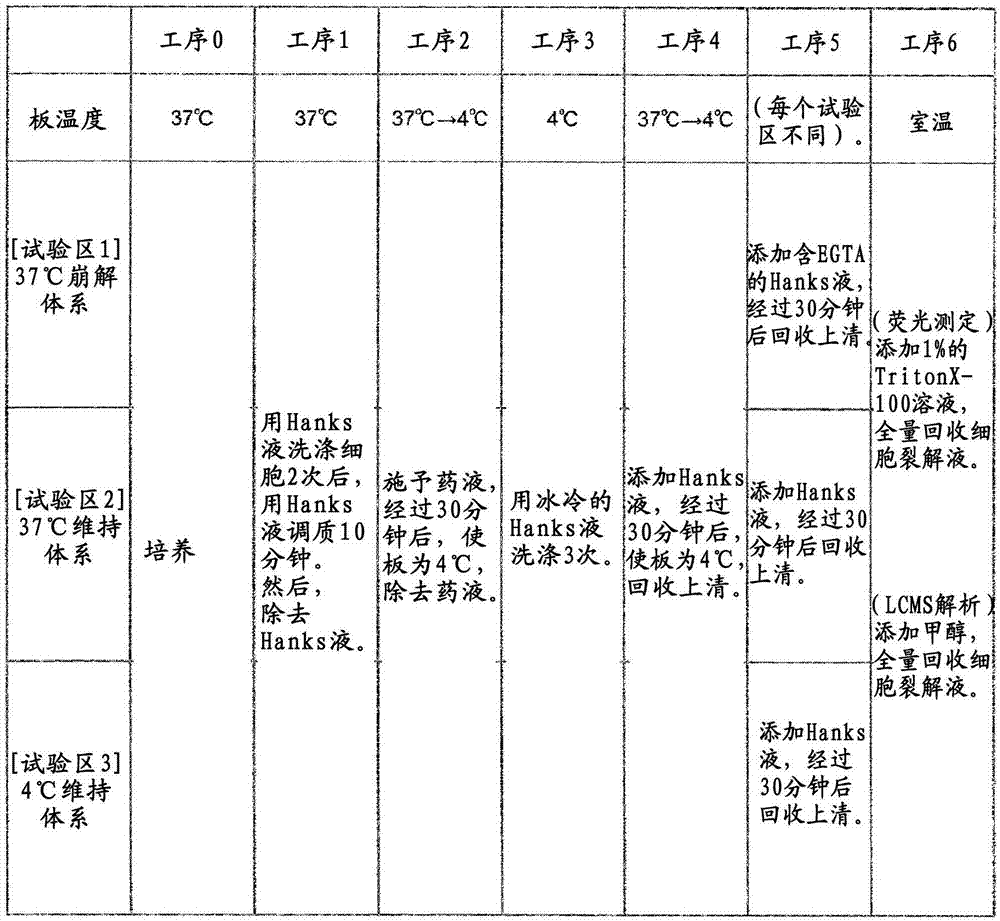
本实施例中,关于用于上述药效评价的成分分析方法,按照图2的工序0~6来进行说明。此外,关于工序4~6,采用图3进行详述。
其中,在以下的多个实施例中,基于药效成分的评价方法进行说明,但只是用于说明本申请发明的一个例子,显然,药剂以外的化学物质、进一步还有药物代谢物的评价也能够应用本申请发明的成分分析方法。此外,本实施例中给出的缓冲液、温度、时间等具体的条件只是一个例子,显然,只要作为技术构思而具有同样的效果,则也可以应用别的条件。
本实施例中,对于使用试验区1~3中的至少3个试验区的情况进行说明。各试验区中,存在保持细胞的保持区域,这些保持区域可以对于各个试验区使用不同的容器,也可以将具有多个保持区域的一个容器内进行分取,设定各试验区。
<工序0:肝细胞的调制和培养>
本工序中,首先,进行了用于验证药剂效果的肝细胞的调制、培养。以下示出一个例子。
肝细胞的调制按照原位胶原酶灌流法进行。详细如下。将大鼠(rat)(5~6周龄)在戊巴比妥麻醉的条件下开腹,在门脉中插入导管注入前灌流液(不含ca2+和mg2+、含有egta的hanks液)。在确认到充分进行了从肝脏的脱血之后停止灌流。将灌流液替换为胶原酶溶液,进行灌流。本实施例中使用含有0.05%胶原酶的hanks液进行灌流,但不限于此。在确认到细胞间组织通过胶原酶而被消化之后,停止灌流。切除肝脏,在冷却的hanks液中切细,通过移液分散至细胞。使用等渗percoll液,将在500g、5分钟的离心分离中存在损伤的肝细胞除去。所得的肝细胞的生存率用台盼蓝排斥法测量,将生存率85%以上的肝细胞用于培养。这里,将生存率85%以上的肝细胞用于培养,但是显然,并不必须限于该条件。此外,肝细胞的调制并不限于原位胶原酶灌流法。使用的肝细胞也不限于源自大鼠,也不限于大鼠的系统。本实施例中利用肝细胞,但不限于此。
使如前所述的利用原位胶原酶灌流法调制的肝细胞悬浮于培养基中,在市售的胶原包被培养皿中,将肝细胞以5×105个细胞/ml的密度在培养基中悬浮播种。播种密度、培养基、培养板001没有特别限制。培养板示于图1。这里,示出了包含24个培养区域(孔,002)的24孔培养板,但不限于此,只要是能够保持规定的细胞的容器,则也可以使用其他形状的容器。播种后,使用co2培养箱在5%co2、37℃的条件下开始培养。经过18小时以上,之后,进行首次培养基交换。对于播种后第18小时以后的培养中使用的培养基没有特别限制,本实施例中,使用在从培养基(10%fcs+)中去除了fcs的培养基(以下称为培养基(fcs-))中添加了基质胶的培养基。之后每24小时使用培养基(fcs-)进行培养基交换。如后所述,在工序5中进行3种不同条件下的试验(试验区1、2、3:在工序5中详述),因此在该时刻,对于同条件的培养板准备独立的3个板。从工序0至4和工序5中,对3种试验区均进行同样的试验操作。
<工序1:肝细胞的调质>
本工序中,将通过工序0培养的细胞调质为适于药剂评价。以下示出一个例子。
将通过工序0培养了4天的细胞的培养上清液除去,添加400l的hanks液作为缓冲液,在37℃培养10分种(图2工序1)。缓冲液的种类和量没有特别限定。
工序1的操作优选重复两次。通过这样地将细胞能够适应的成分从工序0的培养中使用的培养基替换为缓冲液(例如hanks液),能够调整用于在以下的工序中进行正确的测定、解析的基底。但是,显然,工序1的重复次数可以根据所使用的缓冲液的种类、细胞的种类任意变更。
<工序2:药液给药>
本工序中,将进行评价的药液给药至细胞。以下示出一个例子。
除去缓冲液之后,将10m的cdf(荧光试剂)200l添加到孔中,在37℃培养30分钟,然后在4℃保持5分钟(图2工序2)。试剂的种类、浓度、量没有特别限定。由于cdf发出荧光,因此可以用酶标仪作为模型试剂来简便地定量。此外,将给药量设定为200μl,这是作为孔内的细胞整体浸没在试剂中的量而选择的。关于cdf的浓度,只要是以往作为细胞的荧光分析而使用的浓度就可以。作为用于通过酶标仪检测到的试剂量,也优选应用本浓度。培养的时间设定为30分钟,这是基于预备研究的结果而采用的,该预备研究的结果是药剂的摄取和排出基本达到平衡状态为止的时间为30分钟。出于防止所给药的药剂向细胞外漏出的目的,在30分钟培养后将板温度设为4℃。这是因为,通过使容器内的温度低,能引起细胞抑制药剂向外部排出的现象。
通过这样使药剂的温度为规定的温度以下,药剂留在细胞内,能够抑制向细胞外漏出的现象。本实施例中设为4℃,但只要是能够抑制所给药的药剂向细胞外漏出的温度,则不限于此。此外,只要是能够抑制所给药的药剂向细胞外漏出、例如施予抑制剂那样的方法,则不限于降低温度的方法。无论如何,工序2中的温度成为比工序1中设定的板温度低的温度。这是因为,与工序2相反,工序1中的调质优选使细胞内吸收、排出药剂的现象活性化的温度(例如37℃)。
药剂给药的时机不限于本实施例。例如,有时可在试验日的前一天或者几天之前就开始进行药剂给药。这种情况下,在工序0的阶段施予药剂,工序1、2可省略。
<工序3:细胞洗涤>
本工序中,通过工序3洗掉细胞内含有的药液以外的物质。以下对一个例子进行说明。
接着,将板保持于4℃,直接使用冰冷的400μlhanks液洗涤3次(图2工序3)。设定为4℃的目的与前述相同。培养时培养基的量为400μl,出于除去残留在孔内壁的培养基成分的目的,将洗涤hanks液的量设定为400μl。通常的生物化学分析中洗涤次数为3次是通例,遵循该通例。各个条件没有限定。由此,能够除去成为测定对象的药液以外的物质,进一步提高后面的工序中药效评价的精度。
<工序4:血管侧排出组分回收>
作为评价药效的一个指标,有效的是分析所给药的药剂是容易在细胞内长时间停留、还是只能短时间停留。对此,本工序中,为了取得用于上述指标的数据,在后述的工序5评价各试验区内的细胞之前,使药剂在规定时间以内从细胞内漏出。以下示出一个例子。
首先,施予前处理用的缓冲液(例如hanks液),在37℃培养30分钟,回收含药剂的hanks液(上清)(图2工序4)。缓冲液可以使用与工序5中使用的缓冲液相同种类的缓冲液,也可以使用其他种类的缓冲液。为了使直到工序3为止存积在肝细胞(图3、101)内的药剂通过第一血管侧排出、即通过被动扩散途径(图2工序4,(1)’)和转运蛋白(tp)途径(图2工序4,(2)’和示意图中102)排出到hanks液中,维持在37℃。如后所述,工序5中也进行血管侧排出,为了区分,将工序4中的血管侧排出定义为第一血管侧排出,将工序5中的血管侧排出定义为第二血管侧排出。本质上都是从细胞内排出到血管侧(基部/基侧)(上清)的工序。转运蛋白是在细胞膜上发现的负责物质运输的膜蛋白。负责细胞内外的主动物质运输。此外,被动扩散是通过转运蛋白途径以外的途径向细胞外排出,包括从细胞膜漏出等。将工序4中排出到hanks液中的药剂定义为血管侧排出组分,这是因为面向hanks液的细胞上表面部分相当于基部(basal)/基侧(basolateral)面(图3,104),推测为在生体内面向血管的部分。
在接下来说明的工序5中,是通过不同的3种操作进行药剂回收的工序(试验区1、2、3),但在工序5之前,可以事先通过工序4如上述那样获取如第一血管侧排出组分(排出到hanks液的药剂),从而能够获得验证药剂是否容易在细胞停留的指标。
这里,为了探明血管侧排出各组分而使用的hanks液可以使用任意试验区的hanks液。例如,可以对后述的所有试验区1~3的hanks液进行评价,也可以仅使用一部分。
此外,工序3、4是为了更详细地实施根据本发明的分析并且进行高精度评价的工序,显然,可以跳过本发明,进行工序5的操作。如图2所示,上述工序0~4为至少在试验区1~3中进行的工序。就工序5而言,为了通过后述的解析来获得本发明所要求的多个指标数据,分别对于试验区1~3采用不同条件进行处理。以下示出一个例子。
<工序5、试验区1:利用37℃崩解体系的上清的回收>
就试验区1而言,如图3的试验区1所示,使胆管侧排出(3)与第二血管侧排出(也就是从扩散(1)和转运蛋白(tp)(2)的排出)的合计组分从细胞向缓冲液(例如hanks(-)液)排出。hanks(-)液是不含钙离子、镁离子的hanks液,用于本试验区那样的不对细胞间粘附进行强化的情况。以积极地解除细胞间粘附为目的,使用下述的egta那样的螯合剂。接着,添加含有1mmegta的hanks(-)液200μl。egta具有对于与细胞间粘附分子的粘附相关的ca2+、mg2+的作用进行抑制的螯合作用,是用于解除细胞间粘附的试剂。由此,使培养过程中形成的胆管崩解。在37℃培养30分钟之后,回收上清。只要是具有螯合作用的试剂,则不限于egta。含有egta的缓冲液的种类、量和培养温度以及时间没有特别限定。工序5的试验区1中,在工序4结束的阶段存积在细胞内的药剂(图3工序5和示意图(1)、(2))、和排出到胆管中的药剂(图3工序5和示意图(3))全部排出到上清中,并且被回收(图3工序5、试验区1)。将工序5中的(3)定义为胆管侧排出组分是因为,在细胞间粘附部分所形成的间隙周围的细胞膜部分相当于顶部(apical)面(图3,105),并且推测间隙是毛细胆管(图3,103)。工序5的试验区1中,温度维持在37℃,因此从细胞内排出到血管侧的组分包括被动扩散途径(图3工序5,(1))和转运蛋白途径(图3工序5,(2))。
<工序5、试验区2:利用37℃维持体系的上清的回收>
试验区2不像试验区1那样使胆管崩解,而是仅排出图3所说的第二血管侧排出(扩散(1)和转运蛋白(2))。
添加200μl的hanks液。试验区2不同于试验区1,不含egta等螯合剂,所以是维持细胞间粘附的状态,因此,是不诱发毛细胆管崩解的试验区。在37℃培养30分钟后,回收上清。工序5的试验区2中,使工序4结束的阶段存积在细胞内的药剂(图3工序5和示意图(1)、(2))排出到上清中,并回收(图3工序5,试验区2)。按照至此为止的说明,将排出到上清中的药剂定义为第二血管侧排出组分。工序5试验区2中,温度维持在37℃,因此从细胞内排出到血管侧的组分中包括被动扩散途径(图3工序5、(1))和转运蛋白途径(图3工序5、(2))。
通过对从工序5的试验区1和试验区2回收的药剂的量进行定量解析,从而例如从对试验区1中回收的药剂量进行定量化的值中减去对试验区2中回收的药剂量进行定量化的值,从而能够分别算出胆管侧排出(3)的药剂量和第二血管侧排出的药剂量。
<工序5、试验区3:利用4℃维持体系的上清的回收>
关于试验区3,通过设为比后述的试验区1、2更低的温度条件,抑制第二血管侧排出中从转运蛋白(1)排出的药剂,仅排出通过扩散(2)的排出部分。
添加200μl的hanks液,在4℃培养30分钟后,回收上清。试验温度与同样是维持体系的工序5试验区2不同。这是因为,通过设为4℃,抑制转运蛋白途径的血管侧排出。工序5试验区3中,通过采用抑制转运蛋白活性的低温4℃的试验区,能够仅对被动扩散途径的排出量进行定量(图3工序5,(1))、通过与工序5试验区2的比较来算出(定量)通过转运蛋白途径的血管侧药剂排出量。各药剂中存在用于移动细胞内外的特异性转运蛋白。因此,能够排除被动扩散途径的排出量,对转运蛋白途径的排出量进行定量,这意味着能够对各药剂的特异性排出量进行定量。缓冲液的种类、量和培养温度以及时间没有特别限定。与上述同样地,通过对于来自工序5的试验区2和试验区3的回收药剂进行定量,能够算出转运蛋白途径的排出组分。这里,本实施例中示出了使用试验区1、2、3分别算出排出组分的例子,但试验区的数量不必须是3。例如,如果想要仅分离胆管侧排出(3)和第二血管侧排出((1)+(2)),则仅实施试验区1和2即可,如果想要从第二血管侧排出中仅分离出扩散(1)和转运蛋白(2),则仅实施试验区2、3即可。此外,根据需要,通过设计其他用途的4℃崩解体系,能够抑制向毛细胆管侧的排出中经由转运蛋白的排出,仅测定通过扩散的排出部分。由此,例如通过将该4℃崩解体系与试验区3比较,能够分开评价通过扩散向毛细胆管侧的排出和通过转运蛋白途径向毛细胆管侧的排出部分。
上述的各试验区1~3中的工序按照任何顺序进行均可,也可以将各工序并行实施。
<工序6:胆管组分、细胞内组分的回收>
再次在工序6中回到与3试验区共同的操作。工序6中,为了定量细胞内残留组分而进行药剂的回收。当用酶标仪等对荧光药剂等进行定量时,优选添加含有1%的表面活性剂的hanks液例如200μl,使之悬浮,全量回收(图2工序6)。由此,能够使细胞膜破碎,使细胞内存积的药剂排出。将所得的样品移动到培养板,使用酶标仪进行荧光测量。对于用于空白测定,准备仅添加了hanks液的孔。在激发波长484nm、吸收波长519nm测定荧光强度。
此外,当使用质量分析(lcms)装置等对药剂进行定量时,通过由添加水而引起的低渗化、有机溶剂处理等,从而在细胞内抽出残留部分后使用甲醇等有机溶剂使之悬浮,全量回收(图2工序6)。然后,使用lcms装置进行后述的药剂的定量。
<基于测定结果确定向各组分的分配比率,并评分>
基于反映由上述工序所得的药剂量的荧光强度,计算向各组分的分配比率。这里,将工序5、6的总和(图3,b#+c#=(1)+(2)+(3)+(4))设为药剂量100%。将这种情况设为“方式1”。
从利用荧光量测定而求得的6种值(b1、b2、b3、c1、c2、c3),求出图4的方式1所示那样的向各类别的分配比率。基于这些值进行如下的对应命名:
·仅通过扩散的第二血管侧排出组分(extracellulareffluxbydiffusion(通过扩散的细胞外排出),exefx-dif)为b3;
·仅通过转运蛋白途径的第二血管侧排出组分(extracellulareffluxbytransporter(通过转运蛋白的细胞外排出),exefx-tp)为b2-b3;
·胆管侧排出组分(bilecanaliculiefflux(胆管排出),bcefx)为b1-b2;
·细胞内残留组分(cell(细胞))为c1。
基于该结果,能够描绘出向图5的方式1那样的圆形图,能够从视觉上理解向各组分的分配比率的整体情况。
进一步,基于定量结果,能够进行以下的药剂固有的评分。本实施例中,示出了算出的cdf的分数的一个例子。算出的分数不限于此。
对于转运蛋白途径的血管侧排出进行评价的分数为:
·作为通过转运蛋白途径排出的药剂量相对于第二血管侧排出药剂量的比例(ratioofextracellulareffluxbydiffusion(通过扩散的细胞外排出的比例),rexemtp),通过(b2-b3)/b2求得。
对于向胆管的排泄进行评价的分数为:
·作为胆管排泄药剂量相对于摄取到细胞内的总药剂量的比例(biliaryretentiondrug(胆保留药剂),bird),通过(b1-b2)/(c1+c2)求得,
或者,另外的方法中,
·作为胆管排泄药剂量相对于细胞内残留的药剂量的比例,通过(c2-c1)/c2或(b1-b2)/c1等求得。
<不同药剂间的分配比率和分数的比较>
将cdf变更为罗丹明123,进行与上述相同的操作,从而能够得到图6所示的结果(方式1)。可以看出,能够检测到与示出了cdf结果的图5(方式1)显著不同的分配比率。
此外,例如,通过转运蛋白途径排出的药剂量相对于cdf的血管侧排出药剂量的比例(rexemtp)、以及胆管排泄药剂量相对于摄取到细胞内的总药剂量的比例(bird)分别为41.08、18.58,与此相对,罗丹明123的该结果分别为52.52、4.92,可知,与罗丹明123相比,cdf是保持了容易排泄到胆管、难于排出到血管侧的性质的药剂。如上所述,通过本发明,能够评价各个化合物呈现出何种药物动力学。
实施例2
实施例2中,对于如下的情况进行说明:关于基于测定结果确定向各组分的分配比率、以及评分,采用与实施例1不同的方法。
本实施例中,通过利用图3中记载的s#(相当于工序4)的定量值,能够获得实施例1的方式1所示的向各组分的分配比率之外,给药药物易于还是难于在细胞内停留的信息,能够进行更精密的评价。即,将工序4、5、6的总和(图3,s#+b#+c#=(1)’+(2)’+(1)+(2)+(3)+(4))设为100%的给药药物量。将该情况作为“方式2”。因此,能够使用通过工序4、5、6的各试验区求出的9个种类(s1、s2、s3、b1、b2、b3、c1、c2、c3)作为评价指标。
基于通过荧光量测定求得的9个种类的值,求得图4的方式2所示的向各类别的分配比率。由这些值,进行如下的对应命名:
·第一血管侧排出组分(sup组分)为s1(≒s2≒s3);
·仅通过扩散的第二血管侧排出组分(extracellulareffluxbydiffusion(通过扩散的细胞外排出),exefx-dif)为b3;
·仅通过转运蛋白途径的第二血管侧排出组分(extracellulareffluxbytransporter(通过转运蛋白的细胞外排出),exefx-tp)为b2-b3;
·胆管侧排出组分(bilecanaliculiefflux(胆管排出),bcefx)为b1-b2;
·细胞内残留组分(cell(细胞))为c1。
基于该结果,能够描绘出图5的方式2那样的圆形图,能够从视觉上理解向各组分的分配比率的整体情况。通过使用实施例2所示的方法,关于成为在细胞内易于或难于停留的指标的sup组分,cdf为70.82,与此相对罗丹明123为39.29(图6,方式2),可知cdf存在易于向血管侧排出的倾向。这与实施例1的细胞内残留组分评价一致。
进一步,基于定量结果,能够进行药剂固有的评分,这如实施例1所记载。
实施例3
实施例3中,对实施例1和2叙述的一系列工序实现自动化的装置的一个例子进行描述。这里,关于后述的装置的运作目的、各构成的作用等,当与上述实施例1,2重复时,有时省略记载。
对于实施例1~2中示出的在各试验区1~3设定的保持有细胞的区域,在后述的装置构成中,采用“试验区1用孔”“试验区2用孔”“试验区3用孔”等表述来进行说明,它们可以例如分别针对每个试验区设定上述的“孔培养板”的多个容器,也可以对一个孔培养板中的多个孔进行分区、将分区的每个区域设定作为例如“第1容器”“第2容器”“第3容器”等。
特别地,试验区1用孔和试验区2用孔进行几乎相同的温度调整,因此对一个孔培养板内进行分区设定的话,从精度、速度的观点出发,能够有效率地进行评价。
这里,关于后述的装置运作中对各试验区用孔(容器)的交换操作,可以自动交换也可以通过手动操作来交换。关于该容器的交换、设置操作,以下省略说明。
本装置如图7所示,由培养部106、样品调制部107(包括输入部107a)、分析部108和显示部109构成。进一步,样品调制部107具有后述的对各容器(板)内的温度进行调整的温度调整部107b、以及能够向容器供给或回收液体的送液部107c等。分析部108具有测定药剂等成分的量的测定部108a,以及解析部108b,该解析部108b对于从测定部取得的药剂等成分的量、从转运蛋白途径、胆管途径、细胞内残存、转运蛋白和胆管以外排出的部分(扩散)各自的量进行解析。上述装置构成是一个例子,显然,也可以是例如如下的构成等:只有解析部在另外的装置中实行,将从测定部取得的信息发送到该另外的装置。
此外,样品调制部的详细构成示于图8和图9。样品调制部中,像至此在实施例1-2中叙述的那样,目的是自动调制成为分析对象的各组分。各构成要素的说明按照后述的流程来叙述。
自动测量装置的运作流程图示于图10。图10的流程只是一个例子,像实施例1<工序2>中记载的那样,当药剂给药的时机不同时,不限于此。本实施例中,关于保持细胞的容器,作为一个例子使用了具有多个细胞保持区域(孔)的板来说明,但容器不限于板,显然,只要能够保持细胞即可。
<从培养部向样品调制部的移送>
首先,肝细胞在培养部106中培养(图7、图10)(图10(a)子工序1)。然后,将保持有所培养的肝细胞的板移送到样品调制部的带有第一调温功能的板座210上、以及带有第二调温功能的板座(211)上(图7、图10)(图10(a)子工序2)。
<样品调制:相当于实施例1、2的工序1>
设置于送液部107c的、附加有用于吸引液体的吸引嘴的吸引头205移动到上述板座上的、应除去的培养基填充的培养板001的孔002,从孔吸引培养基,进行全量除去(图10子工序3)。除去的培养基被废弃回收到废液槽206中。
接着,将保持液体301的吸头302从保管有多个吸头的吸头架207安装至装配有吸引嘴的吸头端204。吸头端移动至常温药液架209,吸引缓冲液(图10子工序4)。移动至目标孔,添加缓冲液之后(图10(a)子工序5),吸头端移动到集尘箱214,将吸头废弃。为了防止污染等,本文中使用可更换的吸头,但不限于此。
吸引头移动至填充有缓冲液的孔,进行缓冲液的除去(图10(a)子工序6)。除去的培养基被废弃回收到废液槽206中。将该工序重复共计2次(洗涤工序)(图10(a)子工序7)。
接下来,在吸头端204安装吸头架207内的吸头,吸头端移动至常温药液架209,吸引缓冲液(图9子工序8)。移动至目标孔,添加缓冲液之后,吸头端移动至集尘箱214,将吸头废弃。在37℃待机10分钟(调质)(图10(a)子工序9)。然后,吸引头205移动至填充有缓冲液的孔,将缓冲液全量除去(图10(a)子工序10)。
<样品调制:相当于实施例1、2的工序2>
在吸头端204安装吸头架207内的吸头,吸头端移动至常温药液架209,吸引药液(图10(a)子工序11)。移动至目标孔,添加药液之后(图10(a)子工序12),吸头端204移动至集尘箱214,将吸头废弃。在37℃待机30分钟(图10(a)子工序12)。然后,将作为保持有容器的容器保持部的一个构成例的带有第一调温功能的板座210和带有第二调温功能的板座211从37℃变化至4℃之后(图10(a)子工序13),吸引头205移动至填充有药液的孔,将药液全量除去(图10(a)子工序14)。
这里,关于本实施例中的温度调整部,说明了在板座上搭载调温功能,但显然,温度调节部可以与容器保持部分离地存在。
<样品调制:相当于实施例1、2的工序3>
在吸头端204安装吸头架207内的吸头,吸头端移动至冷藏药液架208,吸引缓冲液(图10(a)子工序15)。如前所述,使用冷藏的药液是为了使转运蛋白活性那样的主动生命现象停止。为了这一目的,冷藏药液架208将药液、缓冲液等保持于低温。移动至目标孔,添加缓冲液之后(图10(a)子工序16),吸头端204移动至集尘箱214,将吸头废弃。吸引头移动至填充有缓冲液的孔,将缓冲液除去(图10(a)子工序17)。除去的培养基被废弃至废液槽206。将该工序重复共计3次(洗涤工序)(图10(a)子工序18)。
<样品调制:相当于实施例1、2的工序4>
将带有第一调温功能的板座210和带有第二调温功能的板座211从4℃变化至37℃之后(图10(a)子工序19),在吸头端204安装吸头架207内的吸头,吸头端移动至冷藏药液架208,吸引缓冲液(图10(a)子工序20)。移动至目标孔,添加缓冲液之后(图10(a)子工序21),吸头端204移动至集尘箱214,将吸头废弃。在37℃待机30分钟(图10(a)子工序20)。然后,将带有第一调温功能的板座210、和带有第二调温功能的板座211从37℃变化至4℃之后(图10(a)子工序22),在吸头端204安装吸头架207内的吸头,移动至填充有含药剂的缓冲液的孔,吸引含药剂的缓冲液(上清),分注到第一板座212、和第二板座213上的回收用的回收板中(回收)(图10(a)子工序23)。
<样品调制:相当于实施例1、2的工序5>
将带有第一调温的板座210从4℃变化至37℃之后(图10(a)子工序24),在吸头端204安装吸头架207内的吸头,吸头端移动至常温药液架(209),吸引含有egta的缓冲液(图10(a)子工序24)。移动至第一板座212上的试验区1用的孔,添加含有egta的缓冲液之后(图10(b)子工序25),吸头端204移动至集尘箱214,将吸头废弃。在37℃待机30分钟(图10(b)子工序26)。
在吸头端204安装吸头架207内的吸头,吸头端移动至常温药液架209,吸引缓冲液(图10(b)子工序27)。移动至第一板座212上的试验区2用的孔,添加缓冲液之后(图10(b)子工序28),吸头端204移动至集尘箱214,将吸头废弃。在37℃待机30分钟(图10(b)子工序28)。
在吸头端204安装吸头架207内的吸头,吸头端移动至冷藏药液架209,吸引缓冲液(图10(b)子工序29)。
移动至第二板座213上的试验区3用的孔,添加缓冲液之后(图10(b)子工序30),吸头端204移动至集尘箱214、将吸头废弃。在4℃待机30分钟(图10(b)子工序30)。
在吸头端204安装吸头架207内的吸头,移动至填充有含药剂的egta缓冲液的孔,吸引含药剂的egta缓冲液(上清),分注(回收)至第一板座212上的回收用的回收板中(图10(b)子工序31)。
在吸头端204安装吸头架207内的吸头,移动至填充有含药剂的缓冲液的孔,吸引含药剂的缓冲液(上清),分注(回收)至第一板座212上的回收用的回收板中(图10(b)子工序32)。
在吸头端204安装吸头架207内的吸头,移动至填充有含药剂的egta缓冲液的孔,吸引含药剂的缓冲液(上清),分注(回收)至第一板座213上的回收用的回收板中(图10(b)子工序33)。
将带有第一调温功能的板座210和带有第二调温功能的板座211均变化至室温之后(图10(b)子工序34),在吸头端204安装吸头架207内的吸头,吸头端移动至常温药液架209,吸引1%的tritonx-100或纯水/甲醇(图10(b)子工序35)。移动至带有第一调温功能的板座(210)和带有第二调温功能的板座211上的试验区1、2、3用的孔,添加1%的tritonx-100或纯水/甲醇之后(图10(b)子工序36),吸头端204移动至集尘箱214,将吸头废弃。
在吸头端204安装吸头架207内的吸头,移动至填充有上述试剂的孔,全量吸引细胞悬浮液,分注(回收)至第一板座212和第二板座213上的回收用的回收板中(图10(b)子工序37)。
关于上述装置的运作,对实施例1、2的试验区1~3的各个工序中按顺序实施运作的情况进行了叙述,各工序可以按顺序进行,也可以各个工序并行实施。
<从样品调制部向测定部的移送>
培养板回收的药剂被移动至测定部(图10(b)子工序38)。在测定部中,利用酶标仪或lcms进行药剂的测定(图10(b)子工序39)。
<由解析部进行的分配比率和分数的算出以及结果的显示>
基于测定结果算出向各组分的分配比率和分数(图10(b)子工序40)。然后,将所得的算出值在显示部中显示(图10(b)子工序41)。
以上,关于实施例1~3中说明的构成,如果举出一个例子的话,例如如下所述。
<构成1>
一种成分分析装置,其特征在于,具备:保持多个容器的保持部,所述多个容器保持规定的细胞;调整所述多个容器内的温度的温度调整部;测定所述多个容器内的成分、并对该测定的所述成分进行解析的分析部,
所述多个容器为至少第1容器、第2容器,所述第1容器内和所述第2容器分别保持第1缓冲液,所述温度调整部进行调整以使得所述第1容器内的温度与所述第2容器内的温度成为不同的温度,所述分析部测定从所述第1容器内的细胞向所述第1容器内的所述第1缓冲液排出的成分的量、从所述第2容器内的细胞向所述第2容器内的所述第1缓冲液排出的成分的量,并且通过所述细胞的转运蛋白排出的所述成分的量进行解析。
<构成2>
根据构成1记载的成分分析装置,其特征在于,所述规定的细胞为肝细胞,所述多个容器至少为所述第1容器、所述第2容器和第3容器,在所述第3容器内保持有添加了规定的物质的第2缓冲液,
所述温度调整部进行调整以使得所述第2容器内的第2温度比所述第1容器内和所述第3容器内的第1温度低,所述分析部测定从所述第1容器内的肝细胞向所述第1容器内的所述第1缓冲液排出的成分的量、从所述第2容器内的肝细胞向所述第2容器内的所述第1缓冲液排出的所述成分的量、以及从所述第3容器内的肝细胞向所述第3容器内的所述第2缓冲液排出的所述成分的量,并且对通过所述肝细胞的转运蛋白而排出的所述成分的量、通过所述肝细胞的毛细胆管而排出的所述成分的量、以及从所述肝细胞的转运蛋白和毛细胆管以外排出的所述成分的量进行解析。
<构成2>
根据构成2记载的成分分析装置,其特征在于,进一步具有供给或回收所述多个容器内的液体的送液部,所述送液部向所述多个容器供给含有所述成分的成分溶液,在回收所述成分溶液之后向所述多个容器内供给第3缓冲液,在回收所述第3缓冲液之后向所述第1容器和所述第2容器供给所述第1缓冲液、向所述第3容器供给所述第2缓冲液,所述分析部测定从保持于所述多个培养容器的任一个之中的所述肝细胞向所述第3缓冲液内排出的成分的量。
<构成4>
根据构成3记载的成分分析装置,其特征在于,所述第3缓冲液与所述第1缓冲液为同一种缓冲液。
<构成5>
根据构成3记载的成分分析装置,其特征在于,所述温度调整部调整温度,以使得保持所述第3缓冲液时的所述多个容器中的至少一个容器内的温度比所述第1温度低。
<构成6>
根据权利要求1记载的成分分析装置,其特征在于,所述分析部测定在所述第3容器内的肝细胞内残留的所述成分的量、以及在所述第1容器或所述第2容器中的至少一个容器内的肝细胞中残留的成分的量,并且对在所述肝细胞的毛细胆管以外残留的所述成分的量进行解析。
<构成7>
一种药剂成分分析装置,其特征在于,具备:保持多个容器的保持部(所述多个容器保持吸收了药剂的肝细胞),供给所述多个容器内的液体的送液部,调整所述多个容器内的温度的温度调整部,以及测定所述多个容器内的药剂的量、并且对该测定的药剂进行解析的分析部;所述多个容器为第1容器、第2容器和第3容器;所述送液部向所述第1容器和所述第2容器供给第1缓冲液,并且向所述第3容器供给第2缓冲液(所述第2缓冲液促进所述药剂从所述肝细胞的毛细胆管排出);所述温度调整部调整温度以使得所述第2容器内的温度比所述第1容器内和所述第3容器内的温度低;所述分析部分别解析:从所述第1容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量、从所述第2容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量、从所述第3容器内的肝细胞排出到所述第2缓冲液内的所述药剂的量、
从所述肝细胞的转运蛋白排出的所述药剂的量、从所述肝细胞的毛细胆管排出的所述药剂的量、以及从所述肝细胞的转运蛋白和毛细胆管以外排出的所述成分的量。
<构成8>
一种药剂成分分析装置,其特征在于,具备:保持多个容器的保持部(所述多个容器保持吸收了药剂的肝细胞),供给或排出所述多个容器内的液体的送液部,调整所述多个容器内的温度的温度调整部,以及测定所述多个容器内的药剂的量、并且对该测定的药剂进行解析的分析部;所述送液部向所述多个容器供给所述药剂,在将所述药剂从所述多个容器排出之后供给前处理用缓冲液,在将所述前处理用缓冲液从所述多个容器回收之后向所述多个培养容器中的所述第1容器和所述第2容器供给第1缓冲液,以及向所述第3容器供给第2缓冲液(所述第2缓冲液促进所述药剂从所述肝细胞的毛细胆管排出);所述温度调整部调整温度以使得所述第2容器内的第2温度比所述第1容器内和所述第3容器内的第1温度低;
所述分析部分别解析:从所述多个容器内的肝细胞排出到所述前处理用缓冲液内的所述药剂的量,从所述第1容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量,从所述第2容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量,从所述第3容器内的肝细胞排出到所述第2缓冲液内的所述药剂的量,在对所述肝细胞进行前处理的阶段从所述肝细胞排出的所述药剂的量,从所述肝细胞的转运蛋白排出的所述药剂的量,从所述肝细胞的毛细胆管排出的所述药剂的量,以及从所述肝细胞的转运蛋白和毛细胆管以外排出的所述药剂的量。
<构成9>
根据构成8记载的药剂成分分析装置,其特征在于,所述前处理用缓冲液与所述第1缓冲液为同一种缓冲液。
<构成10>
根据构成8记载的药剂成分分析装置,其特征在于,所述温度调整部调整温度,以使得所述第1温度比保持所述前处理用缓冲液时的所述多个容器中的至少一个容器内的温度高。
<构成11>
根据构成7至10记载的药剂成分分析装置,其特征在于,所述分析部测定在所述第3容器内的肝细胞内残留的所述成分的量、以及在所述第1容器或所述第2容器中的至少一个容器内的肝细胞中残留的成分的量,并且对在所述肝细胞的毛细胆管以外残留的所述成分的量进行解析。
<构成12>
一种成分分析方法,其特征在于,包括:调温工序,调整温度以使得保持规定的细胞的第2容器内的温度比保持所述规定的细胞的第1容器内的温度低;测定工序,测定从所述第1容器内的细胞向所述第1容器内的所述第1缓冲液排出的成分的量、以及从所述第2容器内的细胞向所述第2容器内的所述第1缓冲液排出的成分的量;以及解析工序,基于由所述测定工序测定的结果,对通过所述细胞的转运蛋白而排出的所述成分的量进行解析。
<构成13>
根据构成12记载的成分分析方法,其特征在于,所述细胞为肝细胞;在保持有所述肝细胞的所述第3容器内,保持添加了规定的物质的第2缓冲液;在所述调温工序中,进行调整以使得所述第2容器内的第2温度比所述第1容器内和所述第3容器内的第1温度低;在所述测定工序中测定:从所述第1容器内的肝细胞向所述第1容器内的所述第1缓冲液排出的成分的量,从所述第2容器内的肝细胞向所述第2容器内的所述第1缓冲液排出的所述成分的量,以及从所述第3容器内的肝细胞向所述第3容器内的所述第2缓冲液排出的所述成分的量;在所述解析工序中分别解析:通过所述肝细胞的转运蛋白而排出的所述成分的量,通过所述肝细胞的毛细胆管而排出的所述成分的量,以及从所述肝细胞的转运蛋白和毛细胆管以外排出的所述成分的量。
<构成14>
根据构成13记载的成分分方法,其特征在于,在所述调温工序之前进一步包括送液工序,供给或回收包括至少所述第1容器、所述第2容器和所述第3容器的多个容器内的液体;在所述送液工序中,向所述多个容器供给含有所述成分的成分溶液,在回收所述成分溶液之后向所述多个容器内供给第3缓冲液,以及在回收所述第3缓冲液之后向所述第1容器和所述第2容器供给所述第1缓冲液、向所述第3容器供给所述第2缓冲液;在所述测定工序中,解析从保持于所述多个培养容器的至少一个中的所述肝细胞向所述第3缓冲液内排出的成分的量。
<构成15>
根据构成14记载的成分分析方法,其特征在于,所述第3缓冲液与所述第1缓冲液为同一种缓冲液。
<构成16>
根据构成14记载的成分分析方法,其特征在于,在所述调温工序之前包括前处理调温工序,调整温度以使得保持所述第3缓冲液时的所述多个容器中的至少一个容器内的温度比所述第1温度低。
<构成17>
一种药剂成分分析方法,其特征在于,包括:送液工序,向多个容器供给液体,所述多个容器保持吸收了药剂的肝细胞;调温工序,调整所述多个容器内的温度;测定工序,测定所述多个容器内的药剂的量;以及解析工序,对所述测定工序中测定的药剂进行解析。所述多个容器为第1容器、第2容器和第3容器;在所述送液工序中,向所述第1容器和所述第2容器中供给第1缓冲液,向所述第3容器供给第2缓冲液,所述第2缓冲液促进所述药剂从所述肝细胞的毛细胆管排出;在所述调温工序中,调整温度以使得所述第2容器内的温度比所述第1容器内和所述第3容器内的温度低;在所述测定工序中测定:从所述第1容器内的肝细胞排出到所述第1缓冲液内所述药剂的量,从所述第2容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量,从所述第3容器内的肝细胞排出到所述第2缓冲液内的所述药剂的量,在所述第3容器内的肝细胞内残留的所述成分的量,以及在所述第1容器或所述第2容器中的至少一个容器内的肝细胞中残留的成分的量;在所述解析工序中分别解析:从所述肝细胞的转运蛋白排出的所述药剂的量,从所述肝细胞的毛细胆管排出的所述药剂的量,从所述肝细胞的转运蛋白和毛细胆管以外排出的所述药剂的量,以及在所述肝细胞的毛细胆管以外残留的所述成分的量。
<构成18>
一种药剂成分分析方法,其特征在于,具备:送液工序,供给或排出多个容器内的液体,所述多个容器保持吸收了药剂的肝细胞;调温工序,调整所述多个容器内的温度;测定工序,测定所述多个容器内的药剂的量;以及解析工序,对由所述测定工序测定的药剂进行解析,在所述送液工序中,向所述多个容器供给所述药剂,在将所述药剂从所述多个容器排出之后供给前处理用缓冲液,在将所述前处理用缓冲液从所述多个容器回收之后向所述多个培养容器中的所述第1容器和所述第2容器供给第1缓冲液、向所述第3容器供给第2缓冲液,所述第2缓冲液促进所述药剂从所述肝细胞的毛细胆管排出;在所述调温工序中,调整温度以使得所述第2容器内的第2温度比所述第1容器内和所述第3容器内的第1温度低;在所述测定工序中测定:从所述多个容器内的肝细胞排出到所述前处理用缓冲液内的所述药剂的量,从所述第1容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量,从所述第2容器内的肝细胞排出到所述第1缓冲液内的所述药剂的量,从所述第3容器内的肝细胞排出到所述第2缓冲液内的所述药剂的量,在所述第3容器内的肝细胞内残留的所述成分的量,以及在所述第1容器或所述第2容器中的至少一个容器内的肝细胞中残留的成分的量;在所述解析工序中分别解析:在对所述肝细胞进行前处理的阶段从所述肝细胞排出的所述药剂的量,从所述肝细胞的转运蛋白排出的所述药剂的量,从所述肝细胞的毛细胆管排出的所述药剂的量,从所述肝细胞的转运蛋白和毛细胆管以外排出的所述药剂的量,以及在所述肝细胞的毛细胆管以外残留的所述成分的量。
<构成19>
根据构成18记载的成分分析方法,其特征在于,所述前处理用缓冲液与所述第1缓冲液为同一种缓冲液。
<构成20>
根据权利要求18记载的药剂成分分析方法,其特征在于,在所述调温工序之前包括前处理调温工序,调整温度以使得所述第1温度比保持所述前处理用缓冲液时的所述多个容器中的至少一个容器内的温度高。
- 还没有人留言评论。精彩留言会获得点赞!