免疫测定对照及其使用方法与流程
本专利申请要求于2016年3月7日提交的申请号为62/304,762的美国临时专利申请以及于2016年6月6日提交的申请号为62/346,347的美国临时专利申请的优先权,其全部内容(包括所有表格、附图以及权利要求)通过引用并入本申请。
本发明涉及使用测定法,特别是免疫测定法,以及在某些实施方案中,使用免疫色谱测定法测量分析物的量的方法和组合物。
背景技术:
仅提供以下对本发明背景的讨论以帮助读者理解本发明,并且不承认其描述或构成本发明的现有技术。
由于它们的简单性、相对准确性、快速结果报告和用户友好性、特异性结合测定,特别是免疫测定,在诊断工业中经历了巨大的增长。这种技术已被广泛用于怀孕和妇女的健康测定、心脏和紧急情况监测和测试、传染病,包括病毒筛查、癌症标记筛查和滥用药物测试。然而,与任何实验室技术一样,这种测定中的每个观察法不仅是目标分析物的函数,而且是多个变异源的函数,其卷积结果。这些变异来源于生物和技术因素。生物因素包括样品基质的性能,个体患者的特征,以及测试中使用的生物分子(例如抗体)的特征。技术因素,例如装置变化、温度、测试系统随时间的降解等,与涉及的生物因素相结合,以影响测定的精确度、灵敏度、再现性和特异性。在侧向流动测定的情况下,流体通过侧向流动膜的流动以及流体样品的粘性和其他因素可能有助于限制测定的性能。
已有减轻这些卷积因素影响的策略。例如,采用阻断策略来防止非特异性结合的混杂效应。另外,执行数据的标准化以消除由技术因素引入的不希望的系统方差。美国专利5,356,782、5,753,517、7,691,595和7,713,703描述了包括测定对照的各种测定平台,其试图对免疫测定数据进行解卷积。通过从数据中对生物和技术效果的解卷积,可以获得更准确的测试结果。
技术实现要素:
本发明的一个目的是提供用于设计免疫测定对照的组合物和方法。
在各个方面,本发明提供了合成肽,其包含序列cprrpyil(seqidno:1)或其类似物(下文定义为“cprrpyil肽”);结合cprrpyil肽的特异性结合试剂;生产这种试剂的方法;以及利用这些试剂的测定以提供与分析物或目标分析物的测量无关的测定对照信号,这是因为分析物测定中使用的试剂不会对对照信号产生影响。在某些方面,特异性结合试剂与cprrpyil肽的结合用于标准化或以其他方式调节测定结果。
在各个方面,本发明还提供了合成肽,其包含序列elaglgfaelqc(seqidno:4)或其类似物(下文定义为“elaglgfaelqc肽”);结合elaglgfaelqc肽的特异性结合试剂;生产这种试剂的方法;以及利用这些试剂的测定以提供与分析物或目标分析物的测量无关的测定对照信号,这是因为分析物测定中使用的试剂不会对对照信号产生影响。在某些方面,特异性结合试剂与elaglgfaelqc肽的结合用于标准化或以其他方式调节测定结果。
在各个方面,本发明还提供了合成肽,其包含序列cdwrknidal(seqidno:8)或其类似物(下文定义为“cdwrknidal肽”);结合cdwrknidal肽的特异性结合试剂;生产这种试剂的方法;以及利用这些试剂的测定以提供与分析物或目标分析物的测量无关的测定对照信号,这是因为分析物测定中使用的试剂不会对对照信号产生影响。在某些方面,特异性结合试剂与cdwrknidal肽的结合用于标准化或以其他方式调节测定结果。
在第一方面,本发明提供:
(a)包含seqidno:1的合成肽;
(b)合成肽,其包含与seqidno:1在8个连续残基上至少87.5%同源的序列;
(c)特异性结合(a)和/或(b)的合成肽的特异性结合试剂(例如抗体)
(d)固相,其包含固定在其表面上的(a)和/或(b)的合成肽;以及
(e)固相,其包含固定在其表面上的(c)的特异性结合试剂;
(f)与(a)和/或(b)的合成肽缀合的可检测标记;和/或
(g)与(c)的特异性结合试剂缀合的可检测标记。
在相关方面,本发明提供了一种用于检测样品中至少一种分析物的测定装置,包括:
基质,其限定至少一个诊断道;
基质上的样品施加区,用于接收样品;
基质上的干试剂区流体连接到样品施加区;
基质上的检测区包括至少一个控制区和至少一个测定区,检测区流体连接到样品施加区,并且样品施加区使得施加到样品施加区的样品在到达检测区之前流过干试剂区;
其中,至少一个对照区包含对cprrpyil肽具有结合特异性的特异性结合试剂(例如抗体),并且其中,干试剂区包含cprrpyil肽,或者
其中,至少一个对照区包含cprrpyil肽,并且其中,干试剂区包含对cprrpyil肽具有结合特异性的特异性结合试剂(例如,抗体)。
在各种实施例中,
(i)对照区或干试剂区包含特异性结合包含序列cprrpyil(seqidno:1)的合成肽的抗体(cysproargargprotyrlleleu;seqidno:1);
(ii)干试剂区或对照区包含合成肽,其包含序列cprrpyil(seqidno:1)的合成肽(cysproargargprotyrlleleu;seqidno:1);
(iii)合成肽是cprrpyil;
(iv)特异性结合试剂选自以下组从而特异性地结合seqidno:1:单克隆抗体、多克隆抗体、fab片段、fab2片段、fv片段、scfv片段或以上的其它肽片段;
(v)cprrpyil肽与表位序列缀合或以肽键与表位序列结合,所述表位序列包括心肌肌钙蛋白i的表位、脑利钠肽的表位、胎盘生长因子的表位、可溶性fms如酪氨酸的表位和/或内皮糖蛋白的表位。
(vi)cprrpyil肽已与可检测标记组合,其中可检测标记优选为酶、金属溶胶颗粒、乳胶颗粒、易感磁性颗粒、最优选地为荧光标记的乳胶颗粒;和/或
(vii)干试剂区或对照区包含已与可检测标记组合的抗体,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选地为荧光标记的乳胶颗粒。
另一方面,本发明提供了一种标准化特异性结合(例如免疫测定)的测定结果的方法,包括:
提供如段落[0010]或[0011]中所述的测定装置;
将样品施加于样品施加区;
在样品和掺入试剂区的试剂之间形成在试剂区内的混合物;
沿着诊断道流动样品试剂混合物;
检测由于在对照区的样品试剂混合物的成分的相互作用引起的响应;
检测由于在测定区的样品试剂混合物的成分的相互作用引起的响应;以及
基于在对照区获得的响应调制测定区的响应。
在该方法的各种实施例中,
(i)由于试剂区中掺入试剂,对照区的响应独特地发生;
(ii)由于样品的成分,未发生对照区的响应;和/或
(iii)基于对照区的响应,增加或减少测定区的响应。
在又一方面,本发明提供了一种装置,包括:
基质,其限定至少一个诊断道;
样品施加区;
干试剂区;
检测区,其包括组合的对照区和组合的测定区;
其中,组合的测定区和对照区包含对cprrpyil肽具有结合特异性的第一特异性结合试剂(例如抗体)和对目标分析物特异的第二特异性结合试剂。
在各种实施例中,该装置进一步定义如下:
(i)第一特异性结合试剂是特异性地结合包含序列seqidno:1的肽的抗体,其中,肽优选为cprrpyil(seqidno:1);
(ii)干试剂区或组合的测定区和对照区包含含有序列seqidno:1的肽,其中,肽优选为cprrpyil(seqidno:1);
(iii)特异性结合试剂选自以下组从而特异性地结合seqidno:1:单克隆抗体、多克隆抗体、fab片段、fab2片段、fv片段、scfv片段或以上的其它肽片段;
(iv)干试剂区或组合的测定和对照区包含已与可检测标记组合的肽,其中,可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,并且最优选为荧光标记的胶乳颗粒;
(v)干试剂区或对照区包含已与可检测标记组合的抗体,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选地为荧光标记的乳胶颗粒。
另一方面,本发明提供了一种标准化特异性结合(例如免疫测定)的测定结果的方法,包括:
提供如段落[0014]或[0015]中所述的装置,其中,cprrpyil肽与表位序列缀合或以肽键与表位序列结合,该表位序列包含心肌肌钙蛋白i的表位、脑利钠肽的表位、胎盘生长因子的表位、可溶性fms如酪氨酸的表位和/或内皮糖蛋白的表位;
将样品施加到样品施加区;
在样品、荧光标记颗粒和cprrpyil肽之间形成在试剂区内的混合物,从而目标分析物和cprrpyil肽都被荧光标记颗粒上的特异性结合试剂结合;
沿着诊断道流动样品试剂混合物;
检测由于存在于cprrpyil肽上的seqidno:1的表位与固定在对照区的抗体的相互作用引起的响应;
检测由于目标分析物的表位与固定在测定区的抗体相互作用引起的响应;以及
基于在对照区获得的响应调制测定区的响应。
在该方法的各种实施例中,
(i)由于cprrpyil肽,对照区的响应独特地发生;
(ii)由于样品的成分,未发生对照区的响应;
(iii)基于对照区的响应,增加或减少测定区确定的响应。
(iv)cprrpyil肽由cprrpyil(seqidno:1)和目标分析物特有的肽序列组成。
另一方面,本发明提供:
(a)包含seqidno:4的合成肽;
(b)合成肽,其包含与seqidno:4在8个连续残基上至少87.5%同源的序列;
(c)特异性地结合(a)和/或(b)的合成肽的特异性结合试剂(例如抗体);
(d)固相,其包含固定在其表面上的(a)和/或(b)的合成肽;以及
(e)固相,其包含固定在其表面上的(c)的特异性结合试剂;
(f)与(a)和/或(b)的合成肽缀合的可检测标记;和/或
(g)与(c)的特异性结合试剂缀合的可检测标记。
在相关方面,本发明提供了一种用于检测样品中至少一种分析物的测定装置,包括:
基质,其限定至少一个诊断道;
基质上的样品施加区,用于接收样品;
基质上的干试剂区流体连接到样品施加区;
基质上的检测区包括至少一个对照区和至少一个测定区,检测区流体连接到样品施加区,并且样品施加区使得施加到样品施加区的样品在到达检测区之前流过干试剂区;
其中至少一个对照区包含对elaglgfaelqc肽具有结合特异性的特异性结合试剂(例如抗体),并且其中干试剂区包含elaglgfaelqc肽,或者
其中至少一个对照区包含elaglgfaelqc肽,并且其中干试剂区包含对elaglgfaelqc肽具有结合特异性的特异性结合试剂(例如抗体)。
在各种实施例中,
(i)对照区或干试剂区包含特异性地结合包含序列elaglgfaelqc(seqidno:4)的合成肽的抗体;
(ii)干试剂区或对照区包含含有序列elaglgfaelqc(seqidno:4)的合成肽;
(iii)合成肽是elaglgfaelqc;
(iv)特异性结合试剂选自以下组从而特异性地结合seqidno:4:单克隆抗体、多克隆抗体、fab片段、fab2片段、fv片段、scfv片段或以上的其它肽片段;
(v)elaglgfaelqc肽与表位序列缀合或以肽键与表位序列结合,表位序列包括心肌肌钙蛋白i的表位、脑利钠肽的表位、胎盘生长因子的表位、可溶性fms如酪氨酸的表位和/或内皮糖蛋白的表位。
(vi)elaglgfaelqc肽已与可检测标记组合,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选为荧光标记的胶乳颗粒;和/或
(vii)干试剂区或对照区包含已与可检测标记组合的抗体,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选为荧光标记的乳胶颗粒。
另一方面,本发明提供了一种标准化特异性结合(例如免疫测定)的测定结果的方法,包括:
提供如段落[0019]或[0020]中所述的测定装置;
将样品施加于样品施加区;
在样品和掺入试剂区的试剂之间形成在试剂区内的混合物;
沿着诊断道流动样品试剂混合物;
检测由于在对照区的样品试剂混合物的成分的相互作用引起的响应;
检测由于在测定区的样品试剂混合物的成分的相互作用引起的响应;以及
基于在对照区获得的响应调制测定区的响应。
在该方法的各种实施例中,
(i)由于试剂区中掺入试剂,对照区的响应独特地发生;
(ii)由于样品的成分,未发生对照区的响应;和/或
(iii)基于对照区的响应,增加或减少测定区的响应。
在又一方面,本发明提供了一种装置,包括:
基质,其限定至少一个诊断道;
样品施加区;
干试剂区;
检测区,其包括组合的测定区和对照区;
其中,组合的测定区和对照区包含对elaglgfaelqc肽具有结合特异性的第一特异性结合试剂(例如抗体)和对目标分析物特异的第二特异性结合试剂。
在各种实施例中,该设备进一步定义如下:
(i)第一特异性结合试剂是特异性地结合包含序列seqidno:4的肽的抗体,其中肽优选为elaglgfaelqc(seqidno:4);
(ii)干试剂区或组合的测定区和对照区包含含有序列seqidno:4的肽,其中肽优选为elaglgfaelqc(seqidno:4);
(iii)特异性结合试剂选自以下组从而特异性地结合seqidno:4:单克隆抗体、多克隆抗体、fab片段、fab2片段、fv片段、scfv片段或以上的其它肽片段;
(iv)干试剂区或组合的测定和对照区包含已与可检测标记组合的肽,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,并且最优选为荧光标记的胶乳颗粒;
(v)干试剂区或对照区包含已与可检测标记组合的抗体,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选为荧光标记的乳胶颗粒。
另一方面,本发明提供了一种标准化特异性结合(例如免疫测定)的测定结果的方法,包括:
提供如段落[0023]或[0024]中所述的装置,其中elaglgfaelqc肽与表位序列缀合或以肽键与表位序列结合,该表位序列包含心肌肌钙蛋白i的表位、脑利钠肽的表位、胎盘生长因子的表位、可溶性fms如酪氨酸的表位和/或内皮糖蛋白的表位;
将样品施加于样品施加区;
在样品、荧光标记颗粒和elaglgfaelqc肽之间形成在试剂区内的混合物,由此目标分析物和elaglgfaelqc肽都被荧光标记颗粒上的特异性结合试剂结合;
沿着诊断道流动样品试剂混合物;
检测由于elaglgfaelqc肽上存在的seqidno:4的表位与固定在对照区的抗体相互作用引起的响应;
检测由于目标分析物的表位与固定在测定区的抗体相互作用引起的响应;以及
基于在对照区获得的响应调制测定区的响应。
在该方法的各种实施例中,
(i)由于elaglgfaelqc肽,对照区的响应独特地发生;
(ii)由于样品的成分,未发生对照区的响应;
(iii)基于对照区的响应,增加或减少测定区确定的响应;以及
(iv)elaglgfaelqc肽由elaglgfaelqc(seqidno:4)和目标分析物特有的肽序列组成。
另一方面,本发明提供:
(a)包含seqidno:8的合成肽;
(b)合成肽,其包含与seqidno:8在8个连续残基上至少87.5%同源的序列;
(c)特异性地结合(a)和/或(b)的合成肽的特异性结合试剂(例如抗体);
(d)固相,其包含固定在其表面上的(a)和/或(b)的合成肽;以及
(e)固相,其包含固定在其表面上的(c)的特异性结合试剂;
(f)与(a)和/或(b)的合成肽缀合的可检测标记;和/或
(g)与(c)的特异性结合试剂缀合的可检测标记。
在相关方面,本发明提供了一种用于检测样品中至少一种分析物的测定装置,包括:
基质,其限定至少一个诊断道;
基质上的样品施加区,用于接收样品;
基质上的干试剂区流体连接到样品施加区;
基质上的检测区包括至少一个对照区和至少一个测定区,检测区流体连接到样品施加区,并且样品施加区使得施加到样品施加区的样品在到达检测区之前流过干试剂区;
其中至少一个对照区包含对cdwrknidal肽具有结合特异性的特异性结合试剂(例如抗体),并且其中干试剂区包含cdwrknidal肽,或者
其中至少一个对照区包含cdwrknidal肽,并且其中干试剂区包含对cdwrknidal肽具有结合特异性的特异性结合试剂(例如抗体)。
在各种实施例中,
(i)对照区或干燥试剂区包含特异性地结合包含序列cdwrknidal(seqidno:8)的合成肽的抗体;
(ii)干试剂区或对照区包含含有序列cdwrknidal(seqidno:8)的合成肽;
(iii)合成肽是cdwrknidal;
(iv)特异性结合试剂选自以下组从而特异性地结合seqidno:8:单克隆抗体、多克隆抗体、fab片段、fab2片段、fv片段、scfv片段或以上的其它肽片段;
(v)cdwrknidal肽与表位序列缀合或以肽键与表位序列结合,表位序列包括心肌肌钙蛋白i的表位、脑利钠肽的表位、胎盘生长因子的表位、可溶性fms如酪氨酸的表位和/或内皮糖蛋白的表位。
(vi)cdwrknidal肽已与可检测标记组合,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选为荧光标记的胶乳颗粒;和/或
(vii)干试剂区或对照区包含已与可检测标记组合的抗体,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选为荧光标记的乳胶颗粒。
另一方面,本发明提供了一种标准化特异性结合(例如免疫测定)的测定结果的方法,包括:
提供如段落[0028]或[0029]中所述的测定装置;
将样品施加于样品施加区;
在样品和掺入试剂区的试剂之间形在成试剂区内的混合物;
沿着诊断道流动样品试剂混合物;
检测由于在对照区的样品试剂混合物的成分的相互作用引起的响应;
检测由于在测定区的样品试剂混合物的成分的相互作用引起的响应;以及
基于在对照区获得的响应调制测定区的响应。
在该方法的各种实施例中,
(i)由于试剂区中掺入试剂,对照区的响应独特地发生;
(ii)由于样品的成分,未发生对照区的响应;和/或
(iii)基于对照区的响应,增加或减少测定区的响应。
在又一方面,本发明提供了一种装置,包括:
基质,其限定至少一个诊断道;
样品施加区;
干试剂区;
检测区,其包括组合的测定区和对照区;
其中,组合的测定区和对照区包含对cdwrknidal肽具有结合特异性的第一特异性结合试剂(例如抗体)和对目标分析物特异的第二特异性结合试剂。
在各种实施例中,该装置进一步定义如下:
(i)第一特异性结合试剂是特异性地结合包含序列seqidno:8的肽的抗体,其中肽优选为cdwrknidal(seqidno:8);
(ii)干试剂区或组合的测定区和对照区包含含有序列seqidno:8的肽,其中肽优选为cdwrknidal(seqidno:8);
(iii)特异性结合试剂选自以下组从而特异性地结合seqidno:8:单克隆抗体、多克隆抗体、fab片段、fab2片段、fv片段、scfv片段或以上的其它肽片段;
(iv)干试剂区或组合的测定和对照区包含已与可检测标记组合的肽,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,并且最优选为荧光标记的胶乳颗粒;
(v)干试剂区或对照区包含已与可检测标记组合的抗体,其中可检测标记优选为酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒,最优选为荧光标记的乳胶颗粒。
另一方面,本发明提供了一种标准化特异性结合(例如免疫测定)的测定结果的方法,包括:
提供如段落[0032]或[0033]中所述的装置,其中cdwrknidal肽与表位序列缀合或以肽键与表位序列结合,该表位序列包含心肌肌钙蛋白i的表位、脑利钠肽的表位、胎盘生长因子的表位、可溶性fms如酪氨酸的表位和/或内皮糖蛋白的表位;
将样品施加于样品施加区;
在样品、荧光标记颗粒和cdwrknidal肽之间形成在试剂区内的混合物,由此目标分析物和cdwrknidal肽都被荧光标记颗粒上的特异性结合试剂结合;
沿着诊断道流动样品试剂混合物;
检测由于cdwrknidal肽上存在的seqidno:8的表位与固定在对照区的抗体相互作用引起的响应;
检测由于目标分析物的表位与固定在测定区的抗体相互作用引起的响应;以及
基于在对照区获得的响应调制测定区的响应。
在该方法的各种实施例中,
(i)由于cdwrknidal肽,对照区的响应独特地发生;
(ii)由于样品的成分,未发生对照区的响应;
(iii)基于对照区的响应,增加或减少测定区确定的响应;以及
(iv)cdwrknidal肽由cdwrknidal(seqidno:8)和目标分析物特有的肽序列组成。
技术人员将认识到本文所述的cprrpyil肽及其对应的抗体,本文所述的elaglgfaelqc肽及其对应的抗体,以及本文所述的cdwrknidal肽及其对应的抗体也可以在同一装置内一起被使用。因此,在某些方面,本发明提供了一种装置,包括:
基质,其限定至少一个诊断道;
样品施加区;
干试剂区;以及
检测区包括至少一个对照区和至少一个测定区;
其中a-f中的一个或多个为真:
(a)至少一个对照区包含特异性地结合具有与seqidno:1至少87.5%同源的序列的肽的抗体,并且其中,干试剂区包含与seqidno:1具有87.5%同源性的肽,或者
(b)至少一个对照区包含与seqidno:1具有87.5%同源性的肽,并且其中,干试剂区包含特异性地结合具有与seqidno:1至少87.5%同源的序列的肽的抗体,或者
(c)至少一个对照区包含特异性地结合具有与seqidno:4至少87.5%同源的序列的肽的抗体,并且其中,干试剂区包含与seqidno:4具有87.5%同源性的肽,或者
(d)至少一个对照区包含与seqidno:4具有87.5%同源性的肽,并且其中,干试剂区包含特异性地结合具有与seqidno:4至少87.5%同源的序列的肽的抗体,或者
(e)至少一个对照区包含特异性地结合具有与seqidno:8至少87.5%同源的序列的肽的抗体,并且其中,干试剂区包含与seqidno:8具有87.5%同源性的肽,或者
(f)至少一个对照区包含与seqidno:8具有87.5%同源性的肽,并且其中,干试剂区包含特异性地结合具有与seqidno:8至少87.5%同源的序列的肽的抗体。
在某些实施例中,(a)和(b)中的至少一个为真,(c)和(d)中的至少一个为真,并且(e)和(f)中的至少一个为真。
在某些实施例中,特异性地结合具有与seqidno:1至少87.5%同源的序列的肽的抗体是特异性地结合具有序列cprrpyil(seqidno:1)的肽的抗体,优选地,具有与seqidno:1至少87.5%同源的序列的肽是包含seqidno:1的肽。最优选地,该肽由seqidno:1组成。
在某些实施例中,特异性地结合具有与seqidno:4至少87.5%同源的序列的肽的抗体是特异性地结合具有序列elaglgfaelqc(seqidno:4)的肽的抗体,优选地,具有与seqidno:4至少87.5%同源的序列的肽是包含seqidno:4的肽。最优选地,该肽由seqidno:4组成。
在某些实施例中,特异性地结合具有与seqidno:8至少87.5%同源的序列的肽的抗体是特异性地结合具有序列cdwrknidal(seqidno:8)的肽的抗体,优选地,具有与seqidno:8至少87.5%同源的序列的肽是包含seqidno:8的肽。最优选地,该肽由seqidno:8组成。
干试剂区或对照区可包括已与可检测标记组合的肽或抗体。可检测标记可以是酶、金属溶胶颗粒、胶乳颗粒、易感磁性颗粒或荧光标记的乳胶颗粒。根据以下详细说明、示例性实施例和权利要求,本发明的其他实施例将是显而易见的。
附图说明
图1描绘了本发明的示例性测定装置。
具体实施方式
本发明涉及使用测定,特别是免疫测定,以及在某些实施例中为免疫色谱测定法测量分析物的量的方法和组合物。特别地,本发明涉及其中提供对照的测定,其使用与测量分析物或目标分析物无关的特异性结合试剂。这些特异性结合试剂与具有序列cprrpyil(seqidno:1)或其类似物的肽(本文统称为“cprrpyil肽”)结合;与具有序列elaglgfaelqc(seqidno:4)或其类似物的肽(本文中统称为“elaglgfaelqc肽”)结合;或与具有序列cdwrknidal(seqidno:8)或其类似物的肽(本文统称为“cdwrknidal肽”)结合。如下文所述,特异性结合试剂与cprrpyil肽、elaglgfaelqc肽或cdwrknidal肽的结合用于标准化或以其他方式调制测定结果。
为清楚起见,提供了关于本发明化合物的以下术语的定义。
如本文所用,“测定”是指用于分析样品以确定一种或多种分析物的存在、不存在或数量的体外程序。本发明的测定通常利用分析物和至少一种特异性地结合分析物的分析物结合剂。分析物和分析物结合剂是特定“结合对”的构件,其中结合对的第一构件(例如,分析物)与第二构件(例如结合剂)特异性地反应。结合对的一个或两个构件可以是抗体。例如,结合对的第一构件(例如,目标分析物)可以是抗体,结合对的第二构件(例如,结合剂)可以是抗免疫球蛋白抗体;或者,结合对的第一构件(例如,分析物)可以是抗原,结合对的第二构件(例如,结合剂)可以是抗体(在本文称为“免疫测定”)。
在一个优选的实施例中,该测定是“夹心”测定,这是对分析物的测试,其中用来测定分析物的存在或不存在,或分析物的数量的流体样品与第一分析物结合剂接触,和与第二分析物结合剂接触,第一分析物结合剂与分析物结合(例如抗体),第二分析物结合剂也与分析物结合。检测分析物和两种结合试剂的“夹心”复合物。通常以这种形式,一种抗体被可检测地标记,而另一种抗体与固相结合。
术语“侧向流动测定”是指将样品施加到侧向流动基质的测定形式。样品沿着侧向流动基质流动,并且样品中待检测的一种或多种分析物成分与至少一种试剂反应,所述试剂被提供在侧向流动基质中或被添加到侧向流动基质中。通常将至少一种试剂固定在装置中以与待检测的分析物成分或其试剂反应,并且通常使用标记物以测量与固定化试剂的反应程度。参见,例如,美国专利和专利申请公开:5,602,040;5,622,871;5,656,503;6,187,598;6,228,660;6,818,455;2001/0008774;2005/0244986;6,352,862;2003/0207465;2003/0143755;2003/0219908;5,714,389;5,989,921;6,485,982;11/035,047;5,656,448;5,559,041;5,252,496;5,728,587;6,027,943;6,506,612;6,541,277;6,737,277b1;5,073,484;5,654,162;6,020,147;4,956,302;5,120,643;6,534,320;4,942,522;4,703,017;4,743,560;5,591,645以及re38,430。侧向流动测定装置可包括壳体,该壳体具有样品端口和样品端口下游的结果窗口,并且可选地,在结果窗口下游具有对照窗口。样品端口适于接收一定量的流体缓冲液或施加于其上的样品,其经由壳体内的侧向流动基质横穿侧向流动路径,从样品端口延伸到下游位置。壳体可以由任何合适的材料形成,其示例包括模制塑料,并且优选地足够刚性以为侧向流动路径或容纳在其中的路径提供支撑和稳定性,粘合剂可以被组装在壳体表面上,其中粘合剂面向侧向流动基质以有助于将侧向流动基质保持在壳体内的适当位置。
在本发明测定的某些实施例中,一种或多种结合剂不是抗体:例如,结合对的第一构件可以是配体,结合对的第二构件可以是受体;或者,结合对的第一构件可以是凝集素,结合对的第二构件可以是糖。在另一个实施例中,结合对的第一构件可以是核酸(例如dna、rna),结合对的第二构件可以是与结合对的第一构件特异性地杂交的核酸。无论分析物和结合剂的组合物如何,这两种成分仍形成特异性结合对,其中第一构件与第二构件特异性地反应。结合对的构件之间的特异性相互作用表明结合对的第一构件优先结合或以其他方式与结合对的第二构件相互作用,优选地排除与测定中的另一种化合物的任何结合。
如本文所用,术语“分析物”或“目标分析物”是指将测量其量的分子或化合物。分析物的示例包括孢子;蛋白质,如激素或酶;糖蛋白;肽;小分子;多糖;抗体;核酸;药物;毒素(例如环境毒素);病毒或病毒颗粒;细胞壁的一部分;以及其他化合物。在一个优选的实施例中,分析物是“免疫原性的”,其表明抗体(如下所述)可以被提升至分析物,或提升至与载体结合的分析物(例如,半抗原-载体缀合物,其抗体可以被提升至半抗原)。在一些代表性实施例中,目标分析物可以是肌红蛋白;ck-mb;肌钙蛋白i;psa;地高辛;茶碱;激素(例如t-3或t-4);滥用药物(lsd、thc、巴比妥类药物等);或炭疽芽孢杆菌(炭疽)的孢子。目标分析物可以是流体样品;或者,目标分析物可以是干燥的(非流体)样品(例如,固体,例如颗粒样品、粉末样品或土壤样品)。
在某些实施例中,测定流体样品的目标分析物的存在或不存在或数量。流体可以是润湿膜材料的流体;其支持目标分析物和分析物结合剂之间的反应,例如抗体/抗原反应(即,不干扰抗体/抗原相互作用);并且其粘性足够低以允许通过毛细管作用移动流体。在优选的实施例中,流体是水溶液(例如体液)。流体样品可以是具有相对较少成分的流体,例如含有目标分析物的水溶液;或者,流体样品可以是具有许多成分的流体,例如复杂的环境样品(例如,污水、废水、地下水或其他水样品),或复杂的生物流体(例如,全血、血浆、血清、尿液、脑脊液、唾液、精液、玻璃体液、滑液或其他生物流体)。在流体是生物流体的优选实施例中,流体是全血、血浆或血清。如果需要,可以稀释流体样品;例如,如果使用复杂的生物流体作为流体样品,可以用溶液(例如水溶液)稀释。
如本文所用的术语“抗体”是指衍生自、模拟或基本上由免疫球蛋白基因或其免疫球蛋白基因或其片段编码的肽或多肽,其能够特异性地结合抗原或表位。参见,例如,fundamentalimmunology,第3版,w.e.paul,ed.,ravenpress,n.y(1993);wilson(1994;j.immunol.methods175∶267-273;yarmush(1992)j.biochem.biophys.methods25:85-97。术语抗体包括抗原结合部分,即保留结合抗原能力的“抗原结合位点”(例如,片段、子序列、互补性决定区(cdr)),其包括:(i)fab片段,由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab′)2片段、包含两个fab片段的二价片段,所述fab片段在铰链区通过二硫键连接;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段,(v)dab片段(wardetal.,(1989)nature341:544-546),其由vh结构域组成;以及(vi)分离的互补性决定区(cdr)。单链抗体也包括在术语“抗体”中作为参考。
如本文所用的术语“多肽”是指具有通过肽键连接的氨基酸序列的分子。该术语包括蛋白质、融合蛋白、寡肽、环肽和多肽衍生物。以上在单独的部分中讨论了抗体和抗体衍生物,但出于本发明的目的,抗体和抗体衍生物被视为多肽和衍生物的亚类。术语蛋白质是指从天然来源分离的多肽,或使用重组dna技术从分离的cdna产生的多肽,并且具有长度为至少约200个氨基酸的氨基酸序列。
本文所用的术语“肽”是指70个氨基酸或更少,更优选是50个氨基酸或更少,更优选是25个氨基酸或更少,最优选是12个氨基酸或更少的多肽。“合成肽”是指通过体外或重组方法合成的肽,与通过表达和加工生物体内源基因而获得的肽相反。
本文所用的术语“核酸”应该通用于多脱氧核糖核苷酸(含有2′-脱氧-d-核糖或其修饰形式)、多核糖核苷酸(含有d-核糖或其修饰形式),以及任何其他类型的多核苷酸,它是嘌呤或嘧啶碱基的n-糖苷,或修饰的嘌呤或嘧啶碱基。
如本文所用的术语“适体”是单链或双链寡脱氧核糖核苷酸、寡核糖核苷酸或特异性地结合和改变目标分子的生物功能的修饰衍生物。目标分子定义为蛋白质、肽及其衍生物。适体能够在生理条件下结合目标分子。适体效应与反义效应的区别在于,通过与蛋白质、肽及其衍生物结合诱导了适体效应,并且不是通过在生理条件下与核酸的相互作用或结合诱导的。
如本文所用的术语“多糖”是指包含多于10个糖苷键连接的单糖残基的分子,而术语“寡糖”是指包含2-10个糖苷键连接的单糖残基的分子。
术语“小分子”包括分子量小于约5,000道尔顿(da),优选小于约2,500da,更优选小于1,000da,最优选小于约500da的任何分子。
cprrpyil肽
如本文所述,特异性结合试剂与cprrpyil肽的结合用于标准化或以其他方式调制测定结果。术语“cprrpyil肽”在本文中用于指包含序列cprrpyil(seqidno:1)的合成肽,和在连续的8个残基段上与序列cprrpyil(seqidno:1)具有至少87.5%同源性的一种或多种合成肽。属于cprrpyil肽定义内的该序列的类似物的示例是序列kprrpyil(seqidno:5),其代表人神经降压素(swiss-protp30990)的残基156-163(seqidno:3):
elaglgfaelqc肽
如本文所述,特异性结合试剂与elaglgfaelqc肽的结合用于标准化或以其他方式调制测定结果。术语“elaglgfaelqc肽”在本文中用于指包含序列elaglgfaelqc(seqidno:4)的合成肽,以及在连续的8个残基段上与elaglgfaelqc序列(seqidno:4)具有至少87.5%同源性的一种或多种合成肽。属于elaglgfaelqc肽定义内的该序列的类似物的示例是序列elaglgfaelqd(seqidno:6),其代表来自心肌的肌钙蛋白i(swiss-protp19429)的残基84-95(seqidno:7):
cdwrknidal肽
如本文所述,特异性结合试剂与cdwrknidal肽的结合用于标准化或以其他方式调制测定结果。术语“cdwrknidal肽”在本文中用于指包含序列cdwrknidal(seqidno:8)的合成肽,以及在连续的8个残基段上与序列cdwrknidal(seqidno:8)具有至少87.5%的同源性的一种或多种合成肽。属于cdwrknidal肽定义内的该序列的类似物的示例是序列gdwrknidal(seqidno:9),其代表来自心肌的人肌钙蛋白i的残基189-198(swiss-protp19429)(seqidno:7):
本发明的cprrpyil肽、elaglgfaelqc肽和cdwrknidal肽可用于产生抗体。使用合成肽免疫的优点是可以使用无限量的纯稳定抗原。该方法涉及合成短肽序列,将它们与大载体分子联接,并使用肽-载体分子免疫选择的动物。抗体的性能取决于一级序列信息。通常可以通过仔细选择序列和联接方法产生对所需肽的良好响应。大多数联接方法依赖于氨基酸中的反应性官能团,例如-nh2、-cooh、-sh和酚-oh。以下描述示例性的联接方法。
本发明的小分子例如cprrpyil肽、elaglgfaelqc肽和cdwrknidal肽通常不具有免疫原性,即使在佐剂存在下给药也是如此。为了产生对这些化合物的免疫响应,通常需要将它们附着到蛋白质或其他化合物(称为载体)上,该化合物具有免疫原性。当附着于载体蛋白时,小分子免疫原被称为半抗原。半抗原还与载体蛋白缀合,用于免疫测定。载体蛋白提供了将半抗原连接到固体支持物如微量滴定板或硝酸纤维素膜上的方法。当与琼脂糖连接时,它们可用于纯化抗半抗原抗体。它们还可以用于产生能够形成大抗原-抗体复合物的多价抗原。当选择载体蛋白时,请记住动物会形成载体蛋白以及附着的半抗原的抗体。因此,选择与可能在测定样品中发现的蛋白质无关的免疫载体蛋白是重要的。如果半抗原被缀合用于免疫和测定,则两种载体蛋白应尽可能不同。这允许使用抗血清而不必将抗半抗原抗体与抗载体抗体分离。
匙孔血蓝蛋白(keyholelimpethemocyanin,klh)是一种在软体动物中发现的呼吸蛋白。其大尺寸使其具有非常好的免疫原性,并且可用于缀合的大量赖氨酸残基使其非常适用作小肽例如本发明的cprrpyil肽的载体。哺乳动物和软体动物之间的系统发育分离增加了免疫原性并降低了抗klh载体的抗体与哺乳动物样品中天然存在的蛋白质之间交叉反应的风险。
结合试剂
优选地,选择在测定中使用的抗体或其他结合配偶体,其特异性地结合目标标记物,在这种情况下为cprrpyil肽,并且不结合可能存在于样品中的某些不需要的非目标分子。术语“特异性地结合”并不意味着抗体/结合配偶体仅与其预期目标结合。相反,如果抗体/结合配偶体对其预期目标的亲和力与其对非目标分子的亲和力相比大约高5倍,则抗体/结合配偶体“特异性地结合”。优选地,抗体对于目标分子的亲和力比其对非目标分子的亲和力大至少约5倍,优选10倍,更优选25倍,甚至更优选50倍,最优选100倍或更多。在优选的实施例中,抗体或其他结合剂与抗原之间的特异性结合意指至少106m-1的结合亲和力。优选的抗体结合的亲和力至少约为107m-1,优选地为约108m-1至约109m-1,约109m-1至约1010m-1,或约1010m-1至约1011m-1。
亲和力被计算为kd=k0ff/kon(koff是解离速率常数、kon结合速率常数,以及kd是平衡常数。通过测量不同浓度(c)的标记配体的结合部分(r),可以在平衡时确定亲和力。使用斯卡查德方程绘制数据:r/c=k(n-r)
其中:
r=结合配体的摩尔数/平衡时受体的摩尔数;
c=平衡时游离配体浓度;
k=平衡关联常数;以及
n=每个受体分子的配体结合位点数
通过图形分析,在y轴上绘制r/c,在x轴上绘制r,从而产生斯卡查德图。亲和力是线的负斜率。koff可以通过竞争结合的标记配体与未标记的过量配体来确定(参见,例如,美国专利号6,316,409)。靶向剂对其目标分子的亲和力优选为至少约1×10-6摩尔/升,更优选为至少约1×10-7摩尔/升,甚至更优选为至少约1×10-8摩尔/升,甚至更优选为至少约1×10-9摩尔/升,最优选至少约1×10-10摩尔/升。通过斯卡查德分析的抗体亲和力测量是本领域熟知的。参见,例如vanerpetal.,j.immunoassay12:425-43,1991;nelsonandgriswold,comput.methodsprogramsbiomed.27:65-8,1988。
抗体的产生和选择可以通过几种方式完成。例如,一种方法是使用例如本领域熟知的固相肽合成方法纯化目标多肽或合成目标多肽。参见,例如guidetoproteinpurification,murrayp.deutcher,ed.,meth.enzymol.vol182(1990);solidphasepeptidesynthesis,gregb.fieldsed.,meth.enzymol.vol289(1997);kisoetal.,chem.pharm.bull.(tokyo)38:1192-99,1990;mostafavietal.,biomed.pept.proteinsnucleicacids1:255-60,1995;fujiwaraetal.,chem.pharm.bull.(tokyo)44:1326-31,1996。然后可以将选择的多肽注射到例如小鼠或兔子中,以产生多克隆或单克隆抗体。本领域技术人员将认识到许多方法可用于产生抗体,例如,在antibodies,alaboratorymanual,edharlowanddavidlane,coldspringharborlaboratory(1988),coldspringharbor,n.y中所述。本领域技术人员还将理解,模拟抗体的结合片段或fab片段也可以通过各种程序从遗传信息被制备(antibodyengineering:apracticalapproach(borrebaeck,c,ed.),1995,oxforduniversitypress,oxford;j.immunol.149,3914-3920(1992))。
此外,许多出版物报道了使用噬菌体展示技术来产生和筛选多肽文库以结合选定的目标。参见,例如cwirlaetal.,proc.natl.acad.sci.usa87,6378-82,1990;devlinetal.,science249,404-6,1990,scottandsmith,science249,386-88,1990;以及ladneretal.,u.s.pat.no.5,571,698。噬菌体展示方法的基本概念是在编码待筛选多肽的dna与多肽之间建立物理关联。这种物理结合由噬菌体颗粒提供,其显示多肽作为包围编码多肽的噬菌体基因组的衣壳的一部分。多肽与其遗传物质之间的物理关联的建立允许同时大量筛选携带不同多肽的大量噬菌体。展示对目标具有亲和力的多肽的噬菌体与目标结合,并且通过对目标的亲和力筛选以丰富这些噬菌体。来自这些噬菌体展示的多肽的身份可以从它们各自的基因组确定。使用这些方法,然后可以通过常规方法大量合成鉴定为对所需目标具有结合亲和力的多肽。参见,例如美国专利no.6,057,098,其全部内容通过引用并入本文,包括所有表格、附图和权利要求。
然后可以通过首先用纯化的目标多肽筛选亲和力和特异性来选择通过这些方法产生的抗体,并且如果需要,将结果与抗体与希望从结合中排除的多肽的亲和力和特异性进行比较。筛选程序可包括将纯化的多肽固定在微量滴定板的不同孔中。然后将含有潜在抗体或抗体组的溶液置于各自的微量滴定孔中并孵化约30分钟至2小时。然后洗涤微量滴定孔,并向孔中加入标记的第二抗体(例如,如果提升的抗体是小鼠抗体则碱性磷酸酶与抗小鼠抗体缀合)并孵化约30分钟然后洗涤。将基质加入孔中,并且出现颜色反应,其中存在针对固定化多肽的抗体。
或者,为了优化抗原特异性噬菌体的捕获并使无关噬菌体抗体的结合最小化,采用同时的阳性和阴性选择策略。在这种情况下,在少量抗原(例如在细胞表面、磁性颗粒、其他固相等)和过量的不需要的交叉的反应物之间建立竞争,所述交叉反应物用作无关噬菌体抗体非特异性粘附的接收器。举例来说,可以将携带目标抗原(cprrpyil肽)的细胞稀释成过量的不需要的交叉反应物纤维蛋白原。在将细胞混合物与噬菌体文库一起孵化后,回收抗原阳性细胞群,并在细菌培养物中洗脱并繁殖编码抗原特异性抗体的噬菌体。
然后可以在所选择的测定设计中进一步分析如此鉴定的抗体的亲和力和特异性。在开发目标蛋白的免疫测定中,纯化的目标蛋白作为标准,用于使用所选抗体判断免疫测定的灵敏度和特异性。因为各种抗体的结合亲和力可能不同;某些抗体对(例如,在夹心测定中)可以在空间上相互干扰等,抗体的测定性能可能是比抗体的绝对亲和力和特异性更重要的量度。
本领域技术人员将认识到,可以采用许多方法产生抗体或结合片段,并筛选和选择各种多肽的亲和力和特异性,但这些方法不改变本发明的范围。
除抗体外,可以使用不依赖于免疫球蛋白支架的其他特异性结合物质来代替它们。举例来说,核酸适体是通过重复的体外选择进行工程改造的核酸种类,或者等效地,selex(通过指数富集系统进化配体)以结合各种分子目标的核酸种类,各种分子目标例如小分子、蛋白质、核酸,甚至细胞、组织和生物体。肽适体是设计用于干扰细胞内其他蛋白质相互作用的蛋白质。它们由在两端连接到蛋白质支架的可变肽环组成。这种双重结构约束极大地增加了肽适体的结合亲和力到与抗体相当的水平(纳摩尔范围)。适体在生物技术和治疗应用中是有用的,因为它们提供的分子识别特性可与常用的生物分子抗体相媲美。除了它们的区别识别之外,适体还提供优于抗体的优点,因为它们可以在试管中完全工程化,易于通过化学合成产生,具有期望的储存性能,并且在治疗应用中引起很少或没有免疫原性。自从适体发现以来,许多研究人员已经使用适体选择作为产生用于结合测定的合适结合配偶体的手段。
免疫测定对照中的cprrpyil肽、elaglgfaelqc肽以及cdwrknidal肽和结合试剂
cprrpyil肽、elaglgfaelqc肽和cdwrknidal肽及其对应的结合试剂可用作任何免疫测定形式的测定对照。基本上,试剂用作结合对,当与样品基质混合时,其与目标分析物测定类似地反应,因为cprrpyil肽、elaglgfaelqc肽或cdwrknidal肽与其对应的结合配偶体的结合暴露于作为分析物测定的相同的样品基质、温度、储存条件等。
在一个实例中,测试装置用于检测“分析物a”的存在或量。包含序列cprrpyil(seqidno:1)和/或elaglgfaelqc(seqidno:4)和/或cdwrknidal(seqidno:8)的肽被可检测地标记,并且特异性地分别结合到seqidno:1、seqidno:4或seqidno:8的抗体或其他结合试剂被固定在固相上的“对照捕获区”。对照捕获区定位成使得其紧邻分析物捕获区(例如,固相上的“分析物捕获试剂”,例如分析物a的抗体被固定的位置),使得在对照捕获区和分析物捕获区两者中,测定条件相似(例如,基本上相同)。
在替代实施例中,测试装置用于检测“分析物b”的存在或量。包含序列cprrpyil(seqidno:1)和/或elaglgfaelqc(seqidno:4)和/或cdwrknidal(seqidno:8)或由其组成的肽固定在固相上的“对照捕获区”上,而可检测地标记分别与seqidno:1、seqidno:4或seqidno:8特异性地结合的抗体或其他结合试剂。对照捕获区定位成使得其与分析物捕获区紧密相邻(例如,固相上的“分析物捕获试剂”,例如分析物b的抗体被固定的位置),使得在对照捕获区和分析物捕获区两者中,测定条件相似(例如,基本上相同)。
在每种情况下,将可检测标记的cprrpyil肽/结合试剂对和/或elaglgfaelqc肽/结合试剂对和/或cdwrknidal肽/结合试剂对的构件与待分析的样品混合,然后施加到测试装置,使其与对照捕获区和分析物捕获区接触。从分析物捕获区产生测定信号,其与分析物的存在或量相关,并且从对照捕获区产生对照信号,其与cprrpyil肽和/或elaglgfaelqc肽和/或cdwrknidal肽与其结合试剂的结合有关。使用适用于所用标签类型的装置检测信号。在一个优选的实施例中,通过光学方法检测该量,例如通过测量分析物结合颗粒的标记的荧光量。或者,可以使用电导率或电介质(电容)来检测信号。或者,可以使用电化学检测释放的电活性剂,如铟、铋、镓或碲离子,如下所述:hayesetal.(analyticalchem.66:1860-1865(1994))或者robertsanddurst建议的亚铁氰化物(analyticalchem.67:482-491(1995))。
免疫测定对照中的特异性肽和结合试剂
可以进行免疫测定,其中制备载体和合成肽的预定义缀合物,其代表目标分析物的目标表位,并固定在测定装置内测试位置下游的位置。载体缀合物以这样的方式配置,使得一个或多个合成表位存在于诊断测试道的表面,使与标记的检测抗体混合的样品流动。未与样品中存在的目标结合的任何标记的检测抗体将沿着测试道流动,其中它可以与载体缀合物上存在的一个或多个合成表位结合,载体缀合物固定在测试区下游的固相位置。
在测试点下游使用这样的合成表位将产生指示(i)标记的捕获抗体成功再水化并悬浮在样品流体中以及(ii)标记的捕获抗体的抗体具有生物活性和功能的信号。因此,在测定装置中实施这种阳性对照装置使得确定指定的试剂如期发挥作用。
在人心肌肌钙蛋白i(hctn1)的测定中,可以合成具有代表hctn1的氨基酸区域84-94的氨基酸序列elaglgfaelqc的合成肽,并将其掺入测定中。任选地或另外地,可以合成具有代表hctn1的氨基酸区域190-198的氨基酸序列cdwrknidal的合成肽并将其掺入测定中。使用标准肽固定化学技术将合成的elaglgfaelqc和/或cdwrknidal肽与合适的载体蛋白缀合,例如人血清白蛋白。随后将载体蛋白质固定在测定装置的测试道内,所述测定装置位于抗hctn1抗体的区域下游(即,在测试道的另一个距离处,样本流体迁移到首次施用样品的位置),其中抗hctn1抗体识别不同的表位区,例如hctn1的氨基酸27-39和34-55(捕获抗体)已被固定。
在免疫测定中使用针对氨基酸区域84-94或氨基酸区域190-198的抗体,其与可检测标记缀合。合适的标记的示例包括酶、荧光标记、放射性核素、电化学活性物质、化学发光物质、胶体溶胶颗粒(例如金溶胶或乳胶颗粒)。在一些实施例中,标记是荧光能量转移胶乳(fetl)颗粒。检测抗体能够同时结合已被捕获抗体结合的hctn1。因此,氨基酸区域27-39/34-55和84-94或190-198在空间上充分分离,当捕获抗体和检测抗体都与hctn1结合时,不会发生空间位阻。
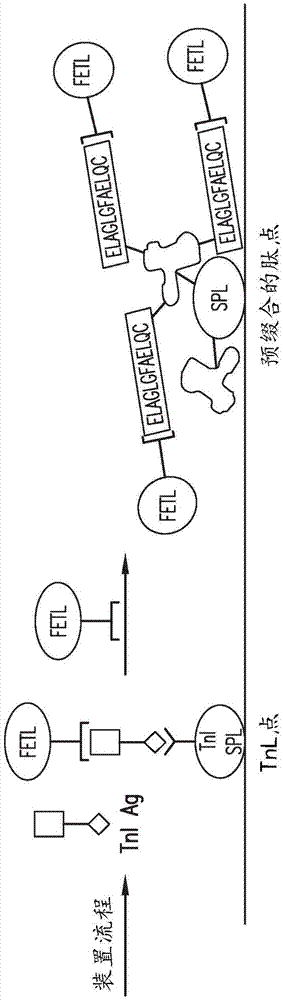
图1描绘了示例性实施例的测定装置,其包括测定测试点,其被配置成检测hctn1(tn1点)的存在以及特定对照点(预缀合肽点),其位于测试点的下游相对于沿着诊断道的测试样品的流动。测试点包含针对hctn1的氨基酸区域27-39/34-55的固定的捕获抗体。对照点包含由合成肽组成的缀合物,所述合成肽具有与人血清白蛋白载体(hsa)蛋白共价偶联的氨基酸序列elaglgfaelqc。cprrpyil肽和cdwrknidal肽将以类似的方式使用。
将怀疑含有目标靶标(hctn1)的样品流体(例如血液、血清、血浆、尿液、唾液、精液、脑脊髓液)应用于上游位置的测试装置。在上游位置内提供过量的干燥检测抗体,其被样品流体溶解。检测抗体随后与样品中存在的任何目标相互作用并结合。之后,标记的样品沿着诊断道流动。样品最初接触测试点,其中目标可以与固定的捕获抗体相互作用并被捕获。当样品流体沿着诊断道继续流动时,过量的检测抗体与固定在对照点上的合成肽相互作用并结合。
因此,可检测信号分别在测试点和对照点处发展。测试点处的信号强度指示样品流体中存在目标的存在或量。对照中信号的存在表明(i)将足够的样品施加到装置上以使干燥的检测抗体重新悬浮并沿着测试点将其携带至对照点,以及(ii)检测抗体具有生物活性并能够结合目标。
校正测定信号
使用如美国专利5,356,782、5,753,517、7,691,595和7,713,703中所述的方法,使用对照信号校正测定信号。在一个示例中,可以根据以下等式确定校正的测定信号:
归一化的测定信号=a*(signalassay)/signalcontrol
在另一个示例中,可以根据以下等式确定校正的测定信号:
归一化的测定信号=a*(signalassay)b3/(signalcontrol1b1*signalcontrol2b2)
如上所述,诸如免疫测定的测定需要检测方法,并且用于定量结果的最常用方法之一是缀合酶、荧光团或其他分子以形成抗体-标记缀合物。可检测标记可包括本身可检测的分子(例如,荧光部分、电化学标记、金属螯合物等)以及可通过产生可检测的反应产物间接检测的分子(例如,诸如辣根过氧化物酶的酶、碱性磷酸酶等)或通过本身可检测的特异性结合分子(例如,生物素、洋地黄毒苷、麦芽糖、寡聚组氨酸、2,4-二溴苯、苯基胂酸盐、ssdna、dsdna等)。特别优选的可检测标记是荧光乳胶颗粒,如美国专利5,763,189、6,238,931和6,251,687中所述的那些;以及国际公布wo95/08772,其各自通过引用整体并入本文。下文描述了与这种颗粒的示例性缀合。直接标记包括附着于抗体的荧光或发光标签、金属、染料、放射性核素等。间接标记包括本领域熟知的各种酶,例如碱性磷酸酶、辣根过氧化物酶等。
固相固定化
如上所述,诸如免疫测定的测定通常依赖于固定在固相基质上的试剂用作亲和支持物或用于样品分析。因此,抗体或其结合片段、cprrpyil肽、elaglgfaelqc肽、cdwrknidal肽等可以固定在固相基质上。本文所用的术语“固相”是指多种材料,包括本领域技术人员通常使用的固体、半固体、凝胶、薄膜、膜、网、毛毡、复合材料、颗粒、纸等以隔离分子。固相可以是无孔的或多孔的。合适的固相包括在固相结合测定中开发和/或使用的固相。参见,例如,immunoassay第9章,e.p.dianiandis和t.k.christopouloseds.,academicpress:newyork,1996,在此引入作为参考。合适的固相的示例包括膜过滤器、纤维素基纸、珠(包括聚合物、乳胶和顺磁颗粒)、玻璃、硅晶片、微粒、纳米颗粒、tenta凝胶、agro凝胶、pega凝胶、spocc凝胶和多孔板。参见,例如leonetah,bioorg.med.chem.lett.8:2997,1998;kessleretah,agnew.chem.int.ed.40:165,2001;smithetah,j.comb.med.1:326,1999;orainetal,tetrahedronlett.42:515,2001;papanikosetal,j.am.chem.soc.123:2176,2001;gottschlingetal,bioorg.med.chem.lett.11:2997,2001。
可以修饰如上所述的表面以提供连接位点,例如通过溴乙酰化、硅烷化、使用硝酸添加氨基,以及中间蛋白、树枝状大分子和/或星形聚合物的附接。该列表不意味着限制,可以采用本领域技术人员已知的任何方法。
试剂的联接
化学交联剂是制备抗体-可检测标记的缀合物、抗原构建体、免疫毒素和其他标记的蛋白质和核酸试剂的有价值的工具。这些试剂可根据以下分类:
1.功能组和化学特异性;
2.交联桥的长度和组合物组成;
3.交联组是相似的(同双功能的)还是不同的(异双功能的);
4.这些组是化学反应还是光化学反应;
5.试剂是否可裂解;以及
6.试剂是否可以放射性标记或用其他标签标记。
由于本发明的cprrpyil、elaglgfaelqc和cdwrknidal肽的半胱氨酸残基提供可用的硫醇作为连接点,可以制备目标以提供合适的硫醇反应性位点。通过巯基(硫醇)偶联的交联剂可从许多商业来源获得。马来酰亚胺、烷基和芳基卤化物和α-卤代酰基与巯基反应形成硫醇醚键,而吡啶基二硫化物与巯基反应生成混合的二硫化物。吡啶基二硫化物产物是可裂解的。此类试剂可以是双功能的,因为试剂上的第二位点可用于修饰缀合目标以掺入硫醇反应性位点。除了硫醇之外,可以使用交联剂靶向的反应性基团包括伯胺、羰基化合物、碳水化合物和羧酸。此外,许多反应性基团可以使用交联剂(例如光反应性苯基叠氮化物)非选择性地偶联。对于合适的试剂,参见pierce2003-2004appplicationshandbookandcatalog#1600926,其通过引用并入本文。在一端具有胺反应性且在另一端具有巯基反应性的交联剂是非常常见的。如果使用异双功能试剂,通常首先使最不稳定的基团反应以确保有效的交联并避免不希望的聚合。
必须考虑许多因素来确定最佳的交联剂与目标摩尔比。根据应用,缀合程度是一个重要因素。例如,当制备免疫原缀合物时,通常需要高度缀合以增加抗原的免疫原性。然而,当与抗体或酶缀合时,低至中等程度的缀合可能是最佳的,以确保保留蛋白质的生物活性。考虑蛋白质表面上反应基团的数量也很重要。如果存在许多目标组,则可以使用较低的交联剂与蛋白质比率。对于有限数量的潜在目标,可能需要更高的交联剂与蛋白质比率。对于小分子量蛋白质,这转化为每克更多的交联剂。
还可以通过在相互作用之前和之后进行交联研究来分析与特定相互作用相关的蛋白质的结构变化。通过使用不同的臂长交联剂并分析缀合的成功进行比较。当蛋白质的构象改变使得受阻氨基酸变得可用于交联时,可能需要使用具有不同反应基团和/或间隔臂的交联剂。
交联剂可具有不同长度的间隔臂或连接反应性末端的桥。该桥最明显的属性是它能够处理要连接的部分的空间考虑。因为空间效应决定了交联的潜在反应位点之间的距离,所以可以考虑不同长度的桥用于相互作用。较短的间隔臂通常用于分子内交联研究,而分子间交联有利于含有较长间隔臂的交联剂。
包含聚合物部分(例如,聚乙二醇(“peg”)均聚物、聚丙二醇均聚物、其他烷基-聚环氧乙烷、双聚环氧乙烷和共聚物或聚(环氧烷)的嵌段共聚物)在某些情况下,交联可以是有利的。参见,例如,美国专利5,643,575、5,672,662、5,705,153、5,730,990、5,902,588和5,932,462;以及topchievaefah,bioconjug.chem.6:380-8,1995)。例如,美国专利5,672,662公开了包含peg聚合物部分和单酯键的双功能交联剂。据说这种分子在水中提供约10至25分钟的半衰期。
设计交联剂涉及选择要使用的功能部分。功能部分的选择完全取决于待交联物种上可用的目标位点。一些物种(例如,蛋白质)可以存在许多可用于靶向的位点(例如,赖氨酸e-氨基、半胱氨酸巯基、谷氨酸羧基等),并且可以凭经验选择特定的功能部分,以便最好地保留目标的生物特性(例如,抗体的结合亲和力、酶的催化活性等)。
1.通过胺基团联接
亚氨酸酯和n-羟基琥珀酰亚胺基(“nhs”)酯通常用作胺特异性官能部分。nhs酯与伯胺或仲胺反应后产生稳定的产物。联接在生理ph下是有效的,并且nhs-酯交联剂在溶液中比它们的亚氨酸酯对应物更稳定。同双功能nhs-酯缀合通常用于在一步或两步反应中交联含胺蛋白。伯胺是nhs-酯的主要目标。存在于蛋白质n-末端的可接近的α-胺基团与nhs-酯反应形成酰胺。然而,由于蛋白质上的α-胺并不总是可用,因此与氨基酸侧链的反应变得重要。虽然五个氨基酸在其侧链中具有氮,但只有赖氨酸的ε-氨基与nhs-酯显着反应。当nhs-酯交联剂与伯胺反应,释放n-羟基琥珀酰亚胺时,形成共价酰胺键。
2.通过巯基组联接
马来酰亚胺、烷基和芳基卤化物、α-卤代酰基和吡啶基二硫化物通常用作巯基特异性官能部分。当反应混合物的ph保持在ph6.5-7.5之间时,马来酰亚胺基团对巯基具有特异性。在ph7下,马来酰亚胺与巯基的反应比与胺快1000倍。马来酰亚胺不与酪氨酸、组氨酸或蛋氨酸反应。当游离巯基不足量存在时,通常可通过还原可用的二硫键产生它们。
3.通过羧基联接
碳二亚胺将羧基与伯胺或酰肼联接,导致形成酰胺或腙键。碳二亚胺与其他共轭反应不同,因为在碳二亚胺和联接的分子之间不形成交叉桥;相反,在可用的羧基和可用的胺基之间形成肽键。蛋白质的羧基末端、以及谷氨酸和天冬氨酸侧链可以被靶向。在过量交联剂存在下,可能发生聚合,因为蛋白质含有羧基和胺。没有形成交叉桥,并且酰胺键与肽键相同,因此在不破坏蛋白质的情况下不可能逆转交联。
4.非选择性标记
光亲和试剂是化学惰性但在暴露于紫外或可见光时变得具有反应性的化合物。芳基叠氮化物是光亲和试剂,其在250-460nm之间的波长下光解,形成反应性芳基氮宾。芳基氮烯非选择性地反应形成共价键。必须谨慎使用还原剂,因为它们可以还原叠氮基。
5.羰基特异性交联剂
羰基化合物(醛和酮)在ph5-7下与胺和酰肼反应。与酰肼的反应比使用胺更快,这使得它可用于位点特异性交联。羰基化合物不易存在于蛋白质中;然而,使用偏高碘酸钠轻微氧化糖部分会将邻位羟基转化为醛或酮。
测定系统
本领域技术人员熟知许多方法和装置用于受体结合测定的实践。参见,例如,美国专利6,143,576;6,113,855;6,019,944;5,985,579;5,947,124;5,939,272;5,922,615;5,885,527;5,851,776;5,824,799;5,679,526;5,525,524;以及5,480,792,其中的每个都通过引用整体并入本文,包括所有表格、附图和权利要求。这些装置和方法可以利用各种夹心、竞争或非竞争性测定形式的可检测标记的分子和抗体固相,以产生与目标分析物的存在或量相关的信号。本领域技术人员还认识到机器人仪器包括但不限于beckmanaccess、abbottaxsym、rocheelecsys、dadebehringstratus系统,其是能够进行这种免疫测定的免疫测定分析仪。另外,可以采用某些方法和装置,例如生物传感器和光学免疫测定来确定分析物的存在或量,而不需要标记的分子。参见,例如,美国专利5,631,171;以及5,955,377,其中的每个都通过引用整体并入本文,包括所有表格、附图和权利要求。如本文所述,优选的测定使用针对cprrpyil肽产生的抗体。
在其最简单的形式中,根据本发明的测定装置可以包含固体表面,所述固体表面包含特异性结合一种或多种目标分析物的受体。例如,可以将抗体固定在各种固体支持物上,例如磁性或色谱基质颗粒、测定板的表面(例如微量滴定孔)、固体基质材料或膜(例如塑料、尼龙、纸)等,其使用本发明的交联剂。多种分析物的分析可以与一种测试样品分开或同时进行。对于标记物的单独或顺序测定,合适的装置包括临床实验室分析仪,例如elecsys(罗氏roche)、axsym(雅培abbott)、access(贝克曼beckman)、
示例
以下实施例用于说明本发明。这些实施例决不旨在要限制本发明的范围。
实施例1.plyenkprrpyilc和cprrpyil肽缀合物
将匙孔血蓝蛋白(klh,calbiochem#374817,甘油中50mg/ml)通过在0.1m磷酸钾、0.1m硼酸盐、0.15m氯化钠缓冲液(ph7.5)中平衡的40mlgh25柱以除去甘油。加入1.5倍摩尔过量的n-乙基马来酰亚胺,并将混合物在室温下温育30分钟。在涡旋的同时加入来自50mm蒸馏水原液的200倍摩尔过量的磺基-smcc(pierce#22322)。继续涡旋另外30秒,然后在室温下孵化10分钟。在涡旋的同时加入来自80mm乙腈原液的100倍摩尔过量的smcc(pierce#22360)。加入1mkoh以保持ph在7.2和7.4之间。将混合物在室温下搅拌90分钟。孵化90分钟后,使用在0.1m磷酸钾、0.02m硼酸盐、0.15m氯化钠缓冲液、ph7.0中平衡的gh25柱,通过凝胶过滤纯化klh-smcc。
肽-匙孔血蓝蛋白(klh)缀合物基本上如美国专利no.6,057,098的实施例21中所述制备,修改如下:klh-smcc与2倍过量的肽和各5%的padre(来自alexander等的肽1024.03,immunity1:751-761,1994)反应。
具有肽的牛血清白蛋白(bsa)缀合物基本上如美国专利no.6,057,098的实施例21中所述制备。通过首先将bsa生物素化(美国专利号6,057,098的实施例9),然后使用smcc与肽缀合,制备bsa生物素肽缀合物。对于如下所述的噬菌体展示淘选,使用与bsa-smcc缀合的plyenkprrpyilc(seqidno:2)。
实施例2.磁性乳胶颗粒
将磁性乳胶(estapor,10%固体,邦斯实验室bangslaboratories,fishers,ind.)彻底重悬浮,并将2ml等分到15ml锥形管中。将磁性乳胶悬浮在12ml蒸馏水中,并使用磁铁将其与溶液分离10分钟。在仍然在磁体中的同时,用10ml无菌移液管小心地移除液体。该洗涤过程重复三次。最后一次洗涤后,将胶乳重新悬浮在2ml蒸馏水中。在单独的50ml锥形管中,将10mg抗生物素蛋白-hs(neutravidin,pierce,rockford,111.)溶于18ml40mmtris、0.15m氯化钠、ph7.5(tbs)中。在涡旋的同时,将2ml经洗涤的磁性胶乳加入稀释的抗生物素蛋白-hs中,并将混合物再涡旋30秒。将该混合物在45℃下孵化2小时,每30分钟振荡一次。使用磁铁将抗生物素蛋白磁性胶乳与溶液分离,并如上所述用20mlbbs洗涤三次。最后一次洗涤后,将胶乳重悬于10mlbbs中并在4℃下储存。
*在即将使用之前,将抗生物素蛋白磁性胶乳在淘选缓冲液(40mmtris、150mmnacl、20mg/mlbsa、0.1%tween20(fisherscientific,pittsburgh,pa),ph7.5)中平衡。将淘选实验所需的抗生物素蛋白磁性乳胶(200μl/样品)加入无菌的15ml离心管中,并用淘洗缓冲液加至10ml。将管置于磁体上10分钟以分离胶乳。如上所述,用10ml无菌移液管小心地移除溶液。将磁性胶乳重悬于10ml淘洗缓冲液中以开始第二次洗涤。用淘洗缓冲液将磁性胶乳洗涤总共3次。最后一次洗涤后,将胶乳重新悬浮在淘洗缓冲液中至初始等分试样体积。
实施例3.表达抗plyenkprrpyilc抗体的噬菌体的选择和plyenkprrpyilc的单克隆fab的选择
第一轮抗体噬菌体通常如美国专利no.6,057,098的实施例7中所述制备,其来自用与klh和padre缀合的plyenkprrpyilc(seqidno:2)免疫的小鼠分离的rna(pan-drt-辅助表位)。用dynalm-280链霉抗生物素蛋白磁性乳胶(lifetechnologies,carlsbad)淘选抗体噬菌体样品,一般如美国专利no.6,057,098的实施例16中所述。使用与bsa-smcc-生物素缀合的plyenkprrpyilc(seqidno:2)以2x10-9m最终bsa浓度选择第一轮抗体噬菌体样品(来自5个不同脾脏的10个样品),添加9x10-7mbsa-smcc以去除smcc臂特异性抗体。洗脱的第二轮噬菌体富集7f11磁性胶乳(美国专利号6,057,098的实施例22),然后富集的噬菌体以2×10-9m最终bsa-肽生物素浓度和9×10-7mbsa-smcc被第二次淘选。合并从第二轮淘选中洗脱的噬菌体,并用2×10-9m最终bsa肽生物素浓度进行第三轮淘选。将选择的噬菌体亚克隆到质粒表达载体中,一般如美国专利no.6,057,098的实施例18中所述。从亚克隆文库中选择单克隆抗体,其显示在n末端结合肽。该单克隆抗体是st0115z1zm01421。该抗体通常如美国专利no.6,057,098的实施例9中所述进行生物素化。
实施例4.选择表达抗elaglgfaelqc抗体的噬菌体和选择elaglgfaelqc的单克隆抗体,其中抗体与肌钙蛋白i复合物交叉反应
第一轮抗体噬菌体通常如美国专利no.6,057,098的实施例7中所述制备,其来自用缀合klh的elaglgfaelqc(seqidno:4)免疫的小鼠分离的rna。用dynalm-280链霉抗生物素蛋白磁性乳胶(lifetechnologies,carlsbad)淘选抗体噬菌体样品,一般如美国专利no.6,057,098的实施例16中所述。使用与bsa-smcc-生物素缀合的elaglgfaelqc(seqidno:4)以1×10-9m最终bsa浓度选择第一轮抗体噬菌体样品(来自2个不同脾脏的4个样品),添加1.4x10-6mbsa-smcc以去除smcc臂特异性抗体。用1x10-8m肌钙蛋白tic复合物生物素第二次淘洗洗脱的第二轮噬菌体。合并从第二轮淘选中洗脱的噬菌体,并用1×10-8m肌钙蛋白tic复合物生物素进行第三轮淘选。将从第三轮淘选洗脱的噬菌体用5×10-10m肌钙蛋白tic复合物生物素第四次淘选。将选择的噬菌体亚克隆到质粒表达载体中,一般如美国专利no.6,057,098的实施例18中所述。
实施例5.选择表达抗cdwrknidal抗体的噬菌体和选择cdwrknidal的单克隆抗体,其中抗体与肌钙蛋白i复合物交叉反应
第一轮抗体噬菌体通常如美国专利no.6,057,098的实施例7中所述制备,其来自用心肌肌钙蛋白i(dako,finland)免疫的小鼠分离的rna。用dynalm-280链霉抗生物素蛋白磁性乳胶(lifetechnologies,carlsbad)淘选抗体噬菌体样品,一般如美国专利no.6,057,098的实施例16中所述。使用与肌钙蛋白c和肌钙蛋白t(tic复合物)生物素复合的心肌肌钙蛋白i以5×10-9m最终tic生物素浓度选择第一轮抗体噬菌体样品(来自5个不同脾的10个样品)。用1x10-9mtic复合物生物素第二次淘洗洗脱的第二轮噬菌体。合并从第二轮淘选中洗脱的噬菌体,并用1×10-9m心肌肌钙蛋白i生物素进行第三轮淘选。将选择的噬菌体亚克隆到质粒表达载体中,一般如美国专利no.6,057,098的实施例18中所述。
实施例6.选择表达抗cprrpyil(seqidno:1)抗体的噬菌体和选择cprrpyil的单克隆抗体
第一轮抗体噬菌体通常如美国专利no.6,057,098的实施例7中所述制备,其来自用与klh和padre(pan-drt-辅助表位)缀合的cprrpyil(seqidno:1)免疫的小鼠分离的rna。通常如上文实施例2中所述,用dynalm-280链霉抗生物素蛋白磁性乳胶(lifetechnologies,carlsbad)淘选抗体噬菌体样品,其不同之处在于bsa肽生物素浓度为1×10-9m。在第二轮选择后,合并各个噬菌体样品,并使用1x10-8m的生物素化的st0115z1zm01421抗体和1x10-9m的未标记的神经降压肽(bachem,torrance)选择合并的噬菌体,通常如美国专利no.6,057,098的实施例15所述。第二次重复该选择,将得到的第四轮噬菌体亚克隆到质粒表达载体中,一般如美国专利no.6,057,098中所述。单克隆抗体st0128z7zm01421选自所得的单克隆抗体。
实施例7.免疫测定形式
对于夹心免疫测定,将血浆样品添加到微流体装置中,所述微流体装置包含干燥形式的所有必需的测定试剂,包括hama抑制剂。等离子体通过过滤器以去除颗粒物质。等离子体通过毛细管作用进入“反应室”。该反应室含有适合于目标分析物的荧光胶乳颗粒-抗体缀合物(下文称为fetl-抗体缀合物),并且可含有与几种选定分析物的fetl-抗体缀合物。将fetl-抗体缀合物溶解到血浆中以形成反应混合物,将其保持在反应室中一段孵化期(约1分钟)以使血浆中的目标分析物与抗体结合。在孵化期后,反应混合物通过毛细管作用向下移动到检测道。将目标分析物的抗体固定在“检测道”表面上的离散捕获区中。在合适的检测区上捕获在反应室中形成的分析物/抗体-fetl复合物以形成夹心复合物,而通过过量血浆将未结合的fetl-抗体缀合物从检测道洗涤到废物室中。通过在整个点上整合信号,用荧光计(
仪表确定每个点的荧光强度积分(或信号),其与结合到固相点的fetl的量成比例。对于每个分析物点,通过校准曲线将信号转换成分析物浓度单位。这是用数学符号写的,如下所示:
x=分析物点信号(积分)
y=分析物浓度(测试结果)=r(x)
r(x)是所研究的特定分析物测定的校准曲线,其等于在每批测试装置的校准期间确定的剂量/响应曲线的倒数。通常,剂量/响应曲线是s形的,并且在分析物的可测量(报告的)范围内可以近似线性。
校准曲线r(x)表示为三次样条,给定r必须通过的一些(x,y)对(称为“结”)。可测量的测定范围分为11个校准品水平(a,b,c,...j和z),其中cala高于可测量范围的上限,calj接近(但高于)可测量范围的下限,并且calz是包含零浓度分析物的“空白”样品。从5-8结开始,用于表示这11个校准品水平的校准曲线。
在校准之前分配每个校准样品的分析物浓度。在校准期间,每个校准样品(水平a-j和z)在被校准的装置批次上进行重复测试(通常每水平20至32次测试),并计算每个水平的x0平均值。通过将x0的平均值与已知的校准物浓度对齐来确定校准曲线。
实施例8.测定标准化
基于8个氨基酸的肽序列(cprrpyil;seqidno:1)和对该肽特异的抗体(本文称为“st128”),在该装置内包括测定标准化系统。选择st128抗体,因为它不结合天然神经降压肽,也不结合源自人和cho细胞系的细胞培养上清液。将cprrpyil肽置于测试装置的反应室中的fetl上,并将抗体置于检测道中的独特区域上。
来自st128检测区的信号紧密地分布在总体中,其平均值和标准偏差基于单独装置的可以预期量级的精确度(即具有最小的基质效应或干扰)。
将分析物信号和st128信号组合在4参数回归模型中,该模型设计用于保持相对于未标准化信号的校准曲线。
通过消除各个测试设备之间不同的矩阵和设备效应,并且不通过基于批次的校准曲线来解释,测定标准化的目的是提高精度(改进的变异系数或cv″)。简单的″除以″标准化可以通过以下等式应用:
y=a*x0/(x1*x2)1/2
其中a是所有重复的(x1*x2)1/2平均值;x0=分析物点信号(积分);x1=对照点1信号(积分);x2=对照点2信号(积分);y=标准化分析物信号=f(x0,x1,x2);以及分析物浓度(测试结果)=r(y)。对此的简单概括是:
y=a*x0β0/(x1β1*x2β2)
其中(a,β0,β1,β2)是通过普通最小二乘回归确定的系数,残差定义为
残差=log(yik)-log(平均x0)k
其中平均值超过每个校准品水平k的所有重复i。对给定分析物的所有校准物水平进行回归。每个分析物具有针对每个单独批次优化的其自己独特的系数组(a,β0,β1,β2)。
简单的“除以”标准化(固定系数β0=1,β1=0.5,β2=0.5)与具有批次特异性(和分析物特异性)系数的4参数(a,β0,β1,β2)模型的表现不同。对于某些分析物,可以看到“除以”标准化实际上增加了测定cv。因此,通过调整每种分析物来改善标准化系数。通过探索具有附加自由参数的替代函数形式y=f(x0,x1,x2),可以构建更复杂的模型。例如,通过允许y的对数是以下形式的二次多项式
iny=a+β0*lnx0+β1*1nx1+β2*1nx2+β3*1nx0*1nx1+β3*1nx0*1nx2+β5*1nx1*1nx2+β6*1nx0*1nx0+β7*1nx1*1nx1+β8*1nx2*1nx2
其中(a,β0,β1,β2,...β8)是通过普通最小二乘回归确定的10个系数,其中先前定义了残差。然而,二次项在cv减少方面没有任何益处。这些考虑表明,4参数(a,β0,β1β2)模型足以用最少的自由参数调整每个分析物(和每个批次)的标准化。但是,应该注意,这个4参数模型的特定功能形式不是唯一的解决方案。残基的替代功能形式和/或替代定义可用于调整标准化以在可测量范围的某一部分中提高精确度,例如,与较低浓度相反,向较高浓度加权。
示例9.空白限制(lob)的计算
重要的是有一种与标准化方法一致的计算空白限制(lob)的方法。
虽然y是在可测量范围内定义的,但我们在确定标准化系数时排除了calz,即,回归仅限于样品cala-j和calj高于lob。
在检查calz时出现了另一个问题,因为它由于仪表的背景扣除而具有近似为零的平均信号,并且没有为x0<0定义标准化模型的函数形式。为了计算lob,y的等式重新安排如下
y=a*x0β0/(x1β1*x2β2)=(x0/d)β0其中d=(x1β1*x2β2/a)1/β0
lob定义为“空白”样品(calz)分布的上限第97.5百分位数。因此,我们对x0/d的分布进行抽样,并估计其上限第97.5百分位数。这可以使用参数近似(正态分布噪声)来实现,以得到标准化信号y的lob的以下表达式:
lob(y)=(1.96*sd)β0其中sd是x0/d的标准偏差。
这可以直接与未标准化信号x0的lob进行比较,未标准化信号x0是单独x0标准偏差的1.96倍。lob随着标准化而增加,因为在calz处,分析物信号x0是纯噪声,与对照(x1,x2)不相关,因此x0比xo/d噪声小。尽管lob随着标准化而增加,但它仅增加了非标准化系统的lob的1.05和1.15倍之间的乘数。通常,lob比测定的可测量(可报告的)范围的下限低至少2倍,因此预期该效应对高于测定下限的假升高的数量具有可忽略的影响。特别是,对于标准化或未标准化的方法,tni的正常参考范围的上限第99百分位数(基于血浆或来自表观正常健康个体的全血)应低于0.05ng/ml。
实施例10.预缀合的固相
在另一个示例性实施例中,进行测定,其中制备载体和合成肽的预定义缀合物,其代表目标分析物的目标表位,并固定在测定装置内测试位置下游的位置。以这样的方式配置载体缀合物,使得在诊断测试道的表面呈现一种或多种合成表位,通过所述表面,与标记检测抗体混合的样品被流动。任何未与样品中存在的目标结合的标记检测抗体沿着测试道流动,其中它与载体缀合物上呈递的一个或多个合成表位结合,所述载体缀合物固定在测试区下游的固相位置。
在测试点下游使用这样的合成表位产生了一个信号,其表明(i)标记的捕获抗体成功再水合并悬浮在样品液中,以及(ii)标记的捕获抗体的抗体具有生物活性和功能。因此,在测定装置中实施这种阳性对照装置使得确定指定的试剂如预期的那样表现。
在人心肌肌钙蛋白i(hctn1)的测定中,合成了具有氨基酸序列elaglgfaelqc的合成肽,其代表hctn1的氨基酸区域84-94。任选地或另外地,合成具有代表hctn1的氨基酸区域190-198的氨基酸序列cdwrknidal的合成肽。随后使用标准肽固定化学技术将合成的elaglgfaelqc和/或cdwrknidal肽缀合至合适的载体蛋白。随后将载体蛋白固定在测定装置的测试道内,所述测定装置位于抗hctn1抗体的区域下游,所述抗hctn1抗体识别不同的表位区域,例如hctn1(捕获抗体)的氨基酸27-39和34-55。
将针对氨基酸区域84-94或氨基酸区域190-198的抗体与可检测标记缀合。合适的标记的示例包括酶、荧光标记、放射性核素、电化学活性物质、化学发光物质、胶体溶胶颗粒(例如金溶胶或乳胶颗粒)。在一些实施例中,标记是荧光能量转移胶乳(fetl)颗粒。检测抗体能够同时结合已被捕获抗体结合的hctn1。因此,氨基酸区域27-39/34-55和84-94或190-198在空间上充分分离,当捕获抗体和检测抗体都与hctn1结合时不会发生空间位阻。
对照点包含由合成肽组成的缀合物,所述合成肽具有与人血清白蛋白载体(hsa)蛋白共价偶联的氨基酸序列elaglgfaelqc或cdwrknidal。随后将hsa固定在诊断道上。
将怀疑含有目标靶标(hctn1)的样品流体(例如血液、血清、血浆、尿液、唾液、精液、脑脊髓液)施加到上游位置的测试装置。在上游位置内提供过量的干燥检测抗体,其被样品流体溶解。随后,检测抗体与样品中存在的任何目标相互作用并结合。然后,标记的样品沿着诊断道流动。样品最初接触测试点,其中目标与固定的捕获抗体相互作用并被捕获。当样品流体沿着诊断道继续时,过量的检测抗体与固定在对照点上的合成肽相互作用并结合。
分别在测试点和对照点产生可检测信号。测试点处的信号强度指示样品流体中存在目标的存在或量。对照中信号的存在表明(i)将足够的样品施加到装置上以使干燥的检测抗体重新悬浮并沿着测试点将其携带至对照点,以及(ii)检测抗体具有生物活性并能够结合目标。
尽管已经足够详细地描述和举例说明了本发明以使本领域技术人员制造和使用本发明,但是在不脱离本发明的精神和范围的情况下,各种替换、修改和改进应该是显而易见的。
本领域技术人员容易理解,本发明非常适合于实现所述目的并获得所述的目的和优点,以及其中固有的目的和优点。本文提供的实施例是优选实施方案的代表,是示例性的,并不意图作为对本发明范围的限制。本领域技术人员将想到其中的修改和其他用途。这些修改包含在本发明的精神内,并由权利要求的范围限定。
对于本领域技术人员显而易见的是,在不脱离本发明的范围和精神的情况下,可以对本文公开的发明进行各种替换和修改。
本说明书中提及的所有专利和出版物表示本发明所属领域普通技术人员的水平。所有专利和出版物在此引入作为参考,其程度如同每个单独的出版物被具体和单独地指出通过引用并入。
本文说明性地描述的本发明可适当地在缺少本文未具体公开的任何要素、限制的情况下实施。因此,例如,在本文的每种情况下,任何术语“包含”、“基本上由..组成”和“由..组成”可以用其他两个术语中的任一个替换。已经使用的术语和表达用作描述的术语而非限制,并且无意在使用这些术语和表达来排除所示和所描述的特征的任何等同物或其部分,而是认识到在所要求保护的本发明的范围内可以进行各种修改。因此,应该理解,尽管已经通过优选实施例和可选特征具体公开了本发明,但是本领域技术人员可以采用本文公开的概念的修改和变化,并且这些修改和变化被认为是在由所附权利要求限定的本发明的范围内。
在以下权利要求中阐述了其他实施例。
- 还没有人留言评论。精彩留言会获得点赞!