生物分子测量装置的制作方法
本发明涉及生物分子测量装置。
背景技术:
近年来,使用在薄膜上形成的纳米尺度的微小孔(以下,纳米孔)作为传感器的生物分子测量装置受到注目。下述专利文献1记载有通过在纳米孔的两侧附加电极,并测量流过纳米孔内的dna(deoxyribonucleicacid:脱氧核糖核酸)分子的隧道电流来确定碱基的种类的技术。如果与以往的荧光方式的dna排序器比较,该文献记载的技术不需要高价的荧光试剂,在排序时由于不需要dna的伸长反应所以不容易产生由于伸长反应引起的错误。因此,它被认为是低成本、高精度、长链地决定dna的碱基序列的新型的dna排序器。测定对象的分子并不局限于dna,rna(ribonucleicacid:核糖核酸)自不必说,若适当地选择纳米孔的直径等则也能够评价蛋白质等生物高分子。
纳米孔方式的dna排序器通过将纳米孔集成,并同时测量各纳米孔中的阻塞电流,能够提高碱基解读的速度(生产率)。然而,纳米孔的发展历史较短,2015年时的并行度最高为500左右。这远远不及以往的荧光方式dna排序器的几十亿,生产率也慢2个数量级以上。因此,预计今后将进一步推进集成化并提高生产率。
现有技术文献
专利文献
专利文献1:日本特开2005-257687号公报
技术实现要素:
发明要解决的课题
在使用纳米孔的生物分子测量装置中,若增加纳米孔的集成度,则担心纳米孔的阻塞电流信号反转至相邻的纳米孔(串扰),使测定精度恶化。特别是若为了提高生产率而缩小纳米孔间的距离,则纳米孔间的阻抗降低,所以串扰有可能变得更加显著。
本发明是鉴于上述情况而完成的,其目的在于提供能够减少腔室间的串扰的影响的生物分子测量装置。
用于解决课题的手段
本发明的生物分子测量装置向各腔室所具备的电极供给实施了相互不同的调制后的电压。
发明效果
根据本发明的生物分子测量装置,即使集成度增大也能够减少串扰的影响。
附图说明
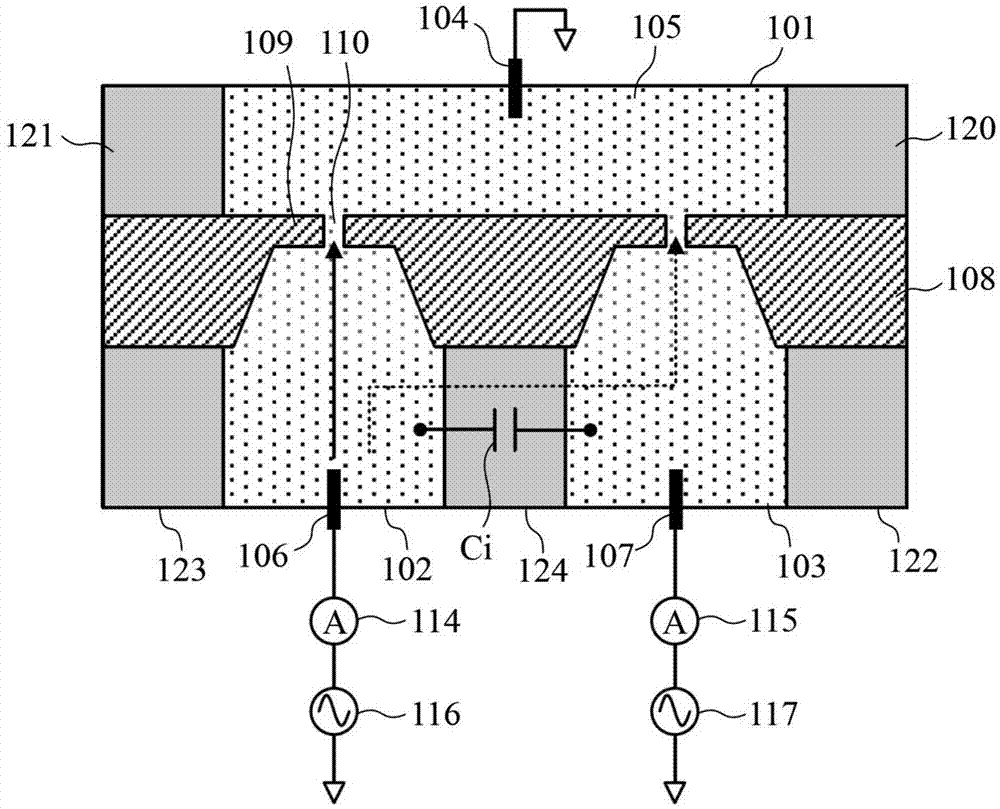
图1是实施方式1的生物分子测量装置的结构图。
图2是说明测定阻塞电流的方法的图。
图3表示通过模拟来评价在ch2中阻塞电流以100us变化δi2时,经由寄生电容ci泄漏到ch1的串扰量ixt的结果。
图4是图1的等效电路图。
图5是1ch的电压源116和电流计114的具体的结构例。
图6是各信号的波形图。
图7是使用锁定放大器作为滤波电路403的例子。
图8是实施方式1的变形例。
图9是实施方式1的变形例。
图10是实施方式2的生物分子测量装置的结构图。
图11是实施方式2的变形例。
图12是实施方式3的生物分子测量装置的结构图。
图13是表示运算装置405求出寄生电容的过程的图。
图14是说明实施方式4的生物分子测量装置中的偏置电压的施加定时的波形图。
图15是实施方式4中的1ch的电压源116和电流计114的结构例。
图16是实施方式5的生物分子测量装置的结构图。
图17是实施方式6的生物分子测量装置的结构图。
图18是ch11、ch21、ch22的偏置电压的波形例。
具体实施方式
<实施方式1>
图1是本发明的实施方式1的生物分子测量装置的结构图。本实施方式1的生物分子测量装置具备基准腔室101、第一腔室102、第二腔室103、纳米孔芯片108。基准腔室101由分隔壁120~121和纳米孔芯片108包围。第一腔室102被分隔壁123~124和纳米孔芯片108包围。第二腔室103由分隔壁122以及124和纳米孔芯片108包围。各腔室中充满电解质溶液105。
基准腔室101具有基准电极104,第一腔室102具有第一电极106,第二腔室103具有第二电极107。各电极被浸在电解质溶液105中。
在纳米孔芯片108上形成有膜109,进一步在膜109中开有纳米孔110。基准腔室101与第一腔室102之间通过图1的左侧的纳米孔110连通,基准腔室101与第二腔室103之间通过右侧的纳米孔110连通。膜109非常薄,具有与测定对象的生物分子样本对应的例如亚纳米到数十纳米的厚度。纳米孔110的直径取决于测定对象,但在读取单链的dna的情况下优选大约是1nm~5nm左右的范围。其原因在于,若小于大约1nm则单链dna无法通过,若大于5nm则对应于不同的碱基种类的阻塞电流的变化量变小,识别精度恶化。
电流计114和电压源116连接到第一电极106。电流计115和电压源117连接到第二电极107。将在后面描述这些电流计和电压源的详细内容。
图2是说明测定阻塞电流的方法的图。首先,对基准腔室101投入测定对象的dna样本。dna通过扩散分布在基准腔室101内。此时,若将基准电极104的电位作为基准向第一电极106和第二电极107施加正电压,则dna样本通过在纳米孔110的附近形成的电位梯度被导向纳米孔110。这是因为dna带负电。若dna进入纳米孔110,则根据在纳米孔110中存在的碱基的种类,纳米孔110的阻塞率变化。此时,若对第一电极106和第二电极107施加偏置电压,则如图2所示,与每个碱基的阻塞率对应的电流(阻塞电流)在第一电极106与基准电极104之间、以及第二电极107与基准电极104之间流过。根据此时的阻塞电流的值能够推断纳米孔110中的碱基种类。
向纳米孔110导入dna时的电压值和测定阻塞电流时的偏置电压值可以不同。例如能够以1v以上的电压将dna高效地导入纳米孔110,并在导入纳米孔110之后降低到100mv~500mv左右来测定阻塞电流。通过在将dna导入纳米孔110之后降低偏置电压,纳米孔110附近的电场变弱,dna行进的速度变慢。其结果,不变更电流计114或115就使每1碱基的阻塞信号的测定样本个数增加,所以具有能够高精度化的优点。
对测定阻塞信号时的串扰进行说明。在图1中,第一腔室102和第二腔室103经由分隔壁124相邻。以下为了方便说明,将通过第一腔室102、第一电极106、电流计114、电压源116测定阻塞电流的系统设为ch1,将通过第二腔室103、第二电极107、电流计115、电压源117测定阻塞电流的系统设为ch2。通过由树脂等绝缘材料构成分隔壁124,能够抑制由ch1与ch2之间的类似dc的漏电流引起的串扰。另一方面,由于在第一腔室102与第二腔室103之间存在寄生电容ci,因此成为以ac方式耦合的状态,并有可能产生串扰。
图3表示通过模拟来评价在ch2中阻塞电流以100us变化δi2时,经由寄生电容ci泄漏到ch1的串扰量ixt的结果。横轴表示寄生电容ci的电容。纵轴是δi2相对于阻塞信号串扰量ixt的比例,并示出高信号品质。在该情形中,若ci是1nf左右则信号量是32db且能够充分确保。但是,若ci为10nf,则信号量降低到0db,这即指串扰量ixt与阻塞信号量δi2恶化到几乎相等的水平。为了将纳米孔110高集成化,使分隔壁124变薄很有效,但由此ci增加且串扰增加。为了即使将纳米孔阵列高集成化也不降低阻塞电流的测定品质,不得不减少串扰量。
图4是图1的等效电路图。若通过dna阻塞纳米孔110,则能够认为纳米孔110的电阻值会发生变化。因此,在图4中,将纳米孔110表现为根据阻塞量而变化的可变电阻rp1、rp2。cm1、cm2分别是膜109、纳米孔芯片108具有的寄生电容,前者与第一腔室102对应,后者与第二腔室103对应。
图5是1ch的电压源116和电流计114的具体的结构例。图5中的放大电路406和电压源407构成的电路相当于将电压源116和电流计114一体地构成的电路。运算装置405经由滤波电路403和ad转换器404获取电流计114的测量结果,并进行处理。滤波电路403、ad转换器404、运算装置405既可以作为生物分子测量装置的构件,也可以独立构成。运算装置405例如能够使用具备cpu(centralprocessingunit:中央处理器)的计算机构成,但也可以使用其他适当的运算设备。
跨阻抗放大器401将流过第一电极106的阻塞电流iin转换成电压信号。对跨阻抗放大器401的参考端子施加从电压源407调制后的偏置电压vb。跨阻抗放大器401以施加于参考端子的偏置电压vb和电流输入端子的电压ve相等的方式动作,所以电压ve也根据偏置电压vb被调制。此时的阻塞电流iin使用纳米孔110的等效电阻rp由下述公式1表示。并不限定偏置电压vb的调制方法,但这里假定是单纯的正弦波且ve=v0×sin(ωt)。ω是角频率。
[公式1]
图6是各信号的波形图。若纳米孔110的阻塞率变化则rp变化,作为结果,公式1的iin(t)为根据rp的变化而调幅的正弦波。波形600是偏置电压vb和电压ve的电压波形。假设阻塞率由于纳米孔110中的dna的运输而变化,等效电阻rp如波形601那样变化,则阻塞电流iin为波形602这样的振幅调制波形。跨阻抗放大器401的输出vo1为iin×rf+ve。差分放大器402减去ve分量,从而得到波形603所示的输出vo2=iin×rf。vo2被滤波电路403振幅解调,得到放大波形601后的输出波形604。滤波电路403既可以是单纯地由二极管、电阻、电容构成的传统的包络检波电路,也可以通过后述的锁定放大器进行同步检波。
考虑将相互不同的频率ω1、ω2的正弦波作为偏置电压vb给予ch1和ch2。此时,由下述公式2和公式3表达对于电流计114输入的电流分量iin(t)。
[公式2]
[公式3]
irp1是流过电阻rp1的电流分量,是所希望的阻塞电流信号。因为是电阻分量,所以对于偏置电压vb以同相位并且同频率地进行变化。icm1是流过寄生电容cm1的电流分量,虽然与偏置电压vb同频率但相位旋转90°。icm2//rp2是经由ch1与ch2之间的寄生电容ci来平行地流过电容cm2和电阻rp2的电流分量。icm2//rp2的频率是ω1,与irp1的频率相等,但由于电容ci和cm2的影响,相位进行旋转。φcm2//rp2是该相位的旋转角度。i117是流入电压源117的电流分量,相位和频率相对于偏置电压vb变化。根据以上可知irp1以外的分量的相位、频率与偏置电压vb不同。因此,通过将偏置电压vb作为参照信号对于所得到的电流iin实施同步检波,能够选择性地对频率和相位进行检波来仅提取irp1。
图7是使用锁定放大器作为滤波电路403的例子。锁定放大器是同步检波电路的一个例子。模拟混频器701将测定对象的信号和参照信号相乘。滤波器702提取信号的dc分量。根据需要,也能够具备对参照信号的相位进行微调的移相器703。在本实施方式1中,作为参照信号,输入对跨阻抗放大器401输入的偏置电压vb。由此,锁定放大器能够高精度地仅提取与公式2的右边中第一项的频率和相位匹配的分量。
同步检波不一定需要由电路实现。例如图5所示,也可以在ad转换器404将测量结果转换成数字信号后,通过运算装置405对测量结果进行数据处理来提取irp1。由此,在提高了集成度时也能够防止电路规模的增大。即使在不通过电路进行同步检波的情况下也可以有滤波电路403。若滤波电路403是低通滤波器,则能够防止ad转换器404中的混叠,并预先去除位于所希望的带域外的噪声。其结果,能够进一步提高信号的品质。
图8是本实施方式1的变形例。在图8中,除了在图5中说明的结构以外,还在从跨阻抗放大器401的电流输入端子到第一电极106的路径上的布线801中并行配置保护电极800。保护电极800连接到电压源407。由此,布线801和保护电极800保持同电位,所以从布线801向周围泄漏的电流减少,能够更高精度地测定阻塞电流。该结构对于纳米孔110的阻抗高且从布线801向周边的电路泄漏的电流与阻塞电流相比不能忽略的情况特别有效。第二电极107也能够同样地设置保护电极。
图9是本实施方式1的变形例。在图9中,通过分隔壁906分离基准腔室101。并且,通过将基准电极104分离为2个单个电极904、905而在相邻ch之间分离阻塞电流流通的dc路径,并且电压源900和901(相当于电压源116和117)连接到单个电极904和905,电压源不连接电流计114和115。在该结构中,连接到跨阻抗放大器401的电压源为电流输入端子侧。向参考端子输入的电位例如可以是gnd等基准电位。由此,跨阻抗放大器401以使输出与基准电位匹配的方式动作。图5中的跨阻抗放大器401的输出是电压ve与偏置电压vb之和,所以需要减去偏置电压vb的差分放大器402,但图9中的跨阻抗放大器401的输出未被叠加偏置电压vb,所以不需要差分放大器402,电路被简化。
<实施方式2>
图10是本发明的实施方式2的生物分子测量装置的结构图。本实施方式2的生物分子测量装置除了具备在实施方式1中说明的结构以外,还具备用于使偏置电压偏移的dc电压源vofst。dc电压源vofst具有使电压源116~117供给的电压的中心电压偏离基准电极104的电位的作用。
作为dna的性质,已知进行如下动作,即如果外部电场的变化为某频率(例如100hz以下)则dna跟随外部电场的变化而移动,另一方面,如果成为高频(例如10khz~10mhz),则dna本身不响应电场且不移动(例如非专利文献:“conformationdependentnon-linearimpedanceresponseofdnainnanofluidicdevice,”pungetmongkol,etal.,proc.ieeeinternationlaconferenceonnanotechnology,2015)。并且,由于dna在高频区域中极化,所以有dna通过与外部电场的相互作用而线性地延伸的性质。因此,通过将调制频率设为比dna的响应频率更快,并且为溶液中的离子能够响应的频率以下,能够在线性地拉伸dna的同时测定阻塞电流。
作为纳米孔的课题,列举有以下可能,即有效的分子直径由于dna缠结或者自组织而增大,堵塞纳米孔并降低阻塞电流的测定精度。若在上述的频带进行调制则dna为线性,所以具有能够减少由堵塞引起的测定精度降低的可能性的优点。为了对dna进行排序,优选以恒定速度在纳米孔中进行运输。根据本实施方式2,能够以恒定速度运输dna,并能够使阻塞电流的信号品质提高。在不存在dc电压源vofst的情况下,例如能够通过在基准电极104与第一电极106之间产生电位差来运输dna。
图11是本实施方式2的变形例。图11所示的生物分子测量装置通过促动器1100来运输dna。优选的是能够以1nm以下的位置分辨率来控制促动器1100,例如使用压电元件的促动器是合适的。在促动器1100的末端连接有实施了用于固定dna的修改的基板1101,并在此固定测定对象的dna样本1102。
本变形例中的dna的碱基序列决定方法如下。首先,向接近纳米孔110的方向驱动促动器1100,使dna样本1102的末端向纳米孔110附近接近。此时,通过偏移电压源vofst向第一电极106施加以基准电极104为基准的正电压,从而通过纳米孔110附近的电场将dna样本1102引导向纳米孔110内。能够通过阻塞电流降低来确认dna样本1102是否进入纳米孔110。接下来,向远离基板1101的方向驱动促动器1100,并且,施加调制后的偏置电压来测定阻塞电流的变化,由此决定碱基序列图案。在该期间中,理想的是,也通过偏移电压源vofst来施加以基准电极104为基准的正电压。根据这样的结构,在解读碱基序列图案时在朝向第一电极106的方向上对dna样本1102给予张力f,能够期待使dna样本1102呈线性伸长的效果。由此,能够稳定地运输dna样本1102,并提高阻塞电流的测定精度。
<实施方式3>
图12是本发明的实施方式3的生物分子测量装置的结构图。本实施方式3的生物分子测量装置除了具备在实施方式1中说明的结构以外,还具备校准电路1200和电压源1205。在本实施方式3中,在投入dna样本前,校准电路1200监视电流计114和115的值并且控制电压源116、117、1205的输出信号。由此,能够计算以ci为首的寄生电容分量。
具体而言,若将电压源117固定为基准电压,用同一信号(同一频率、同一振幅、同一相位)来驱动电压源1205和116,则电流计114测量的电流是流过ci的电流分量。能够根据此时的驱动频率/驱动振幅/电流量来计算ci。同样地,若将电压源1205固定为基准电压,用同一信号驱动电压源116和117,则能够根据电流计114测量的电流计算ch1的寄生电容cm1。也适用于寄生电容cm2。
运算装置405能够预先计算这些寄生电容ci、cm1、cm2。运算装置405通过针对电流计114的测量结果使用公式2~公式3,能够计算与iin(t)中的irp1相当的分量。该情况下,不需要使用用于从iin(t)中提取irp1的同步检波电路,而是对电流计114的测量结果进行ad转换并直接移交给运算装置405即可,所以具有能够简化电路结构的优点。
图13是表示运算装置405求出寄生电容的过程的图。用户首先对各腔室填充溶液(s1301)。其后,校准电路1200如上述那样设置各电极间的电位差,并从各电压源施加调制信号(s1302)。各电流计测定电流信号,运算装置405根据其结果计算各寄生电容(s1303)。为了提高精度也可以反复进行相同的处理(s1304)。若计算寄生电容结束则向腔室导入dna样本(s1305),并测定阻塞电流(s1306)。根据该过程,能够准确地计算由电解质溶液接触形成的各种寄生分量,并且,能够抑制伴随dna样本的投入导致的阻塞电流的变化的影响,所以能够提高阻塞电流的测定精度。
<实施方式4>
图14是说明本发明的实施方式4的生物分子测量装置中的偏置电压的施加定时的波形图。在本实施方式4中,在ch1与ch2之间分时地间歇地施加偏置电压vb。
图15是本实施方式4中的1ch的电压源116和电流计114的结构例。图15所示的电路结构除了具备在实施方式1中说明的结构以外,还具备备用电压供给电源vstby、偏置电压选择开关1400、驱动定时控制电路1401。在图14的期间1300中,对ch1施加偏置电压vb。该期间,ch2的偏置电压vb固定为备用电压vstby。在期间1301中更换ch1和ch2。根据这样的结构,相邻沟道间的阻塞电流在时间轴上被分离,因此能够进一步减少串扰。
在测定阻塞电流时对纳米孔附近施加高电场,所以若长时间持续施加偏置则孔径有可能增大。在本实施方式4中,通过间歇地驱动偏置电压vb,能够减少对纳米孔110施加电压的时间,并能够延长纳米孔110的寿命。
进一步,可以将通过驱动定时控制电路1401激活ad转换器404的定时和施加偏置电压vb的定时同步。根据这样的结构,能够将激活ad转换器404的时间设为必要的最小值,并抑制装置的消耗电力。若同样地将激活滤波电路403的定时也与施加偏置电压vb的定时同步,则能够进一步抑制消耗电力。
<实施方式5>
图16是本发明的实施方式5的生物分子测量装置的结构图。在本实施方式5中,设置多个在实施方式1中说明的放大电路406并配置成阵列状,并且,设置电源vb1和vb2作为各放大电路406的电压源。对于相邻的放大电路406,使用不同的偏压电源。在图16所示的例子中,通过电源vb1对ch11进行偏置,并且通过电源vb2对与ch11在上下左右方向相邻的ch21和ch12进行偏置。若将vb1和vb2的输出分别设为不同的频率的正弦波,则能够抑制具有最大寄生电容的相邻沟道间的串扰。
若对放大电路406进行阵列配置,则在各ch的输出信号的布线间也存在寄生电容cw,所以成为在输出期间产生串扰的重要因素。在本实施方式5中,相邻沟道间的输出实施了不同的调制,所以例如vo11和vo12通过后段的锁定放大器700将各自的调制波vb1、vb2解调为参照信号,从而能够将输出容易地分离。另外,因为每个沟道共用偏置电压源vb1和vb2,所以能够减少必要的硬件量。
<实施方式6>
图17是本发明的实施方式6的生物分子测量装置的结构图。在本实施方式6中,设置多个在实施方式1中说明的放大电路406并配置成阵列状,并且,设置4个电源vb1、vb2、vstby、vzap作为各放大电路406的电压源。进一步,每个沟道具备选择连接哪个偏压电源的开关1601及其控制电路1600。
在阻塞电流测定时,与实施方式5相同,通过对相邻沟道施加不同的偏置信号vb1、vb2来确保较高的沟道间分离性能。另一方面,在dna运输中存在纳米孔110堵塞的情况。若堵塞一次,则不能进行之后的碱基序列的解读,所以在发生了堵塞的情况下需要随时消除堵塞。在本实施方式6中,设为能够对发生了堵塞的纳米孔110选择性地施加负电压vzap,并对dna施加与运输方向相反方向的力来消除堵塞。
图18是ch11、ch21、ch22的偏置电压的波形例。根据偏置电压波形1800和1801可知,在通常的测定阻塞电流时,相邻的沟道ch11和ch21对于偏置电压以相互不同的频率施加调制。波形1804是对ch21的输出信号vo21进行了检波后的阻塞电流vo21d的波形。若纳米孔110堵塞,则阻塞电流如波形1805那样较长时间稳定在较低的电平。运算装置405基于预先决定的阻塞电流电平的阈值和无变动时间的阈值来判定纳米孔110是否堵塞。在判断为堵塞的情况下,经由控制电路1600使用开关1601仅选择性地对堵塞的孔将偏置电压切换为vzap。于是,如波形1802那样,偏置电压vb向负侧较大地变化。其结果,对dna赋予与运输方向相反的力,并能够消除纳米孔110的堵塞。
这样的堵塞消除动作也可能导致电压变化大于阻塞电流的信号变化,所以对相邻的频道造成串扰。但是,由于与实施堵塞消除动作的沟道相邻的沟道对阻塞电流信号进行调制、解调,所以能够抑制由堵塞消除动作引起的串扰的影响。在通过堵塞消除动作对相邻沟道的纳米孔110施加意外的过电压而可能扩大孔径的情况下,也可以将相邻沟道的偏置电压固定为备用电压vstby。由此,能够减少相邻沟道的孔径的扩大。
<本发明的变形例>
本发明并不局限于上述的实施例,包含有各种变形例。例如,上述的实施例是为了以容易理解的方式说明本发明而详细地说明的内容,不一定限定为具备说明的所有结构。另外,能够将某实施例的结构的一部分置换为其他的实施例的结构,另外,也能够对某实施例的结构添加其他的实施例的结构。另外,针对各实施例的结构的一部分也能够进行其他的结构的添加、删除、置换。
附图标记的说明
101:基准腔室
102:第一腔室
103:第二腔室
104:基准电极
105:电解质溶液
106:第一电极
107:第二电极
108:纳米孔芯片
109:膜
110:纳米孔
114~115:电流计
116~117:电压源
120~124:分隔壁
401:跨阻抗放大器
402:差分放大器
403:滤波电路
404:ad转换器
405:运算装置
406:放大电路
407:电压源
701:模拟混频器
702:滤波器
703:移相器
800:保护电极
801:布线
900~901:电压源
904~905:单个电极
906:分隔壁
1100:促动器
1101:基板
1200:校准电路
1205:电压源
1400:偏置电压选择开关
1401:驱动定时控制电路
1600:控制电路
1601:开关。
- 还没有人留言评论。精彩留言会获得点赞!