对用两亲强碱性部分改性的聚糖进行电喷雾电离的方法与流程
本申请要求2016年6月21日提交的美国临时专利申请no.62/352,755的优先权,该申请以引用方式并入本文。
背景技术:
当受到电喷雾电离时,甲酸基流动相中的标记的聚糖易于经由源内断裂而降解,即使当采用相对温和的质谱源条件且聚糖用强碱性残基进行改性时也是如此。因此需要获得对这些标记的聚糖的更高灵敏度、更少含糊性的ms分析。
技术实现要素:
本文提供了对已用两亲强碱性部分改性的聚糖进行电喷雾电离的溶液、方法和系统。用于电喷雾电离的溶液包含具有两亲部分和pka>5的碱性残基的多种聚糖以及选自胺、氨、氨盐、二乙胺或三甲胺的一种或多种挥发性组分。在一个实施方案中,该溶液具有约3至约6之间的ph以及约0mm至约500mm之间的离子强度。在一个实施方案中,该溶液还可包含溶剂。在一个实施方案中,该溶剂可为乙腈、甲醇、四氢呋喃、乙醇或异丙醇。此外,在一个实施方案中,该聚糖用两亲强碱性部分进行改性,该两亲强碱性部分具有约1与约3之间的logp值。在一个实施方案中,该两亲强碱性部分具有大于6的pka值。在一个实施方案中,该碱性残基为叔胺。在一个实施方案中,该聚糖的两亲部分由rfms赋予。在一个实施方案中,这些聚糖可为o-聚糖或n-聚糖。
另外,本文提供了用于聚糖分析的色谱系统,这些色谱系统包括溶液,该溶液具有经改性而包含两亲部分和pka>5的碱性残基的多种聚糖以及选自胺、氨、氨盐、二乙胺或三甲胺的一种或多种挥发性组分;以及含疏水性固定相的色谱装置。在一个实施方案中,该溶液具有约3至约6之间的ph以及约0mm至约500mm之间的离子强度。在一个实施方案中,该色谱系统具有反相保留机制。在一个实施方案中,该色谱装置是反相色谱与混合模式反相色谱的组合。在一个实施方案中,这些聚糖可为o-聚糖或n-聚糖。
本文还提供了检测聚糖的方法,所述方法包括以下步骤:(1)提供具有聚糖的样品;(2)在该样品中形成衍生化的聚糖,其中该聚糖经改性而包含两亲部分和pka大于5的碱性残基;(3)在色谱装置中及在包含选自胺、氨、氨盐、二乙胺或三甲胺的一种或多种挥发性组分的溶液中分离衍生化的聚糖,该溶液具有约3至约6之间的ph以及约0mm至约500mm之间的离子强度;以及(4)使用电喷雾电离来检测分离的衍生化的聚糖。在一个实施方案中,这些聚糖可为o-聚糖或n-聚糖。
附图说明
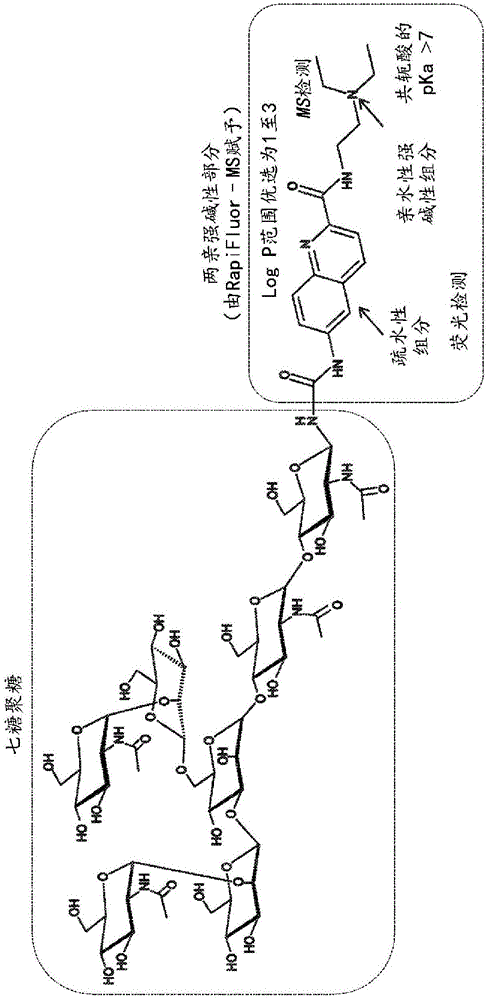
图1示出了用两亲强碱性部分改性的聚糖的示例性化学结构。
图2示出了用两亲强碱性部分改性的聚糖的又一个示例性化学结构。
图3a是从包含0.1%甲酸/20%乙腈的溶液电喷雾时rfms标记的fa2g2聚糖的esi质谱。
图3b是从包含大约20:80乙腈和50mm甲酸铵(ph为4.4)的溶液电喷雾时标记的fa2g2聚糖的esi质谱。
图3c是从包含0.1%甲酸/20%乙腈的强酸性esi+条件电喷雾且由用ph3与ph6之间的挥发性铵盐缓冲的溶液加以稳定时2-ab标记的fa2g2聚糖的esi质谱。
图3d是从包含大约20:80乙腈和50mm甲酸铵(ph为4.4)的溶液电喷雾时2-ab标记的fa2g2聚糖的esi质谱。
具体实施方式
聚糖在整个生物系统中以游离状态以及作为糖蛋白、糖脂和蛋白聚糖的一部分以缀合形式存在。聚糖在各种生物和生理过程中发挥作用。此外,聚糖的结构纷繁复杂。因此,对聚糖谱进行分析可较困难。
由于近年来在质谱仪器方面取得了进展,液相色谱、荧光和ms的组合已普遍作为常规表征荧光标记的n连接的聚糖的分析仪器平台。相对定量和分子量测量可在单次分析中完成。shigeosuzukietal.,comparisonofthesensitivitiesofvariousderivativesofoligosaccharidesinlc/mswithfastatombombardmentandelectrosprayionizationinterfaces,1006analchem2073(1996)(shigeosuzuki等人,“具有快速原子轰击和电喷雾电离接口的lc/ms中低聚糖的各种衍生物的灵敏度的比较”,第1006卷,《分析化学》,第2073页,1996年)。
高效液相色谱(“hplc”)可用于分析聚糖谱。这些方法包括但不限于反相色谱、离子交换色谱和亲水作用色谱(“hilic”)分离。可通过hilic或另选地通过使用石墨固定相(诸如,多孔石墨化碳)和用甲酸酸化的流动相的反相色谱分离释放的聚糖。另外,可通过毛细管电泳分离聚糖。
分离后,可使用吸光度或荧光检测器执行检测过程。当在分离后从色谱柱洗脱每种标记的聚糖时,通过质谱仪和/或其光学特性检测其存在和量。该测定法的灵敏度当然取决于所产生的信号的强度。用于分析聚糖的方法已变得相当复杂。可分析聚糖的示例性分析仪器和相关联的色谱装置包括但不限于毛细管电泳(“ce”)、高效阴离子交换色谱与电化学检测联用(“hpaec-ped”)、具有荧光检测的亲水作用色谱(“hilic-lc/flr”)、反相液相色谱与质谱联用(“rplc/ms”)以及基质辅助激光解吸/电离质谱(“maldi-ms”)。
尽管如此,聚糖不能经由电喷雾电离(“esi”)有效电离,并且不易通过单独的液相色谱-质谱(“lc-ms”)检测,因为吸光度和荧光响应非常弱。甚至无法检测较大的聚糖,诸如高度唾液酸化和多唾液酸化的聚糖,因为它们极其不稳定并且表现出低电离效率。
因此,为了增加检测灵敏度,可使用衍生化试剂将聚糖转化为衍生聚糖(本文也称为“标记的聚糖”)。衍生化试剂可通过使衍生化的聚糖的灵敏度、收率和稳定性最大化来影响该分析的灵敏度和精确度。因此,已证实某些衍生试剂(本文也称为“试剂”或“标记试剂”)能形成稳定、高度荧光性ms衍生化合物和缀合聚糖。标记试剂的选择是分析程序的重点。
例如,我们实验室近来的工作已证实,具有以下化学结构的新型葡基胺标记试剂rapifluor-ms(“rfms”):
可形成在基于正离子模式电喷雾电离(“esi+”)的hilic分析期间具有增强的ms灵敏度的标记的聚糖(“rfms标记的聚糖”)。以引用方式并入本文的lauber,m.a.etal,rapidpreparationofreleasedn-glycansforhilicanalysisusingalabelingreagentthatfacilitatessensitivefluorescenceandesi-msdetection,analchem,87(10),5401-9(2015)(lauber,m.等人,“使用促进灵敏荧光和esi-ms检测的标记试剂快速制备释放的n-聚糖以供hilic分析”,《分析化学》,第87卷,第10期,第5401-5409页,2015年)。图1和图2示出了用rfms标记的七糖聚糖部分,使得其得以用两亲强碱性部分改性。正如所述,这些特定试剂(rfms和instantpc)将两亲标签掺入到聚糖上,从而增加分析物疏水性并引入碱性残基(pka>5),即叔胺。这些特性界定了展现气相质子亲和力的标记的聚糖的结构。例如,rfms标记的聚糖可显示出esi+ms期间的高电离效率以及相应地高电荷态(≥2+)质子化离子。
由rfms试剂赋予的聚糖标签(图1)仅代表两亲强碱性部分的一个示例。可使用具有带相同特性的对应标记部分的其他试剂,包括但不限于以下文献指出的标记试剂:以引用方式并入本文的名称为rapidfluorescencetaggingofglycansandotherbiomoleculeswithenhancedmssignals(“实现ms信号增强的聚糖和其他生物分子的快速荧光标记”)的美国专利申请no.14/458,760第2页第4行至第4页第9行;第11页第4行至第25页第18行以及第29页第1行至第30页第10行;以引用方式并入本文的名称为methodforanalysisofcompoundswithaminogroupandanalyticalreagenttherefor(“用于分析具有氨基的化合物的方法及其分析试剂”)的美国专利no.7,148,069第8栏第56行至第9栏第54行以及第15栏第22至29行;以引用方式并入本文的名称为methodandapparatusforanalyzingcompoundswithaminogroup(“用于分析具有氨基的化合物的方法和设备”)的美国专利no.7,494,815第7栏第19行至第11栏第24行;以引用方式并入本文的美国专利no.8,124,792第2栏第13行至第4栏第5行以及第7栏第11行至第17栏第20行;以及以引用方式并入本文的名称为activatedcarbamatescompounds(“活化的氨基甲酸酯化合物”)的美国专利no.5,296,599第4栏第66行至第5栏第32行以及第5栏第66行至第7栏第28行。这些试剂各自包含logp值在0与5之间、优选地在1与3之间且pka值大于6、优选地大于8的两亲强碱性部分。附加示例性试剂可包含通过仲胺、脲或酰胺键掺入到聚糖中的普鲁卡因胺和普鲁卡因部分。参见美国临时专利申请no.62/352,724和62/352,734。如本文所用,术语“部分”意指一个化学官能团或多个化学官能团,包括但不限于喹啉环或与二乙氨基乙基化合的喹啉环(guinolinering)。可结合本发明方法和系统使用的附加示例性部分在以下文献中有所描述:以引用方式并入本文的作为wo2013/049622公布的申请no.pct/us2012/057996第21页第9行至第30页第10行;以引用方式并入本文的美国公布no.2016/0139136第2页第9行至第4页第8行(在式i中以“fl-r3”形式提及)。
当滴定到ph4.4的常规hilic缓冲液(诸如甲酸铵缓冲液)用于流动相时,用具有两亲强碱性部分的试剂标记的聚糖可易适合于hilic(以及esi+ms)。尽管如此,在某些常规rplc电喷雾条件下,在将标记的聚糖用于反相液相色谱(“rplc”)时面临意料之外的问题。例如,有时标记的聚糖被强保留并且不能充分拆分。因此,本文描述了具有可用于促进在基于反相液相色谱的分离期间标记的聚糖的检测、具体地促进对用两亲强碱性部分标记的聚糖的esi-ms分析所作的检测的溶液条件的方法和系统,其中从ph在2.8与7或约3与约6之间的溶液中对聚糖进行电喷雾。
用于衍生化的聚糖的高效且有效的分析的一般方法包括三个紧密相关的过程:(1)该样品中衍生化的聚糖的形成;(2)衍生化的聚糖的分离;以及(3)分离的衍生化的聚糖的检测。按以下方式通过若干化学反应之一执行衍生化的聚糖的形成:使包含聚糖的生物样品(或已从生物样品分离的聚糖)与一种或多种试剂反应,从而得到衍生化的聚糖(本文有时称为“衍生化的化合物”、“衍生化的聚糖”、“标记的聚糖”、“rfms标记的聚糖”或“标记的化合物”)。用于形成衍生化的聚糖的不同过程包括但不限于快速标记或还原胺化。此类过程在以引用方式并入本文的作为wo2016/069664公布的pct/2015/057848中有所描述,特别是在第2和4页进行了概述。然而,有效标记的聚糖的形成仅是第一步。
标记的聚糖的分离处理基于衍生化的聚糖的化学结构的差异。参见例如qing,y.etal.,arapidsamplepreparationmethodformassspectrometriccharacterizationofn-linkedglycans,rapidcommun.massspectrom2005192331-2336(2008)(qing,y.等人,“用于n连接的聚糖的质谱表征的快速样品制备方法”,《质谱学快讯》,2005年,第19卷,第2331-2336页)。标记的聚糖彼此相异的方式可与前体化合物的化学结构相异的方式相同。在本发明方法中,分离标记的聚糖,使得检测器信号可与每种聚糖的浓度正确地相关。如上所述,在这些方法中,标记的聚糖由反相保留机制单独地或部分地进行色谱分离,并且随后通过电喷雾电离进行检测。
一般来讲,源内断裂(“isf”)与电喷雾电离(“esi”)源接口处的脱溶剂和活化能直接相关。脱溶剂/活化能由锥孔电压(也称为喷嘴-分离器电压或去簇电压)控制。更高的脱溶剂/活化能可增强离子收率,但同时会因为升高的离子能而促进isf,从而影响最终离子收率。在实践中,研究人员可通过平衡这两个成反比的因素,使离子增益最大化,从而优化esi-ms脱溶剂过程。
当不通过hilic分离时,通常使用色谱装置通过反相液相色谱和其他色谱方法来分离从生物混合物释放的聚糖。对于反相色谱而言,色谱装置可为石墨固定相(包括但不限于多孔石墨化碳),以及通常仅基于甲酸的强酸性流动相。west,c.etal.,porousgraphiticcarbon:aversatilestationaryphaseforliquidchromatography,jchromatogra1217(19),3201-16(2010)(west,c.等人,“多孔石墨碳:液相色谱的通用固定相”,《色谱法期刊a》,第1217卷,第19期,第3201-3216页,2010年);ruhaak,l.r.,glycanlabelingstrategiesandtheiruseinidentificationandquantification,analbioanalchem397(8),3457-81(2010)(ruhaak,l.r.,“聚糖标记策略及其在鉴定和定量方面的应用”,《分析和生物分析化学》,第397卷,第8期,第3457-3481页,2010年)。然而,当在甲酸基流动相中受到电喷雾电离时,用强碱性残基改性的标记的聚糖易于经由源内断裂而降解-即使当采用相对温和的ms源条件时也是如此。
图3a和图3b示出了当从强酸性esi+条件进行电喷雾但由用ph3与6之间的挥发性铵盐缓冲的溶液加以稳定时rfms标记的n-聚糖可不稳定。作为比较,在图3a中,示出了从由大约0.1%甲酸/20%乙腈组成的溶液电喷雾的rfms标记的fa2g2聚糖的esi质谱。在图3b中,示出了从包含大约20:80乙腈:50mm甲酸铵(ph4.4)的溶液电喷雾的rfms标记的fa2g2聚糖的esi质谱。在这些图中,“-hexnac”表示n-乙酰化己糖胺残基的失去。“-hex”表示己糖残基的失去。根据牛津命名法对聚糖进行命名。
图3a展示了通过从包含大约0.1%甲酸/20%乙腈的溶液中电喷雾出聚糖而获得的rfms标记的fa2g2的质谱。发生了显著的源内断裂。应当注意,充电一直进行到三重质子化电荷态。问题更大的是,该谱图显示了因源内断裂引起的显著离子水平。已发现即使使用比此前公布为rfms标记的n-聚糖的最佳条件的源参数相对较低的源电势和温度,也会发生这种现象。参见例如以引用方式并入本文的lauber,m.a.;etal.,rapidpreparationofreleasedn-glycansforhilicanalysisusingalabelingreagentthatfacilitatessensitivefluorescenceandesi-msdetection,analchem2015,87(10),5401-9,at5407to5408(lauber,m.等人,“使用促进灵敏荧光和esi-ms检测的标记试剂快速制备释放的n-聚糖以供hilic分析”,《分析化学》,2015年,第87卷,第10期,第5401-5409页中的第5407至5408页)。比较而言,更高ph的溶液可稳定标记的聚糖免受isf的影响。如图3b所示,从由大约20:80乙腈:50mm甲酸铵(ph4.4)组成的溶液电喷雾的rfms标记的fa2g2聚糖的esi质谱。该质谱示出了当从ph4.4甲酸铵缓冲液电喷雾时达到双重质子化电荷态而没有明显源内断裂的理想电离。
如本文所述,本发明方法提供了可用于促进用两亲强碱性部分改性的聚糖的液相色谱-质谱(“lc-ms”)分析的溶液条件。已发现,当从包含大约20:80乙腈:50mm甲酸铵/10mm甲酸(ph4.4)的溶液电喷雾时,rfms标记的fa2g2显示出信噪比高得多、背景更低的质谱。这些效应与此前对用常规荧光团标签诸如2-氨基苯甲酰胺(“2-ab”)标记的聚糖的观察结果相反。参见图3a和图3b。
当从强酸性溶液(ph≤3)中电喷雾出时,用两亲强碱性残基标记的聚糖可被迫达到非常高的电荷态和低m/z值。看起来高电荷态、低m/z物质本质上不稳定,并且易于发生源内断裂。可通过使用本文所述的溶液条件避免该问题。
因此在考察该现象后,我们已发现,使用已用挥发性组分(包括但不限于甲酸铵、甲酸、乙酸铵和/或乙酸)缓冲的ph3至ph6溶液时,用两亲强碱性残基标记的聚糖被最佳地电喷雾。在聚糖、尤其是用两亲强碱性残基标记的那些聚糖的lc-esi+ms分析期间使用挥发性ph3至ph6缓冲液可使标记的聚糖达到稳定。本文所提供的溶液和溶液条件对于用两亲强碱性残基标记的聚糖的反相lc-ms和直接输注ms而言是新颖的。已证实用两亲强碱性残基标记的聚糖具有经历源内断裂的倾向。本文提出的溶液可与不止一种液相色谱技术相结合。例如,这些溶液条件可与常规反相色谱和混合模式反相色谱相结合。混合模式色谱的代表可为离子交换保留与基于疏水性的保留机制(如果为反相液相色谱的话)的组合。因此,当分离过程的至少一种机制基于反相保留机制时,在esi期间对标记的聚糖进行稳定化。
如本文所用,术语“反相”描述了与正相hplc正好相反的色谱模式。在正相hplc中,固定相是极性的,并且保留具有类似极性的流动相的化合物。极性类似于流动相的化合物将优先被吸引到其上,并且更快流过固定相。这样,基于每种化合物对于每个相的相对吸引力的差异,通过改变分析物的速度而形成了分离。
换句话讲,在正相色谱中,固定相是亲水性的,并且因此对流动相中的亲水性分子具有强亲和力。因此,流动相中的亲水性分子往往会结合(或“吸附”)到柱,而疏水性分子会穿过柱并首先被洗脱。在正相色谱中,可通过增加流动相中的溶液的极性,从而将亲水性分子从柱洗脱下来。
反相色谱(也称为“rpc”、“反相色谱法”、“反相液相色谱”、“rplc”或“疏水色谱”)是使用疏水性固定相的色谱方法。rpc是指液相(而非气相)色谱。历史上,使用共价结合到固相载体的烷基链的技术的推出产生了疏水性固定相或色谱装置,其对疏水性化合物具有更强亲和力。疏水性固定相的使用可被视为正相色谱的相反情形或“反面”,并且因此使用术语“反相色谱”。反相色谱通常采用极性(含水)初始流动相。因此,极性流动相中的疏水性分子往往会吸附到疏水性固定相,并且流动相中的亲水性分子将穿过柱并首先被洗脱。可使用降低疏水相互作用的有机(非极性)溶剂来减小流动相的极性,从而将疏水性分子从柱洗脱下来。该分子疏水性越大,其结合到固定相越强,并且洗脱该分子所需的有机溶剂的浓度越高。用于其他色谱方法的数学和实验考虑因素也可应用于反相色谱(例如,分离解析度取决于柱长)。
理论上,实现充分填充的任何惰性非极性物质或色谱装置均可用于反相色谱,因为用于反相色谱的色谱装置是疏水性固定相。一种此类色谱装置包括具有十八烷基碳链(c18)键合的二氧化硅的柱(usp分类l1)。其他色谱装置包括c8键合的二氧化硅柱(l7-166柱)、纯二氧化硅柱(l3-88柱)、氰基键合的二氧化硅柱(l10-73柱)以及苯基键合的二氧化硅柱(l11-72柱)。应当注意,c18、c8和苯基键合的二氧化硅是专用反相树脂,而氰基柱可用于反相模式,具体取决于分析物和流动相条件。并非所有c18柱都具有相同保留特性。可在与不同短链有机硅烷(在第二步中用于覆盖其余硅烷醇基(封端))的单体反应或聚合反应中执行二氧化硅的表面官能化。虽然整体保留机制保持不变,但不同固定相的表面化学的细微差异将引起选择性的变化。柱可具有不同极性。例如,pfp是五氟苯基。cn是氰基。nh2是氨基。ods是十八烷基或c18。odcn是c18和腈类的混合模式柱。scx是用于分离有机胺的强阳离子交换基底。sax是用于分离羧酸化合物的强阴离子交换。
另外,水或含水缓冲液和有机溶剂的混合物可用于将分析物从反相柱洗脱下来。这些溶剂必须可与水混溶,并且最常用的有机溶剂是乙腈、甲醇和四氢呋喃(“thf”)。可使用其他溶剂,诸如乙醇或2-丙醇(异丙醇)。可执行等度洗脱(其中水-溶剂组成在分离过程期间不改变),或可通过使用溶液梯度来执行洗脱(水-溶剂组成在分离过程期间改变,通常方式是减小极性)。流动相的ph对分析物的保留可具有重要作用,并且可改变某些分析物的选择性。可通过使用离子配对(也称为离子相互作用)在反相柱上分离带电分析物。该技术称为反相离子配对色谱。
利用与c18键合的反相固定相,分离过程往往会产生有问题的共洗脱,因为净电荷方面有差别的聚糖结构之间的选择性通常较差。从糖蛋白释放的n-聚糖与糖蛋白本身完全不同。具体地讲,释放的n-聚糖表现出不同于肽的电荷特性,因为它们通常仅含中性或酸性亲水残基。释放的n-聚糖中的酸性残基及其羧酸或磷酸基团对聚糖物质的特性和净电荷状态具有显著影响。含更多酸性残基的聚糖将具有更负的净电荷。类似地,这些酸性物质通常与生物医药的疗效相关。
此外,色谱装置(诸如美国专利公布no.2013/03199086中描述的那些)提供了多峰色谱介质(保留机制)和聚糖分析方法,这提供了不同生物大分子之间的高解析度,以及基于大小、组成、结构(例如,异构、键合)和/或电荷的独特选择性。这些类型的柱允许通过标准方法(例如,质谱、荧光检测)检测从介质中洗脱的大分子,而无需或很少需要净化或纯化事后分析和预检测(例如,荧光标记)。此外,为了实现足以完全分离聚糖(特别是n-聚糖)的灵敏度和选择性,可使用具有含色谱表面的高纯色谱材料(“hpcm”)的色谱装置。此处,色谱表面(保留机制)具有疏水性表面基团以及一种或多种可电离改性剂。此类hpcm在2016年4月24日提交的未公布的美国专利申请no.62/326,783第5和6页中有所描述,该申请以引用方式并入本文。
在本发明方法中,该溶液可用甲酸铵、甲酸、乙酸铵和/或乙酸等进行缓冲。聚糖洗脱及被电喷雾时的流动相的离子强度可在无限低和接近0mm到约500mm的范围内,以及介于约1与约100mm之间。该现象可归因于可与聚糖残基配对的抗衡离子。这样,本文提供的方法的一个方面是使用挥发性组分,诸如ph3至6条件下的胺化合物。同样,虽然标记的聚糖的分离在本文中描述为是在乙腈/水流动相系统中进行的,但可在流动相系统中利用其他溶剂且将它们配对在一起,这些溶剂包括但不限于甲醇、异丙醇、丁醇、正丙醇和四氢呋喃。挥发性组分是胺,包括但不限于氨、二乙胺或三乙胺。在一个实施方案中,可出于分析原因,例如为了收集组成或结构信息,而有目的地利用极限充电,该极限充电在从强酸性条件电喷雾出的rfms标记的聚糖的质谱中是显而易见的。该方面可结合用两亲强碱性部分标记的任何聚糖一起使用。
实施例i
用rapifluor-ms与2-ab标记的聚糖的电喷雾电离质谱(esi-ms)
根据先前公布的条件从人igg(sigmai4506)制备rfms和2-ab标记的n-聚糖。参见例如lauber,m.a.;yu,y.q.;brousmiche,d.w.;hua,z.;koza,s.m.;magnelli,p.;guthrie,e.;taron,c.h.;fountain,k.j.,rapidpreparationofreleasedn-glycansforhilicanalysisusingalabelingreagentthatfacilitatessensitivefluorescenceandesi-msdetection,analchem87(10),5401-9(2015)(lauber,m.a.、yu,y.q.、brousmiche,d.w.、hua,z.、koza,s.m.、magnelli,p.、guthrie,e.、taron,c.h.、fountain,k.j.,“使用促进灵敏荧光和esi-ms检测的标记试剂快速制备释放的n-聚糖以供hilic分析”,《分析化学》,第87卷,第10期,第5401-5409页,2015年)。
然后从由大约0.1%甲酸/20%乙腈组成的溶液或由大约80:20乙腈:50mm甲酸铵(ph4.4)组成的溶液以200μl/min的流速对标记的fa2g2聚糖进行电喷雾。使用waterssynaptg2-s质谱仪采集质谱。在对比如图3a、图3b、图3c和图3d所示的电喷雾条件之间的差异的这些分析中采用相对温和的ms条件。
下面紧接的是所利用的质谱条件:
- 还没有人留言评论。精彩留言会获得点赞!