肽交换系统和方法与流程
本申请要求2016年5月13日提交的美国临时申请号62/336,189和2016年11月15日提交的美国临时申请号62/422,409的权益。这些申请各自的内容通过引用以其整体结合到本文中。
发明背景
在免疫应答期间,抗原呈递细胞通过mhci类和ii类分子与抗原特异性t细胞受体的相互作用激活t淋巴细胞,其进而触发cd4+和cd8+t淋巴细胞增殖。通过分别使用mhcii类和i类四聚体,可能检测这些抗原特异性cd4+和cd8+t细胞,如altman等的美国专利号5,635,363中所述,其通过引用以其整体结合到本文中。mhci类四聚体通过四个生物素化的mhc-肽单体与荧光染料-缀合的链霉亲和素的结合形成。t细胞受体识别四聚体的能力依赖于mhc等位基因和肽序列二者。对特定的抗原/等位基因组合具有特异性的cd8+t淋巴细胞的百分数可通过在免疫荧光多色测定中用荧光mhci类四聚体染色白细胞,接着流式细胞术分析来测定。mhci类单体包含mhc重链、β2微球蛋白和抗原肽。对于大多数mhci类分子而言,mhc-肽复合物的成功体外折叠依赖于肽与重链的结合,并要求肽以通常在纳摩尔范围的亲和力结合至重链。得到的四聚体是稳定的实体,其中肽与mhc蛋白紧密结合。
需要产生包含这样的肽的mhci类分子,所述肽可在折叠过程中较不紧密地结合重链,使得它们可容易地被目标肽或mhc结合分子替换,而不影响mhc复合物的完整性。肽被小分子交换或置换允许产生mhc-衍生的试剂,其可用于研究不同的抗原特异性cd8+t细胞群。一些技术已知用于在mhc蛋白中的肽交换,例如描述于springer等,美国专利公开号2014/0370524,其内容通过引用以其整体结合到本文中。然而,需要用于定量肽交换的技术。例如,对于用于流式细胞术染色的四聚体,这是需要的。
发明简述
在一个方面,本公开内容提供了对mhc蛋白进行肽交换(例如定量肽交换)的方法。mhc蛋白可以是i类或ii类分子,和它们可在任何多聚体状态(例如单体、四聚体、八聚体或十二聚体)下被交换。
在另一个方面,本公开内容提供了具有高的肽交换能力的mhci类四聚体,和用于产生它们的方法。
在另一个方面,本公开内容提供了含交换的肽的mhci类四聚体。
在另一个方面,本公开内容提供了用于进行本文公开的方法的组合物和试剂盒。
附图简述
图1a-1f说明用于进行本文所述的方法的示例性方案。图1a显示单个珠的选择以及双珠和更大团块的排除。图ib显示基于未使用的珠设置pmt电压和收获,以具有在第一个log十进位(约0.2-0.3)中的平均荧光强度(mfi)。图1c显示对fl1通道的补偿,以消除在fitc通道中的荧光染料干扰。图id显示对0%标记的肽(即100%肽交换)的校准水平。图ie显示对100%标记的肽(即0%肽交换)的校准水平。图if显示对于样品交换的示例性数据。
图2a是示例性的肽交换的示意图。图2b显示通过肽交换获得的四聚体使细胞染色,正如用mart-1肽初始制备的四聚体一样。
图3a和3b是本文所述的夹心免疫测定的示意图。
图4显示在通过流式细胞术测量的抗-dnp信号和实际退出的dnp-标记的肽水平之间的线性相关。
图5显示在通过流式细胞术测量的抗-dnp信号和实际捕获的dnp抗原之间的线性相关。
图6显示用退出肽mtyk(dnp)fpvt和ytvk(dnp)falv以及各种进入肽的肽交换结果。
图7显示用退出肽ilkekk(dnp)vhgv和ilkek(dnp)vhgv以及各种浓度的进入肽ylleftppv的肽交换实验的结果。
图8为对于各种肽测量的肽交换率与它们的预测的亲和力的图示。
图9为对于各种肽预测的亲和力与它们的测量的肽交换率的图示。
图10a-j显示对于复合物hla-a*24:02/qydpvaalf而言,天然和交换的四聚体用于染色表达t细胞受体的昆虫细胞的反应性。
图11显示对mhcii类等位基因hla-dr4的肽交换结果。
图12a-12e显示在复杂的混合物(疫苗)中肽交换的结果和将所述结果与基于细胞的t2移位测定和基于动物的ifn-γelispot测定进行比较。
发明详述
在一些方面,本公开内容提供了对mhc分子进行肽交换的方法,包括:
提供与第一种肽结合的mhc分子;和
使与第一种肽结合的mhc分子与第二种结合配偶体(任选地与第三种结合配偶体组合,任选地在肽交换因子存在的情况下)接触,其中接触步骤产生与第二种结合配偶体和任选地第三种结合配偶体结合的mhc分子。
在一些实施方案中,肽交换对一定数量的mhc分子进行。根据这些实施方案,所述方法包括:
提供第一数量的与第一种肽结合的mhc分子;和
向与第一种肽结合的mhc分子添加,任选地肽交换因子,和第二数量的第二种结合配偶体(任选地与第三种结合配偶体组合),从而形成得到的混合物,其包含与第一种肽结合的mhc分子或与第二种结合配偶体和任选地第三种结合配偶体结合的mhc分子,和未结合的第一种肽或未结合的第二种结合配偶体和任选地第三种结合配偶体。
在一些实施方案中,第二种结合配偶体是肽。
在一些实施方案中,第二种结合配偶体是mhc蛋白的非肽配体。
例如,如美国专利公开号us2008/0044405中所述,某些含贵金属离子的化合物可与ii类mhc蛋白形成复合物,和干扰它们的肽-结合能力。
在一些实施方案中,提供第二种和第三种结合配偶体。根据这些实施方案,第二种和第三种结合配偶体一起与mhc结合。例如,阿巴卡韦被认为结合mhc等位基因hla-b*57:01,这改变了结合沟,使得与未结合阿巴卡韦的hla-b*57:01相比,结合阿巴卡韦的hla-b*57:01可结合不同的肽。
在一些方面,本公开内容提供了对mhc分子进行肽交换的方法,包括:
提供与第一种肽结合的mhc分子;和
使与第一种肽结合的mhc分子与第二种肽接触(任选地在肽交换因子存在的情况下),其中接触步骤产生与第二种肽结合的mhc分子。
在一些实施方案中,肽交换对一定数量的mhc分子进行。根据这些实施方案,所述方法包括:
提供第一数量的与第一种肽结合的mhc分子;和
向与第一种肽结合的mhc分子添加,任选地肽交换因子,和第二数量的第二种肽,从而形成得到的混合物,其包含与第一种肽结合的mhc分子或与第二种肽结合的mhc分子,和未结合的第一种肽或未结合的第二种肽。
在上文的一些实施方案中,mhc分子是mhci类分子。在一些实施方案中,mhc分子是mhcii类分子。
在一些方面,本公开内容提供了对mhci类分子进行肽交换的方法,包括:
提供与第一种(即,退出)肽结合的mhci类分子;和
使与第一种肽结合的mhci类分子与第二种(即,进入)肽接触(任选地在肽交换因子存在的情况下),其中接触步骤产生与第二种肽结合的mhci类分子。
在一些实施方案中,肽交换对一定数量的mhci类分子进行。根据这些实施方案,所述方法包括:
提供第一数量的与第一种肽结合的mhci类分子;和向与第一种肽结合的mhci类分子添加,任选地肽交换因子,和第二数量的第二种肽,从而形成得到的混合物,其包含与第一种肽结合的mhci类分子或与第二种肽结合的mhci类分子,和未结合的第一种肽或未结合的第二种肽。
在一些方面,本公开内容提供了对mhcii类分子进行肽交换的方法,包括:
提供与第一种(即,退出)肽结合的mhcii类分子;和
使与第一种肽结合的mhcii类分子与第二种(即,进入)肽接触(任选地在肽交换因子存在的情况下),其中接触步骤产生与第二种肽结合的mhcii类分子。
在一些实施方案中,肽交换对一定数量的mhcii类分子进行。根据这些实施方案,所述方法包括:
提供第一数量的与第一种肽结合的mhcii类分子;和
向与第一种肽结合的mhcii类分子添加,任选地肽交换因子,和第二数量的第二种肽,从而形成得到的混合物,其包含与第一种肽结合的mhcii类分子或与第二种肽结合的mhcii类分子,和未结合的第一种肽或未结合的第二种肽。
在一些实施方案中,第二种结合配偶体(例如第二种肽)比第一种肽过量添加。在一些实施方案中,交换是完全的,使得得到的混合物不包含与第一种肽结合的mhc分子,例如mhci类分子。在一些实施方案中,交换是基本上完全的,和得到的混合物包含与第一种肽结合的mhc分子(例如mhci类分子)、与第二种结合配偶体(例如第二种肽)结合的mhc分子(例如mhci类分子)、未结合的第一种肽和未结合的第二种结合配偶体(例如第二种肽)。在一些实施方案中,交换是99%完全的,即,在得到的混合物中99%的mhci类分子与第二种结合配偶体(例如第二种肽)结合。在一些实施方案中,交换是95%完全的、90%完全的、85%完全的、80%完全的、75%完全的、70%完全的、65%完全的、60%完全的、55%完全的、50%完全的、40%完全的、30%完全的、20%完全的或10%完全的。
在一些实施方案中,第一种肽用第一种标记物标记。标记物可以具有肽的任何特征,其使得它可通过本领域已知的方法区分或检测。例如,标记物可以是由抗体识别的氨基酸序列,例如表位标签,或荧光团。本文公开了示例性的标记物和检测方法。在一些实施方案中,第一种标记物选自表位标签、荧光标签、猝灭剂、放射性标记物或氨基酸修饰,例如磷酸化、糖基化或硫酸化。在一些实施方案中,第一种标记物是表位标签,使得第一种肽展示第一种表位标签。在一些实施方案中,两种不同的标记物与退出肽的两个不同区域缀合。根据这些实施方案,可在裂解后(其中裂解可例如通过uv辐射或通过高碘酸盐进行),通过本文公开的方法对可裂解肽的两个得到的片段进行定量。
在一些实施方案中,第二种结合配偶体(例如第二种肽)用第二种标记物标记,所述第二种标记物可不同于第一种标记物。在一些实施方案中,第二种标记物选自表位标签、荧光标签、猝灭剂、放射性标记物或氨基酸修饰,例如磷酸化、糖基化或硫酸化。在一些实施方案中,第二种标记物是表位标签,使得第一种肽展示第一种表位标签。在一些实施方案中,第二种结合配偶体(例如第二种肽)不被标记。
在一些实施方案中,所述方法进一步包括定量肽交换的完全性。在一些实施方案中,这包括测定至少一项以下数量:与第一种肽结合的mhc分子的量,与第二种结合配偶体(例如第二种肽)结合的mhc分子的量,未结合的第一种肽的量或未结合的第二种结合配偶体(例如第二种肽)的量。在一些实施方案中,所述方法进一步包括测定未结合的第一种肽的量,和将未结合的第一种肽的量与第一数量的与第一种肽结合的mhc分子(例如mhci类分子)的量进行比较。在一些实施方案中,测量步骤通过进行免疫测定完成。在一些实施方案中,免疫测定是夹心免疫测定。
在一些实施方案中,进行夹心免疫测定包括:
提供与第一种抗体缀合的支持物,例如珠或微板孔;
使第一种抗体结合至与第一种肽结合的mhc分子和与第二种结合配偶体(例如第二种肽)结合的mhc分子二者;
提供能够结合第一种肽的第二种抗体;
使第二种抗体结合至与第一种肽结合的mhc分子,从而第二种抗体结合至支持物,例如珠或微板孔;
测定结合至支持物,例如珠或微板孔的第二种抗体的量。
这种一般程序描述于图3a和3b。在一些实施方案中,支持物包括珠。在一些这样的实施方案中,进行夹心免疫测定包括使用磁铁、离心或通过抽吸,使珠沉淀。在一些实施方案中,支持物包含微板孔。
在一些实施方案中,测量步骤包括进行荧光测量。
在一些实施方案中,第一种抗体是抗-mhc或抗-链霉亲和素抗体。
用于夹心免疫测定的第二种抗体可根据第一种肽上的标签选择。例如,第一种肽可用dnp标记和第二种抗体可以是抗-dnp抗体。或者,标签和抗体可如本文所描述。在可选的实施方案中,第二种抗体可被与第一种肽上的标签匹配的配体或凝集素替换,如本文所述。
第二种抗体可如本文所述,例如用荧光团或放射性标记物标记。
在一些实施方案中,所述方法进一步包括进行对照肽交换。
在一些方面,本公开内容提供了用于肽交换的试剂盒,其包含与第一种肽结合的mhci类分子和肽交换因子。
在一些实施方案中,第一种肽用第一种标记物标记。标记物可以具有肽的任何特征,其使得它可通过本领域已知的方法区分或检测。例如,标记物可以是可由抗体识别的氨基酸序列,例如表位标签,或荧光团。本文公开了示例性的标记物和检测方法。在一些实施方案中,第一种标记物选自表位标签、荧光标签、猝灭剂或放射性标记物。在一些实施方案中,第一种标记物是表位标签,使得第一种肽展示第一种表位标签。
在一些实施方案中,第一种肽展示第一种表位标签和试剂盒进一步包含抗-第一种表位标签抗体。在一些实施方案中,第一种肽展示第一种表位标签和试剂盒进一步包括包含抗-第一种标签抗体的捕获系统。
在一些实施方案中,试剂盒进一步包含参考肽。
在一些实施方案中,mhc蛋白是mhci类分子。在一些实施方案中,mhci类分子是单体。在一些实施方案中,mhci类分子是多聚体的组分。在一些实施方案中,多聚体包含4个mhci类分子。在一些实施方案中,多聚体包含6个mhci类分子。在一些实施方案中,多聚体包含12个mhci类分子。
在一些实施方案中,mhci类分子是hla-a*02:01。
在一些实施方案中,mhc蛋白是mhcii类分子。在一些实施方案中,mhcii类分子是单体。在一些实施方案中,mhcii类分子是多聚体的组分。在一些实施方案中,多聚体包含4个mhci类分子。在一些实施方案中,多聚体包含6个mhcii类分子。在一些实施方案中,多聚体包含12个mhcii类分子。
在一些实施方案中,mhcii类分子是hla-dr4。
在一些实施方案中,使用肽交换因子。肽交换因子可以是本领域已知的任何肽交换因子。在一些实施方案中,肽交换因子是肽交换因子1、甘氨酰-甲硫氨酸、甘氨酰-环己基丙氨酸、甘氨酰-亮氨酸、甘氨酰-精氨酸、甘氨酰-赖氨酸、甘氨酰-(叔)-丁基丙氨酸或甘氨酰-同型亮氨酸。
在一些实施方案中,第一种肽是ilkekk(dnp)vhgv、siink(dnp)ekl、mtyk(dnp)fpvt或ytvk(dnp)falv。在一些实施方案中,第一种肽是与ilkekk(dnp)vhgv、siink(dnp)ekl、mtyk(dnp)fpvt或ytvk(dnp)falv具有至少75%同一性、至少80%同一性或至少90%同一性的其功能同系物。
在一些实施方案中,第二种肽是ilkekkvhgv、siinkekl、mtykfpvt、ytvkfalv、elagigiltv、ilkepvhgv、aagigiltv、ylleftppv或kafspevipmf。在一些实施方案中,第一种肽是与ilkekkvhgv、siinkekl、mtykfpvt、ytvkfalv、elagigiltv、ilkepvhgv、aagigiltv、ylleftppv或kafspevipmf具有至少75%同一性、至少80%同一性或至少90%同一性的其功能同系物。
mhc蛋白
在本公开内容的方法中提供和使用的mhc蛋白可以是本领域已知的任何合适的mhc分子,其中需要用另一种肽交换mhc蛋白初始包含的肽。通常,它们具有式(α-β-ρ)n,其中n是至少2,例如2-10,例如4。α是i类或ii类mhc蛋白的α链。β是β链,在本文定义为ii类mhc蛋白的β链或mhci类蛋白的β2微球蛋白。p是肽抗原。
mhc蛋白可来自任何哺乳动物或鸟类物种,例如灵长类,特别是人;啮齿动物,包括小鼠、大鼠和仓鼠;兔;马;牛;犬;猫等。例如,mhc蛋白可源自人hla蛋白或鼠h-2蛋白。hla蛋白包括ii类亚基hla-dpα、hla-dρβ、hla-dqα、hla-dcβ、hla-drα和hla-drβ,和i类蛋白hla-a、hla-b、hla-c和β2-微球蛋白。h-2蛋白包括i类亚基h-2k、h-2d、h-2l和ii类亚基ι-αα、ι-αβ、i-eα和ι-εβ,和β2-微球蛋白。
一些代表性的mhc蛋白的序列可见于kabat等,sequencesofproteinsofimmunologicalinterest,nihpublicationno.91-3242,pp724-815。适合用于本发明的mhc蛋白亚基是可溶形式的正常膜结合蛋白,其如本领域已知的,例如通过删除跨膜结构域和胞质结构域制备。
对于i类蛋白而言,可溶形式包括αl、α2和α3结构域。可溶性ii类亚基包括对于α亚基的αl和α2结构域,和对于β亚基的β1和β2结构域。
α和β亚基可单独产生,和允许体外缔合以形成稳定的异双联体复合物,或两种亚基可在单一细胞中表达。用于产生mhc亚基的方法是本领域已知的。
为了制备mhc-肽复合物,亚基可与抗原肽组合,和允许体外折叠以形成具有链内二硫化物键合的结构域的稳定的异二聚体复合物。肽可包括在初始折叠反应中,或可在随后的步骤中添加至空的异二聚体。在本发明的方法中,这是退出肽。允许亚基和肽的折叠和缔合的条件是本领域已知的。作为一个实例,大致等摩尔量的溶解的α和β亚基可在尿素溶液中混合。
重折叠通过稀释或透析至不含尿素的缓冲溶液中起始。肽可在约ph5-5.5下加载至空的ii类异二聚体约1-3天,接着中和、浓缩和缓冲液交换。然而,特定的折叠条件对于实施本发明而言不是关键的。
单体复合物(α-β-ρ)(本文的单体)可以被多聚化。得到的多聚体将在长时间内稳定。优选地,多聚体可通过α或β亚基上的特定连接点将单体结合至多价实体形成,如本领域已知的(例如,描述于美国专利号5,635,363)。呈单体或多聚体形式的mhc蛋白还可与珠或任何其它支持物缀合。
通常,多聚体复合物将被标记,以致当用于本领域已知的免疫染色或其它方法时可被直接检测,或与特异性结合复合物的第二标记的免疫试剂结合使用,如本领域已知的和如本文所述的。例如,标记物可以是荧光团,例如异硫氰酸荧光素(fitc)、罗丹明、德克萨斯红、藻红蛋白(pe)、别藻蓝蛋白(apc)、brilliantviolet™421、brilliantuv™395、brilliantviolet™480、brilliantviolet™421(bv421)、brilliantblue™515、apc-r700或apc-fire750。在一些实施方案中,多聚体复合物通过能够特异性结合另一部分的部分标记。例如,标记物可以是生物素、链霉亲和素、寡核苷酸或配体。其它目标标记物可包括染料、酶、化学发光剂、颗粒、放射性同位素或其它直接或间接可检测的试剂。
本文公开的方法可用于对任何合适的mhc蛋白进行肽交换。用于本文公开的方法和肽的示例性的mhc蛋白包括h-2kb单体、hla-a*02:01单体、hla-a*24:02单体、hla-a*02:01四聚体、hla-a*24:02四聚体和h-2kb四聚体。然而,根据例如用于预测肽与mhc等位基因的亲和力的已知技术,在选择合适的退出肽时,任何mhc等位基因可用于本文的方法。
用于定量肽交换的标记物
根据本文公开的方法的一些实施方案,退出肽(即,将要被交换的肽)被标记,使得保持结合mhc蛋白的退出肽的比例可被(例如通过夹心免疫测定)定量。
特别适合定量交换的标记物是不使肽不能结合mhc蛋白并且能够特异性结合检测部分的那些。示例性的特异性结合对包括生物素或其变体与链霉亲和素或其变体,标签与其互补抗体、配体或凝集素,半抗原与它们结合的蛋白,或寡核苷酸序列与其互补序列。
因此,在一些实施方案中退出肽可用标签,即被抗体、凝集素或特异性配体识别的部分标记。示例性的标签包括二硝基苯酚(dnp)、唾液酸、亚硝酰、硫酸化糖、o-糖基化氨基酸、n-糖基化氨基酸、磷酸丝氨酸、磷酸苏氨酸和磷酸酪氨酸。
在一些实施方案中,退出肽可用生物素部分或已知的生物素变体标记,以结合链霉亲和素或链霉亲和素变体。示例性的生物素变体是2-亚氨基生物素、羧基生物素、生物胞素或亚氨基生物胞素。
按所述标记的退出肽将与对退出肽上的标记物具有特异性的结合配偶体结合。结合配偶体可用能够直接检测的部分,例如荧光部分或放射性标记物,或能够间接检测的部分,例如酶标记物例如辣根过氧化物酶(hrp)或碱性磷酸酶标记。然后,未被交换的mhc蛋白,即保留退出肽的那些,可被检测,例如通过夹心测定,其中与抗-mhc蛋白抗体缀合的捕获珠或任何其它合适的支持物用于捕获mhc蛋白,和结合配偶体用于鉴定仍结合退出肽的那些mhc蛋白。夹心测定的结果可见于图3a:mhc蛋白通过组合α亚基(1)和β亚基(2)形成。mhc蛋白通过连接至链霉亲和素(3)四聚化。四聚体mhc复合物被标记(例如被荧光团)(4)。与复合物中的每个mhc蛋白结合的是退出肽(5)或进入肽(6)。mhc四聚体通过mhc抗体(9)结合至珠或任何其它合适的支持物(8)。在退出肽(5)仍与mhc蛋白缔合的情况下,标记的抗-标签抗体(10)将结合。在进入肽(6)已替换退出肽时,标记的抗-标签抗体将不结合。如3b中可见,高水平的交换导致没有退出肽保持与mhc蛋白缔合(上图),因此抗-标签抗体不结合和低荧光信号被测量。低水平的交换导致退出肽的高度保留(下图),因此大量的抗-标签抗体结合,和高荧光信号被观察到。
在其中结合配偶体被酶标记物(例如hrp)标记的实施方案中,代替测量荧光水平的是:可加入酶的底物(例如四甲基联苯胺(tmb)、3,3'-二氨基联苯胺(dab)或2,2'-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(abts))以显出可检测的颜色。高水平的交换导致没有退出肽保持与mhc蛋白缔合,因此抗-标签抗体不结合,不存在酶,和不显色。低水平的交换导致退出肽的高度保留,因此大量的抗-标签抗体结合,大量的酶存在,因此显色。
可用于标记结合配偶体(例如,可用于标记抗体)的示例性的荧光部分包括7-氨基-4-甲基-香豆素(amc)、5-((2-氨基乙基)氨基)萘-l-磺酸(edans)、fitc、fam、7-硝基苯并-2-氧杂-1,3-二唑(nbd)、罗丹明b、tamra或任何其它合适的荧光部分。
可用于标记结合配偶体(例如,可用于标记抗体)的示例性的放射性标记物包括32p、35s甲硫氨酸和125i。连同抗体、凝集素或配体使用这样的放射性标记物的方法是本领域已知的。
肽交换因子
任何合适的肽交换因子可用于本文提供的方法。示例性的肽交换因子包括甘氨酰-甲硫氨酸、甘氨酰-环己基丙氨酸、甘氨酰-亮氨酸、甘氨酰-精氨酸、甘氨酰-赖氨酸、甘氨酰-(叔)-丁基丙氨酸、甘氨酰-同型亮氨酸。
退出肽
本领域技术人员能够产生除了本文所述的那些之外的退出肽,包括具有各种标记物和各种序列(其适合于以合适的强度结合至许多已知mhc等位基因的任何一个)的退出肽。这样的退出肽可通过已知的技术,例如通过预测特定肽与特定mhc等位基因的亲和力的可得的工具设计。它们可任选地按本文所公开进行标记。本文公开的示例性的退出肽包括ilkekk(dnp)vhgv、ilkek(dnp)vhgv、siink(dnp)ekl、mtyk(dnp)fpvt、tfqrk(dnp)paaf或ytvk(dnp)falv。其它示例性的退出肽是与前述肽具有至少75%、80%、85%、90%或95%序列同一性的那些。
进入肽
本领域技术人员能够产生除了本文所述的那些之外的进入肽,包括具有各种标记物和各种序列(其适合于以合适的强度(例如大于或相当于使用的退出肽的结合强度)结合至许多已知mhc等位基因的任何一个)的进入肽。这样的进入肽可通过已知的技术,例如通过预测特定肽与特定mhc等位基因的亲和力的可得的工具设计。它们可任选地按本文所公开进行标记。本文公开的示例性的进入肽包括ilkekkvhgv、ilkekvhgv、siinkekl、mtykfpvt、ytvkfalv、elagigiltv、ilkepvhgv、aagigiltv、ylleftppv、kafspevipmf、amaprtlll、atdalmtgy、evdpighly、flseltqql、fmysdfhfi、gladqlihl、glavvthgl、gyslklskl、imdqvpfsv、iystvassl、lnmadkket、rahynivtf、rvraytysk、rymrwtyrf、slyntvatl、flyddnqrv、gladqlihl、avldgllsl、glavvthgl、wmhkvpasl、cingvcwtv、wmhhnmdli、slpppgtrv、ltlgeflkl、imqlmpfgc、imqimpygc、rikdflrnl、allavgatk、cslwngphl、eyilsleel、alalevgel、syvpsaeqi、atvqgqnlk或irlrpggkk。其它示例性的进入肽是与前述肽具有至少75%、80%、85%、90%或95%序列同一性的那些。
用于交换的介质
本文所述的方法可在任何合适的介质中进行。
在一些实施方案中,反应混合物包含在缓冲溶液中的试剂。因此,反应混合物可基本上由与第一种(退出)肽结合的mhc分子、第二种(进入)肽和肽交换因子组成。根据这些实施方案,mhc分子、第一种肽、第二种结合配偶体(例如第二种肽)和肽交换因子全部可如本文所述。
在一些实施方案中,反应混合物包含在溶液中的试剂,和溶液可包含其它物类,例如并非第一种和第二种肽的肽、脂质、多核苷酸或其它生物学或非生物学物类。在某些实施方案中,溶液可包含体液、来自正常或异常组织的组织提取物、来自正常或异常组织的细胞提取物、来自肿瘤的细胞提取物或来自其它病理的细胞提取物。在某些实施方案中,溶液可包含微生物例如病毒、细菌、寄生虫或酵母的提取物或裂解物。在某些实施方案中,溶液可包含环境水、空气和土壤样品,或其提取物。在某些实施方案中,溶液可包含合成的混合物,例如蛋白水解产物、灌流液、疫苗或合成的组织培养基。根据这些实施方案,mhc分子、第一种肽、第二种结合配偶体(例如第二种肽)和肽交换因子全部可如本文所述。
试剂盒
在一些方面,本公开内容提供了用于肽交换、例如定量肽交换的试剂盒。试剂盒可包含数个模块,其可包括mhc模块、肽检测模块、交换因子模块和/或参考肽模块。试剂盒的组分可经选择,使得试剂盒的使用者能够制备剩余的必要组分,以进行本文公开的方法。
mhc模块通常包括冻干或溶液中的用于交换的mhc蛋白(呈单体或多聚体形式),例如包含退出肽。溶液有利地被缓冲,和还可包含其它组分以稳定溶液。例如,溶液可包含蛋白稳定剂和/或叠氮化钠。与mhc蛋白缔合的肽通常按本文所述进行标记。肽的序列经选择以提供试剂盒mhc蛋白的稳定性和对目标肽的交换能力。
肽检测模块通常包含任何合适的肽检测系统,其与mhc模块中提供的标记的可交换肽匹配。例如,如果检测系统考虑夹心磁性珠免疫测定,则检测模块可包含含有与mhc捕获抗体偶联的磁性珠的小瓶,和含有对退出肽有反应性的荧光-标记抗体的小瓶(在标记的肽的情况下)。
交换因子模块通常包含冻干或溶液中的肽交换因子。溶液有利地被缓冲,和还可包含其它组分以稳定溶液。例如,溶液可包含蛋白稳定剂和/或叠氮化钠。
定义
冠词"a"和"an"在本文用于指冠词语法对象的一个或超过一个(即,至少一个)。例如,"要素"意指一个要素或超过一个要素。
术语"氨基酸"意图涵盖所有分子,无论是天然还是合成的,其包括氨基官能团和酸官能团二者,和能够包含在天然存在的氨基酸的聚合物中。示例性的氨基酸包括天然存在的氨基酸;其类似物、衍生物和同源物;具有变体侧链的氨基酸类似物;和任何前述氨基酸的所有立体异构体。
词语"源自"当涉及"源自"未重排的可变区和/或未重排的可变区基因区段的重排的可变区基因而使用时,是指回溯重排的可变区基因的序列至一组未重排的可变区基因区段的能力,所述未重排的可变区基因区段经重排以形成表达可变结构域的基因(在合适时,是剪接差异和体细胞突变的原因)。例如,已经历体细胞突变的重排的可变区基因仍源自未重排的可变区基因区段。在一些实施方案中,在内源基因座被通用轻链或重链基因座替换时,术语"源自"表示回溯序列来源至所述重排的基因座的能力,即使该序列可能已经历体细胞突变。
实施例
现在一般性描述本发明,参考以下实施例,其将得到更容易理解,所述实施例仅为说明本发明的某些方面和实施方案的目的而包括在内,和不意图限制本发明。
实施例1:用于测量肽替换的示例性方案
试剂:制备或提供以下贮存溶液:
在添加有蛋白稳定剂和≤0.09%叠氮化钠的缓冲的50μg/ml(通过单体含量测量)溶液中具有退出肽的四聚体(例如hla-a*02:01)。
在含≤0.09%叠氮化钠的0.25-0.5m溶液中的肽交换因子(例如肽交换因子1)。
在添加有蛋白稳定剂和≤0.09%叠氮化钠的缓冲的nacl150mm、na2hpo4·2h2o6.5mm、ph7.1-7.35溶液中与四聚体捕获抗体缀合的磁性珠。
在添加有蛋白稳定剂和≤0.09%叠氮化钠的缓冲的nacl150mm、na2hpo4·2h2o6.5mm、ph7.1-7.35溶液中对退出肽有反应性的荧光标记抗体(例如用fitc标记)。
在10mmdmso溶液中的参考交换肽,在水中稀释至1mm。
在10mmdmso溶液中的所需交换肽,在水中稀释至1-5mm,或在一些情况下不稀释。
测定缓冲溶液,nacl150mm、na2hpo4·2h2o6.5mm、ph7.1-7.35,添加有蛋白稳定剂和≤0.09%叠氮化钠(1.5mlx1个带普通盖的小瓶)。在2-8°c下贮存。
肽交换程序:将50μl的四聚体溶液与1μl的肽交换因子例如甘氨酰甲硫氨酸(得到5-20mm的最终肽交换因子浓度)和1μl的肽溶液合并,和将得到的溶液混合,然后在室温下孵育4小时。
夹心磁性珠免疫测定:将20μl捕获珠吸移到96孔板上的孔1-4中。将5μl的测定缓冲液吸移到孔2中。将5μl的交换四聚体吸移到孔4中。另外的交换四聚体可吸移到孔5和之后的孔中。将板避光保护,和以550rpm/min摇动45min。将150μl的测定缓冲液分配至每个孔中。将板置于盘状磁铁上,和使珠沉降至少5分钟。
单独地,fitc-缀合的抗-标签抗体的制备物以10μg/ml制备。将25μl的fitc-缀合的抗-标签抗体吸移到除了孔1的每个孔中,和再次将板避光保护,和以550rpm/min摇动45min。
将150μl的测定缓冲液分配至每个孔,和将板置于盘状磁铁上。使珠沉降至少5分钟。使珠在鞘液中重悬浮,和转移至标记的流式细胞仪管(在本文中通过它们所吸出的孔的编号命名),其然后在流式细胞仪上分析。
流式细胞术分析:未使用的磁性珠用于设置fsc(前散射光)和ssc(侧散射光)电压和收获,使得活门(livegate)选择单个珠和排除双珠和更大团块,参见图1a。pmt电压和收获基于未使用的珠设置,以具有在第一个log十进位(约0.2-0.3)中平均荧光强度(mfi),如图ib所示。管1经运行以进行fl1中的补偿,以消除fitc通道中的荧光染料干扰,参见图1c。fl1mfi被设置为第一个log十进位,接近仅用珠所获得的。管2,其包含未捕获四聚体和因此无标记的肽的珠,经运行以校准0%标记的肽(即100%肽交换)的水平(参见图1d)。在此处提供的示例性数据中,mfi为0.287。管3,其包含其中所有四聚体展示初始标记肽的溶液,经运行以校准100%标记的肽(即0%肽交换)的水平(参见图1e)。在此处提供的示例性数据中,mfi是20.4。管4和以后的管经运行以评价样品。肽交换的四聚体将展示各种数量的标记的肽,这取决于它们对hla-a*02:01分子的结合亲和力。因此,测量的fl1mfi将介于用管2和3获得的mfi值中间。参见图if,其中在此处提供的示例性数据中,mfi是9.37。对照数据然后可经内推,以发现样品中标记的肽的百分比,如表1所示。
表1:肽交换率的示例性计算
实施例2:用fitc-缀合的dnp-特异性抗体检测退出肽准确地测量肽交换
hla-a*02:01四聚体用各种比率的肽ilkekk(dnp)vhgv和ilkepvhgv构建。它们用抗hla-abc抗体-缀合的珠捕获,和用fitc缀合的抗dnp染色。fl1中的平均荧光强度在流式细胞仪上收集,并针对ilkekk(dnp)vhgv百分数作图。结果在图4中提供,表明在通过流式细胞术测量的抗-dnp信号和实际退出的dnp-标记的肽水平之间存在线性相关。
实施例3:用fitc缀合的dnp特异性抗体检测dnp准确地测量h-2kb四聚体中的肽交换。
h-2kb四聚体用各种比率的肽siinfekl和siink(dnp)ekl构建。它们用抗h-2kb抗体缀合的珠捕获,和用fitc缀合的抗dnp染色。收集fl1中的平均荧光强度,并针对siink(dnp)ekl百分数作图。结果在图5中描述,表明在通过流式细胞术测量的抗-dnp信号和捕获的实际dnp抗原之间存在准确的线性相关。
实施例4:退出肽序列的选择
肽交换使用280μg/ml的两种h-2kb四聚体进行,它们用肽mtyk(dnp)fpvt和ytvk(dnp)falv制备。在10μg/ml竞争肽的存在下进行交换。四聚体用与抗h-2kb特异性抗体缀合的珠捕获。用10μg/ml的fitc-缀合的抗-dnp抗体进行检测。结果在图6中描述,其中退出肽如下标记:
用mtyk(dnp)fpvt构建的四聚体允许与很多种肽交换;对于退出肽ytvk(dnp)falv,这是不可能的。
实施例5:退出肽序列的比较
使用280μg/ml的由肽ilkekk(dnp)vhgv和ilkek(dnp)vhgv制成的两种hla-a*02:01四聚体进行肽交换。在gm(甘氨酸-甲硫氨酸)10mm以及10和1μg/ml的高亲和力竞争肽ylleftppv的存在下进行交换。四聚体用与10μg/ml的抗hla-abc特异性抗体缀合的珠捕获。结果在图7中描述,表明用ilkekk(dnp)vhgv构建的四聚体在肽交换中表现更好。
实施例6:使用交换的四聚体进行细胞染色
用肽rmfnapyl(在本实施例中显示)以及肽rmysyvatl、ilkek(dnp)vhgv和ilkekk(dnp)vhgv构建的hla-a*02:01四聚体与竞争肽mart-1(elagigiltv)l-100μg/ml以及交换因子甘氨酸-甲硫氨酸10mm孵育4小时,如图2a所图示。mhc蛋白通过组合α亚基(1)和β亚基(2)形成。mhc蛋白通过连接至链霉亲和素(3)四聚化。四聚体mhc复合物被标记(此处用荧光团)(4)。与复合物中的每个mhc蛋白结合的是退出肽(5)。对于交换,添加进入肽(6)和肽交换因子(7)。退出肽(5)被替换。得到的复合物包含与mhc蛋白结合的进入肽(6)。交换的四聚体然后用于细胞染色,和与初始用mart-1肽折叠的四聚体(即,无肽交换)比较。如图2b所示,通过肽交换获得的四聚体使细胞染色,正如初始用mart-1肽制备的四聚体一样。
实施例7:用不同的荧光团的交换率的比较
50μl的具有退出肽tfqrk(dnp)paaf的mhc四聚体(h-2kbpe、h-2kbapc或h-2kbbv421)与1μl的0.25m肽交换因子(甘氨酰-甲硫氨酸)和1μl的1mm或0.1mm参考进入肽(siyryygl)混合。混合物在室温下避光孵育4小时。
将20μl的磁性捕获珠加入v-底96孔板的对于每种测试的肽的孔,加上对照样品的孔。每个测试孔接受5μl的肽交换样品。将板以550rpm在室温下避光摇动45分钟。冲洗珠后,各孔接受25μl的1x退出肽抗体。将板以550rpm在室温下避光摇动45分钟。将珠冲洗,重悬于1x测定缓冲液和在fc500流式细胞仪上运行。单个珠在fsc对比ssc上经门控,和测量500个事件/测试的mfi。肽交换率使用用来自对照的mfi值产生的校准曲线计算。结果显示在表2中:
表2:用各种荧光团的交换率
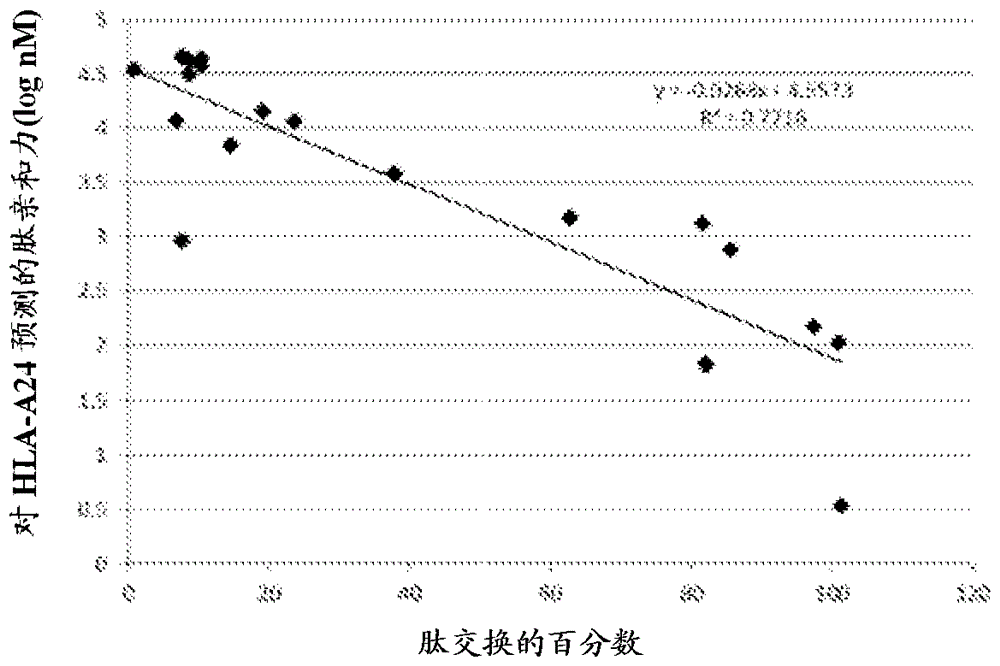
实施例8:hla-a*02:01肽交换定量和预测的亲和力的比较
具有不同预测的hla-a*02:01结合亲和力的随机肽以终浓度20μμ加入具有退出肽ilkekk(dnp)vhgv的可交换的hla-a*02:01四聚体。在孵育肽(终浓度20μμ)与四聚体4小时后,然后接着用抗hla-abc珠捕获和用抗-dnpfitc抗体染色,获得肽交换数据。
具有1nm-1000nm的不同预测亲和力的肽以高比率(在90%范围)交换。较低结合亲和力(>1000nm)肽触发较低的肽交换(60-20%)。然而,预测的低亲和力的数种肽显示高交换率。结果提供在表3和图8。
表3
本文提供的肽交换定量测定可用于筛选良好的hla-a*02:01结合肽和验证高比率的肽交换。
实施例9:用退出肽tfqrk(dnp)paaf制备的hla-a*24:02四聚体适合于肽交换
将具有不同预测的hla-a*02:01结合亲和力的随机肽以终浓度20μμ加入具有退出肽tfqrk(dnp)paaf的可交换的hla-a*24:02四聚体。在孵育肽(终浓度20μμ)与四聚体4小时后,然后接着用抗hla-abc珠捕获和用抗-dnpfitc抗体染色,获得肽交换数据。
对hla-a*24:02预测的肽结合亲和力和对hla-a*24:02四聚体的肽交换率是相关的,除了几个离群值之外,如图9和表4所示。
表4
实施例10:通过肽交换产生的fla-a*24:02四聚体具有与通过折叠产生的四聚体相同的细胞反应性
将50μl的具有退出肽tfqrk(dnp)paaf的hla-a*24:02四聚体与1μl的0.25m肽交换因子(甘氨酰-甲硫氨酸)和1μl的1mm或0.1mmcmv肽qydpvaalf混合。混合物在室温下避光孵育4小时。将表达复合物hla-a*24:02/qydpvaalf的t细胞受体的s2昆虫细胞以5x106个细胞/ml重悬于包含0.2%bsa和0.1%nan3的pbs。100μl的细胞与2.5或5μl的四聚体在室温下孵育30分钟,所述四聚体为阴性对照四聚体(pnt01044)、市售的hla-a*24:02cmvqydpvaalfpe四聚体(t01043)或通过肽交换获得的hla-a*24:02cmvqydpvaalfpe四聚体。在用包含0.2%bsa和0.1%nan3的pbs洗涤后,将细胞重悬于400μl的包含0.5%甲醛的pbs,然后在fc500流式细胞仪上进行分析。数据提供在图10中,显示市售的hla-a*24:02cmvqydpvaalfpe四聚体(t01043)与通过肽交换获得的hla-a*24:02cmvqydpvaalfpe四聚体不可区分。
实施例11:在mhcii类四聚体上肽的交换
将50μl具有退出肽序列k(dnp)lpkppkpvskmrmatpllmqalpm的pe缀合的mhcii类drb1*04:01四聚体的样品与2μl的24.1mm、12.05mm和6.025mm顺铂在室温下避光孵育3小时。顺铂触发的肽交换的定量用流式细胞术夹心免疫测定进行。将20μl的抗hladr-缀合的磁性捕获珠加入v-底96孔板的对于每个测试的顺铂稀释度的孔,加上对照样品的孔。每个测试孔接受5μl的顺铂处理的样品。将板以550rpm在室温下避光摇动45分钟。在冲洗珠后,孔接受25μl的1x退出肽抗体。将板以550rpm在室温下避光摇动45分钟。将珠冲洗,重悬于1x测定缓冲液和在fc500流式细胞仪上运行。单个珠在fsc对比ssc上经门控,和测量500个事件/测试的mfi。使用用来自对照的mfi值产生的校准曲线计算肽交换率。结果在图11中描述。
实施例12:测定疫苗的生物活性
本文所述的方法经评价以测定它们是否可检测疫苗的生物活性。测试的疫苗是dpx-survivac,一种卵巢癌疫苗候选物,其包括各自受限于不同的人i类等位基因的数个存活素肽抗原。疫苗中的肽之一是sura2.m,一种hla-a2-受限肽。本研究中使用的肽列于表4,其对hla-a2的亲和力通过iedb人工神经网络方法计算。
表5:用于疫苗研究的肽
本文所述的定量肽交换与用于定量疫苗的生物活性的已建立方法比较。
定量肽交换测定:制备包含退出肽ilkekk(dnp)vhgv的hla-a*02:01四聚体。针对(a)在缓冲溶液中单独制备的肽或(b)在水性制剂中制备的dpx-survivac疫苗,进行肽交换。hla-a*02:01四聚体和肽交换因子甘氨酰甲硫氨酸与待测试的每种肽混合。肽交换然后通过流式细胞术夹心免疫测定,使用磁性捕获珠定量。
该比较,显示于图12a,显示sura2.m的肽交换率不显著可区分其是单独溶于缓冲溶液中还是与疫苗的其它组分混合。数据显示为三个独立重复的平均值±sem。进行student'st-检验以比较在每个浓度水平下dpx-survivac的肽交换水平与sura2.m肽的肽交换水平;在p<0.05时,未检出统计学差异。
该结果可依赖于肽对hla-a2的亲和力。因此,通过使用各个肽优化浓度曲线,hla-a*02:01mhc蛋白可用于在简单溶液或较复杂制剂中定量hla-a2受限肽的浓度。
t2hla-a2移位测定:t2细胞是人细胞系,所述细胞系由于缺乏tap蛋白而在其表面上表达低水平的hla-a2。在用可结合hla-a2的肽孵育时,在表面上hla-a2的表达增加,因为该肽使复合物稳定。使用荧光素-缀合的单克隆抗体(抗-hla-a2)的t2细胞的免疫荧光染色用于在抗原刺激后体外定量hla-a2的相对表达。在该研究中,t2细胞用各种量的肽刺激24h;hla-a2表面表达使用bb7.2-pe抗-hla-a2抗体(其使用bdfacscalibur定量)检测。结果提供在图12b,表明该测定的反应范围为10-110μg/ml。数据表示为三个独立实验的平均值±sem和相对于未刺激的对照表示。
ifn-γelispot测定:hla-a2转基因小鼠(hhd,n=6)用以递减剂量的hla-a2受限肽sura2.m配制的dpx-survivac免疫接种。接种后8天,处死小鼠,和收集脾脏。脾细胞在ifn-yelispot板中用培养基(背景)、不相关的hla-a2受限肽或sura2.m肽刺激。在18小时后将板显色和使用immunospotreader(c.t.l.)定量斑点形成单位(sfu)。结果提供在图12c中,显示观察到剂量反应。通过单向anova接着dennett's后检验,进行统计学分析,以比较至最大值50μg的各剂量的反应;*p<0.05,**p<0.01。ifn-γelispot测定可检出疫苗中sura2.m的90%降解。
肽交换测定与t2hla-a2移位测定的比较:对各种量的肽/反应进行本文所述的肽交换测定和t2hla-a2移位测定。结果提供在图12d(t2hla-a2移位测定)和12e(肽交换测定),其中三个独立重复以菱形、正方形和三角形显示。当应用于包含10μg/反应至110μg/反应的sura2.m肽的样品时,t2移位测定提供了高度线性。肽交换测定具有低于0.2μg/反应的定量上限,和具有可接受线性度的反应范围为0.004μg/反应至0.04μg/反应。
通过引用并入
本文提及的所有出版物和专利通过引用以其整体结合到本文中,如同每个单独的出版物或专利明确和单独地指明通过引用并入一样。在冲突的情况下,以本申请,包括本文的任何定义为准。
1.altmanjd,davismm.mhc-peptidetetramerstovisualizeantigen-specifictcells.currprotocimmunol.2003;17(17):13
2.toebesm等(2006)designanduseofconditionalmhcclassiligands.natmed12(2):246-251.
3.rodenkob,toebesm,celieph,perrakisa,schumachertn:ovaah:classimajorhistocompatibilitycomplexesloadedbyaperiodatetrigger.jamchemsoc2009,131:12305-12313.
4.sainisk,schusterh,ramnarayanvr,rammenseehg,stevanovics,springers.dipeptidescatalyzerapidpeptideexchangeonmhcclassimolecules.procnatlacadsciusa.2015112(l):202-7.
5.luft,t.等exogenouspeptidespresentedbytransporterassociatedwithantigenprocessing(tap)-deficientandtap-competentcells:intracellularloadingandkineticsofpresentation.j.immunol.167,2529-2537(2001).
等同方案
尽管已论述了本发明的特定实施方案,但上文的说明书是说明性而非限制性的。对本领域技术人员而言,在阅读本说明书和下文的权利要求书后,本发明的许多变化将变得显而易见。本发明的完整范围应参考权利要求书,以及它们等同方案的完整范围,和说明书以及这样的变化来确定。
- 还没有人留言评论。精彩留言会获得点赞!