无机离子检测系统和方法与流程
本申请要求澳大利亚临时专利申请2016903232和2017902304的优先权。这些申请中的每一个的说明书的整体在此通过引用并入本说明书中。
本发明涉及使用电泳(例如毛细管电泳)分离和检测样品中的无机阴离子的系统和方法。所述系统和方法特别适用于样品分析,以能够检测通常存在于爆炸物中的无机阴离子的存在。本发明还涉及与所述系统和方法相关的毛细管、试剂容器和用途。
背景技术:
由于用于识别爆炸物的分析提供的结果构成了调查和预防恐怖袭击期间不可或缺的工具,因此对开发快速和可靠的用于识别爆炸物的分析方法非常感兴趣。
无机简易爆炸装置(ied)基于强无机氧化剂和燃料的组合。与严格控制的有机高爆炸物相比,无机ied组件可以以低成本容易地和合法地获得。由这些组件制造ied也相对简单。
爆炸性残留物的检测可以大致分为爆炸前分析或爆炸后分析。爆炸后分析涉及从爆炸现场周围区域直接分析和识别爆炸物。另一方面,爆炸前分析涉及用某种装置识别爆炸性组件,并用于公共交通地点、货物进入点和安全设施。虽然两种类型的检测都很重要,但爆炸前检测的预防性质使其非常有用。可以使用批量检测技术(例如x射线、拉曼和ir)或爆炸物痕量检测(etd)来实现爆炸前检测。痕量检测涉及使用拭子(或一阵空气)从表面(可以是皮肤、衣服、袋子等)中除去爆炸性残留物或标记物,然后将其放入仪器中并测量提供的每种爆炸物的量。
使用离子迁移谱(ims)和气相色谱-质谱(gc-ms)的直接爆炸前分析目前在世界上大多数主要机场中使用。将拭子样品直接插入这些仪器中以在几秒钟之后得到结果,然而由于目标物质的物理化学性质,它们对基于无机或过氧化物的爆炸物的适用性受到限制。
毛细管电泳(ce)提供了具有识别无机ied潜力的特征的有吸引力的组合。使用ce的主要限制是相对高的检测限、难以在现有形式的分离柱中获得可重复的迁移时间、以及相对长的分析时间。
因此,需要用于检测存在于无机ied中的类型的无机阴离子的替代或改进的方法、系统和/或组件。对于实施方案,期望实现离子之间足够的分辨率,并在合理的时间范围内实现分离,并且具有可靠的再现性。
技术实现要素:
根据第一方面,提供了一种用于分离和检测样品中的无机阴离子的系统,所述系统包括:
·具有阳离子聚合物和阴离子聚合物的三个或更多个交替层的内涂层的分离通道,其中第一层和最后一层是阳离子聚合物层;
·用于检测通过分离通道的检测区的无机阴离子的检测器;
·用于将包含样品溶液和背景电解质的流体注入分离通道的入口端的注射系统;
其中背景电解质包含聚乙烯亚胺,并且形成阳离子聚合物层的阳离子聚合物不是聚乙烯亚胺。
用于涂覆分离通道的阳离子聚合物可以是叔胺聚阳离子或季胺聚阳离子(例如己二甲胺聚合物)。用于涂覆分离通道的阴离子聚合物可以是磺化或硫酸化的聚合物或共聚物,例如聚苯乙烯磺酸盐。
根据第二方面,提供了一种用于分离和检测样品中的无机阴离子的系统,所述系统包括:
·接收器,所述接收器成形为接收可替换的容器,所述容器包括具有阳离子聚合物和阴离子聚合物的三个或更多个交替层的内涂层的分离通道,其中第一层和最后一层是阳离子聚合物层;
·检测器,所述检测器设置成当包括分离通道的容器被设置在接收器中时检测通过分离通道的检测区的无机阴离子;
·注射系统,所述注射系统用于当容器位于接收器中时将包含样品溶液和背景电解质的流体注入包括在容器中的分离通道的入口端;
·控制器,所述控制器用于控制注射系统、流体的流、用于检测无机阴离子的检测器的操作。
使用阳离子聚合物和阴离子聚合物的交替层与在背景电解质中使用另外的阳离子聚合物的组合提供了分离时间的减少,同时保持足够的效率和分辨率。阳离子聚合物和阴离子聚合物的交替层控制电渗流,而背景电解质中另外的阳离子聚合物的存在通过离子交换机制改变分离选择性。此外,分离通道的多层涂层的增加的稳定性允许延长的通道寿命,同时保持无机阴离子的良好分离分辨率。快速分离和较长运行时间的组合使电泳系统适用于自动化和高样品通量应用。
根据第一方面和第二方面以及随后的那些方面,涂层位于通道或毛细管的与通过通道的流体(例如背景电解质)接触的内表面上。
在第三方面中,提供了一种使用电泳分离和检测样品中的无机阴离子的方法,所述方法包括样品处理顺序,其包括:
-将样品和包含聚乙烯亚胺的背景电解质引入涂覆有阳离子聚合物和阴离子聚合物的交替层的分离通道中,其中分离通道涂层的第一层和最后一层是阳离子聚合物层,并且形成阳离子聚合物层的阳离子聚合物不是聚乙烯亚胺;
–跨分离通道施加电势以实现无机阴离子的分离;以及
检测经分离的无机阴离子的存在。
所述系统还可以包括用于通过注射系统和分离通道产生背景电解质的流的流体流动发生器,例如泵。
所述系统还可以包括控制器,所述控制器控制注射系统、通过注射系统和分离通道的背景电解质的流、以及在电极上施加的电压。
在第四方面中,提供了一种用于分离和检测样品中的无机阴离子的分离毛细管,其包括己二甲胺聚合物和聚苯乙烯磺酸盐或其共聚物、盐或衍生物的三个或更多个交替层的内涂层,其中第一层和最后一层是溴化己二甲胺层。
与涂覆有单层阳离子聚合物的毛细管相比,涂覆有阳离子己二甲胺聚合物(例如溴化己二甲胺)和阴离子聚苯乙烯磺酸盐的交替层的毛细管具有增加的稳定性。涂层的增加的稳定性延长了系统保持eof保留和迁移时间的再现性的运行次数。
在第五方面中,提供了一种包括该分离毛细管的容器。所述容器还可以包括包含如本文所述的背景电解质的背景电解质贮存器。将毛细管包括在成形为可释放地插入系统(或装置)中以进行分离的容器中,允许快速补充装置中的消耗品,并且可以由本领域非熟练使用者进行。
在其他变型中,可以将原位形成涂层和补充背景电解质所需的溶液包装在一起并作为试剂容器出售,而不是用包括分离毛细管和背景电解质的可替换容器来设计系统。在这样的情况下,提供了一种试剂容器,其包括:
-包含己二甲胺聚合物的第一毛细管涂覆组合物;
-包含聚苯乙烯磺酸盐的第二毛细管涂覆组合物;和
-包含聚乙烯亚胺的背景电解质组合物。
另一种形式的试剂容器可以包括:
-分离毛细管,其包括溴化己二甲胺和聚苯乙烯磺酸盐的三个或更多个交替层的内涂层,其中第一层和最后一层是溴化己二甲胺层;和
-包含聚乙烯亚胺的背景电解质组合物。
附图说明
注意在所有图中,峰用附图标记示出,那些峰标记为:1=氯化物,2=硝酸盐,3=氯酸盐,4=氟化物,5=高氯酸盐,6=硫氰酸盐,7=碳酸盐,8=丙磺酸盐,9=硫酸盐,10=甲磺酸盐,12=甲酸盐,13=戊磺酸盐。
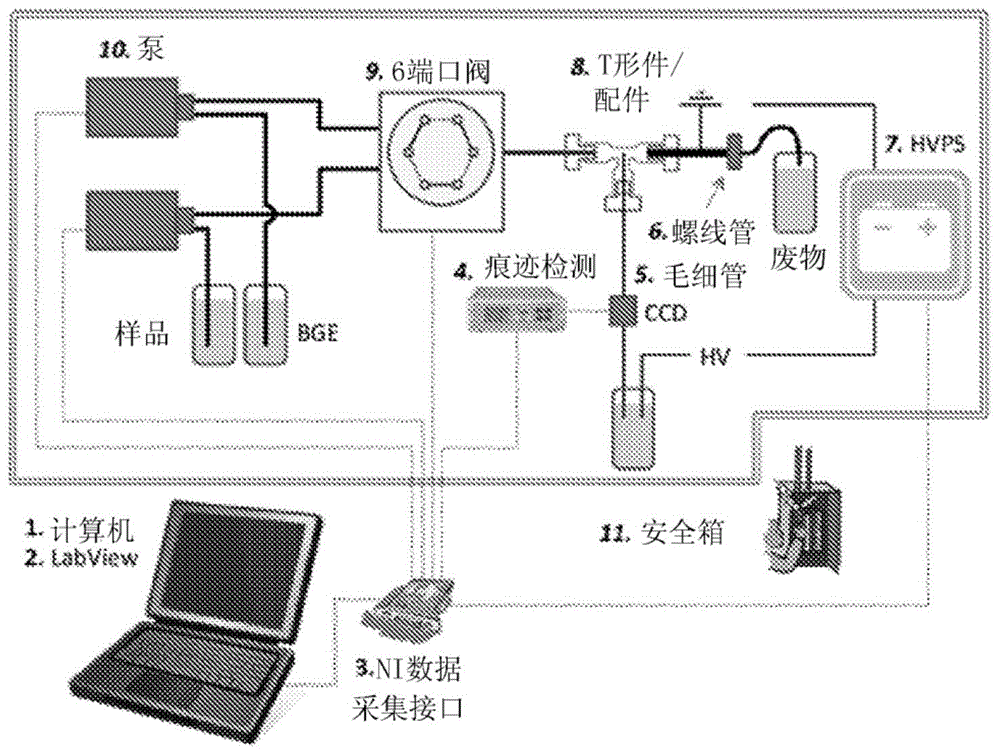
图1是scantexsi-ce设置的示意图。
图2是使用图1所示的仪器布局和以下条件分析目标阴离子混合物(1ppm)获得的电泳图:bge:50mmtris/ches+0.05%pei,毛细管:25μm×35cm(至检测器26.5cm)经hdmb涂覆,电压:25kv,注射1kv持续1秒。在运行之间冲洗毛细管。样品阴离子浓度为2ppm。
图3是示出%pei对目标阴离子的si-ce分离的影响的电泳图的比较。bge:50mmtris/ches+变化的pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:50kv,注射1μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm,不同之处在于甲磺酸盐浓度为5ppm,丙磺酸盐浓度为2ppm。
图4是示出使用涂覆有单层hdmb的毛细管并且在分析之间没有冲洗步骤的si-ce系统的再现性的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:25μm×35cm(至检测器25cm)经hdmb涂覆,电压:25kv,注射1μl/秒持续1秒。
图5是示出使用涂覆有单层hdmb的毛细管并且在分析之间用bge冲洗的si-ce系统的再现性的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:25μm×35cm(至检测器25cm)经hdmb涂覆,电压:25kv,注射0.5μl/秒持续0.5秒。在运行之间冲洗毛细管。样品阴离子浓度为2ppm,不同之处在于丙磺酸盐浓度为5ppm。
图6是示出用hdmb的新层重新涂覆用过的毛细管的效果的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:25μm×35cm(至检测器25cm)经hdmb涂覆,电压:25kv,注射1kv持续1秒。在运行之间冲洗毛细管。
图7是示出使用3个或5个经涂覆的毛细管的scantexsi-ce分离的电泳图的比较。bge:50mmtris/ches+0.07%pei,毛细管:25μm×35cm(至检测器25cm)经hdmb/pss/hdmb和hdmb/pss/hdmb/pss/hdmb涂覆,电压:25kv,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为2ppm,不同之处在于丙磺酸盐浓度为5ppm。
图8是示出使用经hdmb和pddac涂覆的毛细管与scantexsi-cein-bes实现的分离的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:50μm×35cm(至检测器25cm)经hdmb和pddac/pss/pddac涂覆,电压:25kv,注射0.5μl/秒持续0.5秒。在运行之间冲洗毛细管。样品阴离子浓度为2ppm,不同之处在于丙磺酸盐浓度为5ppm。
图9是示出使用表2中概述的涂覆程序的毛细管与毛细管再现性的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:50μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm,不同之处在于丙磺酸盐浓度为2ppm。
图10是示出使用涂覆程序的毛细管与毛细管再现性的图。
图11是示出bge的老化对目标阴离子的in-bes分离的影响的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:50kv,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm,不同之处在于甲磺酸盐和丙磺酸盐浓度为2ppm。
图12是示出在ph6.0下pei对scantexin-bes分离的影响的电泳图的比较。bge:30mmmes/21mm组氨酸,ph6.0,毛细管:50μm×60cm(至检测器46.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:使用fes压力电磁阀关闭4秒。在运行之间冲洗毛细管。
图13是示出使用ph6.0的mes/组氨酸bge分离目标阴离子混合物的电泳图。bge:30mmmes/21mm组氨酸+0.02%pei,ph6.0,毛细管:50μm×60cm(至检测器46.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:使用fes压力电磁阀关闭4秒。在运行之间冲洗毛细管。
图14是示出使用ph6.0的mes/组氨酸bge的eof稳定性的电泳图的比较。bge:30mmmes/21mm组氨酸+0.02%pei,ph6.0,毛细管:50μm×60cm(至检测器46.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:使用fes压力电磁阀关闭4秒。在运行之间冲洗毛细管。
图15是示出毛细管直径对观察到的分离的影响的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:25/50μm×35cm(至检测器26.5cm)经hdmb涂覆,电压:25kv,注射1μl/秒持续0.5秒。在运行之间冲洗毛细管。阴离子浓度为2ppm,不同之处在于丙磺酸盐浓度为5ppm。
图16是示出对毛细管出口/高电压接口的修改的示意图。
图17是比较目标无机爆炸物标记阴离子的si-ce分离的电压的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:50μm×35/50cm(至检测器21.5/36.5cm)经hdmb/pss/hdmb涂覆,电压:30/50kv,注射1μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm,不同之处在于丙磺酸盐浓度为2ppm。
图18是示出使用spellmansl120pnhv电源和图16所示的接口的增加的电压对目标阴离子的si-ce分离的影响的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:50μm×35cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:如标记,注射1μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm,不同之处在于丙磺酸盐浓度为2ppm。
图19是示出使用spellmansl120pnhv电源的检测器位置对基线稳定性的影响的电泳图的比较。bge:50mmtris/ches+0.05%pei,毛细管:50μm×35cm(至检测器约26.5cm)经hdmb/pss/hdmb涂覆,电压:30kv,注射1μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm,不同之处在于丙磺酸盐浓度为2ppm。
图20是示出分离时间相对于施加电压的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:如标记,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm。
图21是示出使用标准375μmod熔凝石英毛细管的高场强分离的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm(375μmod)经hdmb/pss/hdmb涂覆,长度如标记,电压:40kv,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm。
图22是示出使用标准375μmod熔凝石英毛细管的高场强分离的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm(375μmod)×20cm(至检测器6.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射如标记。在运行之间冲洗毛细管。样品阴离子浓度为1ppm。
图23是示出系统中使用的不同t形件单元的效果的电泳图的比较。bge:50mmtris/ches+0.055%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射fes压力电磁阀关闭5秒。在运行之间冲洗毛细管。甲磺酸盐浓度为1ppm,其他峰残留在拭子上。
图24是一个t形件设计的示意图。
图25是示出scantexsi-ce系统的替代t形件布局的示意图。
图26是示出使用图24和图25所示的三个t形件取向的分离9种目标阴离子标准品的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:fes压力电磁阀在上部分离中关闭2秒,在下部两个分离中关闭4秒。在运行之间冲洗毛细管。
图27是示出使用图25b所示的t形件取向的加标有10μl40ppm标准品的拭子的scantex分析之后的清除的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:fes压力电磁阀关闭4秒。在运行之间冲洗毛细管。
图28是示出阳性分析之后fes携带的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:手动注射或fes压力电磁阀关闭5秒。在运行之间冲洗毛细管。
图29是示出scantexin-bes内毛细管安装的再现性的电泳图的比较。bge:50mmtris/ches+0.055%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射:fes压力电磁阀关闭5秒。在运行之间冲洗毛细管。样品阴离子浓度为1ppm。
图30是示出样品流量对scantex-in-bes分离的影响的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:45kv,注射如标记。在运行之间冲洗毛细管。样品阴离子浓度为1ppm。
图31是示出使用scantexin-bes对不同样品流量的峰面积和峰高的影响的图。条件如图30所示。
图32是示出在没有温度控制的情况下scantexin-bes超过965次连续运行的再现性的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:45kv,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为0.5ppm,不同之处在于甲磺酸盐和丙磺酸盐浓度为1ppm。
图33是示出图32所示的分离的迁移时间和相对迁移时间的图。
图34是示出使用经温度控制的壳体超过1875次连续分析的迁移时间和相对迁移时间的图。除了25kv的分离电压之外,其他条件如图32所示。
图35是示出在使用经温度控制的壳体的scantexin-bes的再现性研究期间的第一次和最后一次运行的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:25kv,注射0μl/秒持续0秒。在运行之间冲洗毛细管。样品阴离子浓度为0.5ppm,不同之处在于甲磺酸盐和丙磺酸盐浓度为1ppm。
图36是示出手拭子的分析和随后的提取的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:25kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。峰是;1=氯化物,7=碳酸盐。
图37是示出从最近暴露于海水的皮肤中取出的拭子的分析的电泳图的比较。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:25kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图38是示出用coles抗菌洗手液洗涤的手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图39是示出在施用redwinsorbolene保湿霜之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图40是示出在使用coles定型凝胶之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图41是示出在使用aerogard热带强度驱虫剂之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图42是示出在使用强生婴儿爽身粉之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图43是示出在使用有机护理调理洗发剂之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图44是示出在处理cc奶酪至尊玉米片之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图45是图44所示的电泳图的比较的放大图。
图46是示出在施用coles滚动止汗剂之后手的拭子的电泳图的比较。将1ppm内标(甲磺酸盐)直接添加到萃取溶液中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图47是示出在范围日运动期间对加标有目标阴离子标准品的拭子的分析以及在洗涤后对同一拭子的随后分析的电泳图的比较。从scantex系统的后续迭代中修改了仪器设置:用简单的t形件替换用于将样品或bge转移到si-cet形件的切换阀。该布局以与最终scantexin-bes相同的方式起作用,不同之处在于fes和bes的冲洗仅可以在分离完成后进行。取样:在将拭子插入scantex系统之前,将拭子浸入100ppm目标阴离子标准品中。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:25kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图48是示出在一定范围内采集的样品的分析的电泳图的比较。取样:在制备ied后,在一定范围内在其中一个人的手上擦拭湿拭子和干拭子。在基于黑色粉末的ied爆炸之后,将另一个湿拭子擦过验证板。将所有拭子装袋并带回scantex系统所在的移动实验室并在现场进行分析。bge:50mmtris/ches+0.06%pei,毛细管:25μm×40cm(至检测器26.5cm)经hdmb/pss/hdmb涂覆,电压:25kv,注射电磁阀关闭0秒。在运行之间冲洗毛细管。
图49是示出来自一般人群的志愿者测试的所选筛选结果的电泳图的比较。从每个志愿者中取出单个拭子样品,将拭子通过志愿者的手、他们的裤腿和他们的鞋的顶部。每次分析使用经milli-q水润湿的新拭子。使用加标有10μl40ppm标准品的空白拭子获得顶部迹线。bge:50mmtris/ches+0.06%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭4秒。t形件构造如图34b所示。在运行之间冲洗毛细管。
图50是示出来自一般人群的志愿者在与图49提及的不同日期和地点的测试的所选筛选结果的电泳图的比较。从每个志愿者中取出单个拭子样品,将拭子通过志愿者的手、他们的裤腿和他们的鞋的顶部。单个拭子用于所有测试,而不是每次分析用新拭子替换。通过向拭子中添加10μl40ppm标准品获得加标样品然后分析。bge:50mmtris/ches+0.06%pei,毛细管:25μm×50cm(至检测器36.5cm)经hdmb/pss/hdmb涂覆,电压:40kv,注射电磁阀关闭4秒。t形件构造如图34b所示。在运行之间冲洗毛细管。
图51是示出scantex系统的完整分析时间范围的示意图。条件如表1所示。样品:施加有5μl100ppm标准品的不锈钢板的湿拭子并使其干燥。
具体实施方式
如上所述,本申请涉及在使用电泳分离和检测样品中的无机阴离子的系统或方法中,在分离通道上使用阳离子聚合物和阴离子聚合物的交替层作为涂层。在下文中,我们描述了在分离通道上使用多层涂层,在一些实施方案中,将其与在背景电解质中使用阳离子聚合物相结合。还描述了毛细管电泳和分离毛细管的用途,但应理解,本发明扩展到使用其他形式的分离通道而不仅仅是毛细管。
分离通道
术语“分离通道”包括分离毛细管和其他通道布置,例如微芯片中的微机械通道,通过它们可以实现分析物或离子的分离。在下文中,当提及毛细管电泳时,应理解,相同的布置可以应用于其他形式的电泳,例如微芯片电泳和mekc,因此这样的引用在这方面是非限制性的。
分离通道可以是熔凝石英毛细管。使用较小孔的毛细管可以减少由较小的毛细管中较大的表面积与体积比引起的电渗流(eof)增加所引起的分析时间。分离毛细管的内径可以为约10μm至100μm,例如10μm至75μm、10μm至50μm、20μm至50μm、20μm至30μm、25μm至50μm。分离毛细管的标称内径可以为25微米、30微米或50微米。
使用较小孔的毛细管,例如使用25μm毛细管,允许使用仅25kv的分离电压在50秒内分离目标阴离子。作为另一个实例,使用50μm毛细管引起分离时间约为60秒。虽然这些差异相对小,但在总结连续使用数天或数周时,它们可能很重要。
分离毛细管的长度可以为约15cm或更长,并且至多100cm,虽然为了较短的分离时间,优选15cm至60cm的较短的毛细管长度。该长度是指总柱长。应注意,检测区通常与毛细管的出口端间隔开,因此有效长度比对应于检测区位置的长度短。实施例中使用的分离毛细管的长度为20cm至60cm。
分离通道(例如熔凝石英毛细管)涂覆有阳离子聚合物和阴离子聚合物的三个或更多个交替层,使得涂层的第一层(最内层)和最后一层(最外层)均为阳离子聚合物层。层位于通道或毛细管的内表面上。在这种排列中,阳离子聚合物和阴离子聚合物的交替层引起形成稳定的涂层。作为一个实例,阳离子聚合物的第一层形成在分离毛细管(例如首先用碱处理以形成阴离子表面的熔凝石英毛细管)的带负电荷的表面上,然后阴离子聚合物的第二层形成在第一阳离子聚合物层的带正电荷的表面上,最后阳离子聚合物的第三层形成在阴离子聚合物的带负电荷的表面上,留下阳离子聚合物层作为最后一层。应理解,可以向涂层添加阳离子聚合物和阴离子聚合物的另外的交替层,条件是最后一层(最外层)是阳离子聚合物层。
涂层将具有奇数个层。层数至少为3个层,并且可以为3个层、5个层、7个层、9个层、11个层或13个层。优选3个层、5个层或7个层,最优选3个层。
用于涂覆分离通道的阳离子聚合物可以是叔胺聚阳离子或季胺聚阳离子。用于涂覆分离通道的阳离子聚合物可以是己二甲胺聚合物或聚二烯丙基二甲基铵聚合物。己二甲胺聚合物的实例包括溴化己二甲胺;己二甲胺卤化物(溴化物、碘化物等)和氢氧化己二甲胺。聚二烯丙基二甲基铵聚合物的实例包括聚二烯丙基二甲基氯化铵;聚二烯丙基二甲基卤化铵(氯化物、溴化物、碘化物等);聚二烯丙基二甲基氢氧化铵;聚二烯丙基二甲基硫酸铵;聚二烯丙基二甲基硫酸氢铵;聚二烯丙基二甲基碳酸铵和聚二烯丙基二甲基乙酸铵。聚二烯丙基二甲基铵聚合物的分子量可以为至多1000000,作为一个实例,分子量在100000至1000000的范围内。在实施例中,用于涂覆分离通道的阳离子聚合物是溴化己二甲胺。
用于涂覆分离通道的阴离子聚合物可以是磺化或硫酸化的聚合物或共聚物,例如聚苯乙烯磺酸盐、硫酸葡聚糖、聚(乙烯基磺酸盐)或者磺化或硫酸化单体与第二单体(例如丙烯酸或酯)的共聚物,一个实例是聚(4-苯乙烯磺酸-共聚-马来酸)。值得注意的实例是聚苯乙烯磺酸盐及其共聚物、盐或衍生物。聚苯乙烯磺酸盐的共聚物可以包括聚苯乙烯磺酸盐和其他可共聚单体,例如其他芳族单体、乙烯基单体、丙烯酸单体或酯单体,它们中的每一种可以为磺化或未磺化的。聚苯乙烯磺酸盐的盐可以包括钠盐、钙盐和钾盐。聚苯乙烯磺酸盐的衍生物可以包括聚苯乙烯磺酸盐的烷基衍生物,例如聚苯乙烯乙磺酸盐。在示例中,用于涂覆分离通道的阴离子聚合物是聚苯乙烯磺酸盐。聚苯乙烯磺酸盐的分子量可以为至多10000,作为一个实例,分子量在500至10000的范围内。
已经将分离通道描述为具有“阳离子聚合物和阴离子聚合物的三个或更多个交替层的内涂层,其中第一层和最后一层是阳离子聚合物层”。描述分离通道的涂层的另一种方式是具有“等于或大于三个的奇数个内涂层,包括阳离子聚合物的第一涂层、阴离子聚合物的第二涂层和形成第一层的所述阳离子聚合物的第三涂层”。这两种引用的表达可以互换使用。
分离通道或毛细管可以与系统(装置)一起供应,或者可以作为单独的消耗品供应。在任一种情况下,分离通道可以预先涂覆有阳离子聚合物和阴离子聚合物的交替层,或者可以原位涂覆。通常,可以通过首先用处理溶液处理通道(例如用碱溶液处理通道),然后使包含每种聚合物的毛细管涂覆组合物按顺序通过分离通道来实现涂覆。合适的处理溶液包括弱碱性溶液,例如1mnaoh溶液,然后用水(例如milli-q水)洗涤。使第一毛细管涂覆组合物通过分离通道,然后在引入第二毛细管涂覆组合物和后续毛细管涂覆组合物之前除去。使毛细管涂覆组合物通过通道的时间为约1分钟至10分钟,例如约5分钟。在涂覆顺序期间,所使用的流量可以在约1μl/分钟至100μl/分钟的范围内,但流量可以根据毛细管的内径而变化。毛细管涂覆组合物可以包含0.01%至20%的阳离子聚合物(用于第一毛细管涂覆组合物)或阴离子聚合物(用于第二毛细管涂覆组合物),例如0.1%至10%的聚合物,1%的解决方案特别适合。依次涂覆毛细管涂覆组合物,使得第一层(即与通道壁相邻并通过静电相互作用连接至通道壁二氧化硅的层)和最后一层由包含阳离子聚合物的第一毛细管涂覆组合物制成。这引起涂层具有正表面,并且通道具有带正电荷的内表面。
所得分离通道具有稳定的涂层、延长的寿命并且可以重复制备。在某些条件下,通道可以重复使用多至30000次运行或多至20000次运行,同时保持相对迁移时间和/或相邻峰之间的分辨率的稳定性。在一些实施方案中,通道可以进行多至30000、多至20000、至少2000、至少1000、1000至30000、1000至20000、2000至30000、2000至20000、1000至2000、300至30000、300至20000、300至2000、500至2000、300至1000、或500至100个样品分离顺序,同时保持相对迁移时间和/或相邻峰之间的分辨率的稳定性。在用新的分离通道替换分离通道之前,分离毛细管可以用于进行多个样品处理顺序。在一些实施方案中,在用新的分离通道替换分离通道之前,分离通道可以用于进行不少于2000个或不少于1000个样品处理顺序。
毛细管包括检测区。检测区与毛细管的入口间隔开足够的距离以进行分离。在一些实施方案中,毛细管包括c4d检测区,所述c4d检测区位于毛细管的入口的适当距离处以发生无机阴离子的分离。在使用光学检测器的情况下,可以存在毛细管的光学透明区以使得能够通过检测器进行检测。
在操作期间,沿着电极对之间的分离通道施加高电压(hv)电势。电极对通常是hv电极和接地电极。电压电势通过分离通道驱动样品中的离子朝向hv电极。毛细管包括低电压(lv)端和hv端。检测区朝向hv端定位。
当存在背景电解质通过流体通道的流时,在分离阶段期间在分离柱(纵向)上施加高电压。在该步骤期间施加的典型电压多至-50kv,例如约-20kv至-45kv、约-30kv至-50kv、约-20kv至-45kv、约-25kv至-45kv、或约-30kv至-40kv。
检测器
检测器可以是用于检测无机阴离子的存在(和相对量)的任何合适形式的检测器。实例包括非接触电导检测器,包括电容耦合式非接触电导检测器(c4d检测器);具有与毛细管流体接触的电极的接触电导检测器;和光学检测器(光学透射率/吸光度检测器),例如光度检测器。示例中使用的检测器是c4d检测器。由检测器产生的信号可以由控制器转换成便于记录和分析信号的可视图像。分离通道(分离毛细管)的检测器区适当地定位在距离分离通道出口5cm至15cm的距离处,例如距离分离通道出口约10cm的距离处。检测器与检测区对齐。
该方法/系统能够检测10ppm或甚至更低浓度的目标无机离子。在1分钟的时间范围内,该系统能够从样品的提取物中筛选该样品,以通过电泳系统进行分析。在一个实施方案中,从样品注射到通过电泳系统分离无机阴离子所花费的时间可以小于1分钟,并且在一些情况下,小于30秒。在另一个实施方案中,该系统在30秒至2分钟、30秒至1分钟、20秒至50秒或小于1分钟的时间范围内分离包括硝酸根离子、高氯酸根离子、叠氮根离子和氯酸根离子的无机离子。
可以通过该方法/系统分离的无机阴离子包括存在于爆炸物中的硝酸根离子、高氯酸根离子、叠氮根离子和氯酸根离子。该方法/系统还将这些无机阴离子从与爆炸物无关的背景离子分开,所述背景离子例如氯离子、硫酸根、硫氰酸根、氟离子、磷酸根和碳酸根。有必要分别分离并检测这些阴离子中的每一种,以确保不会得到假阳性或假阴性的检测爆炸物的读数或分析。
注射系统
注射系统提供将包含样品溶液和背景电解质的流体注入分离通道的入口端。在一些实施方案中,注射系统包括样品注射系统、与样品注射端口流体连通的流体通道、以及用于贮存背景电解质的背景电解质贮存器,所述背景电解质贮存器与样品注射系统流体连通以使流体能够流过流体通道并流入分离通道的入口端。
样品注射系统可以包括样品注射端口,并且还可以包括这样的注射器阀:其可以被操作以控制流体通道打开至样品注射端口(以使样品进入流体通道)或背景电解质。
该方法可以涉及在进行样品处理序列之前的样品制备步骤。这可能涉及取一个表面拭子并使拭子与样品溶液接触以将无机阴离子提取到样品溶液中。然后可以将样品溶液注入注射端口中。
该系统可以涉及顺序注入样品,然后是背景电解质,其通过背景电解质的稀释效应来使样品的“堵塞物”的分散得以防止或最小化。因此不需要高流量,这会影响分离效率,且试剂的消耗量较低。该顺序系统使注射的时间范围缩短到约5秒或更短。
该系统可以使用压力注射或电动注射将样品加载到分离毛细管上。使用电动注射,在样品注射的最后阶段期间可以跨毛细管施加电压电势,以引起存在于样品中的离子沿着毛细管通过。
通过分离通道的包含背景电解质的流体的流,可以通过泵或任何其他流体流动发生器的操作来实现。通向分离通道的系统的尺寸和组件可以如我们的较早的申请pct/au2013/000889中所述,其全部内容通过引用并入本文。
背景电解质可以贮存在与注射系统流体连通以使其能够流经并流入分离通道的背景电解质贮存器中。背景电解质贮存器可以位于系统(装置)本身内,或者可以位于可以插入装置中的容器内。在分离的时间段期间,背景电解质流量可以在约10μl/分钟至1000μl/分钟的范围内,并且通常其将在约10μl/分钟至200μl/分钟的范围内。在实施例中使用50μl/分钟的流量,并且该水平附近的流量适合于该过程。
背景电解质包含阳离子聚合物组分,其不同于用作分离通道或毛细管上的涂层的阳离子聚合物。背景电解质中使用的阳离子聚合物可以是叔胺聚阳离子或季胺聚阳离子。背景电解质中使用的阳离子聚合物可以是阳离子表面活性剂。根据优选实施方案,背景电解质中的聚合物组分是聚乙烯亚胺(pei)。
pei可以是高分子量pei,例如分子量高达1000000的pei,例如高达100000的、或50至100000的pei,并且作为一个实例,50至60000的pei。pei在背景电解质中的量合适地在约0.01%至0.5%的范围内,例如约0.01%至0.4%、0.01%至0.3%、0.01%至0.2%、0.01%至0.1%、0.02%至0.08%、0.03%至0.08%和0.04%至0.08%。已发现约0.06%的水平是有效的。
背景电解质还可以包含一种或更多种缓冲剂,以及任何其他典型的电解质组分。背景电解质中使用的缓冲剂可以包括以下任何组合:强碱和弱酸、强酸和弱碱、或弱酸和弱碱。合适的缓冲剂的实例包括tris、ches、磷酸盐、乙酸盐、硼酸盐、甲酸盐,hepes、双-三丙烷、乙二胺和三乙醇胺。在实施例中,使用的缓冲剂是tris和ches。电解质的ph可以在约7.5至11、约8至10、或约8至9的范围内。在一些实施方案中,电解质的ph为约8.9,尽管取决于其他主要条件,但是ph可以距该ph值+/-1.0。
其他系统特征
该系统可以包括在准备使用的位置的分离通道(例如毛细管),或者系统可以不供应毛细管,意图是单独购买分离毛细管,并直接插入或通过使其包括在可释放地插入系统中的容器中。该系统可以呈便携式装置的形式,可以包括用于将容器或分离毛细管加载到目标位置的容器接收器或毛细管加载区域。容器可以成形为允许可释放地插入系统中。在这种情况下,系统/装置的接收器具有用以接收容器的互补形状,并且在这方面可包括夹子、卡销(detent)或其他形状的特征。向容器中插入使分离柱或毛细管定位在正确的位置,以便一旦插入就可以进行样品处理。在容器还包括背景电解质贮存器的情况下,其与系统/装置的组件对准,使得包含在贮存器中的背景电解质可以根据需要流经系统。
使用诸如计算机的控制系统来操作该装置。控制器控制装置的操作阶段,包括控制注射系统、控制泵操作(以及背景电解质的流的速度)、施加电压电势等。控制系统还可以控制检测系统,包括处理由检测器接收的信号并将该信号转换成可视表示(在显示器或其他装置上的)。控制系统可以包括个人计算机或者尺寸适于装置的便携性的专用控制系统。在一些实施方案中,控制系统可以控制分离通道涂覆顺序,以施加阳离子聚合物和阴离子聚合物的三个或更多个交替层的内涂层。控制器通常包括这样的处理器:其处理存储在相关的有形存储器中的计算机可读指令,以向用户呈现输入请求,经由输入装置接收一种或更多种输入并根据输入和存储在存储器中的指令控制辐射源。术语“处理器”一般用于指代可以根据存储的指令处理输入以控制辐射源的任何装置,并且可以包括:微处理器、微控制器、可编程逻辑装置或其他计算装置、通用计算机(例如,pc)或服务器。
该系统可以包括适当地控制注射系统、背景电解质的流和施加的电压的控制器,以产生以下步骤序列:
-将样品注入样品注射端口以流入流体通道的接口区域,而没有背景电解质流经流体通道;
-在随后的冲洗步骤之前跨电极施加电压电势,以使位于接口区域的样品中存在的无机阴离子移动到分离通道中;
-在不跨电极施加电压电势的情况下,背景电解质流经流体通道以从流体通道的接口区域冲洗样品;
-在冲洗步骤之后跨电极施加电压电势,伴随背景电解质流过流体通道,以实现样品中的无机阴离子的分离。
该系统可以呈现便携式装置的形式。该装置可以是单部件装置,也可以是单独的部件。
试剂容器
以上描述了包括容器的实施方案。在替代实施方案中,系统或装置可以补充有试剂容器,该试剂容器包括:
-包含溴化己二甲胺的第一毛细管涂覆组合物;
-包含聚苯乙烯磺酸盐的第二毛细管涂覆组合物;和
-包含聚乙烯亚胺的背景电解质组合物。
用于试剂容器的组合物如先前所述的用于形成分离通道的层和用于背景电解质的组合物。第一毛细管涂覆组合物中的己二甲胺聚合物的浓度通常为0.1重量/体积%至10重量/体积%,优选为0.1重量/体积%至5重量/体积%。相同的浓度范围可以用于聚苯乙烯磺酸盐溶液。
实施例
现在,将参照证明本发明潜在的原理的以下实施例以及本发明的具体实施方案更详细地描述本发明。本领域技术人员将理解,在不背离本发明的如广义描述的精神或范围的情况下,可以对如具体实施方案中所示的发明做出许多修改和/或变化。因此,这些实施方案在所有方面被认为是说明性的而非限制性的。
1.实验
1.1化学品
除非另有说明,否则所有试剂均为从sigma-aldrich(sydney,australia)获得的分析级,并且如所提供的那样使用。试剂的溶解总是在milli-q水(millipore,bedford,ma,usa)中制备。通过溶解高氯酸盐、氯酸盐、磷酸盐、硝酸盐、硫酸盐(bdh,kilsyth,vic,australia)、硫氰酸盐、氯化物(univar,redmond,wa,usa)、氟化物、叠氮化物(ajax,sydney-melbourne,australia)的钠盐或钾盐来制备阴离子标准溶液(1000μgl-1)。使用丙磺酸钠(fluka,buch,switzerland)作为内标。每天对这些溶液进行体积稀释以制备工作标准溶液。
1.2背景电解质
最佳的背景电解质由50mm的2-氨基-2-羟基甲基-丙烷-1,3-二醇(tris)和50mm的2-(环己基氨基)乙磺酸(ches)在ph为8.9下组成。添加pei(聚(乙烯亚胺),m.w.50至60000,acrossorganics,geel,belgium)以改变选择性,最佳浓度为0.06%(w/v)。
1.3电泳步骤
使用来自polymicrotechnologies(phoenix,az,usa)的内径为25μm或50μm的熔凝二氧化硅毛细管进行分离。
1.4毛细管涂覆
使用溴化己二甲胺(hdmb,聚凝胺)和聚(4-苯乙烯磺酸钠)(pss)来涂覆熔凝二氧化硅毛细管的壁以逆转电渗流(eof)。在施加毛细管涂覆试剂之前,毛细管用氢氧化钠(naoh)溶液冲洗。
使用以下步骤涂覆毛细管:
1.切割50cm的25μmfs毛细管。
2.使用upchurchfingertight10-32螺母(p/n:f-300-01)、高压套圈(p/n:f-142x)、1/16x0.0155fep套管(p/n:f-242x)和10-32母对母luer适配器(p/n:p-659)来将毛细管的一端连接至含有1mnaoh的一次性注射器。
3.将注射器和毛细管加载到注射泵上,并将流量设置为0.03ml/小时(0.5μl/秒)
4.用1mnaoh冲洗毛细管10分钟。
5.用另一个含有过滤蒸馏水的注射器替换1mnaoh注射器。
6.用水冲洗毛细管10分钟。
7.用另一个含有1%(w/v)溴化己二甲胺(hdmb)的注射器替换水注射器。
8.用hdmb冲洗毛细管15分钟。
9.在hdmb冲洗之后,移除luer适配器并用水充分冲洗以去除任何残留的hdmb。
10.附接水注射器并冲洗毛细管10分钟。
11.用另一个含有1%(w/v)聚苯乙烯磺酸盐(pss)的注射器替换水注射器。
12.用pss冲洗毛细管15分钟。
13.在pss冲洗之后,移除luer适配器并用水充分冲洗以去除任何残留的pss。
14.附接水注射器并冲洗毛细管10分钟。
15.用含有1%(w/v)hdmb的注射器替换水注射器。
16.用hdmb冲洗毛细管15分钟。
17.用含有in-bes(50mmtris/ches+0.06%pei)的bge的注射器替换hdmb注射器。
16.用bge冲洗毛细管60分钟。
17.现在毛细管准备好插入in-bes中。
1.5仪器
所有实验均使用内部构建的连续-注射-毛细管电泳单元(被称为scantexsi-ce)进行。该仪器的示意图如图1所示。其由两个能够连续供应bge和样品的milligat泵组成。使用泵来通过系统递送样品和bge。使用六端口注射器阀(mxp-7980,rheodyne,oakharbor,wa,usa)将样品或bge递送至接口。将商业peekt形连接件(p-727,upchurchscientific,oakharbor,wa,usa)用于流动系统与ce毛细管的接口。虽然用于实施例中的单元使用这些组件,但是可以使用对仪器的变型,特别是对于定制单元。
从注射器针头(0.51mmi.d.)切下2cm的不锈钢管处理为出口和接地电极,同时使接地电极的截面为圆形或管状。虽然用于实施例的单元中的接地电极为这种结构,但是可以使用不同形状、组成或结构的电极。
在最小的内部体积(0.57μl)和足够大的内径(0.5mm)的基础上在可商购的选项中选择接口,以使毛细管插入接口的中心。该内径与用于将注射阀和泵连接至接口的peek管的内径一致,消除了死体积并进一步减少了湍流。借助于穿过t形水平臂引入的毛细管件(360μmo.d.),将毛细管尖端固定在靠近接口中心的恒定位置。将毛细管的出口侧引入装有bge的25ml玻璃小瓶中。利用这种设计,施加了高达2000vcm-1的电场,而没有明显的电流泄漏。
由innovativesensortechnologies(strassahof,austria)购买商业电容耦合式非接触电导检测器(c4d)(tracedec)。针对每个毛细管内径和bge组成优化检测参数。对于最终选择的条件,探测器的操作参数是:频率,高;电压,-6db;增益,100%,以及偏移(offset),004。应注意,可以使用其他c4d检测器来代替实施例中使用的检测器。这些可以从其他商业供应商获得,或者可以专门为商业规模生产的单元制造。使用agilent35900ea/d转换器(agilenttechnologies,waldbronn,germany)将c4d产生的信号与用于记录和分析信号的agilentchemstation软件连接。同样,可以使用其他转换器。除非另有说明,否则在所有实践期间,检测器头位于距ce毛细管出口10cm处,并且至检测点的有效长度为总毛细管长度减去10cm。
分离由emcodx-250高压电源驱动,该电源在与浸没在出口玻璃小瓶中的阴极(-)电极的相反极性下工作。
该系统用个人计算机控制,利用rs232串联连接注射泵。通过来自nationalinstruments(austin,tx,usa)的niusb-6212数据采集装置将注射器阀和高压电源(极性控制,开/关和电压输出)连接至计算机。使用来自nationalinstruments的labview8.1编写的软件来控制系统。使用相同的软件来监控电源提供的电压和电流。对于以商业规模生产的单元,可以使用用于执行所需功能的定制硬件和软件。
1.6操作条件
scantex系统的操作条件如表1所示。擦拭样品的完整分析在60秒内完成,前端系统(frontendsystem,fes)花费25秒萃取拭子并将所得样品递送至作为用于分析无机阴离子的si-ce的无机返回终端系统(in-bes)。然后,在分析之前,in-bes需要另外10秒以从cet形件冲洗样品溶液。in-bes的完整分析在25秒内完成,即内标(甲磺酸盐)通过ce系统迁移所需的时间。
表1scantex系统的参数
图2示出了使用图1所示的仪器布局、使用经单层hdmb涂覆的毛细管和背景电解质实现的分离,所述背景电解质包含50mmtris/ches和0.05%pei(比较组合物),而不是本发明的经涂覆毛细管。目标化合物(硝酸盐、氯酸盐和高氯酸盐)在45秒内完全溶解,并且系统的再现性在40次连续运行中是良好的。
2.化学优化
2.1分析物的选择
选择四种无机阴离子作为爆炸物鉴定的目标。高氯酸盐、氯酸盐和硝酸盐是ied上使用的最常见的氧化剂,如钾盐或铵盐。叠氮化铅通常用作引爆装置的一部分以引发二次爆炸。
氯化物、硫酸盐、磷酸盐以及较小程度的氟化物和硫氰酸盐是最可能的存在于样品中的背景离子。还重要的是,考虑到来自大气co2快速溶解至样品和标准溶液中的碳酸盐。
2.2背景电解质组合物
使用含有50mmtris、50mmches和0.05%pei的背景电解质作为起始组合物。在系统中使用该浓度导致图3的底部迹线上显示的分离。
获得所有目标阴离子以及可能的污染物的完全分辨率。在上面的两个分离中显示了增大pei浓度的效果,并且可以看出氟化物和高氯酸盐之间的分辨率显著提高。此外,如后面所示,当分析实际样品时,氟化物被证明是比硫氰酸盐更普遍的污染物。
基于图3中所示的结果,优选的电解质组合物设定为0.06%pei的量。
2.3比较例-单层毛细管涂层
图4涉及包含涂覆有单层hdmb的毛细管并且在分析之间没有冲洗步骤的比较例。可以看出,虽然在一天内再现性相对较好,但在多天内使用相同的毛细管导致观察到的eof的减少(分析物迁移后看到的大幅下降)以及一些目标阴离子之间的分辨率的损失。
图5示出使用经单层涂覆的毛细管并且在分析之间使用冲洗的系统的再现性。可以看出,在连续使用2至4天的过程中目标阴离子的分辨率开始劣化。分析时间保持恒定的事实表明毛细管涂层相对稳定,然而,如图4所示,导致分析时间更长并且可能损失分辨率的涂层缓慢脱除的可能性仍然存在。
毛细管坚固性是重要的,因为不可能用新的hdmb层重新涂覆毛细管。这可以在图6中看到,其中用新的hdmb层重新涂覆毛细管的过程无法成功地恢复毛细管性能。
使用包含第一层hdmb(如上)、阴离子聚合物聚苯乙烯磺酸盐(pss)的随后层和hdmb的最后一层的经三层涂覆的毛细管进行测试。这些经三重涂覆的毛细管显示出与经单一涂覆的品种类似的分离性能,但它们的坚固性和可用性是远远优越的。
还测试了使用经5重涂覆的毛细管(hdmb/pss/hdmb/pss/hdmb)的可能性。图7示出使用经三重涂覆的毛细管和经5重涂覆的毛细管获得的分离之间的比较。
还测试了使用更强阳离子聚合物聚二烯丙基二甲基氯化铵(pddac),因为已知其在毛细管表面上形成比ph依赖性hdmb更强的涂层。图8比较了使用经hdmb涂覆的毛细管或基于pddac/pss/pddac的经三重涂覆的毛细管获得的分离。虽然两种涂层都产生反向eof和相对快速的分离(使用25kv约70秒),但经hdmb涂覆的毛细管的性能优于基于pddac的毛细管。
经多层涂覆的毛细管需要不时替换。因此,毛细管到毛细管再现性是重要的考虑,使得当安装新的毛细管时可以预期可靠的结果。
制备经hdmb/pss/hdmb三重涂覆的毛细管所需的步骤如表2所示。其涉及按先后顺序通过毛细管冲洗聚合物溶液,确保在引入后续涂覆溶液之前彻底去除先前的聚合物。
图9示出使用利用表2中概述的步骤制备的8个不同毛细管获得的si-ce分离。可以看出,在所测试的8个毛细管上获得了良好的迁移时间再现性。此外,在所有毛细管上保持目标阴离子之间的一致分辨率。
表2毛细管涂覆步骤
图10示出了8个毛细管的迁移时间再现性以及对于目标阴离子的相对于甲磺酸盐(is)的迁移时间。目标阴离子在所测试的8个柱中的相对迁移时间非常好(<0.48%rsd)。
2.4bge稳定性
对于系统再现性重要的问题是bge稳定性。图11中的下部迹线显示了使用存储在空气中并开放在实验室温度波动中的旧bge的目标阴离子的分离。
为了使bge在空气中的长期暴露最小化,研究了两种方法。第一种涉及在bge储存器上使用二氧化碳捕集器。捕集器保持二氧化碳吸附剂(苏打石棉),使得吸入储存器的空气将被去除二氧化碳。虽然证明这种方法在限制吸附二氧化碳的问题方面是有效的,但它仍然使bge暴露在空气中。后来的方法涉及每天早晨在使用前用氮气吹扫bge储存器,使得从bge顶部空间移除所有空气。证明该方法简单可靠,并且在数天甚至数周的连续分析中获得了良好的bge稳定性。
2.5背景电解质ph
还研究了bgeph作为提高长期稳定性的选择。图12中的下部迹线显示了使用ph6.0的mes/组氨酸bge在没有pei添加到bge的情况下9种阴离子目标混合物的in-bes分离。将pei的量增加到0.02%允许目标离子与潜在的背景干扰完全分离(注意,内标(峰8和10)被添加到萃取溶液中,因此可以容易地去除和/或被不同的is替换)。图13显示了使用ph6.0的mes/组氨酸bge优化分离目标阴离子混合物并除去内标甲磺酸盐。
2.6电渗流(eof)的稳定性
图14显示了使用ph6.0的mes/组氨酸bge的eof稳定性。pei用于大概通过替换任何洗掉表面的hdmb分子来稳定毛细管壁上的hdmb涂层。
3.硬件优化
用更短且更小孔的毛细管和更高的电压的组合,可以有效地缩短给定分离的分析时间。然而,时间缩短必须与分离的足够分辨率和灵敏度平衡。测试和优化影响分离的效率和性能的主要工具变量,以在保持充分的分离特性的同时缩短分析时间。
3.1毛细管直径
毛细管直径对观察的scantexsi-ce分离的影响如图15所示。
3.2电压
scantexsi-ce系统所需的确切周转时间在某种程度上取决于其被应用的特定应用。emcodx-250hv电源仅可以产生25kv。使用能够产生高达120kv的spellmansl120pn单元来研究使用更高的电压。
3.2.1接口设计
图16示出对scantexsi-ce系统内的毛细管出口/高压接口进行的改变。
3.2.2高压系统性能
图17示出更高分离电压的优点,其中使用50kv和50cm毛细管在60秒内完全分辨了所有目标阴离子。图18示出使用spellmansl120pn单元在高达50kv的电压下对目标阴离子的hv分离。
图19示出当使用scantexsi-ce系统时毛细管位置对观察到的基线的影响。
图20示出使用40cm毛细管和30kv至45kv的电压获得的分离。随着电压的增大,分离时间缩短,分辨率损失有限。虽然使用30kv在45秒(is迁移花费的时间)内完成全部分析,但通过在45kv下操作系统可以将其缩短到接近30秒。
3.2.3高场强
图21示出氯酸盐和高氯酸盐以及背景阴离子氯化物和碳酸盐的高场强分离。对于该系统,我们将施加的电压限制在40kv以提高可靠性,但逐渐缩短分离毛细管,从而将场强从1.0kv/cm增加至高达2.0kv/cm。可以看出,虽然在1.0kv/cm的场强下(对应于使用40cm毛细管,到检测器26.5cm)获得4种阴离子的相对快速分离,但这可以随着场强的增加而显著降低。对于1.6kv/cm的场强(对应于25cm毛细管,到检测器11.5cm)仍然观察到4种阴离子的完全分离,但是分离的时间尺度现在远低于10秒。
3.2.4电压结论
由使用更高电压和/或更高电场强度的研究可以得出结论,分辨率、速度和坚固性之间的最佳折衷是使用30cm至50cm的375μmod毛细管。因此,这些条件用于随后的测试工作。
3.3t形件设计
图23示出在使用两种不同的t形件单元(相同类型和供应商)时获得的分离。图24示出t形件内的用于将分离毛细管连接到样品流过系统的体积。图25中示出另外两种布局。图26示出使用上述三种t形件取向实现的分离。
图27示出使用图25b中所示的t形件构造分析加标有10μl的40ppm标准品的拭子之后的清除。
3.4毛细管安装
研究了不同毛细管安装方法对分离结果的影响,结果如图29所示。含有毛细管的容器在插入装置时需要正确定位毛细管,以实现可再现的分离。
4.性能
4.1线性
图30和图31示出对不同样品流量的分离的影响。
4.2再现性
图32示出系统和方法的长期再现性,同时迁移时间和相对迁移时间如图33所示。这些运行在没有温度控制的情况下进行,并且可以清楚地看到在24小时时间段过程中对迁移时间产生影响。虽然绝对迁移时间受温度变化的影响,但相对于甲磺酸盐(is)的迁移时间非常稳定,在1000次连续运行中rsd<0.20%。除了相对迁移时间的稳定性之外,在所有1000次运行的过程中也保持了相邻峰之间的分辨率(对于高氯酸盐和硫氰酸盐的最差分辨峰,分辨率rsd为3.5%)。
在图33中,表明使用相对迁移时间可以显著改善系统的再现性。使用温控环境可以进一步减轻温度波动带来的变化。
图34示出使用温度控制壳体时的迁移时间和相对迁移时间。
图35示出图35中所示的长期再现性研究的第一次和最后一次运行。可以看出两次运行之间的良好一致性,在更接近迁移的阴离子(高氯酸盐、硫氰酸盐和甲磺酸盐)之间仅有轻微的分辨率损失。此外,虽然这一系列运行是在温控环境中进行的,但在运行系统时没有采取其他特殊注意事项,在所有分析的入口和出口位置都使用相同的bge。除了分辨率之外,还可以看出峰面积和高度在1875次连续运行过程中相对不受影响。
4.3背景干扰
通过使用scantex系统筛选一系列日常化学品、食品和材料来测试该系统在现实世界样品中的应用,以确定是否存在任何潜在的掩蔽剂。如果可能的话,以最符合实际可能使用的方式测试材料。
图36示出来自手拭子以及相同拭子的在由四次漂洗组成的洗涤序列之后的随后萃取物(下部三个迹线)的分析结果。采集皮肤拭子时观察到的主要成分是氯化物,这可以在图36中清楚地看到。还分析了由皮肤采集然后加标有100ppm目标阴离子标准物的拭子,显示三个目标峰与氯化物和碳酸盐之后迁移的未知峰良好的分辨。目前尚不清楚这个未知的峰是什么,但是其通常存在于采集皮肤拭子时,但是因为其在碳酸盐峰之后迁移并远离任何目标化合物,因此认为这个峰的鉴定并不重要。
由于氯化物可能是实际样品分析中的主要污染物,因此测试了擦拭最近暴露于海水中的皮肤的效果(图37)。如预期的,观察到非常大的氯化物峰,虽然该峰确实对硝酸盐和氯酸盐的迁移时间产生影响,但是将两者的迁移时间推迟几秒钟,这两个峰仍然清晰可见。
图38至46示出一系列潜在的现实世界污染物的分析。将每种产品处理或直接施用于手,随后取出拭子并使用scantex系统直接分析。抽样进行如下:
·在图38中,手用抗菌手洗洗涤并漂洗。然后采集拭子并直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图39中,将润肤霜施用于手并采集拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图40中,将发型啫哩如同即将被使用施用于手并采集拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图41中,将驱虫剂施用于手并采集拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图42中,将婴儿爽身粉施用于手、掸去并采集拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图43中,将洗发香波如同即将被使用施用于手并采集拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图44中,将炸玉米片如同即将被吃掉而完全抓住,然后采集手的拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
·在图46中,将止汗剂直接施用于手并采集拭子。然后将该拭子直接分析或加标直接施加到拭子上的10μl的100ppm目标阴离子标准物,然后通过scantex系统分析。
5.场地分析
将系统在三个不同的场地进行不同程度的评估。第一测试在位置a进行,以及涉及用于样品萃取的与scantexsi-ce(也被称为无机返回终端系统或“in-bes”)耦接的前端系统(fes)。另外两个实例发生在大学校园内(位置b和c),涉及包括fes和in-bes的完整系统的测试。
5.1在位置a的距离测试
在正在进行爆炸物爆炸演习的位置对暴露于ied准备和爆炸的个体和样品进行直接分析。
图47示出使用存在于位置a的改变的系统对加标拭子样品的分析。可以看出,获得了目标物质(硝酸盐、氯酸盐、高氯酸盐)的良好检测。此外,对相同拭子的后续分析显示fes和in-bes的有效清洁,使得在三次洗涤拭子后,除去大部分目标残余物。
图48示出在制备所使用的ied之后炸弹技术人员的手的湿拭子和干拭子分析,以及取自与基于ied的黑色粉末一起使用的一个验证板的拭子样品。可以看出,虽然在使用干拭子时没有拾取到目标残留物,但是炸弹技术人员手的湿拭子确实拾取了氯酸盐的痕迹,可能在制备其中一个ied期间使用。
如预期的,黑色粉末ied验证板的湿拭子显示出硝酸盐的大信号,突出了scantex系统应用于爆炸后分析以及爆炸前筛选的可能性。
位置a测试的结果表明,该系统能够检测参与ied准备的人员身上的目标物质,如氯酸盐。此外,虽然在位置a测试期间检测到硝酸盐的背景水平(如在位置b和c测试中观察到的),但是当从暴露于基于黑色粉末的装置的验证板采集拭子样品时观察到升高的水平。
5.2在位置b和位置c的测试
使用scantex系统在两个不同的日期和两个不同的位置(位置b和c)对来自位置b和c的一般人群的个体筛选。邀请个体使其进行“随机”筛选,其中涉及其衣服和鞋子的湿拭子以及随后的scantex系统分析。分析结果在现场进行。
5.2.1在位置b的测试
5.2.1.1in-bes结果
图49示出位置b场地测试的第一天的一些选定筛选结果。该系统没有问题地运行。
图49示出来自四名个体的筛选结果。使用用milli-q水润湿的新拭子进行每个测试。从结果可以看出,观察到非常相似水平的常见背景离子氯化物、碳酸盐和较小程度的氟化物,尽管氟化物峰可能是由拭子本身或用于润湿拭子的水中的污染物引起的。在大多数样品中也观察到硝酸盐的背景水平,然而,这些水平较低且相对一致,因此为了常规筛选目的,应该可以适当设置阈值限制并且如果阈值水平被破坏则仅返回“正”结果。如预期的,在任何样品中都没有检测到氯酸盐或高氯酸盐。
5.2.2在位置c的测试
5.2.2.1in-bes结果
图50示出在位置c进行的测试的筛选结果的选择。使用的条件和方案与先前的场地测试类似,然而,单个拭子用于所有分析。从结果可以看出,氯化物、碳酸盐和碳酸盐之后的未知物质的常见背景物质再次存在于所有样品中,尽管这些(尤其是氯化物)的水平因个体而异。在许多样品中再次观察到硝酸盐,尽管与之前的场地测试一样,观察到的水平相对较低,范围为按质量计约15pg至75pg(基于如图50所示的峰高计算)。在任何样品中均未观察到氯酸盐或高氯酸盐。
图50还示出在实际筛选样品和加标空白拭子两者之后的后续分析结果。在两种情况下,可以看出,观察到可忽略不计的残留,表明在筛网之间使用的冲洗方案足以完全清洁准备用于每次新分析的拭子。
5.3在位置b和c的场地测试的结论
scantex系统在所有三个场地测试中都表现良好,没有遇到任何仪器问题。
来自位置b和c场地测试的初步背景分析结果表明,例如氯化物和碳酸盐的干扰物质的标准背景水平不会干扰目标物质硝酸盐、氯酸盐和高氯酸盐。还发现,最初未考虑的其他背景物质对目标物质的分析没有造成任何问题。发现在位置b和c场地测试期间测试的所有志愿者中干扰物质的水平相对恒定。在目标物质中,在一般人群中仅检测到硝酸盐,然而其水平相对较低,因此在将筛选程序应用于现实世界分析时可以容易地设定这样的最小阈值。
6.讨论和结果
上述结果和讨论概述了原型爆炸物残余物筛选装置的开发和测试,该装置能够测试指示基于无机和过氧化物两者的爆炸装置的目标物质的存在。
该系统能够在1分钟的时间范围内可再现地分析拭子样品中存在基于无机爆炸物两者的残余物(硝酸盐、氯酸盐、高氯酸盐)。在系统中留有灵活性,使得筛选无机残余物所需的分析时间可以容易地针对特定应用进行调整。
scantex系统的主要特征如下:
·提供了一种简单分析任何表面存在基于无机的爆炸物残余物的方法。
·目前筛选时间为约1分钟至2分钟,但可以相对简单地缩短。
·使用计算机软件容易地控制系统。
·分析结果实时显示在计算机上。
·fes和in-bes使用的试剂已经最小化,fes每次分析使用约4ml溶液(主要是水),in-bes每次分析使用约0.3ml溶液。
·系统的再现性非常好,允许延长的连续操作时间。
6.1最终的系统参数
scantex系统的参数如表1所示,得到的分析时间表和结果如图51所示。擦拭样品的完整分析在小于60秒内完成,fes花费25秒萃取拭子并将所得样品递送到in-bes。然后,在分析之前,in-bes需要另外10秒以从cet形件冲洗样品溶液。in-bes的完整分析在25秒内完成,即内标(甲磺酸盐)迁移通过ce系统所需的时间。图51中所示的分析时间表提供了在60秒内对无机ied残留物进行快速基于拭子的筛选。
应理解,如果在本文中提及任何现有技术出版物,这样的提及不构成承认该出版物在澳大利亚或任何其他国家形成现有技术中的公知常识的一部分。
在所附权利要求以及本发明的前述描述中,除非由于表述语言或必要暗示而上下文需要另有所指之外,否则所使用的词语“包括/包含”或变体为包含性的,即,规定所述特征的存在,但并不排除本发明的各种实施例中的另外的特征的存在或附加。
- 还没有人留言评论。精彩留言会获得点赞!