用于检测细菌性感染的设备和方法与流程
本发明涉及诊断的领域,并且更特别地,涉及通过响应于细菌性感染而检测由个体产生的蛋白质来确定细菌性感染在所述个体中的存在或不存在。本发明还涉及确定所述个体中的细菌性感染的严重性和/或监视所述个体中的细菌性感染。
背景技术:
当入侵的病原微生物获得立足点、成功生长且从而扰乱组织的正常生理特性时,发生感染[petersonjw,1996]。为了最小化对患者的伤害,必须识别对感染负责的微生物,确定其对抗生素的易感性,并立即发起有效疗法[tunkelar,p.1267,2004]。抗生素的发现和实现在将具体病原体作为目标、有效地消除它们且挽救生命和资源时极其有价值[infectiousdiseasessocietyofamerica(idsa),s397,2011]。然而,充分的指南和适合的诊断仪器对社区来说并不始终可用,以支持适合的抗生素施用。与摄入和不受管制的施用有关的不充分依从已经部分地导致耐药菌株的发展[pecherejc,p.245,2007]。在促进抗菌素耐药性的全球传播的因素当中有增加的国际旅行和广阔的洲际商务。世界的发展中地区中的当前情形也促成了抗菌素耐药性的蔓延——此事无疑与人口密度、家庭购买力、药物可用性、抗生素的柜台交易可用性、保健和卫生标准、以及有组织的疾病控制和预防相关[bonellirr,p.24,2014]。革兰氏阴性细菌中的抗生素耐药率正在快速升高,尤其是关于对第三代和第四代头孢菌素的抗药性并且主要是由于超广谱β-内酰胺酶(esbl)的产生所致(falagas,p.345-354,2009)。由这种产生酶的有机体导致的感染与较高的发病率和死亡率以及较大的财政负担相关联(richih,625170,2012.)。esbl的流行率在世界范围内随来自北美洲、南美洲、欧洲、非洲和亚洲的报道而变化。来自全球监控数据库的数据示出了:esbl产生的速率在拉丁美洲中收集的克雷伯氏肺炎杆菌分离菌当中最高,紧接着是亚太沿岸、欧洲和北美洲(分别为44.0%、22.4%、13.3%和7.5%)(reinert,p.1018-1029,2007)。如来自美国的最新研究中所报道的那样,esbl感染按每10000次放电的发生率针对保健关联感染和社区获取感染两者均升高,前者为每年1.9次(95%ci1-2.8),后者为每年0.85次(95%ci0.3-1.4)(kassakian,p.9,2014)。铜绿假单胞菌是在保健关联感染中、特别是在危重症或免疫受损患者中频繁牵涉的重要病原体(hirsch,p.441-451,2010)。分离菌中的广谱抗菌素耐药性显著地限制了有效疗法选项(oliver,p.41-59,2015)。对若干抗生素制剂(尤其是第3代头孢菌素)耐药的产生esbl的沙门氏分离菌被越来越多地报道(uma,p.201-204,2010)。近年来,研究已经建议,国际旅行和/或旅行期间的肠胃炎是关于产生多重耐药esbl的肠杆菌科的感染的风险因素(ostholm-balkhed,p.2144-53,2013)。
尿路感染(uti)仍然是在门诊患者中以及在住院患者中诊断的最常见感染。研究已经揭示了与患者中的尿样本隔离的肠杆菌科中的抗菌素耐药性和esbl产生的全球高频率(cohen-nahump.41-6,2010)。与新活性药物的不充分发展并行的抗菌素耐药菌的快速演进和蔓延严重影响了由于最常见疾病中的革兰氏阴性杆菌所致的细菌性感染、感染性肠胃炎和尿路感染的未来抗感染疗法。该领域中的专家估计:到下一个十年,世界将已经见证无法医治的感染在医院内和在医院外均有的广泛传播(laxminarayanr,p.1057-98,2013)。上呼吸道感染是抗生素处方的主要原因,即使这些感染中的许多感染是由于病毒所致,其中抗生素既不有效也不必要。
为了减少抗生素消耗所作的努力可能对控制新兴多重耐药微生物的全球性问题有影响(nielsen,p.28-42,2015)。因此,控制该问题的有效途径是定向的抗生素疗[gaieskidf,p.1045,2010],其要求开发用于在发起疗法之前诊断感染并识别微生物的方法。被采用以识别病原微生物外加它们对具体抗菌剂的易感性的实验室培养方法和高科技的基于pcr的化验是极其有价值的[kerremansjj,p.428,2008]。但是,为了充分确定针对抗生素疗法的需要,将病原体的无害移植与活性感染进行区分是关键的。此处布设了需要阐明的某个水平的复杂度,这是因为宿主环境容纳了被称为生物膜的可一起共生地产生协同生存机制的不同系列的病原微生物[steartps,p.135,2001]。在多种微生物的环境中,慢生长的细菌构成由于其生长率使培养中的真实结果模糊的快生长微生物而难以检测的感染。使用甚至最近的pcr方法,多重结果使执业医生混淆[wolcottr,p107,2013;melendezjh,p.1762,2010]。因此,用于评定组织对腐蚀性病原体的存在的炎症反应和响应的工具是急切需要的。诸如排泄物白细胞的粪便之类的体液的直接检查已经在数十年来被用作肠炎的指示符[harrisjc,1972]。该方法足够简单以使得具有显微术技艺和非常基础的实验室的某人可以可靠地执行测试。每hpf大于10个白细胞的研究结果被视为对于感染而言是阳性的。
具有短半衰期的标记物提供了包括恢复的器官状态的最近图片。急性期反应物、c-反应蛋白和降钙素原已经被广泛研究,且被内科医生确认为用于指示和监视急性伤害的工具,该急性伤害包括由感染维持的那些伤害[pepysmb,p.1805,2003;xiaoz,p.1093,2015;lamsw,2015]。然而,这些标记物被系统地分析,且不能定位感染的病灶,尤其是在危险亚急性和隐性感染期间。
细胞外基质(ecm)由提供对周围细胞的结构和生物化学支持的器官组织中的细胞所产生的分子组成[theocharisad,2015]。通过研究健康的人中的ecm的生理方面,在其对应物和产物中发现的变更可能反映疾病。硫酸乙酰肝素蛋白多糖(hspg)是除了其他以外在细胞活素的活化和消除中涉及的ecm的重要组分以及由各种细胞在伤害期间产生的生长因子[nadanakas,p.7,2008]。一个这样的很好地研究的生长因子是肝细胞生长因子(hgf),其被称为对受伤上皮细胞来说内分泌递送的(系统的)以及旁泌性递送的(局部的)多功能再生因子[molnarfin,p.293,2015;nakamurat,p.188,2011]。生物活性hgf的产生在急性细菌性感染期间增加了[nayerif,p.13,2005;nayerif,p.2092,2000]。体液中的hspg的结合分布图可以反映受伤器官的病理生理状态,识别由于微生物入侵所致的急性炎症,并将急性炎症与慢性炎症区别开来[lönnj,p.33,2013]。
可以基于蛋白质与对应抗体的具体相互作用来检测蛋白质。然而,该测量系统依赖于专用资源,从而限制了其在未配备的中心中或作为自测试的有用性。异染性是由某些苯胺染料在结合到向色物质时展现的特性颜色改变[bergeronja,1958]。该现象已经被广泛地用在组织学中。亚甲蓝(邻甲苯胺)是在结合到高分子量多糖(诸如,硫酸聚糖)时从蓝色改变到粉色的极好异染性染料[phamna,2007]。粉色染料然后将在添加具有对硫酸聚糖的高亲和力的成比例的量的蛋白质之后快速地变回到蓝色(反向异染性)。
我们先前已经在若干研究中示出,肝细胞生长因子(hgf)的量和生物活性可以用于诊断体液中的急性炎症。然而,仍然存在进一步开发现今可用的细菌性感染的诊断方法且使该诊断方法敏感的需要。还存在针对用于监视细菌性感染的疗法(诸如,抗生素疗法)的更快速更可靠措施的需要。
技术实现要素:
上面的问题和缺陷现在已经被本文提供的设备和体外方法克服或至少减轻。因此在本文中,我们提出了一种测试(或一种套件),其包括根据本公开的用于通过确定个体中的急性期蛋白诊断细菌性感染(例如,使得可以监视在小于36个小时中施用的进行中抗生素疗法)的设备。该测试可以是经由以每测试小于5分钟且小于0.4gbp成本在没有任何准备的情况下对包括体液的生物样本的分析来执行的。
使用所述设备的测试可能由遍及全世界的患者、亲属或保健工作者执行,并且结果可以以98%的阴性预测值排除细菌性感染或疗法失效的可能性。该测试被设计成在环境方面无害、低重量、对温度或机械应变来说稳定且具有超过2年保质期。阳性结果(天蓝色)与阴性结果(地平线红色)之间的范围可由裸眼(正常视野)在日光中检测,且具有使用分光光度法或rgb读取器(红绿蓝读取器)给出定量值的能力。使用测试可能导致社会和个体成本中的巨大降低以及客观的抗生素治疗策略。日常监视可以在几天内检测由于抗生素耐药性所致的疗法失效,并且因此,可以在几个但合理的情况中使用用于识别抗生素耐药基因的高科技资源。
相应地,本文提供了一种用于定量地确定一种或多种急性期蛋白在来自个体的生物样本中的存在或不存在的设备,所述一种或多种急性期蛋白诸如是肝细胞生长因子(hgf),其中一种或多种急性期蛋白在所述生物样本中的存在指示所述个体中的急性细菌性感染,所述设备包括:
a)至少一个表面,在其上已经使包括蛋白氨基聚糖和甲苯胺蓝的成分固定不变,
b)可选地,固体支撑物,所述至少一个表面附着到其上,
其中所述至少一个表面包括适于使包括蛋白氨基聚糖和甲苯胺蓝的所述成分固定不变的材料。
更特别地,蛋白氨基聚糖可以是硫酸葡聚糖。
所述成分中蛋白氨基聚糖的量与甲苯胺蓝的量之比足以检测一种或多种急性期蛋白在所述生物样本中的存在或不存在。其示例在本文中由表面上蛋白氨基聚糖(诸如,硫酸葡萄糖)与甲苯胺蓝的具体预定比率提出,作为足以检测一种或多种急性期蛋白在生物样本中的存在的参数的示例。
本文提出的表面的不同组合对于由于各种生物流体中存在的急性期蛋白的成分而检测不同生物流体中的急性期蛋白而言特别有用。这可以由于相应生物流体中的急性期蛋白的不同消除模式所致。因此,本文提出了表面的不同组合。
根据本公开的设备的表面还可以被描述为“相互作用”表面,这是由于其能够与包括甲苯胺蓝和蛋白氨基聚糖的成分相互作用且结合该成分。
通过在生物样本已经被添加到设备的该至少一个表面之后研究设备的该至少一个表面的颜色,定量确定是可能的。蓝颜色越强,则越多急性期蛋白存在于生物样本中。如果所有表面的颜色仍然为红色或红紫色(地平线红色),则这意味着在样本中不存在急性期蛋白。
当然,再一次,急性期蛋白在生物样本中的“不存在”不应当被理解为急性期蛋白在所述样本中的绝对不存在,而是应当被理解为处于这样的低水平以使得在所述样本或所述个体中基本上不存在急性期蛋白或严重细菌性感染。
本文还提供了一种部件套件,所述部件套件包括如本文所公开的设备,所述套件进一步包括用于定量地确定由所述设备检测的(一种或多种)急性期蛋白的颜色检测装置以及可选地包括用于使用的指令。所述部件套件可以包括条上存在的一个、两个或三个(相互作用)表面,或者所述表面可以是组织或合适材料。
此外,本公开提供了一种用于定量地确定一种或多种急性期蛋白在来自个体的生物样本中的存在或不存在的体外方法,一种或多种急性期蛋白的所述存在指示所述个体中的急性细菌性感染,所述方法包括下述步骤:
a)将所述生物样本添加到如本文所提供的设备,
b)在步骤a)中的所述设备的表面上孵化所述生物样本,以及此后
c)将表面的颜色与利用急性期蛋白的已知量获得的参考进行比较,以确定一种或多种急性期蛋白在所述生物样本中的存在或不存在。
该方法是定量且快速的,且可以立即检测个体中的细菌性感染中的增加或减少,这使得可以连续地监视进行中的疗法,诸如抗生素疗法。
附加地,本文提供了一种用于确定如针对本文的设备而限定的表面的合适材料的方法,所述方法包括下述步骤:
a)在液体溶液中浸泡包括下述成分的材料,所述成分包括以如本文所限定的比率中的任一个存在的蛋白氨基聚糖和甲苯胺蓝,所述蛋白氨基聚糖诸如是硫酸葡聚糖,
b)在步骤a)的溶液中浸泡之后确定材料的颜色,
其中如果材料在浸泡之后呈现甲苯胺蓝的颜色,则所述材料适于如本文所限定的表面。
这引入了简单的方法,以便选择哪种材料最适当以用于使由适合量的蛋白氨基聚糖(例如,硫酸葡聚糖)和甲苯胺蓝(相互作用表面)组成的溶液固定不变,以便选择最负担得起的一种;以及选择哪种材料最适合以用作(相互作用)表面的支撑材料,以便选择最稳定的测试配置。
本发明的各种其他目的和优势将从本发明的附图和以下描述中变得明显。
附图说明
将考虑到附图更充分地理解以下详细描述,在附图中:
图1描述了以下述形式存在的根据本公开的设备的示例:具有一个表面的条(1a)、具有两个表面的条(1b)、具有三个表面的条(1c)、包括表面的组织(1d)、具有包括表面的组织的棒(1e)、1d中的设备的蛋白结合表面(1f)、包括表面的牙周设备(1g)和1g中的设备的蛋白结合表面(1h)。
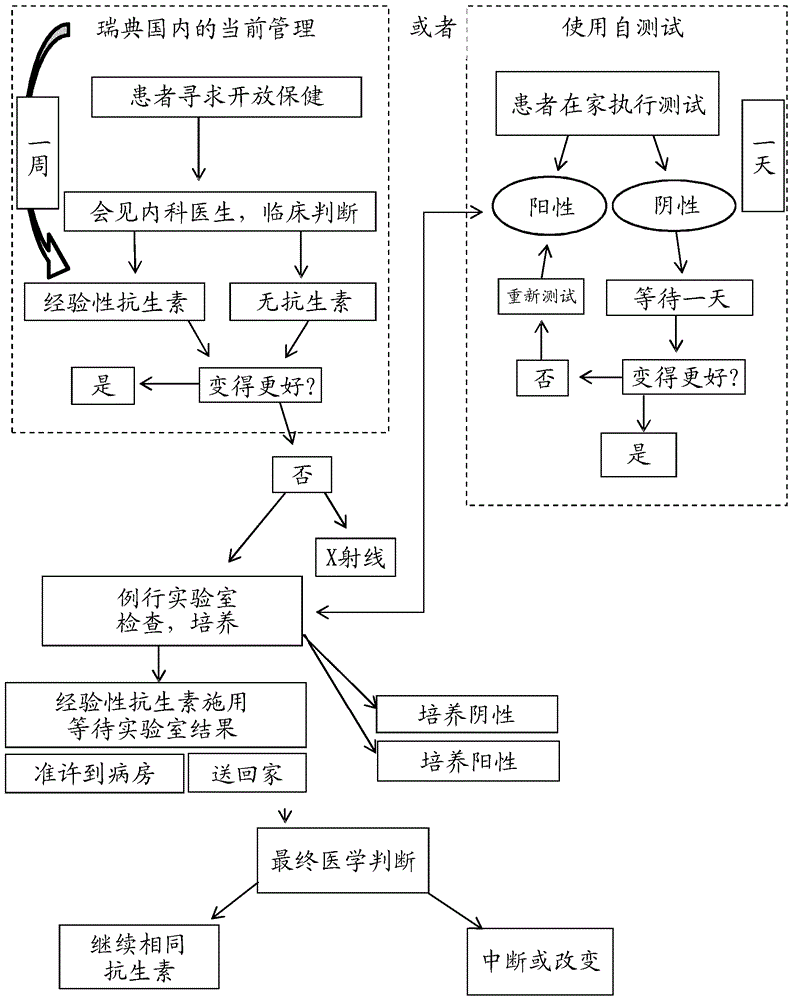
图2描述了在有自测试的情况下和在没有自测试的情况下急性呼吸道感染的病例管理。该流程图示出了在有指标测试(根据本公开的设备)的情况下和在没有指标测试的情况下瑞典国内的呼吸感染的患者管理。其图示了与现今使用的测试相比利用根据本公开的设备和方法提供的改进。
具体实施方式
认识到临床重要性以及所推荐的疗法之间的差异,那么身体中的炎症紊乱之间的鉴别诊断已经成为若干调查研究的主体。一个主要临床问题是确定感染或其他炎症紊乱是否导致疾病。存在典型地被内科医生用于建立正确诊断的若干标记物,该正确诊断诸如是体液的微观分析和培养、白血球计数、c-反应蛋白、血浆降钙素原和乳酸盐。然而,仍然不存在要使用的黄金标准。建立正确诊断时的问题在除了其他以外治疗肠中的炎症紊乱、溃疡、关节疾病、cns紊乱、腹膜、胸腔和心包积液时每天发生。例行标记物(诸如,crp和wbc)的量可能在若干紊乱中是高的,并且培养不始终是阳性的而不管感染如何。
也被称为非特异性免疫系统的先天免疫系统是包括防御宿主免于感染的细胞和机制的总体免疫系统的重要子系统。嗜中性白血球是对细菌性感染作出响应的主要白血球,因此,嗜中性白血球增多的最常见原因是细菌性感染,尤其是化脓性感染。另一方面,急性病毒性感染导致淋巴细胞增多。局部急性期蛋白和再生因子是由嗜中性白血球产生的,而不是由淋巴细胞产生的。因此,体液中急性期蛋白的检测指示细菌性感染。在细菌性感染期间产生的最重要蛋白质示出了对细胞外基质中的硫酸乙酰肝素蛋白聚糖(hspg)以及诸如硫酸葡聚糖之类的硫酸聚糖的高亲和力。
我们已经使用该知识以产生包括本文描述的设备的测试,该设备类似于对由嗜中性白血球在细菌性感染期间产生的急性期蛋白的细胞外基质的亲和力。因此,本公开涉及一种用于对该现象进行可视化的快速方法和设备。我们已经建立了并在本文中描述了基于反向异染性的方法。将蛋白氨基聚糖(例如,硫酸葡聚糖)添加到甲苯胺蓝导致蓝颜色到红色的改变。添加具有对蛋白氨基聚糖、硫酸葡聚糖的高亲和力(与最小量的快速结合)的蛋白质使红颜色改变回到与下述各项成比例的蓝色:
a-蛋白质浓度;
b-对硫酸葡聚糖的结合亲和力。
因此,测试结果与在由光显微术检测到的细菌性感染期间嗜中性白血球在体液中的存在高度相关,且自数十年以来被广泛使用以在世界范围内检测感染。测试意在评定由嗜中性白血球产生的急性期蛋白例如在感染期间在体液中的存在。
之前(wo2010151222)已经提出使用异染性以检测体液中的蛋白质的体液中的急性期蛋白的检测的诊断值。然而,这些研究结果现在已经被进一步开发。相应地,本文提出了:
1-在急性期蛋白对蛋白氨基聚糖(例如,硫酸葡聚糖)的结合亲和力与在感染期间在体液中检测到的嗜中性白血球的数目之间发现的高相关性。
2-异染性中的重要时刻的描述;蛋白氨基聚糖(例如,硫酸葡聚糖)的量与甲苯胺蓝之间的比例,以便使用反向异染性来检测急性期蛋白的增加的量。
3-以大于95%的高阴性预测值检测细菌性感染和监视抗生素疗法的可能性。
4-使用该知识以排除其中抗生素疗法没有价值的情况的可能性。
本文提出了蛋白氨基聚糖(例如,硫酸葡聚糖)和甲苯胺蓝在可检测不同量的急性期蛋白(诸如hgf)的溶液中的合适比例。其示例在下文中(表1)进一步示出。特别是在这点上,还可以在本文的设备或方法中使用亚甲蓝作为针对甲苯胺蓝的代替物,尽管优选地在本公开的上下文中使用甲苯胺蓝。还可想到,可以在本上下文中使用针对甲苯胺蓝的其他代替物,如果这种代替物对本领域技术人员来说明显的话。
相应地,在本文中示为特别有用的是,将反向异染性的途经用于检测急性期蛋白在个体的生物样本中的存在。通过将包括一种包括蛋白氨基聚糖(诸如,硫酸葡聚糖)和甲苯胺蓝的成分的液体溶液添加到设备的表面,在生物样本被添加到该表面之前在该表面上使与甲苯胺蓝结合的蛋白氨基聚糖固定不变。通过在将甲苯胺蓝添加到蛋白氨基聚糖之后添加生物样本,急性期蛋白的检测被示为以比先前更快速且高效的方式而可能。现在,在生物样本已经被添加到包括蛋白氨基聚糖和甲苯胺蓝的表面之后约1分钟已经可以执行急性期蛋白的检测。还被示为特别高效的是,在生物样本被添加到表面之前在该表面上使蛋白氨基聚糖和甲苯胺蓝(初始存在于被添加到所述表面的水溶液中)固定不变。
在表1中描述了包括下述成分的液体溶液的示例,该成分包括蛋白氨基聚糖和甲苯胺蓝。在表2中示出了在不同体液中的感染的诊断中使用的不同溶液。在实验中提供的蛋白氨基聚糖是硫酸葡聚糖。因此,大约下面的量中的比率在本文的方法或设备中非常有用,如下文中进一步解释。
表1:检测不同量的急性期蛋白的比例
表2:在针对不同体液或样本作出不同测试条时所推荐的组合
基于hgf是在细菌性感染的急性期处产生且由硫酸葡聚糖捕获的蛋白质之一这一知识,我们已经示出:来自(指标)条测试的结果与来自针对hgf的基于抗体的试剂盒(elisa)测试的结果显著相关(n=47;皮尔逊相关,r=0.71;p<0.0001)(表3)。
表3:由条上的以不同浓度固定不变的硫酸葡聚糖捕获的hgf浓度。试剂盒套件具有了0.04ng/ml-8.0ng/ml的检测率
在检测/相互作用表面和支撑材料(固体支撑物)的准备中使用的材料。
为了使包含硫酸葡聚糖和甲苯胺蓝的溶液固定不变,可以使用不同材料。作为建议,reliaflow800ahlström是不对低或高ph或者高量的血红蛋白作出反应的良好材料。然而,为了降低成本并且在流行病期间,可以测试材料并以仍经历适当特性的最低价格选择材料。
在浸泡在溶液中后在变干时保持溶液的紫红颜色的任何材料可能用于检测表面。作为示例,土工织物是便宜且适当的材料。
为了支持条测试,我们使用不与硫酸葡聚糖结合的材料,以便提高测试的稳定性。我们可以通过浸泡在包含蛋白氨基聚糖、硫酸葡聚糖和甲苯胺蓝的溶液中来测试材料。如果材料带蓝颜色,则该材料被标识为对于测试而言适当。诸如木材、纸、羊毛、棉或丝之类的天然产物不与硫酸葡聚糖结合,且可以被用作本文的设备(条测试)中的支撑(即,作为固体支撑物)。
反向异染性:
亚甲蓝(邻甲苯胺)是在结合到高分子量多糖(诸如,硫酸聚糖)时从蓝色改变到粉色的极好异染性染料[phamna,2007]。粉色染料然后将在添加具有对硫酸聚糖的高亲和力的成比例的量的蛋白质之后快速地变回到蓝色(反向异染性)。
该途径现在已经用于开发新的条测试(设备),以评定蛋白氨基聚糖(硫酸葡聚糖)结合蛋白在痰中的存在。还可以在本公开的上下文中使用其他生物样本。
在不希望受理论束缚的情况下,将针对用于检测在感染期间急性期蛋白在体液中的存在的目前研究的途径的理论支持建议如下。(1)具有负电荷的葡萄胺聚糖(gag)聚合物链附着到葡萄胺聚糖结合材料。(2)正甲苯胺蓝(tbo)分子附着到gag的聚合物链,浓缩,并形成堆叠,并且颜色从蓝色改变到红色。(3)添加包含急性期蛋白的样本,并且蛋白质结合到gag。(4)破坏tbo分子堆叠,从而变成自由的经溶解的tbo分子,并且颜色从红色改变到蓝色。因此,当检测到蓝颜色时,这意味着在被测试的所述生物样本中存在急性期蛋白。
相应地,本文提供了一种用于定量地确定一种或多种急性期蛋白在来自个体的生物样本中的存在或不存在的设备,所述一种或多种急性期蛋白诸如是肝细胞生长因子(hgf),一种或多种急性期蛋白在所述生物样本中的存在指示所述个体中的急性细菌性感染,所述设备包括:
a)至少一个表面,在其上已经使包括蛋白氨基聚糖和甲苯胺蓝的成分固定不变,
b)可选地,固体支撑物,所述至少一个表面附着到其上,
其中所述至少一个表面包括适于使包括蛋白氨基聚糖和甲苯胺蓝的所述成分固定不变的材料。
所述成分中蛋白氨基聚糖的量与甲苯胺蓝的量之比足以检测一种或多种急性期蛋白在所述生物样本中的存在或不存在。本文提出了其示例。
所述生物样本通常包括生物流体,诸如例如痰、尿等等或者如本文进一步描述的那样。
所述设备可以包括至少两个表面(诸如三个表面),在其上已经使包括蛋白氨基聚糖和甲苯胺蓝的成分固定不变,其中所述第一表面上的成分中蛋白氨基聚糖的量与甲苯胺蓝的量之比不同于所述第二表面上的成分中蛋白氨基聚糖的量与甲苯胺蓝的量之比,和/或可选地进一步不同于所述第三表面。
本文进一步提供了一种包括至少一个表面的设备,其中所述至少一个表面上存在的所述成分中蛋白氨基聚糖的量与甲苯胺蓝的量之比是:
·约100:1,诸如约90:1至约110:1(表面1);
·约140:1,诸如约135:1至约145:1(表面2);
·约165:1,诸如约160:1至约170:1(表面3);
·约180:1,诸如约175:1至约185:1(表面4);
·约200:1,诸如约190:1至约210:1(表面5);或者
·约225:1,诸如约220:1至约230:1(表面6)。
更特别地,表面1的所述比率可以是约100:1,表面2的所述比率可以是约138:1,表面3的所述比率可以是约165:1,表面4的所述比率可以是约180:1,表面5的所述比率可以是约200:1,和/或表面6的所述比率可以是约226:1。
提供了包括一个或多个这些表面的任何组合的本文的设备。
本文提供的设备可以包括上面提及的表面(图1a-1h中的附图标记2)中的一个或多个,其中表面附着到用于确定一种或多种急性期蛋白的存在的设备或者是该设备的一部分。如果多于一个的话,表面可以被分隔开地呈现在设备上,以便允许不同表面使用蛋白氨基聚糖和甲苯胺蓝的量的不同比率。这例如在图1b和1c中例证。根据本公开的设备的示例在图1a-1h中示出。因此,设备可以以条(1a-1c)、组织(1d、1f)、包括表面的棒(1e)、具有刷子状表面的针对牙科应用而适配的棒(1g、1h)等等的形式存在。用于表面的材料是允许在所述表面上使蛋白氨基聚糖和甲苯胺蓝固定不变的材料。如果所述表面被放置或附着到固体支撑物(图1中的附图标记3)上,则该固体支撑物通常是以不会结合蛋白氨基聚糖和甲苯胺蓝的材料制造的,如本文进一步描述的那样。根据本公开的设备还可以是作为针对婴儿或针对成人而适配的尿布的部分而引入的。该设备可以以优选地处于尿布的胯部中的条的形式布置在尿布中,所述条包括如本文所公开的一个或多个表面,使得可以连续地监视尿或其他体液中的任何细菌含量。这可以便于尿道或生殖道中的细菌性感染(诸如,泌尿感染)的早期检测。可以在穿戴尿布时对如本文先前解释的指示细菌性感染的存在的颜色改变进行可视化。相应地,本文还提供了一种设备,其中所述设备存在于尿布中以用于检测急性细菌性感染。
应当注意,上面提及的比率还可以稍微变化。本文示出了蛋白氨基聚糖(诸如,硫酸葡聚糖)和甲苯胺蓝的量之间的比率,以呈现对于检测急性期蛋白在生物样本中的存在而言特别有用的成分。
蛋白氨基聚糖和甲苯胺蓝的量是已被添加到水成液的干材料的蛋白氨基聚糖和甲苯胺蓝的重量中的量。如本文先前提及的那样,首先,可以将甲苯胺蓝添加到mq水,并且其次,可以将蛋白氨基聚糖(诸如,硫酸葡聚糖)添加到mq,并且此后,混合这两个水溶液。
此外,本文提供了一种设备,其中所述设备包括下述表面中的两个或更多个,诸如两个、三个或四个:表面1、表面2、表面3、表面4、表面5和表面6。这种多于一个表面通常被呈现在测试条上。
附加地,还提供了包括表面1和表面2的设备。包括表面1和表面2中的一个或多个的设备可以用于检测重组hgf。附加地,还提供了包括下述各项中的至少一个(诸如,两个或三个)的设备:表面3、表面4和/或表面5。包括表面3、表面4和/或表面5的设备对于确定急性期蛋白在包括痰、支气管肺泡灌洗、鼻分泌物、脑脊液、尿或肾分泌物的生物样本中的存在而言特别有用。包括表面3和/或表面4的设备对于确定急性期蛋白在包括关节液的生物样本中的存在而言有用。这可以在确定细菌性骨关节炎的存在时使用。包括表面3的设备对于确定急性期蛋白在唾液和/或牙周分泌物中的存在而言特别有用。这也在表2中说明。
此外,还提供了包括表面5和表面6的设备。包括表面5和/或表面6的设备对于确定急性期蛋白在包括溃疡分泌物的生物样本中的存在而言特别有用。
在根据本公开的设备中,所述蛋白氨基聚糖可以选自由hspg(硫酸乙酰肝素蛋白多糖)、硫酸葡聚糖和硫酸肝素构成的组。更特别地,所述蛋白氨基聚糖可以是硫酸葡聚糖。
本文还提供了一种部件套件,所述部件套件包括如本文所公开的设备,所述套件进一步包括用于定量地确定由所述设备检测的(一种或多种)急性期蛋白的颜色检测装置以及可选地包括用于使用的指令。所述颜色检测装置可以使用分光光度法。附加地,所述颜色检测装置可以是适于确定在根据本公开的设备中使用的该至少一个表面的颜色的任何装置、设备等等。其可以是能够自动确定颜色的设备,或者其可以是使用仅一只眼以及具有指示样本中存在的急性期蛋白的量的不同颜色的参考图表(即,颜色图表)来执行的,以用于在与测试的结果进行比较时使用。
根据本公开的设备还可以被呈现在用于解释如本文所提出的方法的结果的选择的检测器中。例如,本文可想到用于方便使用(诸如,以笔的形式存在(笔形检测器)以用于快速指示样本中的细菌性感染)的手持检测器,所述检测器提供了设备在检测器内的定位。检测器可以具有包含检测试剂的透明版本的可更换单次使用尖端。将样本引入到尖端中可以例如是被动的(样本在与样本溶液接触时进入尖端中的反应区域)或主动的(检测器包括用于主动地将样本溶液汲取到尖端中的设备)。检测器可以具有实现尖端的反应区域中的颜色改变的敏感检测的集成光学器件和电子器件。检测器还可以包括指示结果的显示器,且可选地包括开/关按钮。光导和光检测器的设计/几何位置将最可能取决于尖端的所选设计。相应地,本文还提供了一种设备,其中所述设备存在于手持设备中以用于检测急性细菌性感染。
此外,本公开提供了一种用于定量地确定一种或多种急性期蛋白在来自个体的生物样本中的存在或不存在的体外方法,一种或多种急性期蛋白的所述存在指示所述个体中的急性细菌性感染,所述方法包括下述步骤:
a)将所述生物样本添加到如本文所提供的设备,
b)在步骤a)中的所述设备的表面上孵化所述生物样本,以及此后
c)将表面的颜色与利用急性期蛋白的已知量获得的参考进行比较,以确定一种或多种急性期蛋白在所述生物样本中的存在或不存在。
该体外方法可以以下述方式执行:其中直接在步骤b)之后或者至少在约2分钟、诸如约1分钟内执行步骤c)。该时间框架说明了本文提出的方法和设备的功效和快速性质。
因此,所述方法允许诊断个体中的细菌性感染,并包括:将来自个体的体液样本与用于通过由受影响的器官中的细菌性感染刺激的嗜中性白血球的产生确定急性期蛋白的相对水平的装置(例如,比色设备)相接触;以及将所确定的水平与急性感染进行相关。这提供了用于快速确定体液(生物样本)中的急性期蛋白的量的方法,该体液诸如例如是尿、脑脊液、呼出气浓缩物、支气管肺泡灌洗、鼻分泌物、肾分泌物、牙周分泌物、痰、精液、唾液、关节液和溃疡分泌物。如本文所提及,急性期蛋白的浓度的知识便于诊断和监视疾病。
在所述体外方法中确定的急性期蛋白可以是肝细胞生长因子(hgf)、其衍生物或与其相关的蛋白质。所述急性期蛋白还可以是钙卫蛋白。
所述方法采用用于对甲苯胺蓝与蛋白氨基聚糖之间的结合进行可视化的反向异染性方法。阳性免疫反应指示急性期蛋白(例如,hgf(活性形式和非活性形式两者))在样本中的存在。阳性免疫反应提供蓝色表面(已经从蛋白氨基聚糖释放甲苯胺蓝)。
本文提供了蛋白氨基聚糖(硫酸葡聚糖)与甲苯胺蓝之间的可检测急性期蛋白(诸如,hgf或钙卫蛋白)的不同量的高效比例(比率)。这由本文提出的相应表面说明。因此,本文示出了:蛋白氨基聚糖和甲苯胺蓝的高效比例导致通过在适合的过滤器上固定不变而可诊断细菌性感染的等级的溶液。
还提供了一种体外方法,其中所述设备包括如本文所限定的表面1和表面2。在所述体外方法中使用的所述设备还可以包括下述各项中的至少一个(诸如,一个、两个或三个):如本文所限定的表面3、表面4和表面5。当在所述设备中使用所述表面时,被添加到所述设备的所述生物样本特别地包括痰、支气管肺泡灌洗、鼻分泌物、脑脊液、尿或肾分泌物。还提供了一种体外方法,其中所述设备包括如本文所限定的表面5和表面6,并且其中所述生物样本特别地包括溃疡分泌物。
因此,本文示出了:蛋白氨基聚糖相对于甲苯胺蓝的量的某些比例(比率)对于确定急性期蛋白在生物样本中的存在或不存在而言特别有用,并且甚至更多,某些比率特别适于特定类型的生物样本(例如,痰或尿样本)。这在表2中说明。例如,对于痰以及对于家里的自测试,其对包括表面4的设备有用。对于专业使用,所述设备仍包括表面4,但对于甚至更敏感的结果,其还包括表面3和表面5。这些特性的优化呈现了确定生物样本中的急性期蛋白的量且从而遵循感染进展和/或(抗生素)疗法的甚至更高效的方式。
相应地,本公开更宽泛而言涉及:细菌性呼吸感染的诊断;社区获取的或源于医院的,来自病毒性或慢性呼吸紊乱,通过如本文进一步限定的对痰、支气管肺泡灌洗或鼻分泌物的分析。本文提出了针对这些特定生物样本的适当(相互作用)表面(表面3、表面4和/或表面5)。
还提供了本文提出的设备和方法在需要来自远端尿路感染或无感染的大范围且长期抗生素疗法时通过如本文进一步限定的对尿或肾分泌物的分析而在近端尿路感染的诊断中的使用。本文提出了针对这些特定生物样本的适当(相互作用)表面(表面3、表面4和/或表面5)。
还提供了设备和方法在细菌性脑膜炎的诊断中的使用;社区获取的或源于医院的,来自脑脊液细胞增多的其他原因,通过如本文进一步限定的对脑脊液的分析。本文提出了针对这些特定生物样本的适当(相互作用)表面(表面3和/或表面4)。
还提供了设备和方法通过如本文进一步限定的对溃疡分泌物的分析而在急性细菌性溃疡感染的诊断中的使用。本文提出了针对该特定生物样本的适当(相互作用)表面(表面5和/或表面6)。
附加地,还提供了设备和方法通过对关节液的分析而在细菌性骨关节炎的诊断中的使用。本文提出了针对该特定生物样本的适当(相互作用)表面(表面3和/或表面4)。
还提供了设备和方法用于通过对唾液或牙周分泌物的分析确定牙周状态的使用。本文提出了针对该特定生物样本的适当(相互作用)表面(表面3或表面4)。
还提供了如本文所限定的体外方法,其中确定如本文所解释的一种或多种急性期蛋白的存在或不存在用于监视疗法,诸如个体中的抗生素疗法。在这种方法中,急性期蛋白的浓度可以被监视,且被定量地快速确定,且具有规则间隔,并且,可以高效地确定例如是否错误的疗法正在用于某个个体或者疗法有多高效。这例如避免了当所使用的抗生素可能对于个体/特定感染而言不适当时抗生素的不必要使用。
本文还示出了:蛋白氨基聚糖和甲苯胺蓝的高效比例呈现了通过在适合的过滤器上固定不变而可诊断细菌性感染的等级和/或监视抗生素疗法的溶液。本文示出了基于所描述的方法的测试的值,以排除非细菌性感染的情况的可能性且从而降低抗生素消耗。
在根据本公开的设备中,用于检测急性期蛋白的至少一个表面的材料需要基于其将适于该目的的性质而选择。这在本文中进一步描述。
相应地,附加地,本文提供了一种用于确定如针对本文的设备而限定的表面的合适材料的方法,所述方法包括下述步骤:
a)在液体溶液中浸泡包括下述成分的材料,所述成分包括以如本文所限定的比率中的任一个存在的蛋白氨基聚糖和甲苯胺蓝,所述蛋白氨基聚糖诸如是硫酸葡聚糖,
b)在步骤a)的溶液中浸泡之后确定材料的颜色,
其中如果材料在浸泡之后基本上呈现与蛋白氨基聚糖结合的甲苯胺蓝的颜色,则所述材料适于如本文所限定的表面。
此外,表面的合适材料的示例是:例如,包括聚酯纤维的土工织物或过滤器。
本发明现在由以下示例进一步描述。示例是说明性的,而不应当被理解为限制本发明的范围。
实验部分
示例1:
细菌性肺炎的诊断中的剩余痰上的dexact-resp(本公开的设备)的临床性能研究
背景:在患有呼吸感染的临床症状的患者中,要求抗生素疗法的情况的快速识别对避免多重耐药细菌的发展来说是关键的。局部急性期反应物的识别可以有助于评定宿主对伤害部位处的细菌性感染的响应。这里,我们基于具有对多糖的特异性结合亲和力的局部产生的蛋白质开发了负担得起的、稳定的、可行的且准确的诊断工具。我们进一步评估了新测试条在肺炎的情况下检测细菌性感染的能力。
方法
基于反向异染性开发了条测试(所谓的指标测试)。使用指标测试对来自患有可疑肺炎的患者的剩余痰样本(n=467)进行了盲测试(表4)。将这些结果与基于由患者的内科医生执行的独立临床和实验室评定而确定的最终结果进行了比较。
结果
指标测试示出了用于检测宿主在2分钟内对高水平病原菌的反应的98.9%灵敏度和90.2%特异性(表5)。所使用的黄金标准是痰培养和pcr。然而,诸如痰培养、pcr、抗原检测和肺部x射线之类的标准测试对检测细菌性肺炎(由主管的内科医生判断和治疗)的灵敏度小于70%。
在图1中呈现了对于该测试而言有用的设备的示例。
结论
基于反向异染性的新筛选测试具有下述潜力:在肺炎的情况下降低死亡率和发病率,指导抗生素处方,以及节省资源,这在较差配备的中心和农村地区中尤其重要(图2)。
表4.研究材料和指标测试结果的摘要。n标示病例的数目,n标示患者的数目
表5:指标测试结果
表5:在组之间执行了测试评估:阳性控制:由链球菌肺炎、铜绿假单胞菌、流感嗜血杆菌、链球菌、支原体肺炎、金黄色葡萄球菌导致的侵入性细菌性感染;阴性控制:排除了感染的可能性。灵敏度是98.97,特异性是90.21,阳性预测值是83.48,并且阴性预测值是99.43。
表6:该表示出了来自由医院执行的标准测试的结果
在患者上执行了包括培养、pcr、抗原检测和x射线的标准诊断过程,其中收集了剩余痰(n467)并将其用于条测试的评估(表6)。最终诊断由主管的内科医生在医学评估之后在标准测试以及患者的临床征象和症状的基础上设置,而无需与来自条测试的结果有关的知识。标准诊断测试的测试性能是0.68灵敏度、0.85特异性、0.86阳性预测值和0.65阴性预测值。
示例2:
尿路感染的诊断中的剩余尿上的dexact-urine的临床性能研究
尿条测试可以将严重近端尿路感染的情况与无并发症的远端尿路感染和健康区别开来(表7)。
表7:dexact尿的临床性能研究
表7示出了肾itis测试的证实中包括的剩余样本,其基于由瑞典林雪平的地区医院处的不同科室处的医疗团队在2016年5月建立的临床诊断而划分成组。控制组是在2014-2016年登记的。mann-whitneyu-测试:肾itis阳性和阴性样本之间的试剂盒浓度中的显著差异p<0.001。
示例3:
神经外科的科室处包括的患有源于医院的细菌性脑膜炎的患者上的dexact-csf的临床性能研究
当前,细菌性脑膜炎的诊断仍然基于:直接显微术的标准方法;白血球、乳酸盐和蛋白质的差异分析;以及血液和csf的培养[batyv,2000]。然而,神经外科手术后的感染难以与神经手术过程的效果区分[batyv,2008;waltiln,2013]。例如,当患者在外科手术后数天内发展成发烧时,csf中的乳酸盐和细胞的确定不能提供可靠信息。此外,由于预防性治疗,培养在患者的大组中是阴性的,并且像凝固酶阴性葡萄球菌或痤疮丙酸杆菌之类的皮肤菌群的存在可以指示感染或污染。
来自被准许到瑞典林雪平大学的神经外科的科室的病例的关于脑脊液的研究已经示出100%灵敏度和针对条测试的阴性预测值(表8)。
表8.表示出了条测试的临床性能以区分脑脊液中的细菌性脑膜炎
参考文献
1-batyv,vieljf,schuhmacherh,jaegerf,cantonp,hoenb.prospectivevalidationofadiagnosismodelasanaidtotherapeuticdecision-makinginacutemeningitis.eurjclinmicrobiolinfectdis.2000;19(6):422-6
2-beannhandgriffinpm.foodbornediseaseoutbreaksintheunitedstates,1973-1987:pathogens,vehicles,andtrends.jfoodprot,1990;53:804-817.
3-bergeronja,singerm,metachromasy:anexperimentalandtheoreticalreevaluation.jbiophysbiochemcytol4(1958)433-457.
4-bonellirr;moreirabm,picãorc.antimicrobialresistanceamongenterobacteriaceaeinsouthamerica:history,currentdisseminationstatusandassociatedsocioeconomicfactors.drugresistanceupdates,2014;17:24-36
5-cohen-nahumk,saidel-odesl,riesenbergk,schlaefferf,borera.urinarytractinfectionscausedbymulti-drugresistantproteusmirabilis:riskfactorsandclinicaloutcomes.infection.2010feb;38(1):41-6.
6-falagasme,karageorgopoulosde.extended-spectrumβ-lactamase-producingorganisms.journalofhospitalinfection.2009;73(4):345–354.
7-gaieskidf,mikkelsenme,bandra,pinesjm,massoner,furiaff;shoferfs,goyalm.impactoftimetoantibioticsonsurvivalinpatientswithseveresepsisorsepticshockinwhomearlygoal-directedtherapywasinitiatedintheemergencydepartment.criticalcaremedicine,2010;48:1045-1053
8-gopalakrishnanr,sureshkumard.changingtrendsinantimicrobialsusceptibilityandhospitalacquiredinfectionsoveran8yearperiodinatertiarycarehospitalinrelationtointroductionofaninfectioncontrolprogramme.jassocphysiciansindia.2010;58:25-31
9-harrisjc,duponthl,rb.fecalleukocytesindiarrhealillness.anninternmed.1972may;76(5):697-703
10-hirsche,tamvh.impactofmultidrug-resistantpseudomonasaeruginosainfectiononpatientoutcomes.expertrevpharmacoeconoutcomesres.2010aug;10(4):441–451.
11-infectiousdiseasessocietyofamerica(idsa).combatingantimicrobialresistance:policyrecommendationstosavelives.clinicalinfectiousdiseases,2011;52(s5):s397–s428
12-kassakiansz;mermella,changingepidemiologyofinfectionsduetoextendedspectrumbeta-lactamaseproducingbacteria.antimicrobialresistanceandinfectioncontrol2014,3:9
13-kerremansjj,verboomp,stijnent,hakkaart-vanroijenl,goessensw,verbrughha,vosmc.rapididentificationandantimicrobialsusceptibilitytestingreduceantibioticuseandacceleratepathogen-directedantibioticuse.journalofantimicrobialchemotherapy,2008;61,428–435
14-lamsw,bauersr,duggala.procalcitonin-basedalgorithmstoinitiateorstopantibiotictherapyincriticallyillpatients:isittimetorethinkourstrategy
15-laxminarayanr,dusea,wattalc,zaidia,wertheimh,sumpraditn,vlieghee,haragl,gouldi,goossensh,grekoc,soad,bigdelim,tomsong,woodhousew,ombakae,peraltaaq,qamarf,mirf,kariukis,bhuttaz,coatesa,bergstromr,wrightgd,browne,carso,antibioticresistance—theneedforglobalsolutions.lancetinfectdis2013;13:1057–98.
16-lönnj,snakka,holssontbengtssonsalmerfnayeri.differencesinexpressionofhepatocytegrowthfactorinacuteandchronicbowelinflammation—implicationfordiagnosis
17-melendezjh,frankelym,anat;williamsl,pricelb,wangny,lazarusgs,zenilmanjm.real-timepcrassayscomparedtoculture-basedapproachesforidentificationofaerobicbacteriainchronicwounds.clinmicrobiolinfect,2010;16:1762–1769.
18-molnarfin,benkhoucham,funakoshih,nakamurat,laliveph.hepatocytegrowthfactor:aregulatorofinflammationandautoimmunity.autoimmunrev,2015;14(4):293-303.
19-nadanakas,kitagawah.heparansulphatebiosynthesisanddisease.jbiochem,2008jul;144(1):7-14.
20-nakamurat,sakaik,nakamurat,matsumotok.hepatocytegrowthfactortwentyyearson:muchmorethanagrowthfactor.jgastroenterolhepatol,2011;26:188-202.
21-nayerif,hagbergl,brudinl,robergm,söderströmc,forsbergp.ameasurementofhepatocytegrowthfactorvaluesincsf;acomparisonbetweensepticandnon-septicmeningitis.j.infect.dis,2000;181:2092-2094.
22-nielsen,l.,kjerulf,a.andarpi,m.(2015)increasingincidenceofextended-spectrumbeta-lactamase-producingenterobacteriaceae(esbl)andtherelationtoconsumptionofbroad-spectrumantimicrobialagents2003-2011inalargeareaofcopenhagen,denmark.openjournalofmedicalmicrobiology,5,28-42.
23-o’ryanm,luceroy,o’ryan-sorianoma,ashkenazis.anupdateonmanagementofsevereacuteinfectiousgastroenteritisinchildren.expertrevantiinfectther.2010;8(6):671-82.
24-olivera,muletx,lopez-causapec,juanc,theincreasingthreatofpseudomonasaeruginosahigh-riskclones.drugresistupdat.2015;21-22:41-59.
25-ostholm-balkheda,tärnbergm,nilssonm,nilssonlehanbergerh,hällgrena.travel-associatedfaecalcolonizationwithesbl-producingenterobacteriaceae:incidenceandriskfactors.jantimicrobchemother2013;68(9):2144-53.
26-pecherejc,hughesd,kardasp,cornagliag.non-compliancewithantibiotictherapyforacutecommunityinfections:aglobalsurvey.internationaljournalofantimicrobialagents,2007;29:245-253
27-pepysmb,hirschfieldgm.c-reactiveprotein:acriticalupdate.journalclinicalinvestigation,2003;111:1805–1812.
28-petersonjw.bacterialpathogenesis.in:medicalmicrobiology,4thedition,theuniversityoftexasmedicalbranchatgalveston:galveston,tx,1996.
29-phamna,morrisona,jschwockj,avielronens,iakovlevv,tsaom.s.,hoj.,hedleyd.w.,quantitativeimageanalysisofimmunohistochemicalstainsusingacmykcolormodel,diagnpatholpathol,2007;2:8
30-reinertrr,lowde,rossif,zhangx,wattalc,dowzickymj.antimicrobialsusceptibilityamongorganismsfromtheasia/pacificrim,europeandlatinandnorthamericacollectedaspartoftestandtheinvitroactivityoftigecycline.journalofantimicrobialchemotherapy.2007;60(5):1018–1029.
31-richih,dhillonp,clarkj.esbls:aclearandpresentdanger
32-steartps,costertonjw.antibioticresistanceofbacteriainbiofilms,thelancet,2001:358:135-138
33-theocharisad,skandalisss;gialelic,karamanosnk.extracellularmatrixstructureadvdrugdelivrev,2015[epubaheadofprint].
34-thornegm.diagnosisofinfectiousdiarrhealdiseases.infectdisnortham.1988;2(3):747-74
35-tunkelar,hartmanbj,kaplansl,kaufmanba,rooskl;scheldm,whiteleyrj.practiseguidelinesforthemanagementofbacterialmeningitis.clinicalinfectiousdiseases,2004;39:1267–1284
36-umab,prabhakark,rajendrans,lakshmisarayuy.prevalenceofextendedspectrumbetalactamasesinsalmonellaspeciesisolatedfrompatientswithacutegastroenteritis.indianjgastroenterol.2010.29:201-204
37-waltiln,conena,cowardj,jostgf,trampuza.characteristicsofinfectionsassociatedwithventriculardrainsofcerebrospinalfluid.jinfect2013;66(5):424-31.
38-wolcottr,costertonjw,raoultd,cutlersj.thepolymicrobialnatureofbiofilminfection.clinicalmicrobiologyandinfection,2013;19:107-112.
39-xiaoz,wilsonc,robertsonhl,robertsdj,ballcg,jennecn,kirkpatrickinflammatorymediatorsinintra-abdominalsepsisorinjury–ascopingreview.criticalcare,2015;19:1093-1094
- 还没有人留言评论。精彩留言会获得点赞!