用于通过场分辨振动光谱法测量样本的偏振响应上的改变的方法和装置与流程
本发明涉及一种测量样本对光场激励的偏振响应、特别是生物样本的分子的振动响应以及偏振响应的改变的方法。样本的偏振响应通过场分辨(field-resolved)光谱法经由在时域中直接对通过诱导的样本偏振而辐射的快速振荡电场进行采样被测量。此外,本发明涉及一种用于测量样本、特别是生物样本的偏振响应的光谱设备。本发明的应用包括检测样本的物理和化学特性/状态的改变、特别是生物样本的分子组成的改变。可能的生物样本包括来自人或动物有机体、特别是来自生物体的体液、组织和单独的细胞的气体、液体或固体样本。
背景技术:
分子是生物体的最小功能构建块。生命系统需要种类繁多的分子的存在。它们的充裕性允许在较窄的范围内变化的情况下生物体功能正常。作为显著示例,细胞或血液由成千上万的不同分子组成,分子的浓度基于身体的生理状态。血液的单独的分子组分的充裕度上的实质改变因而可用作异常生理的指示符。这样的改变被用作分子病理学的基础,用于对疾病的进程进行检测和后续监视并用于评估个体对特定病变的敏感度,其中,疾病响应并对抗治疗。此外,不同类型的细胞的分子组成上的不同可帮助识别细胞类型(例如,干细胞)并帮助分选来自同一组织的细胞。
在浓度上具有最大相对改变的分子(包括新出现的分子)适于将其本身作为疾病的标记或适于将不同类型的细胞进行相互区分。可通过基于抗体的实验单独识别分子中的微量分子。例如,用于同时感测大量分子的常规技术是rna测序和质谱分析法(检测单独的组分)和振动光谱法(从大量样品测量全局影响)。这些技术主要对高充裕度的组分敏感,高充裕度的组分控制这些技术观测的信号,这些技术对于大量的低充裕度的分子“失效”。然而,低充裕度的分子的浓度上的改变也是高度重要的,例如,突出的示例是细胞激素,已知即使细胞激素的微小的浓度改变也会导致广泛的生理效应。低充裕度的分子很可能包括具有由异常生理导致的相对大的浓度改变的可能的多种不同分子中的一些分子。因此,低充裕度的分子可能理想地适合于或特别与疾病标记或细胞标识/分选相关。对于迄今为止的分子病理学和细胞生物学,难以达成所有这些可能的分子标记。总之,迄今为止的分子病理学和细胞生物学的持续主要挑战是识别复合混合物中的高充裕度分子以及低充裕度分子的最小浓度改变。
振动光谱法需要关于由原子核围绕其平衡位置的周期性振荡诱导的分子样品的偏振响应的信息。数年来,红外光谱法和拉曼光谱法(以下描述)已经用于获取不断扩大的光谱范围的分子振动的幅度响应。相应的样品特征信息通常被称为振动分子指纹,简称:分子指纹。应注意,在文献中,此指定也已经被用在其他物理可观测量的上下文中,虽然通常是以将唯一的指纹(也称为:光谱偏振响应)与特定样本进行关联的目的。不管多个测量技术如何,常规指纹方法总共遭受以下困扰:中等的敏感度、阻止样本的分子组成上的较小改变的稳定检测和低充裕度的组分的稳定检测。
传统上,在频率域通过自相关(傅里叶变换光谱法,fts)或使用单色仪/分光仪布置(直接或间接)获取光谱强度来测量分子指纹。样本的特定签名表明在将所述样本置于光束路径中时以这些强度改变的所述样本本身。这带来两个严重的限制:第一,源的强度噪声对方法/装置的检测由样本诱导的强度改变的能力进行了折中。第二,高强度需要高的动态范围,其必然的有限值设置对激励缩放的极限,其中,小的改变待在高强度之上被分辨。这两个效果促成对样本性能/状态上的最小可检测改变的限制。
最近,已经实现了在红外吸收光谱法的检测极限上的重大进步。其基于分子振动的突然(优选地,飞秒时长)激励(或者更通常地:结构动力学)以及对由尾随突然激励的诱导的偏振响应发射的快速振荡电场的直接时域采样。此场采样获取激励的振动的强度(幅度响应)和激励的振动的延迟并且此场采样已经被称为场分辨光谱法(frs),其中,激励的振动以激励的振动的延迟对外部触发作出反应(相位响应)。在wo2016/102056a1中描述的此方案实质上提高了对样本的性能/状态上、特别是生物样本中的样品浓度上的小的改变进行检测的敏感度,然而,仍然经受以下缺点的困扰:传递由来自高充裕度的组分的贡献控制的信号,此外,其敏感度仍然被在分子信号之前进入检测器的超强激励脉冲折中。在下文中,回顾作为frs的基础的物理原理,重点列出对本发明有利的优点以及由本发明克服的其限制。
作为frs的基础的物理原理
根据wo2016/102056a1利用frs测量偏振响应是基于与正在研究的样本1的当被相干光激励波2激励时发射光波的分子的同步(或:相干),其场振荡优选地在空间和时间上同步(图11,现有技术)。结果,来自相同类型i的单独的分子的光发射有益地叠加,产生具有电场ei(t)的波,电场ei(t)的强度随发射器的数量ni增大。由样本1的所有分子辐射的整个波是所有这些部分波的叠加,所述叠加以其电场的时间变化egmt(t)的形式携带样本的所谓的全局分子指纹(gmf)。原则上,定语“全局”强调以下事实:样本1的gmf携带来自所有分子的信息,例如,这与限制到样本的组分的较小子集的用于生物标记的定向研究(例如,参见“p.e.geyer等."cellsyst."2,185(2016)”)形成对比。
利用比分子激励的寿命短的超短激励波2突然对分子进行冲击性的激励(也参见图11“a.sommer等.“nature”534,86(2016)”)将导致从样本发出电场(样本波3),所述电场包括两部分:由样本的瞬时偏振响应调制的激励激光脉冲(以下被称为主脉冲2’)以及从样本的非瞬时偏振响应产生的(较弱的)拖尾部分,拖尾部分通常被称为自由感应衰减(fid),这也在图11中示出,参见“lanin等“naturescientificreports”4,6670(2014)”和“lauberau和kaiser.“rev.mod.phys.”50,607(1978)”。
在生物样本的情况下,fid信号携带样本的gmf,以下我们称其为gmf波(或:gmf信号)。如果主脉冲2’的持续时间实质上比gmf信号短,则对gmf信号的直接时域测量相对于(连续波)频率域光谱技术呈现以下基本优势:gmf信号可以以无本底方式被访问,这是因为主脉冲2’在其峰值之后随时间指数衰减,所述指数衰减处于比gmf信号的持续时间更短的范围。
这允许对由低浓度样品产生的非常弱的信号进行测量,例如,敏感度提高。与振动光谱的频率域实施形成强烈对比,辐射源的强度噪声不构成对最小可检测gmf信号的限制,这是因为其与激励的时间分离。然而,源的强度噪声转换为gmf信号的相对幅度噪声,这设置了对贡献gmf信号的分子组分的浓度上的最小可检测改变的限制。
技术实施--现有技术
如在wo2016/102056a1中公开的,对样本波3的测量由图12的光谱设备100执行。来自激光脉冲源10、例如如由“o.pronin等.“naturecommun.”6,6988,2015”描述的飞秒激光器的驱动脉冲用于产生如由“i.pupeza等.“naturephoton.”9,721(2015)”描述的激励脉冲2,并用于提供采样脉冲5,其中,激励脉冲2照射正在研究的样本1,采样脉冲5用于利用电光检测器20对样本波3进行电光采样。电光采样可直接测量超过200thz的egmt(t)(参见“s.keiber等.“naturephotonics”10,p.159,2016”)。激励脉冲2基于脉冲内差频生成法例如在非线性晶体(如ligas2晶体)中被产生。样本波3的时间幅度函数直接经历傅里叶变换生成样本1的光谱响应。
作为另外的优点,与例如由“lanin等.“naturescientificreports”4,6670(2014)”中执行的标准频率域光谱法或fid强度的时域测量对比,wo2016/102056a1的技术测量电场,固有地访问全相信息。作为相对于fid强度的时域测量的另一优点,在frs中,fid信号随场幅度的衰减线性跌落,而不是随场幅度的平方值的衰减线性跌落。
尤其是,如果根据图12的仪器以线性响应为特征,则测量的样本波3与样本对(通过相同的仪器以移除了样本来测量的)激励场的全电磁响应对应。以这种方式,以小于飞秒(可能到亚飞秒)时间分辨率获得对样本1的宏观偏振的全部信息的访问。重要的是,增大驱动脉冲的功率会成比例增强检测本底噪声之上的有用的fid(以下:gmf)信号,而不会增加任何干扰本底。因此,wo2016/102056a1的方案针对源是真正功率可扩展的:与以上频率域光谱法的限制对比,在激励功率不“用尽”动态范围的情况下,通过增大源功率可增大分子信号与(强度更强的)激励的时间分离。此外,激励脉冲2和样本波3的电光采样(eos)排除了对差敏感度红外光子检测器的需要。然而,以这些采样技术实施frs也意味着在样本波之前的强激励脉冲对用于测量最小gmf信号(即,最弱采样波)的这些采样技术的敏感度进行了折中。
最近,利用在wo2016/102056a1中公开的frs技术的原型实施例进行了标记实验。在所述标记实验中,利用frs和fts二者研究了在水中稀释的一系列海藻糖。针对fts,使用了现有技术的傅里叶变换光谱仪(mira-分析器,microbiolytics)。实验分别揭示了对于frs达50秒的测量时间的低于0.001毫克/毫升的浓度测量极限以及对于fts达45秒的测量时间的近似0.01毫克/毫升的浓度测量极限。这些结果确认了frs关于弱gms的检测极限极大性能优越性。
受激拉曼散射的物理原理
振动光谱法的另一实施方式基于受激拉曼散射(srs),其中,受激拉曼处理已经用于学习多个分子系统的时间光谱振动结构。在srs中,处于泵浦频率ωp和斯托克斯频率ωs的两个激励场被同时发送到正在研究的样本。如果激励波束的差频δω=ωp-ωs与样本的分子的振动频率ω匹配,则分子跃迁增强,分别导致透射的泵浦强度和斯托克斯强度的损益。诱导的这些强度上的改变与样本的线性散射和线性吸收相比通常较小。这些缺点已经通过缩放激励场的能量(“mccamant等."rev.sci.instrum."75(11),4971(2004)”)或高频调制激励场(“freudiger等.“science”,322(5909),1857(2008)”)被解决。然而,第一种方法针对生物应用具有使用局限,第二中方法经受复杂性和长获取时间的困扰。
使用宽频带(近倍频程)斯托克斯脉冲或泵浦脉冲提供对振动频率的整个光谱的访问。为了以高光谱分辨率组合这些优点,两个泵浦之一必须是窄频带的(以其光谱带宽指示测量的光谱分辨率)并且另一个是宽频带的。之后gmf信号在此再次出现为宽频带、超短泵浦脉冲或斯托克斯激励脉冲的尾迹,类似于利用在wo2016/102056a1中描述的谐振红外激励脉冲的在其自己的光谱频带内以无本底的方式的实施方式。然而,在wo2016/102056a1中未提出srs测量。
frs的局限性
(i)虽然如在wo2016/102056a1中描述的frs已经被证实在相关的分子gmf信号的敏感度方面优于频域振动光谱法,但是其仍然提供了在多个方面进行实质改善的空间。首先,电光采样器测量egmt(t)的检测敏感度小于在不存在激励脉冲时所应有的量级。这是因为携带主脉冲2’和gmf波二者的样本波3波束仅可被缓慢地对焦到采样器中,以防止采样器被gmf波之前的强的主脉冲损坏。移除激励脉冲将允许gmf/样本波更强地对焦到eos检测器中,从而引起对相关的较弱的gmf/样本波进行检测的相应增大的敏感度。
(ii)此外,如以上解释的,在分子病理学和细胞生物学中,主要挑战包括:识别复合混合物中的低充裕度分子和高充裕度分子的浓度上的最小改变。实际上,在迄今为止讨论的frs系统中,即使低充裕度组分的浓度上的相对高的改变也可能由于来自高充裕度样品的影响而被完全掩盖,导致这些可能的生物标记被忽视(正如在能够检测多个组分的所有其他技术中其由于有限的动态范围而未被发现一样)。
(iii)最后但并不是最不重要的,在复合分子混合物、例如生物样本中,gmf信号包括由以低充裕度和高充裕度出现的多种不同类型的分子发射的电场的叠加。由于gmf信号的幅度随发射器的数量(在复合样本中所述数量非常大)增大,因而来自激励的传输到gmf信号的egmt(t)的噪声相对强度也增大。因此,由辐射源噪声导致的幅度变化掩盖由样本的分子组成上的较小的改变诱导的时间指纹。此外,这些改变还需要越过由测量系统的瑕疵导致的可能的本底。
技术实现要素:
发明目的
本发明的目的是提供一种改进的测量样本、特别是生物样本的时间偏振(或:光谱)响应的方法以及一种改进的用于测量样本、特别是生物样本的时间偏振(或:光谱)响应的光谱设备,所述方法和设备能够规避常规技术的限制、特别是上述frs的限制。偏振响应以提高的敏感度和/或可复制性被测量。
发明内容
这些目的通过相应地包括独立权利要求的特征的方法和光谱设备实现。本发明的优选实施例和应用从从属权利要求得出。
根据本发明的第一总体方面,以上目的通过包括以下步骤的测量样本、特别是生物样本的偏振响应的方法来实现。
产生激励波的序列。激励波(在常规frs中称为探测光)利用激光源装置被产生为一连串的激光脉冲,其中,每个激励波具有初级时间形状和光谱内容、优选地具有红外光谱范围中的中心波长。优选地,激励波的半最大强度全宽脉冲持续时间等于或低于1皮秒、特别是等于或低于300飞秒。如果待研究的样本处于气相并具有锐利的振动频带和几十皮秒范围中的fid,则可提供具有等于或低于1皮秒并且高于500飞秒的脉冲持续时间的窄频带激励波。否则,在呈液相的样本具有宽振动频带和1皮秒或短于1皮秒的范围中的fid的情况下,可提供具有等于或低于300飞秒的脉冲持续时间的宽频带激励波。
利用激励波照射待研究的样本,包括激励波与样本相互作用,从而产生样本波(在常规frs中称为修改的探测光)的序列,每个样本波都包括样本的瞬时偏振响应与起源于样本对激励波的非瞬时偏振响应的(通常较弱的)拖尾部分的叠加,其中,样本的瞬时偏振响应被称为样本主脉冲,拖尾部分被称为自由感应衰减、简称为fid信号,或者特别是在生物样本的情况下,拖尾部分被称为样本全局分子指纹(gmf)波(egmf(sample)(t))、简称为gmf波或gmf信号。样本波的修改的时间形状和光谱根据通过样本的偏振响应确定的特征(分别)偏离激励波的初级时间形状和光谱。正在研究的样本是固相样本、液相样本或气相样本、特别是生物起源的固相样本、液相样本或气相样本。
此外,提供参考样本(或:控制样本),其中,参考样本为(呈固相、液相或气相形式的)另一样本、特别是生物样本和/或合成的自然物的样本,待研究的样本将关于其gmf与参考样本进行比较。例如,参考样本可包括不包括相关的特定分子的样本或包括另一浓度的相关的分子的另一样本(例如,来自与正在研究的样本相同源的更旧的样本)。合成的参考样本为具有已知的且高度可复制的分子组成的参考样本、特别是包括在样本的研究中不相关的那些分子的样本。利用激励波的序列照射参考样本,包括激励波与参考样本相互作用,从而产生参考波的序列,每个参考波都包括参考主脉冲与参考gmf波(egmf(ref)(t))的叠加。
根据本发明,在空间和/或时间上将样本波和参考波的差与样本波和参考波二者所共有的gmf波贡献进行光分离。因此,提供至少一个光调节装置,所述光调节装置将样本波和参考波的差与共有gmf波贡献空间和/或时间分离,其中,所述差被检测用于研究样本,共有gmf波贡献不是特定于正在研究的样本的。
检测样本波与参考波的差,并确定均包括样本gmf波与参考gmf波的差的差分分子指纹(dmf)波(δegmf)的时间幅度函数。检测优选地包括电光采样(eos),或者可选地包括光电导采样(pcs)。通过直接检测(采样)或通过基于检测的样本波和参考波的计算确定dmf波。dmf波表示样本的偏振响应(在wo2016/102056中被称为“光谱响应”)。特定类型的偏振响应与激励波的设计有关,例如,激励波可适用于ir吸收或srs测量。
根据本发明,针对光分离步骤,样本波与参考波在检测步骤之前相互空间和/或时间分离。分离样本波与参考波的步骤包括:相对于彼此针对性地调节样本波和参考波、特别是减小样本波和参考波的空间和/或时间重叠。样本波和参考波的重叠优选地在空间域和/或时间域中被最小化或者甚至被排除。换言之,分离样本波与参考波的步骤包括部分或者甚至完全减小其在空间域和/或时间域的重叠。
根据样本波与参考波的分离,dmf波、即对应于样本gmf的电场和对应于参考gmf的电场的差与任何其他参与波的空间和/或时间分离在空间/或时间上被最大化。这通过在空间和/或时间上相对彼此相应地调节参与波(激励波、参考波和样本波)来实现。以这种方式,本发明有利地使用frs的无本底检测来以提高的敏感度测量差信号δegmf(t),差信号δegmf(t)直接反应参考样本与正在研究的样本的分子组成上的差异。
虽然在下文中并未一直强调,但是应注意,激励波包括利用优选地1千赫兹以上、特别优选1兆赫兹以上的重复率产生的激光脉冲的序列。因此,样本波和参考波也是激光脉冲的序列。术语激励波、参考波和样本波分别指用于照射参考样本和正在研究的样本的相应的波形或者由参考样本和正在研究的样本的光谱响应提供的相应的波形。
根据本发明的第二总体方面,关于装置特征,以上目的通过用于测量样本、特别是生物样本的光谱响应的光谱设备实现,所述光谱设备包括激光源装置、光调节装置、检测装置并且可选地包括计算装置。优选地,光谱设备适合于执行以上根据本发明的第一总体方面的测量样本的光谱响应的方法。激光源装置适合于产生激励波的序列,并利用激励波的序列照射样本,包括激励波与样本相互作用,从而产生样本波的序列,每个样本波包括样本主脉冲与样本全局分子指纹(gmf)波(egmf(sample)(t))的叠加;并利用激励波的序列照射参考样本,包括激励波与参考样本相互作用,从而产生参考波的序列,每个参考波包括参考主脉冲与参考gmf波(egmf(ref)(t))的叠加。光调节装置被布置为用于在空间和/或时间上将样本波和参考波的差与样本波和参考波二者所共有的波贡献进行光分离。检测装置被布置为用于检测样本波与参考波的差,并确定均包括样本gmf波与参考gmf波的差的差分分子指纹(dmf)波(δegmf)的时间幅度函数。
根据本发明,用于将样本波和参考波的差与样本波和参考波所共有的波贡献空间和/或时间分离的光调节装置是包括在光谱设备中的调节装置。术语“分离”、“调节”或其变形指任何针对性操作、特别是激励波(或者可选地参考波)的针对性的波形整形,使得携带关于参考样本与正在研究的样本之间的分子组成上的差的有用信息的差gmfδegmf(t)在时间上位于样本波的主脉冲之后尽可能远处。光调节装置包括对激励波和/或样本波的波形进行整形的无源和/或有源光元件,如透射构件和/或反射构件和/或放大构件。发明人已经发现分别通过本发明的分离步骤或调节装置可大幅度抑制由激励波产生的本底或者可大幅度增大检测差gmf的敏感度,因而提高了frs检测的敏感度。
dmf波可被输出为待获得的特征偏振响应。可选地,计算装置可被提供,用于基于检测的样本波和参考波计算dmf波和/或用于分析感测的dmf波、例如用于基于dmf波的时间幅度函数的傅里叶变换提供样本的偏振响应和/或用于基于利用正在研究的样本和/或参考样本确定的dmf波分析样本组成的改变。
根据本发明的优选应用,正在研究的样本包括来自人或动物有机体的生物样本。样本的光谱响应和/或样本的gmf相对于控制(参考)样本的差被测量,用于获得关于有机体的诊断相关信息。术语“诊断相关信息”指关于样本的任何信息、特别是关于样本组成、相对于参考样本的差或样本的时间改变的信息,关于样本的信息可用于提供或验证医疗诊断。特别是,本发明目的在于以前所未有的敏感度在单次测量中通过直接将正在监视的样本(或细胞)与参考物(或来自相同有机体的参考细胞)、还称为“控制物”进行比较来检测分子组成上的改变,分子组成上的改变可标记从正常生理的偏离和/或识别不同的细胞类型。
因此,以本发明的优选实施例,所述测量方法可包括评估样本的光谱响应以获得诊断相关信息的步骤。关于装置特征,光谱设备的优选实施例优选地包括计算装置,所述计算装置适合于处理光谱响应并提供诊断相关信息。有利地,诊断相关信息可被输出到本发明技术的用户,例如,医师。随后,用户可考虑诊断相关信息来提供诊断。可如wo2016/102056a1中公开的那样实现光谱响应评估。
根据本发明的实施例,仅根据较小数量的分子——高充裕度分子和低充裕度分子二者——而产生不同的指纹上的差、即样本的差dmf波被感测。这可按照简单的公式来表示:如果egmf(samp)l(et)是样本gmf信号并且egmf(ref)(t)是参考gmf信号,则以下dmf信号以最大可能敏感度被检测:
δegmf(t)=egmf(sample)(t)-egmf(ref)(t)。
根据本发明的第一变形(本发明的第一实施例,实施例(i)),通过以下方式实现样本波和参考波的差与样本波和参考波所共有的波贡献的光分离:利用一个激励脉冲的相同的复制品(谐振ir吸收)或多个脉冲(srs)同时对样本和参考样本进行曝光,并以宽频带激励脉冲与透射过样本和参考样本的gmf波之间180度的相移对宽频带激励脉冲和透射过样本和参考样本的gmf波进行干涉组合,使得两个激励脉冲极大地相互抵消并且各自的gmf波干涉组合以生成以上差。参考波与样本波的干涉抵消、优选地降低至零等同于dmf波的检测。因此,本发明的第一实施例还被称为差分分子指纹(dmf)或dmf实施例。
激励场的由该干涉组合导致的从信号的消除允许较弱的差分gmf波δegmf(t)被最优地聚焦到光谱设备的检测装置、包括eos或pcs检测器,从而消除如在wo2016/102056a1中公开的frs的以上讨论的限制(i)。差分gmf波δegmf(t)生成正在研究的样本相对于参考样本的差分全局分子指纹,所述差分全局分子指纹包括有不同类型“i”的分子发射的波之间的差,差分分子指纹的强度随数量δni缩放,所述数量δni表示正在研究的样本中的分子类型“i”的数量与参考样本中的分子类型的数量之间的差:
δegmf(t)=δe1(t)+δe2(t)+…+δei(t)+…。
发明人发现针对生物样本中的典型分子浓度,δei(t)∝δni保持非常好的逼近。因此,δegmf(t)包括仅基于分子浓度相对于参考物的改变而与分子的充裕度无关的关于分子的信息,消除了如在wo2016/102056a1中公开的frs的以上讨论的限制(ii)。最后但并不是最不重要的,由于直接对照,因而极大抵消了由egmf(sample)(t)和egmf(ref)(t)携带的均取决于共激励源的噪声的噪声,有效解决了如在wo2016/102056a1中公开的frs的以上讨论的限制(iii)。
根据本发明的第二变形(本发明的第二实施例,实施例(ii)),第二变形包括将样本波和参考波的差与样本波和参考波所共有的波形贡献时间分离,在包括样本和参考样本的波束路径中设置群延迟色散,使得参考波被时间压缩、优选地朝向其傅里叶变换极限缩短。由于对参考波进行压缩,因而dmf信号主要通过gmf波来确定,使得可消除如在wo2016/102056a1中公开的frs的以上限制(i)至(iii)。
根据本发明的第三变形(本发明的第三实施例,实施例(iii)),第三变形包括将样本波和参考波的差与样本波和参考波所共有的波形贡献时间分离,激励波在样本和参考样本内的相互作用长度(l)被设置在从l=2/25α到l=10/α的范围内,其中,α为参考样本的吸收系数。有利地,设置相互作用长度允许最大化样本gmf波和dmf波。
根据本发明的第四变形(本发明的第四实施例,实施例(iv)),在检测之前,dmf信号或样本gmf信号经历光参量放大,引起进一步增大frs的敏感度。
以上本发明的第一实施例至第四实施例可单独实施或以任何组合的方式实施。因此,根据本发明的特别优选的实施例,从直接干涉对照(i)产生的dmf信号δegmf(t)可通过细致的色散设置(ii)、结合相互作用几何结构的最优化(iii)并通过在检测之前和/或检测之后的其光参量放大(iv)而被进一步增强。可选地,dmf波可在没有干涉对照(i)的情况下被检测而是利用色散设置(ii)、相互作用几何结构的最优化(iii)和/或光参量放大(iv)被检测。如在wo2016/102056a1中描述的经由谐振红外激励的这些构思的实施方式可利用作为激励机制的受激拉曼散射来实施(srs实施例,实施例(v)),以进入红外和拉曼激活的振动模式,用于获取完整振动指纹。
关于场分辨振动光谱法(frs)绘制的差分分子指纹(dmf)、优选地补充有以上列出的创新的差分分子指纹(dmf)保证了:直接测量分子组分的浓度的改变而不管分子组分的充裕度如何,用于以异常的特有性(得益于前所未有的数量的组分的相关改变的测量)和最高的敏感度(得益于上述优点)进行疾病标记。在下文中概述第一实施例至第三实施例的优选特征。
根据第一实施例的优选变形,使用马赫-增德尔干涉仪获得参考波的干涉抵消。在马赫-增德尔干涉仪的第一端口处输入激励波,将待研究的样本布置在马赫-增德尔干涉仪的第一干涉仪臂中,将参考样本布置在马赫-增德尔干涉仪的第二干涉仪臂中,在马赫-增德尔干涉仪的第一输出端口(差输出端口)处提供dmf波。马赫-增德尔干涉仪优选地被配置为使得修改的探测光以在待研究的样本处和参考样本处的透射被收集。使用马赫-增德尔干涉仪具有关于精度和稳定调整干涉仪臂、有助于抑制参考波和样本波所共有的指纹的优点。
优选地,在马赫-增德尔干涉仪的第一干涉仪臂和第二干涉仪臂中的波束传播路径长度被设置为相等,其中,所述相等为在激励波的一半载波波长、即激励波的一半中心波长的范围内相等。特别优选地,波束传播路径长度通过控制回路最小化在马赫-增德尔干涉仪的输出端口之一处的时间平均功率而被设置为相等。
根据本发明的第二实施例,分离参考波与样本波的步骤包括产生dmf波与参考波的时间分离。优选地,设置群延迟色散的步骤包括缩短参考主脉冲并且缩短共同包括在样本gmf波和参考gmf波二者中的gmf波贡献。共同包括在样本gmf波和参考gmf波二者中的gmf波贡献特别包括等同地包括在样本和参考样本、如例如样本矩阵、如溶剂中的分子的偏振响应、和/或特定研究不相关的分子的偏振响应、和/或样本容器壁的材料和参考容器壁的材料的偏振响应。优选地,在下文中作为概述结合色散补偿呈现用于液体样本或气体样本的样本容器。第二实施例应用于线性和非线性光谱方案。
优选地,激励波被产生为具有傅里叶变换极限脉冲持续时间,激励波和/或样本主脉冲和参考主脉冲经历用于减小沿波束路径的任何物质的脉冲展宽效果的色散补偿。这可通过向样本的样本容器和参考样本的参考容器提供具有负色散或正色散的容器壁材料、和/或通过在样本和参考样本之前和/或之后通过反射元件施加正色散或负色散来获得。可选地,激励波被产生为具有脉冲啁啾,使得沿波束路径引入的色散补偿脉冲啁啾。利用此实施例,向样本容器和参考容器提供具有消除脉冲啁啾的色散的容器壁材料,和/或通过在样本和参考样本之前和/或之后的反射元件施加色散,使得脉冲啁啾被抵消。
根据本发明的另一优选实施例,通过在样本的样本容器和参考样本的参考容器上提供抗反射涂层,和/或通过将样本或样本容器和参考容器布置在相对于激励波波束路径成布儒斯特角,来最大化探测光穿过样本的透射。通过抗反射涂层和/或支持设置布儒斯特角的样本容器来提供调节构件。在这种情况下,本发明的对波形进行调节或整形包括增大幅度、特别是样本波的幅度。
有利地,对样本波或dmf波进行检测的增大的敏感度提供frs技术在srs测量领域的新的应用。因此,根据本发明的另一优选实施例(srs实施例),本发明的对样本的光谱响应的测量包括在样本处的受激拉曼散射的电场检测。利用同时发生的泵浦脉冲和斯托克斯脉冲的序列同时照射样本。泵浦脉冲和斯托克斯脉冲之一是窄频带脉冲并且另一个是宽频带脉冲。窄频带脉冲适合于激励样本的单个振动跃迁,而宽频带脉冲适合于激励样本的多个振动跃迁。激励波由宽频带斯托克斯脉冲(或者可选地,宽频带泵浦脉冲)提供。样本波和参考波分别由通过样本和参考样本的振动拉曼响应增强的斯托克斯脉冲提供,或者可选地,样本波和参考波由通过样本和参考样本的振动拉曼响应减弱的泵浦脉冲提供。关于适合于在样本处的受激拉曼散射的电场检测的光谱设备,激光源装置被配置为用于利用泵浦脉冲和斯托克斯脉冲的序列同时照射样本,检测装置适合于检测由样本的振动拉曼响应增强的斯托克斯脉冲(或者可选地,由样本的振动拉曼响应减弱的泵浦脉冲)。
总之,本发明的由相干、例如几周期脉冲的源驱动的frs提供以下明显的优点。利用充分压缩的脉冲的frs通过消除作为对最小可检测的分子信号的限制的激励信号检测的噪声而相对于频域光谱法提高检测敏感度。基于frs的dmf检测能够以以下几种方式提高检测敏感度:
·通过消除作为对分子信号的最小可检测改变的限制的技术噪声。这是因为由应该被控制的激励噪声引起的分子信号上的任何波动等同地出现在样本臂和参考臂中因而除量子噪声之外在差分输出处抵消。
·同等重要地,dmf还有效地消除可能从偏差导致的任何后激励本底(例如,激励波的非指数衰减和由伪反射引起的卫星峰),后激励本底可严重影响frs敏感度。
·dmf允许在抑制激励脉冲之后直接对差分信号进行光放大。选择性地放大差分gmf波可利用被抑制的激励波诱导比利用当前激励波(如在frs中的激励波)所能诱导的更强的eos检测信号,这是因为当前激励波容易以非常低场强度的有用分子信号在eos晶体中引起光击穿。除了直接通过放大获得的敏感度提高之外,差分分子信号的足够强的光放大可提高差分分子信号的eos检测的敏感度。此提高伴随着带来了对检测电场的动态范围的比较宽松的需求(这是因为从测量的差gmf消除了主脉冲)。
利用本发明实施的全局分子指纹追求与无目标生物标记搜索/筛选、例如经由蛋白质组学和代谢组学的无目标生物标记搜索/遮蔽几乎完全一致的目标。然而,方法根本上是不同的:“组学”方法学目标在于标识分子组成的集合,分子组成的浓度改变(或新的出现)可明确指示特定病状。强烈反差地,由frs获得的gmf的改变是由于可能的巨大数量的现存的分子和可能的一些新出现的分子的微小的浓度改变的积分效果引起的。多个(可能大多数)这样的分子浓度通过组学技术是难以实现的,但是由于场分辨光谱法的优异动态范围多个(可能大多数)这样的分子浓度可以可测量地贡献光谱gmf。低充裕度分子的浓度上的改变也可能是高度重要的,例如,突出的示例是细胞激素,已知即使其微小的浓度改变也会导致广泛的生理效应
通过场分辨光谱法的全局分子指纹的构思保证了:直接获得任何复合生物流体样本(例如,人血液)的gmf从适当选择的参考物的gms上的偏差,从而用于以通过测量直接得到的客观测量搜索临床分类。在同一测量下直接比较两个不同样本的全局分子指纹与潜在的物理可观测量之间的相干有关,这在目前是只能通过激光光谱法来有效满足的条件。此唯一性连同frs的史无前例的动态范围并结合组学技术(例如高压液相色谱法,hplc)保证了:使先进的分子指纹法达到史无前例的敏感度和吞吐量,从而为早期检测和筛选开辟了新的道路。
附图说明
在下文中参照附图描述本发明的另外的细节和优点,附图示出:
图1:根据本发明的第一实施例(dmf实施例)的光谱设备的示意图;
图2和图3:根据本发明的第二实施例的差gmf与参考波和样本波二者所共有的指纹的时间分离的示意图;
图4:主脉冲与gmf的时间分离的示意曲线图;
图5:用于缩短主脉冲的色散补偿的示意曲线图;
图6和图7:根据本发明的第三实施例的使用光参量放大器放大样本的示意图;
图8:组合了本发明的第一实施例至第三实施例的光谱设备的示意图;
图9和图10:根据本发明的srs实施例的光谱设备的示意图;
图11和图12:常规frs技术(现有技术)的示意图。
具体实施方式
在下文中参照差分分子指纹法描述本发明的优选实施例的特征,差分分子指纹法包括干涉对照(i)或srs测量(v)、参考波的色散补偿(ii)、相互作用几何结构的最优化和/或差分指纹的光放大(iv),例如,干涉对照针对ir吸收。特征(i)至特征(iv)实施用于相对彼此调整参与的波使得差gmf的贡献在空间上和/或时间上与参考波和样本波所共有的指纹分离的本发明的测量。例如,(i)通过干涉装置提供差gmf与激励波和参考波的空间分离,而(ii)引入差gmf的时间分离。特征(i)至特征(iv)可被单独提供或以任意组合的形式来提供。作为一个示例,在(i)包括图9的受激拉曼测量或者甚至具有图12的常规设置的特定情况下,特征(ii)和/或特征(iii)可在如图1中示出的差分分子指纹法(i)的设置中被提供。作为另一示例,如果不需要光放大、例如在(图1)差分分子指纹法(i)的设置中不需要光放大,则可省略特征(iv)。此外,特征(i)至特征(iv)可利用液体或固体材料来提供或者利用气体样本来提供。
差分分子指纹法(dmf)以最高的可能的敏感度直接测量分子组分的浓度上的改变,即,疾病标记直接相关的数量上的改变。这支持以下优点:
(a)限制可从单独的测量推得的egmt(t)的最小改变的egmt(t)的噪声可在引用直接相干(参见下文的(i))时抵消(除量子噪声之外);
(b)egmt(t)可与所有参与波的大部分主脉冲部分有效分离并通过(i)ein(t)的宽频带相干控制(参见下文的(ii))和(ii)相互作用几何结构的优化被最大化(参见下文);
(c)差分指纹δegmt(t)可在被电光采样检测之前被参量放大多个量级(参见下文的(iv))。
在下文中通过示例性参照飞秒激光源装置的特定示例和电光采样(eos)的应用描述本发明的优选实施例。需要强调的是,本发明不限于描述的实施例。特别是,为了提供如本描述中指定的探测光脉冲,激光源可被修改。作为一个示例,皮秒激光源装置可特别用于气体样本。此外,eos方法可被另外的光谱技术、如例如利用光敏天线的电场采样或ftir光谱法代替。对用于提供诊断相关信息的本发明的优选应用进行了参考。需要强调的是:本发明不限于研究生物样本,而是可利用其他样本、如例如环境样本来实施。
(i)引用了相干干涉的差分分子指纹法(dmf)
图1示出根据本发明的优选实施例的光谱设备100的特征,本发明的优选实施例适合于dmf波与样品波和参考波所共有的波贡献、特别是与激励波和参考波的干涉分离。光谱设备100类似于图12的常规设置来构建。因此,常规光谱设备的特征、特别是与激光源装置和检测装置尤其是电光检测原理相关的特征可如在wo2016/102056a1中公开的那样实施,其中,wo2016/102056a1通过引用被引入本说明书。
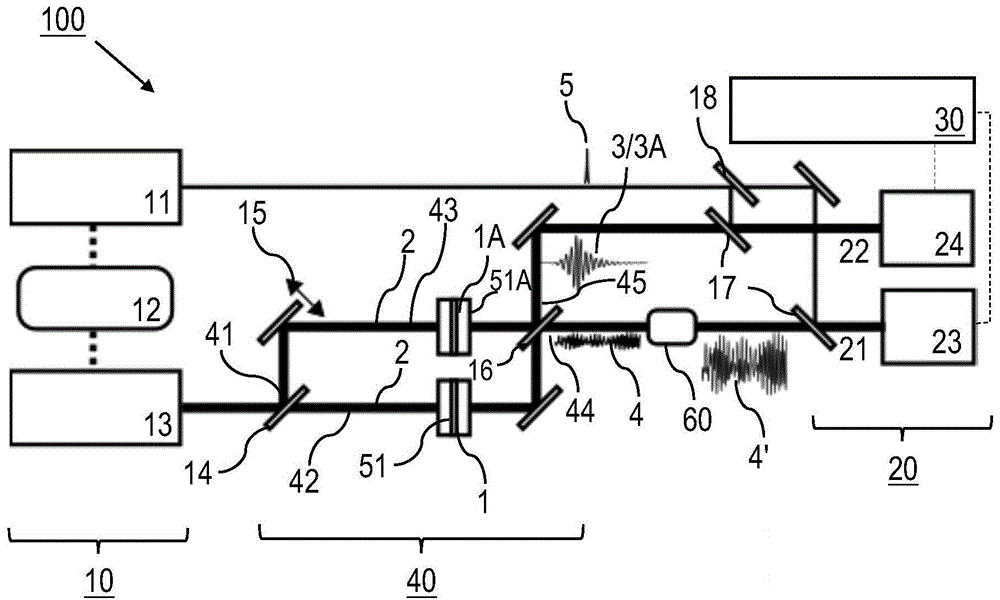
图1的光谱设备100包括激光源装置10,激光源装置10包括可见或近红外(nir)飞秒源11、中红外(mir)飞秒源13(例如,包括ligas2晶体)以及同步和延迟单元12,其中,可见或近红外(nir)飞秒源11用于产生初始的驱动脉冲的序列,中红外(mir)飞秒源13用于基于驱动脉冲产生mir脉冲的序列,同步和延迟单元12用于对mir脉冲和驱动脉冲进行相互调节(例如,如果mir脉冲从可见或nir源11产生则对延迟状态或对同步进行相互调节或者对nir源和mir源的重复率的进行调节)。由驱动脉冲提供的用于与正在研究的样本1和参考样本1a进行相互作用的激励波2从mir飞秒源13输出。
激励波2脉冲利用50:50mir分束器14被分裂到马赫-增德尔干涉仪40的第一干涉仪臂42和第二干涉仪臂43中,其中,50:50mir分束器14提供马赫-增德尔干涉仪40的第一输入端口41。以下描述马赫-增德尔干涉仪40提供光调节装置的功能。在第一干涉仪臂42中,提供具有样本容器51的样本1,例如,样本1包括包含在水中的生物样本分子。参考样本1a包括在第二干涉仪臂43中的相同的参考容器51a中。优选地,样本容器51和参考容器51a适合于整个(中)红外范围(从2微米到30微米)中的低透射损耗。为此目的,抗反射涂层可设置在样本容器51和参考容器51a的表面,用于增大其mir透射。此外,样本容器51和参考容器51a可被布置为相对于沿干涉仪臂42、43的波束路径成布儒斯特角。
此外,示意性示出的用于相互调节干涉仪臂42、43二者的长度的延迟单元15布置在第二干涉仪臂43中。延迟单元15可利用控制回路(未示出)被控制,使得马赫-增德尔干涉仪40的两个干涉仪臂的几何长度差最小化。干涉调节可利用一个或两个以上压电转换器(pzt)来执行。
通过激励波2与正在研究的样本1以及与参考样本1a的相互作用,在第一干涉仪臂42中产生样本波3并在第二干涉仪臂43中产生参考波3a。通过样本波3和参考波3a在50:50mir分束器/合束器16处的相干叠加,在差输出端口44(第一输出端口)处产生dmf波4,在和输出端口45(第二输出端口)处产生参考波和样本波二者所共有的指纹的建设性相干叠加。利用分束器/合束器16,dmf波4被传送到检测装置20的第一检测通道21,样本波3和参考波3a的叠加被传送到检测装置20的第二检测通道22。用于dmf波4的光放大(例如,利用光参量放大(opa))并产生放大的dmf波4’的光参量放大装置60布置在第一检测通道21中。以下参照图6和图7进一步描述光参量放大装置60的细节及其功能。
检测装置20包括各自位于检测通道21、22之一中的电光采样单元23、24。利用飞秒源11产生的驱动脉冲的部分作为采样脉冲5经由mir-nir合束器17和nir分束器18分别被传送到电光采样单元23、24。第一电光采样单元23和第二电光采样单元24分别检测放大的dmf波4’的时间幅度函数以及和信号3/3a的时间幅度函数。
计算装置30包括计算机电路,所述计算机电路基于在第一检测通道21中检测的放大的dmf波4’的时间幅度函数的傅里叶变换计算正在研究的样本1的光谱响应。应注意,第二检测通道22是本发明的可选特征、例如出于监视或控制目的。
在实践中,光谱设备100适合于测量任何相关的气体或液体。此外,应用的材料是真空兼容(对于用于气体的样本容器、气室)、坚硬并且坚固(在较高的压力被施加到用于液体的样本容器时不应该弯曲)和/或不溶解的材料(相对于水、酸和有机溶剂)。
如以下参照图9和图10描述的,根据本发明的可选实施例,光谱设备100可适合于基于样本的受激拉曼散射的srs测量。
在下文中,描述利用图1的光谱设备100测量样本响应。如以上概述的,对差分分子指纹的测量得益于基于如在wo2016/102056a1中描述的场分析光谱法的处理的相干性质:(i)激励波中的电场振荡的时空相干性,(ii)通过空间和时间相干激励波以同步(相干)的方式在整个样本体积中对分子振动的激励,(iii)由于激励的分子的振动的完全同步而由激励的分子对相干辐射(样本波3,参见图11)的再发射。
作为(i)至(iii)的直接结果,样本波3的电场振荡完全相位锁定到激励波2的电场振荡。作为此相干的结果,由同一激励波2(ein(t))的两个复制品同时激励的源于样本和参考物的样本波3egmt(sample)(t)和参考波3aegmt(ref)(t)可被直接相互比较。换言之,来自相关的样本的gmfegmt(sample)(t)可直接与参考指纹的gmfegmt(ref)(t)对照,而从单次测量直接生成差分分子指纹δegmt(t)。
利用场分辨红外吸收光谱法的此基本构思的优选实施方式包括利用图1的设置进行的以下步骤。
1)利用50/50分束器14将(由图1中的mir飞秒转换单元13产生的)飞秒中红外(mir)脉冲分离为两个等同的部分(在其分离之后利用位于两个波束之一中的附加的可变衰减器可实现精确平衡)。
2)发送mir激励脉冲(激励波2)之一穿过参考样本1a。发送另一相同的mir脉冲穿过正在研究的样本1。
3)利用分束器16对两个透射的mir脉冲进行重新组合,同一分束器16用于在测量之前对波束进行分裂(使得在穿过输入分束器和输出分束器二者时由分束器强加的波形上的可能的微小残余改变被抵消)。根据1)至3)描述的设置形成马赫-增德尔干涉仪40,马赫-增德尔干涉仪40的两个相同的臂42、43包括样本1和参考样本1a(二者在几何结构上被布置为尽可能相同)。因此,除了由分子组成上的差异引起的egmt(t)上的改变之外,样本1/参考样本1a以及样本容器51、51a二者的色散和衰减相同。
4)两个干涉仪臂42、43中的波束传播路径长度优选地被设置为相等,其中,所述相等为在激励波2(mir脉冲)的一半载波波长的范围内相等。通过将路径长度差精细地调节到加/减一半载波波长,入射到干涉仪40的输出分束器16的两个脉冲可除其gmf波上的差异之外完全相互抵消,其gmf波上的差异起源于由于样本和参考物的不同的分子组成导致的样本和参考物之间的egmt(t)上的不同。
5)设置路径长度差使得路径长度差最小化而引起携带大约99.9999%的透射过样本并从样本辐射的总辐射能量的激励脉冲的几乎完全相互抵消。剩余的大约0.0001%的能量携带在各个dmf信号4中。如果样本1的分子组成与参考样本1a的分子组成相同,则样本波3和参考波3a将相同并且它们也完全相互抵消。如果样本1的分子组成与参考样本1a的分子组成相互不同,则样本波3和参考波3a不能完全抵消而是产生差而直接生成δegmt(t)。
6)利用电光采样单元23对放大的δegmt(t)信号4’的电场进行采样。这可通过用于图12中的单独的生物样本的常规特征的同一eos系统实现。不携带主脉冲的差分分子信号提供两个重要的益处。第一,eos晶体可被分子信号的更高的电场辐射,其中,在所述更高的电场下,(更强的)激励将不可逆地损坏常规方案(图12)中的晶体。这直接产生除了得益于差分信号放大的敏感度上的增大之外的敏感度上的增大。第二,极大放宽了对处理eos信号的(数字)电子系统的动态范围的需求。系统可被最优化用于检测相关分子信号而不用处理更强的伴随信号。
7)时间上采样的形状的傅里叶变换生成样本1的光谱偏振响应。这还可被计算装置30处理、例如用于获得诊断相关信息。偏振光谱的光谱特征可通过使偏振光谱经历滤波处理来获得。表征人的健康状态的混合物的特定频带可被标识。此外,偏振光谱可与之前利用相同的生命体收集的数据进行比较和/或与利用其他、健康或非健康的对象收集的参考数据进行比较。
(ii)参考波的色散补偿
如上所述,如果gmf信号被有效地与主脉冲分离(这适用于参考波和样本波二者),则gmf测量的敏感度可增大。这是由于与在本发明的开始部分中描述的其他光谱技术对比的wo2016/102056a1的典型的场分辨光谱法的无本底检测。如果参考波和样本波所共有的指纹通过相应地调节参与波的色散而被限制到最短可能时窗,则可获得针对差gmf的此优点的扩展。在这种情况下,差gmf将主要在各个波的末端出现在样本波中(以及在dmf实施例的情况下出现在dmf信号中),最大化了差gmf与参考波和样本波所共有的指纹的分离。
根据本发明的第二实施例,对参与波的调节包括通过在从激光源装置10到检测装置20的波束路径中设置色散来在样本波内将差gmf与参考gmf进行时间分离,用于如图2至图5所示对参考波进行压缩。dmf波与参考gmf波的时间分离可例如利用图1的实施例、图9的srs测量或图11的常规的场分辨光谱法来提供。
在样本波内将差gmf与参考gmf进行时间分离优选地如图2a至图2c示意性示出地获得并还在图3a至图3f中进一步例示。
图2a至图2c示出不具有图1的干涉仪设置的本发明的第二实施例。示图涉及本发明的包括激光源装置10和检测装置20的光谱设备100的变形,其中,仅提供激励波2的单个波束路径,其中,样本和参考样本被布置,并且样本波与参考波3a的差通过连续测量样本波和参考波并随后计算样本波和参考波的差来确定。图2a至图2c示出参考样本1a被布置在波束路径中的状态。激光源装置10包括如上所述的构件11、12和13。检测装置20适合于使用来自nir飞秒源11的采样脉冲5对样本波或参考波进行电光采样。
图2a示出色散调节元件53(光调节装置)布置在样本1之后的设置。利用mir飞秒源13,激励波2被产生、被压缩到傅里叶极限。通过参考样本1a、特别是参考容器51a的壁材料和包括在参考容器51a中的参考样本物质,参考主脉冲和参考波被展宽。通过色散调节元件53的作用,参考波3a再次在时间上被充分压缩。因此,对来自样本波和参考波的差的dmf波进行感测的敏感度增大。
图2b示出在参考样本1a之前设置色散调节元件53的可选情况,而图2c示出替代参考样本而在波束路径中具有样本1的相同的变形。再次,参考波通过色散调节元件53的作用而在时间上充分压缩。结果,针对参考脉冲调节的时间压缩使得dmf信号4尾随样本波出现。应注意,如果与样本或参考样本的相互作用是线性的,则图2a和图2b的变形是等同的。虽然在srs测量的情况下其不是等同的,但是其二者仍可被实施为用于srs。
对于参考波的最优时间压缩,可采用有源且可编程的色散调节元件53。示例包括声光可编程色散滤波器(或炫光器(dazzler))和空间光调制器。
根据图3a,激励波2通常沿朝向检测装置20的波束路径被压缩。这可通过如图3b中示意性示出的由样本容器51的壁材料提供的光调节装置的作用来进行、可选地通过以在参考容器51a之前(图3c)或参考容器51a之后(图3d)引入正色散和负色散的反射元件52的作用的组合来进行、或者仅通过在参考容器51a之前(图3e)或参考容器51a之后(图3f)引入正色散和负色散的反射元件52来进行。相同的色散设置构件被提供有包括样本容器的波束路径(未示出)。
在图4中示意性示出缩短参考波3a的分离效果,其中,曲线a示出、例如74飞秒半极大全宽带宽限制的激励波2,曲线b和曲线c表示在常规kcl样本容器壁材料中的脉冲展宽(分别是10毫米和100毫米)。曲线b和曲线c与曲线d的样本gmf强烈重叠,因而劣化了dmf波4的检测。通过参考波3a的压缩,此叠加被最小化或排除。
针对在场分辨检测器处在时间上对参考波3a进行最优压缩,可区分以下两种情况:
第一,激励脉冲在进入光谱设备100的测量区段之前已经在时间上被充分压缩。这将意味着测量区段的构件、如样本容器、反光镜或其他光构件不能引起任何额外的色散。这可通过以下三个不同的设计策略来实现。
设计1:将多种材料与负群速度色散和正群速度色散进行组合。因此单独的材料的厚度按照每种材料引入的色散被抵消的方式被选择。这些材料还可用作用于液体或气室的窗口,以将相关的样本保持在位。额外的抗反射涂层可施加于窗口,以最大化透射。
基于设计1的用于测量区段的包括设计用于以10微米的中心波长在时间上充分压缩激光脉冲的液体细胞样本容器的示例包括:作为样本容器的壁的两个5毫米的锗窗口以及与锗窗口之一结合的3毫米的硒化锌板。样本容器按照用于色散补偿的布儒斯特角布置。图5示出针对相关的带宽的引入的群速度色散。在10微米处,总gvd等于0。
设计2:最小化色散材料的总量。这可通过最小化所有透射窗口的厚度来实现或通过使用相关的液体样本的自由流动液体喷射来完全免除透射窗口来实现。因此,产生的液体膜应该具有光表面性能,以避免波束变形和不期望的损耗。液体膜也可根据布儒斯特角来布置以最大化透射。具有光性能的液体膜已经被演示(参见“tauber,m.,等.“reviewofscientificinstruments”74.11(2003):4958-4960”)。
设计3:引入定制和/或可调节的色散元件,来补偿由窗口材料、光器件引入的色散或由不相关的样本的成份引入的色散。这些额外的色散元件可以是啁啾镜、空间光调制器(slm)和/或声光可编程色散滤波器(dazzler)。
第二,激励脉冲在进入测量装置之前被啁啾化。这将意味着测量装置必须补偿此啁啾以确保在场分辨检测器处在时间上完全压缩脉冲。与情况1类似,对设计1加设计3稍微变形适合于实现此情况。
设计1:将多种材料与负群速度色散和正群速度色散进行组合。因此单独的材料的厚度按照每种材料引入的色散外加激励脉冲的啁啾被抵消的方式被选择。这些材料还可用作用于液体或气室的窗口,以将相关的样本保持在位。额外的抗反射涂层可施加于窗口,以最大化透射(需求2)。
设计2:引入定制和/或可调节的色散元件,来补偿啁啾和由窗口材料、光器件引入的色散或由不相关的样本的成份引入的色散。这些额外的色散元件可以是啁啾镜、空间光调制器(slm)和/或声光可编程色散滤波器(dazzler)。通常,以上列出的设计的任意组合适合于满足针对测量装置的需求1和需求2。
容器壁的材料、容器壁的厚度和/或色散特性、例如反射元件52的色散特性可基于对沿朝向检测装置20的波束路径的色散进行数值模拟来选择。例如,用于以液体样本矩阵的形式的样本的样本容器可包括用于色散控制的锗壁和硒化锌板(在高透射和有效压缩方面具有优点)、用于色散控制的硅壁和硒化锌板、或溴化铊碘化物(thalliumbromidiodide)(krs-5)壁和锗板。例如,用于不具有样本矩阵的气体样本的样本容器可包括用于色散控制的锗壁和硒化锌板、碘化钾、碘化铷或碘化铯壁、或者溴化钾、溴化铷或溴化铯壁。
(iii)相互作用几何结构的优化
用于获得对样本gmf和/或差gmf的最优访问并有效地将无本底检测特征用于frs的另一方法包括如以下所述通过优化与相关的样本的相互作用长度来最大化样本gmf。
在强吸收参考物的情况下,与感兴趣样本的最优相互作用长度l为:
其中,α是参考样本的吸收系数。
最优相互作用长度l通过最小化针对给定厚度x和场动态范围dre的相对误差sα来获得:
针对相对误差相对于有最优值偏移不超过百分之10的厚度范围生成:
此等式的解为:
因此,w(x)是乘积对数函数。
因此,获得在从l=2/25α到l=10/α的范围中的最优相互作用长度l。
以更多细节,基于以下考虑获得最优相互作用长度
并且“参考物”强度可被认为是
假设检测器噪声限制的敏感度(如以下情况:如果参考脉冲如此短而使得参考脉冲可被有效地从测量的时间窗口排除而不会严重损失关于gmf的信息并且如果忽略经由吸收器到其他光谱元件的强度和相位噪声的耦合)和针对最小化可检测吸收损耗(mdal)读出:
|er|-|es|>nepe,att,(3)
其中,nepe,att是在通过具有α1的介质衰减之后在单独的光谱元件中的噪声等效功率:
使
因此,当以下函数达到最小值时,达到α2中的mdal。
为了找到此值,一阶导数被计算并被设置为0:
解为x=2/α1。
例如,考虑在9.6微米处具有α1=600cm-1的水作为缓冲物质,则获得33微米的最优液体室厚度。假设105的电场测量的动态范围,则从等式(5)获得α2=0.0163cm-1的mdal。
(iv)样本波的光放大
差gmf(参见图1,由样本1发射的gfm波的电场与由参考样本1a发射的gfm波的电场的差)可能非常弱。因此,在被电光采样法(或一些可选的场采样技术)测量之前需要差gmf的放大。根据图6和图7,针对此目的使用光参量放大(opa)。有效opa需要将该处理中涉及的所有三个波、驱动放大处理的泵浦波和被放大的信号波和空闲波的相速度匹配为:kp=ks+ki(以属性“信号”和“空闲”被常规地连接到较高的频率放大波和较低的频率放大波)。如果待由opa放大的波拥有超级倍频程带宽,则此波优选地是最低频“空闲”波,使得以上相位匹配条件可针对其全带宽被合理地充分满足,这是有效放大而不使放大的波失真的必要条件。如果相位匹配条件被满足并且仅泵浦波和待放大的(空闲)波在opa晶体中重叠,则待放大的波将(渐进)经历指数增长。
ai(z)∝ai(0)egz
这里,ai(z)是分子信号(空闲波)在opa晶体中沿z方向传播时分子信号(空闲波)的幅度,g是与泵浦波的幅度成正比的opa增益系数。opa的这种最简单的实施方式的主要缺点是:如果输入信号ai(0)幅度非常低,则该幅度可能不能充分超过在放大器介质中自发出现的辐射的幅度,其中,在放大器介质中自发出现的辐射的幅度控制此本底噪声。如果这样,则放大的信号将受到难以接受的噪声的干扰。由于当前待放大的样本波3确实可能非常弱,后一个问题可通过不仅利用泵浦波并且同时利用输入幅度as(0)的信号波来驱动opa处理而被完美且有效地规避,输入幅度as(0)可容易地比分子信号的幅度强多个量级as(0)>>ai(0)。在这些条件下,假设获得完全相位匹配:
ai(z)∝ai(0)egz
对以上关系进行比较生成在后一种情况下的放大的分子信号的幅度被增强:
g可根据分子波的初始幅度而容易达到103至105那样大。
因此,差分分子信号的放大应该利用泵浦信号驱动的opa来实施。如果用于对分子系统进行照明的中红外波从相同的处理产生,则这是非常明确的。在这种情况下,离开opa系统的泵浦波和信号波可直接针对以上目的被再循环使用。
放大原理在示出图1的设置的另外的细节的图6中并在示出可选实施例的图7中被示出,其中,放大包括在检测装置20中。根据图6,样本波3(与样本相互作用之后的mir脉冲的波束)被发送到光参量放大装置60。放大的样本波3’经由mir-nir合束器17与采用脉冲5组合并被发送到电光采样单元23,电光采样单元23包括电光晶体25、沃拉斯顿棱镜26和平衡检测器27(如图7和图12中所示)。在电光采样单元23中,电光检测在电光晶体25中利用和频产生的(sfg)信号的光放大来进行。sfg信号携带mir信号(分子指纹信号)的真实信息。根据图7,光参量放大装置60包括在电光采样单元23中。
图8示出将图1的干涉设置(实施例i)与色散设置(实施例ii)和光放大(实施例iv)进行组合的光谱设备100的变形。在这种情况下,色散调节元件53置于干涉仪40之前,光参量放大装置60置于第一检测通道21中。
(v)光谱设备的srs实施例
根据本发明的实施例,frs光谱法用于srs测量。图9示出srs测量的一个示例。应注意,本发明的实施方式不限于此特定设置,而是可以可选地具有修改的变形、特别是关于提供泵浦脉冲和斯托克斯脉冲以及参考样本的连续(如示出的)或并行(类似于图1)测量的变形。
根据图9,用于srs测量的光谱设备100包括激光脉冲源10、检测装置20和用于对参考波进行时间压缩的色散设置构件(由样本容器51或参考容器51a的壁材料的设计来实施,未示出)。用于计算样本的光谱响应的计算装置(参见图1)未在图9中示出。示出的光谱设备100的实施例适合于样本波与参考波的时间分离。根据本发明的一个可选实施例,图10的光谱设备100适合于样本波与激励波的干涉分离,例如,根据图1或图8的干涉分离。
激光脉冲源10包括飞秒源11、如yb:yag薄片激光器、产生例如具有30微焦的输出能量、11兆赫兹的重复率、1030纳米的中心波长和50飞秒的脉冲持续时间的驱动脉冲(参见“d.bauer等.“opt.express”20.9,p.9698.,2012;和j.brons等.“opt.lett."41.15,p.3567,2016”;以及h.fattahi等.“opt.express”24.21,pp.24337–24346,2016”)。在产生之后,驱动脉冲被压缩到其傅里叶极限。将脉冲时间限制到大约20飞秒允许以较高的敏感度和信噪比检测分子自由感应衰减(fid)。飞秒转换单元19被设置用于基于驱动脉冲产生具有从450纳米到2000纳米的光谱的cep稳定超连续谱。例如,飞秒转换单元19包括在大宗材料、例如石英中的白光产生。飞秒转换单元19输出的一部分被偏转到第一压缩和延迟单元13a,第一压缩和延迟单元13a包括啁啾镜压缩器和延迟单元,用于提供用于利用检测装置20进行的电光采样的采样脉冲5的序列。
针对受激拉曼散射的电场检测,样本1同时被例如窄频带泵浦脉冲7和宽频带斯托克斯脉冲2的序列(参见图10)辐射,其中,窄频带泵浦脉冲7和宽频带斯托克斯脉冲2的序列均基于来自飞秒转换单元19的输出被产生。通过经由第二压缩和延迟单元13b提供到样本1的宽频带斯托克斯脉冲2表示激励波。窄频带泵浦脉冲7利用声光调制器71(以兆赫兹频率调制)和校准器72来产生,例如,窄频带泵浦脉冲7具有1030的纳米中心波长和1皮秒的脉冲持续时间。在与样本1相互作用之后,调制的探测光包括通过样本1的振动拉曼响应增强的斯托克斯脉冲8和泵浦脉冲。在利用检测装置20进行电光采样之前,增强的斯托克斯脉冲8通过禁止泵浦光的长通滤波器73(例如,1050纳米)。增强的斯托克斯脉冲8表示上述样本波3。为了实施dmf测量,样本1被参考样本替代并且参考波被检测,参考波包括参考样本中激励的增强的斯托克斯脉冲。
用于光电采样的检测装置20如上所述被设计。由第一压缩和延迟单元13a提供的采样脉冲5与样本脉冲、例如增强的斯托克斯脉冲8叠加,采样脉冲5与样本脉冲同时经由电光晶体25(例如,bbo晶体)、700纳米短通滤波器和λ/4片、沃拉斯顿棱镜26被发送到平衡检测器27。
作为一个可选实施例,宽频带泵浦脉冲和窄频带斯托克斯脉冲被产生并且激励波包括窄频带斯托克斯脉冲,其中,探测光包括宽频带泵浦脉冲并且修改的探测光包括通过样本的振动拉曼响应减弱的泵浦脉冲。根据另一可选实施例,图9的光谱设备100可适用于样本波(增强的斯托克斯脉冲8)与参考波的干涉分离,例如,根据图1的干涉分离。特别是,可提供图1的马赫曾德尔干涉仪,在第一干涉仪臂中包括样本1并且在第二干涉仪臂中包括参考样本。泵浦脉冲和斯托克斯脉冲被分裂到第一干涉仪臂中和第二干涉仪臂二者中。
根据图9的斯托克斯脉冲的场检测表示新型飞秒srs方案。本发明的此实施例中的增大的敏感度是由于将斯托克斯脉冲限制到几飞秒(fs)时间窗口中。斯托克斯增益可在从成百上千飞秒开始的皮秒时间帧中被分辨,并且位于激励脉冲的时间窗口之外。由于分子响应随时间以指数衰减,因此无本地测量允许较高的敏感度。
在srs中,在样本中产生窄频带皮秒拉曼泵浦脉冲7和宽频带、几周期的斯托克斯2的同时相互作用宏观偏振。窄频带的泵浦脉冲7提供分辨分子指纹所需的高光谱分辨率。在所述处理期间,锐利的振动增益特征出现在斯托克斯包络顶部并且相当于在时间域中达到成百上千皮秒级的指数衰减。在图10中示出所述处理。斯托克斯脉冲引起样本中的分子的振动相干,所述振动相干随其振动退相时间τvib衰减。相干振动的此有限持续时间导致频率域中的限定的频宽并且诱导的相干振动运动在振动频率处调制宏观偏振(“kukura,p.等.“annu.rev.phys.chem.”58.1,pp.461–488,2007”)。样本的整个指纹范围可通过在时间域中测量增强的斯托克斯脉冲3来检测。
在以上说明书、附图和权利要求中公开的本发明的特征可单独地、以本发明的不同实施例中的本发明的实施例方式的组合形式或子组合形式而具有意义。
- 还没有人留言评论。精彩留言会获得点赞!