一种枇杷叶或含枇杷叶原料的药物的检测方法及鉴别、含量测定方法与流程
本发明涉及一种枇杷叶或含枇杷叶原料的药物的质量检测方法。
背景技术:
枇杷叶为为蔷薇科植物枇杷eriobotryajaponica(thunb.)lindl.的干燥叶。具有清肺止咳,降逆止呕之功效,用于肺热咳嗽,气逆喘急,胃热呕逆,烦热口渴。目前对于枇杷叶(蜜枇杷叶)的质量控制主要是以熊果酸和齐墩果酸为指标。
目前有相关文献报道采用高效液相指纹图谱的方法检测枇杷叶,如:张昌浩,枇杷叶高效液相指纹图谱研究,时珍国医国药2007年第18卷第2期,在色谱柱为kromasilc18(4.6×200mm,5μm),流动相为甲醇-0.1%冰醋酸水溶液(梯度洗脱),检测波长为208nm,柱温为25℃,流速为0.6l/min,条件下测定10批枇杷叶药材,在色谱图中得到10个相应位置稳定的共有指纹峰。林玉霖,等,枇杷叶药材hplc指纹图谱初步研究,中药材,第30卷第10期,应用hplc法建立福建省地道药材枇杷叶的化学指纹图谱。方法:采用hp1100高效液相色谱仪,色谱柱为eclipsexdb-c18(4.6mm×50mm,5μm);流动相为甲醇∶1%醋酸水溶液(90∶10);流速1.0ml/min;柱温为室温,检测波长为215nm。结果:测定福建省的枇杷叶样品12批次,标定出共有峰8个,其指纹图谱相似度均在0.9以上。
蜜批把叶是将枇把叶丝按照蜜炙法(附录ⅱd)炒至不粘手,每100kg枇杷叶丝,用炼蜜20kg,清肺止咳,降逆止呕。用于肺热咳嗽,气逆喘急,胃热呕逆,烦热口渴,化痰止咳,咽喉瘙痒。有文献报道,枇杷叶蜜炙后,其所含具有镇咳活性成分苦杏仁苷的含量变化,因此采用高效液相色谱法测定蜜枇杷叶苦杏仁苷含量(张瑾,等,高效液相色谱法测定蜜枇杷叶苦杏仁苷含量,湖北中医药大学学报,2016年4月第18卷第2期)。
目前报道的枇杷叶药材的hplc指纹图谱,可对中药材质量进行评价,但不能在相同的条件下,既能达到含量测定,又能辨别真伪,以及鉴定不同的炮制品的目的。
技术实现要素:
本发明的目的是提供了一种枇杷叶或含枇杷叶原料的药物的检测方法,本发明还提供了一种鉴别枇杷叶或蜜制枇杷叶的方法以及一种枇杷叶或蜜制枇杷叶以及含有的杷叶或蜜制枇杷叶的药物的含量测定方法。
本发明提供了一种枇杷叶或含枇杷叶原料的药物的检测方法,该方法是采用hplc指纹图谱进行检测,其操作步骤如下:
a、供试品溶液的制备:
取待检测品,加入30-100%甲醇或水,密塞,称定重量,超声或回流提取15min-45min,放冷,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得;
b、参照物溶液的制备:
取绿原酸、新绿原酸、隐绿原酸,制备参照物溶液;
c、分别精密吸取参照物溶液与供试品溶液注入液相色谱仪,以0.4%磷酸-乙腈为流动相进行洗脱,其色谱条件为:
十八烷基硅烷键合硅胶为填充剂;以0.4%磷酸溶液为流动相a,以乙腈为流动相b,按下表中的规定进行梯度洗脱;流速为每分钟0.8-1.2ml;柱温为20-40℃;检测波长为210-360nm,理论板数按绿原酸峰计算应不低于5000,
其中,所述的枇杷叶包括原药材及蜜制枇杷叶。
其中,a步骤所述的提取溶液为50%甲醇;所述的提取方法为超声提取,提取条件为:功率600w,频率40khz;提取时间30min。
其中,b步骤采用50%甲醇制备成绿原酸、新绿原酸、隐绿原酸参照物溶液。
其中,c步骤所述的流程为每分钟1.0ml;柱温为35℃。
本发明还提供了一种鉴别枇杷叶或蜜制枇杷叶的方法,它包括以下步骤:
a、取待检样品;
b、按所述的检测方法检测,所述的检测波长为300nm;
c、分析检测结果。
其中,所述的待检样品为枇杷叶原生药物、蜜制枇杷叶以及含有枇杷叶的配方颗粒、中成药。
其中,检测的指纹图谱中至少含有4个特征峰,相对保留时间为:0.742、0.939、1.000、1.062±5%,待检的药材为枇杷叶。
其中,指纹图谱中还含有2个特征峰,相对保留时间为:0.339±5%,0.454±5%。
本发明还提供了一种枇杷叶或蜜制枇杷叶以及含有的杷叶或蜜制枇杷叶的药物的含量测定方法,它包括以下步骤:
a、取待检样品;
b、按所述的检测方法检测,所述的检测波长为327nm;
c、分析检测结果。
本发明质量检测方法可以进行含量测定和特征图谱,节约检测成本;可以对枇杷叶(药材、饮片、配方颗粒)和蜜枇杷叶(药材、饮片、配方颗粒)进行区别;还可对枇杷叶/蜜枇杷叶生产全过程进行质量控制。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
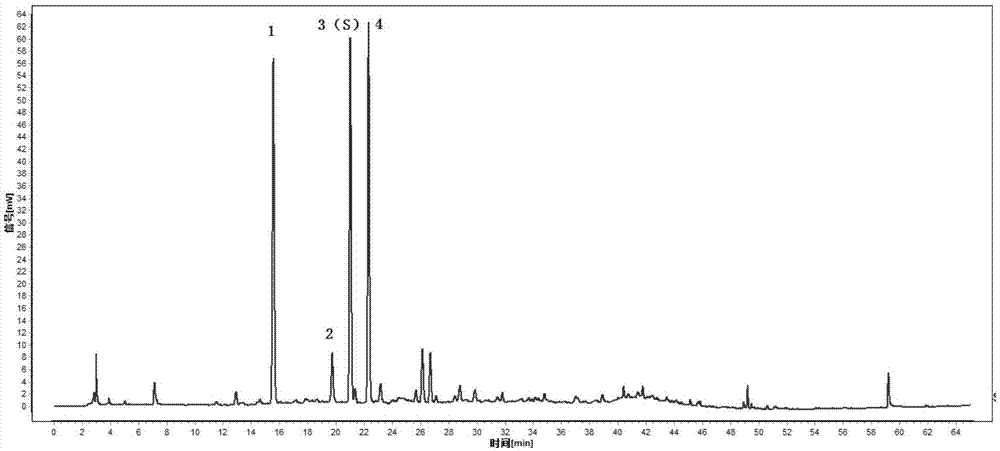
图1对照特征图谱
峰1:新绿原酸,峰3(s):绿原酸,峰4:隐绿原酸
图2对照特征图谱(峰2:5-羟甲基糠醛;峰3:新绿原酸;峰5(s):绿原酸;峰6:隐绿原酸)
图3流动相选择
图4枇杷叶配方颗粒成品3d色谱图
图5枇杷叶配方颗粒各波长比较图
图6柱温考察
图7流速考察
图8提取溶剂考察
图9提取方法考察
图10提取时间考察
图11枇杷叶配方颗粒特征图谱色谱峰指认
图12不同仪器考察
图13枇杷叶配方颗粒色谱柱耐用性考察
图14枇杷叶配方颗粒特征图谱
(注:s1-s3分别代表批次为:sy01803001、sy1803002、sy1804001)
图15枇杷叶药材、饮片及配方颗粒对照特征图谱(峰1:新绿原酸,峰3(s):绿原酸,峰4:隐绿原酸)
图16蜜枇杷叶饮片及配方颗粒特征图谱(峰2:5-羟甲基糠醛;峰3:新绿原酸;峰5(s):绿原酸;峰6:隐绿原酸)
图17枇杷叶配方颗粒生产各工序特征图谱比较
图18蜜枇杷叶配方颗粒生产各工序特征图谱比较
图19绿原酸紫外吸收光谱图
图20不同流速色谱图
图21不同柱温色谱图
图22枇杷叶配方颗粒样品及阴性对照图谱
图23绿原酸标准曲线图
具体实施方式
实施例1本发明hplc特征图谱
【特征图谱】照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒度为5μm);以0.4%磷酸溶液为流动相a,以乙腈为流动相b,按下表中的规定进行梯度洗脱;流速为每分钟1.0ml;柱温为35℃;检测波长为300nm。理论板数按绿原酸峰计算应不低于5000。
参照物溶液的制备取绿原酸、新绿原酸、隐绿原酸对照品适量,加50%甲醇制成每1ml含30μg的溶液,即得。
供试品溶液的制备取本品约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声处理(功率600w,频率40khz)30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,即得。
枇杷叶(药材、饮片、配方颗粒)供试品特征图谱中应呈现4个特征峰,其中1个峰应与参照物峰保留时间相同,与绿原酸参照物相应的峰为s峰,计算各特征峰s峰的相对保留时间,其相对保留时间应在规定值的±5%之内。规定值为:规定值为:0.742(峰1)、0.939(峰2)、1.000(峰s)、1.062(峰4)。(见图1)
蜜枇杷叶(药材、饮片、配方颗粒)供试品特征图谱中应呈现6个特征峰,其中1个峰应与参照物峰保留时间相同,与绿原酸参照物相应的峰为s峰,计算各特征峰s峰的相对保留时间,其相对保留时间应在规定值的±5%之内。规定值为:0.339(峰1)、0.454(峰2)、0.742(峰3)、0.940(峰4)、1.000(峰5)、1.061(峰6)。
。(见图2)
实施例2本发明特征图谱的条件筛选试验
1、实验仪器及材料
高效液相色谱仪:安捷伦1260型高效液相色谱仪、岛津lc-20ad型高效液相色谱仪、waters2695-2996型高效液相色谱仪;
电子天平:me204e/02、ms205du、xp26(梅特勒-托利多仪器有限公司);
超纯水机:细胞型1810a(上海摩勒科学仪器有限公司);
超声波清洗器:kq5200db型(600w,40khz;昆山市超声仪器有限公司);
色谱柱:agilent5hc-c18250×4.6mm5μm、diamonsilc18250×4.6mm5μm、kromasilc185um4.6×250mm。
乙腈、甲醇、磷酸为色谱纯,水为超纯水,其余试剂均为分析纯。
绿原酸(中国食品药品检定研究院,批号:110753-201415,含量以96.2%计)。
枇杷叶配方颗粒1803001、sy1803002、sy1804001。
2、色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒度为5μm);以0.4%磷酸溶液为流动相a,以乙腈为流动相b,按下表中的规定进行梯度洗脱;流速为每分钟1.0ml;柱温为35℃;检测波长为300nm。理论板数按绿原酸峰计算应不低于5000。见表1。
表1拟定的流动相梯度
参照物溶液的制备取绿原酸、新绿原酸、隐绿原酸对照品适量,加50%甲醇制成每1ml含30μg的溶液,即得。
供试品溶液的制备取本品约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声处理(功率600w,频率40khz)30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取参照物溶液和供试品溶液各10μl,注入液相色谱仪,测定,即得。
3色谱条件与系统适用性试验
3.1流动相选择
在以上拟定的实验条件基础上,考察了3种不同流动相的分离效果,分别为:(1)乙腈-0.4%磷酸梯度洗脱;(2)乙腈-水梯度洗脱;(3)甲醇-水梯度洗脱。见图3。
结果表明,乙腈-0.4%磷酸梯度洗脱条件下色谱峰多,且理论板数、分离度、对称性均更好,故将乙腈-0.4%磷酸梯度洗脱作为枇杷叶标准汤剂特征图谱测定方法的流动相。
3.2波长选择
在以上拟定的实验条件基础上,利用二极管阵列检测器对供试品溶液进行全波段扫描,并分别提取供试品溶液在210nm、235nm、254nm、280、300、360nm波长下的色谱图。见图4、5。
结果表明,在检测波长为360nm时色谱峰信息量较大,色谱图基线更平稳,故检测波长应为360nm,但由于考虑到与蜜枇杷叶的区别,故检测波长选择300nm。
3.3柱温考察
在以上拟定的实验条件基础上,分别对柱温为25℃、30℃、35℃、40℃时进行考察。见图6、表2。
表2柱温考察—特征峰相对保留时间比值
结果表明,在柱温为35℃时,色谱图峰形最为对称,分离度最好。故柱温确定为35℃。
3.4流速考察
在以上拟定的实验条件基础上,分别对流速为0.8ml/min、1.0ml/min、1.2ml/min时进行了考察。见图7,表3。
表3流速考察—特征峰相对保留时间比值
结果表明,流速分别为0.8ml/min、1.0ml/min、1.2ml/min时,各特征峰的相对保留时间rsd为%,在流速为1.0ml/min时,色谱图峰形较好,分离度适中。故流速确定为1.0ml/min。
综上所述,枇杷叶配方颗粒特征图谱色谱条件与系统适应性试验确定为:以十八烷基硅烷键合硅胶为填充剂(柱长为250mm,内径为4.6mm,粒度为5μm);以0.4%磷酸溶液为流动相a,以乙腈为流动相b,按下表中的规定进行梯度洗脱;流速为每分钟1.0ml;柱温为35℃;检测波长为300nm。理论板数按绿原酸峰计算应不低于5000。见表4。
表4枇杷叶配方颗粒特征图谱最终流动相梯度
4供试品溶液的制备考察
4.1提取溶剂考察
取本品(批号:sy1803001)约0.2g,精密称定,置具塞锥形瓶中,分别对供试品提取溶剂为水、不同浓度甲醇、乙醇时进行考察,密塞,称定重量,超声处理(功率600w,频率40khz)30分钟,放冷,再称定重量,用提取溶剂补足减失的重量,摇匀,滤过,取续滤液,即得。见图8。
结果表明,在流动相为水和30%-70%甲醇时,所得的色谱图接近,色谱峰信息量大,分离度好。考虑到绿原酸含量测定,故选择50%甲醇作为提取溶剂。
4.2提取方法考察
取本品(批号:sy1803001)约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,分别对供试品提取方法为回流、超声时进行考察,提取时间30min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。见图9。
结果表明,对供试品分别进行超声提取与回流提取时效果一致。因超声提取操作更为简便,故供试品提取方法确定为超声提取。
4.3提取时间考察
取本品(批号:sy1803001)约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声处理(功率600w,频率40khz),分别对供试品提取时间为15分钟、30分钟、45分钟时进行考察,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。见图10。
结果表明,不同提取时间特征图谱差异不大,考虑到含量测定确定供试品提取时间为30分钟。
综上所述,枇杷叶标准汤剂特征图谱供试品溶液的制备方法确定为:取本品约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声处理(功率600w,频率40khz)30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
5方法学考察
5.1色谱峰指认
供试品溶液的制备:按以上拟定的实验条件,制备枇杷叶配方颗粒供试品溶液。
对照品参照物溶液的制备:取绿原酸对照品适量,加50%甲醇分别制成每1ml含30μg的溶液。
阴性对照溶液的制备:按以上拟定的实验条件,制备缺枇杷叶标准汤剂阴性对照溶液。
对枇杷叶标准汤剂特征图谱峰进行定位。见图11。
结果表明,峰1为新绿原酸,峰3为绿原酸,峰4为隐绿原酸。在以下方法学考察中,对样品中的4个峰进行考察。
5.2精密度试验
取本品(批号:sy1803001)约0.2g,按供试品制备方法制备样品,连续进样6次,每次10μl,计算绿原酸的保留时间及峰面积。见表5。
表5精密度考察
结果表明,绿原酸峰保留时间的rsd值为0.10%,峰面积的rsd为0.07%,该仪器精密度良好。
5.3重复性考察
精密称取枇杷叶配方颗粒(批号:sy1803001)6份,按拟定实验方法进行制备及测定。见表6、7。
表6重复性考察—特征峰相对保留时间比值
表7重复性考察—特征峰相对峰面积比值
结果表明,各特征峰相对保留时间的rsd在0.00%~0.04%,各特征峰相对峰面积的rsd在0.21%~0.47%。
5.4中间精密度考察
5.4.1不同仪器考察
在以上拟定的实验条件基础上,分别精密称取枇杷叶配方颗粒(批号:sy1803001),制备供试品溶液,分别在安捷伦1260、waters2695-2996、岛津lc-20ad高效液相色谱仪上进行测定(色谱柱均为agilent5hc-c18(2)250×4.6mm)。见图12、表8、表9。
表8不同仪器考察—特征峰相对保留时间比值
表9不同仪器考察—特征峰相对峰面积比值
结果表明,用上述3种仪器对供试品进行检测时,各特征峰相对保留时间的rsd在0.00%~0.84%;各特征峰相对峰面积的rsd在0.00%~1.55%。
5.4.2不同人员和时间考察
在以上拟定的实验条件基础上,由不同人员(a、b)在不同时间(t1、t2)分别精密称取枇杷叶配方颗粒(批号:sy1803001)各两份,制备供试品,进行测定。见表10、11。
表10不同人员与时间考察—特征峰相对保留时间比值
表11不同人员与时间考察—特征峰相对峰面积比值
结果表明,不同样品制备人员和不同样品制备时间条件下,各特征峰相对保留时间的rsd在0.00%~0.64%;各特征峰相对峰面积的rsd在0.00%~1.60%。
5.5耐用性考察
5.5.1色谱柱耐用性考察
在以上拟定的实验条件基础上,分别对色谱柱为agilent5hc-c18250×4.6mm5μm、diamonsilc18250×4.6mm5μm、kromasilc18250×4.6mm5μm。进行考察。见图13,表12、13。
表12色谱柱耐用性考察—特征峰相对保留时间
表13色谱柱耐用性考察—特征峰相对峰面积比值
结果表明,用上述3种色谱柱对样品进行检测,特征峰相对保留时间的rsd在0.00~0.48%峰相对峰面积的rsd在0.00%~5.81%。
5.5.2稳定性考察
在以上拟定的实验条件基础上,取同一供试品溶液,分别于0h,2h,4h,8h,12h,24h,36h时测定。见表14、15。
表14稳定性考察—特征峰保留时间
表15稳定性考察—特征峰峰面积比值
结果表明,其相对应的特征峰保留时间的rsd在0.00%~0.45%,特征峰峰面积的rsd在0.00%~0.62%。
综上所述,各特征峰相对保留时间的rsd在以上各项考察中均符合要求,该方法良好。将上述4个特征峰纳入后续考察。
6特征峰的确定及对照图谱的建立
采用拟定的方法对本品3批样品进行特征图谱的测定,计算相对保留时间、相对峰面积和相对峰高。见图14,表16、17。
表163批枇杷叶配方颗粒相对保留时间
表173批枇杷叶配方颗粒相对峰面积
根据相对保留时间稳定及各批次样品均能检出且峰相对较高的原则,共选择了4个重复性较好的峰作为特征峰。结果表明,当峰3作为s峰时,3批次枇杷叶配方颗粒特征峰相对峰面积rsd在0%~15.87%,差异较大,故不列入正文。3批次枇杷叶配方颗粒中间体4个特征峰相对保留时间rsd在0%~0.21%,说明该方法重复性好。最终规定:供试品特征图谱中应呈现4个特征峰,其中与绿原酸参照物相应的峰为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的±5%之内。规定值为:0.742(峰1)、0.939(峰2)、1.000(峰s)、1.062(峰4)。
采用中药色谱指纹图谱相似度评价系统(2012版)对3批标枇杷叶配方颗粒中间体进行合成,建立了枇杷叶配方颗粒中间体特征图谱的对照图谱。见图15-图18。
实施例3本发明含量测定方法
1仪器与试药
高效液相色谱仪:安捷伦1260型高效液相色谱仪、岛津lc-20ad型高效液相色谱仪、waters2695-2996型高效液相色谱仪;
电子天平:me204e/02、ms205du、xp26(梅特勒-托利多仪器有限公司);
超纯水机:细胞型1810a(上海摩勒科学仪器有限公司);
超声波清洗器:kq5200db型(600w,40khz;昆山市超声仪器有限公司);
色谱柱:agilent5tc-c18(2)250×4.6mm、phenomenexluna5uc18(2)100a250×4.60mm5micron、kromasilc185um4.6×250mm。
绿原酸(中国食品药品检定研究院,批号:110753-201415,含量以96.2%计)。
乙腈、磷酸为色谱纯,水为超纯水,其余试剂均为分析纯。
枇杷叶配方颗粒sy1803001、sy1803002、sy1804001。
2溶液的制备
2.1对照品溶液制备
取绿原酸对照品适量,精密称定,加50%甲醇制成每1ml含30μg的溶液,即得。
2.2供试品溶液制备
取本品细粉约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声处理(功率600w,频率40khz)30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.3色谱条件选择与系统适用性考察
2.3.1检测波长确定
对绿原酸对照品溶液进行全波长光谱采集,通过对光谱图的分析,并且参考《中国药典》2015年版一部金银花【含量测定】项下“绿原酸”的测定方法中的检测波长,确定枇杷叶配方颗粒中绿原酸的含量测定的最佳检测波长为327nm,见图19。
2.3.2流动相选择
根据枇杷叶标准汤剂中绿原酸含量测定流动相筛选结果,确定流动相为乙腈(b)-0.4%磷酸溶液(a)梯度洗脱,见表18。
表18流动相洗脱梯度
2.3.3流速考察
在乙腈-0.4%磷酸梯度洗脱为流动相,检测波长327nm条件下,分别考察在0.8ml/min、1.0ml/min、1.2ml/min流速下,以绿原酸色谱峰的分离度、理论塔板数、拖尾因子等作为评价指标。结果见图20、表19。
表19不同流速分析结果
结果表明,三种流速均能对绿原酸进行分离和检测,随着流速增加,理论塔板数降低,分离度和拖尾因子变化不大,三者无显著差异,最终确定流速为1.0ml/min。
2.3.4柱温考察
在乙腈-0.4%磷酸溶液梯度为流动相,检测波长327nm,流速1ml/min条件下。考察供试品溶液在25℃、30℃、35℃、40℃柱温下分析情况,以绿原酸分离度、理论塔板数、拖尾因子等作为评价指标。见图21、表20。
表20不同柱温的分析结果
结果表明,在35℃柱温下,绿原酸色谱峰的分离度显著优于其他柱温,故柱温选择35℃。
2.3.5色谱条件和系统适应性试验结果
以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.4%磷酸溶液梯度洗脱;检测波长为327nm,流速为1.0ml/min,柱温35℃,理论板数按绿原酸峰计算应不低于5000。
2.4供试品溶液制备方法考察
2.4.1提取方式考察
取供试品(批号:sy1803001)4份各约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,2份超声提取、2份回流提取,提取时间均为30min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,即得。各取10μl注入色谱仪,分析计算不同提取方式下绿原酸含量,结果见表21。
表21不同提取方式分析结果
结果表明,回流提取和超声提取所得绿原酸含量分别为0.55%和0.56%,二者无显著差异,以操作简捷的超声提取为提取方式。
2.4.2提取溶剂考察
取供试品(批号:sy1803001)12份各约0.2g,精密称定,分别加甲醇、70%甲醇、50%甲醇、30%甲醇、乙醇、水25ml,超声提取30min,放冷,以相应溶剂补足减失重量,滤过,取续滤液10μl注入色谱仪,分析计算不同溶剂提取绿原酸含量。结果见表22。
表22不同提取溶剂的分析结果
结果表明,50%和70%甲醇的提取效率最高,结合标准汤剂方法,选择50%甲醇作为其提取溶剂。
2.4.3提取时间考察
取本品(批号:sy1803001)6份各约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,分别超声提取15min、30min、45min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过取续滤液,即得。各取10μl注入色谱仪,分析计算不同提取方式下绿原酸含量,结果见表23。
表23不同提取时间的分析结果
结果表明,提取时间30分钟和45分钟对绿原酸的含量无明显差异,故选择提取时间为30min。
2.4.4取样量考察
取本品(批号:sy1803001)6份,分别取0.1、0.2、0.5g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声提取30min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过取续滤液,即得。各取10μl注入色谱仪,分析计算不同提取方式下绿原酸含量,结果见表24。
表24不同取样量的分析结果
结果表明,供试品取样量以0.2g峰面积适中,且对绿原酸含量测定结果无影响。
综上所述,供试品的制备方法为,取本品细粉约0.2g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定重量,超声处理(功率600w,频率40khz)30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过取续滤液,即得。
2.5方法学考察
2.5.1专属性实验
按拟定方法制备供试品溶液及阴性对照溶液,进行检测。结果见图22。
结果表明,阴性溶液色谱图对待测峰的测定无干扰,表明该方法专属性好。
2.5.2精密度考察
取枇杷叶配方颗粒样品溶液连续进样6次,记录绿原酸的峰面积,计算rsd值,结果见表25。
表25精密度考察结果
结果表明,精密度考察中绿原酸的峰面积rsd值为0.08%,本方法的进样精密度良好。
2.5.3线性关系
取绿原酸对照品适量,置于10ml容量瓶内,用50%甲醇配置成1240.80μg/ml对照品母液。精密量取上述对照品溶液`1.0ml至5ml容量瓶内,用50%甲醇稀释至刻度,得248.16μg/ml溶液。以此类推,分别稀释得到49.62、9.93、1.99、0.40μg/ml。分别取上述溶液10μl注入液相色谱仪,分析得到峰面积,以进样量(x,μg)为横坐标,峰面积(y)为纵坐标绘制响应曲线,结果见表26、图23。
表26绿原酸标准曲线分析结果
结果表明:绿原酸标准曲线为y=2.6910x+137.1895,r=0.9996。表明进样量在3.97~12408.00μg范围内,线性关系良好。
2.5.4稳定性实验
取同一供试品溶液(批号:sy1803001e),分别在0,2,4,8,16,24,32h测定绿原酸色谱峰面积,结果见表27。
表27绿原酸稳定性实验结果
结果表明,在本实验条件下,绿原酸的峰面积rsd值为0.07%,供试品溶液在32小时内稳定性良好。
2.5.5重复性
取同一供试品(批号:sy1803001)0.2g,精密称定6份,由同一操作人员按照拟定的方法制成供试品溶液,计算6份供试品的含量,结果见表28。
表28重复性实验结果
结果表明,绿原酸的含量rsd值为2.38%,本方法重复性良好。
2.5.6中间精密度
2.5.6.1不同仪器考察
在以上拟定的实验条件基础上,分别精密称取枇杷叶配方颗粒(批号:sy1803001),制备供试品溶液,分别在安捷伦1260、waters2695-2996、岛津lc-20ad高效液相色谱仪上进行测定(色谱柱均为agilent5hc-c18(2)250×4.6mm)。
表29不同仪器考察结果
结果表明,用上述3种仪器对供试品进行检测时,绿原酸含量的rsd在8.45%。
2.5.6.2不同人员和时间考察
取同一供试品(批号:sy1803001)由不同人员(a、b)在不同时间(ⅰ、ⅱ)制备供试品溶液分别在仪器a、b进行分析,计算供试品中绿原酸的含量,结果见表30。
表30中间精密度实验结果
结果表明,绿原酸的含量测定结果rsd值为7.08%,本方法中间精密度良好。
2.5.7加样回收率
取已知含量的供试品(批号:sy1803001,绿原酸的含量0.56%)约0.1g,共6份,精密称定,分别精密加入一定量的绿原酸对照品(纯度:96.2%),按拟定的方法进行供试品溶液的制备并测定,计算回收率,结果见表31。计算公式如下:
表31加样回收实验结果
结果表明,回收率结果的rsd值为1.09%,本方法准确度良好。
2.5.8耐用性考察
采用不同品牌c18色谱柱(agilent5hc-c18250×4.6mm5μm、diamonsilc18250×4.6mm5μm、kromasilc18250×4.6mm5μm)在同一仪器对同一供试品(批号:sy1803001)进行检测,结果见表32。
表32耐用性考察结果
结果表明,不同色谱柱的分析色谱指标良好,3个测量结果的rsd值为0.83%,本方法耐用性良好。
2.6样品含量测定验证
以3批枇杷叶配方颗粒为供试品,按拟定的方法制备供试品溶液并测定,记录峰面积,计算绿原酸的含量,结果见表33。
表333批枇杷叶配方颗粒含量测定结果
结果表明,枇杷叶标准汤剂绿原酸的平均含量为0.39%,标准偏差为0.16%。本品含量测定平均值的70%-130%限量为含绿原酸(c16h18o9)0.27%-0.51%。,含量测定均值加减3倍sd的限量范围为含绿原酸(c16h18o9)0.23%-0.55%。
- 还没有人留言评论。精彩留言会获得点赞!