基于特征肽段定量大鼠CYP2E1酶的检测方法及检测试剂盒与流程
本发明涉及生物检测和蛋白质技术领域,具体而言,涉及基于特征肽段定量大鼠cyp2e1酶的检测方法及检测试剂盒。
背景技术
cyp450酶是药物ⅰ相代谢的主要酶类,其含量是影响活性的重要因素之一。现有的药物代谢酶的定量一般选用免疫方法,如westernblot。但cyp450酶多具有同源性现象,难以找到专一性抗体。故有必要建立更准确、灵敏的定量方法。
不同的研究机构对代谢酶的定量方法不全相同,主要包括定量rt-pcr、半定量rt-pcr从转录水平对mrna定量分析,或以免疫组织化学技术(ihc)、免疫印迹法(westernblot)从翻译水平对相应蛋白质表达水平定量。但是由于mrna的翻译水平调控以及蛋白质的翻译后转移和修饰受多种因素的影响,因此测得的mrna的量不能准确代表药物代谢酶的表达水平。同时,由于外排蛋白具有高度的序列同源性,现有免疫印迹法缺乏专属性,伴有一定的抗原-抗体交叉反应,有可能形成非特异性的抗原抗体复合物,其掺杂在待测物与抗体形成的复合物间,从而导致错误结果的产生。探针底物法是测定酶的活性(从功能上分析)的方法,目前在评价细胞色素p450酶活性时采用最多的是“cocktail”探针底物法,该方法选用主要经该酶代谢的药物作用底物,通过测试底物的减少量或代谢产物的生成量测试酶的活性。通过这种方法涉及到大量样本的采集和测试,时效性差。难以重复。同时,同一个探针底物可被多个酶催化,同一个酶可催化众多化合物,因此,探针底物法的交叉反应使得方法准确性较差。
cyp2e1作为cyp450酶家族重要成员之一,可活化肝脏毒物和前致癌物(如亚硝胺、异烟肼、苯等),引起细胞毒性、癌变甚至死亡。cyp2e1酶活性表达量被认为是机体对某些药物、化学毒物或致癌物敏感程度的重要决定因素。已有少量国内外文献报道使用质谱技术绝对定量cyp450酶,但关于对cyp2e1酶的定量研究较少,现有报道的方法选出3-5条目标蛋白的肽段,将特征肽段串联,通过质粒转化、蛋白表达与纯化,用纯化后的蛋白作为标准品定量。但是该方法在筛选肽段时未用实际样本进行验证,仅借用软件筛选出特异性肽段,是否满足唯一性并能在仪器中有足够高的响应是在前期筛选无法确认的,同时,现有方法开发后未进行方法验证,仅用标曲完成样本定量,定量下限较高,灵敏度不够。因此,迫切需要找到代谢酶新的定量方法,准确定量cyp450酶表达量。
技术实现要素:
本发明的第一目的在于提供基于特征肽段定量检测大鼠cyp2e1酶的检测方法,该检测方法能较为精确地测定样本中大鼠cyp2e1酶的含量。
本发明的第二目的在于提供一种利用特征肽段定量检测大鼠cyp2e1酶的检测试剂盒,该检测试剂盒,能方便快捷的实现对cyp2e1酶的定量检测。
为了实现本发明的上述目的,采用以下技术方案:
基于特征肽段定量检测大鼠cyp2e1酶的检测方法,检测方法包括以下步骤:
合成根据设计的第一定量肽段、第二定量肽段、第一标记肽段和第二标记肽段并制备梯度浓度的第一定量肽段工作液、第二定量肽段工作液、第一标记肽段工作液和第二标记肽段工作液;
将第一定量肽段工作液和第二定量肽段工作液加入血清,分别配制成梯度浓度标准血清样本,分别加入第一标记肽段工作液和第二标记肽段工作液作为内标,进行液相色谱-质谱分析,得到第一标准曲线和第二标准曲线;
将待测样本经变性、还原化、烷基化后酶解,得到酶解片段,分成两份为第一检测样本和第二检测样本,第一检测样本与第一标记肽段工作液混合得到第一待检样本,第二检测样本与第二标记肽段工作液混合得到第二待检样本,第一待检样本和第二待检样本分别进行液相色谱-质谱分析,得到第一检测数据和第二检测数据;
将第一检测数据基于第一标准曲线计算得到第一含量值,将第二检测数据基于第二标准曲线计算得到第二含量值,综合第一含量值和第二含量值,得到样本中大鼠cyp2e1酶的含量。
一种利用特征肽段定量检测cyp2e1酶的检测试剂盒,检测试剂盒包括第一定量肽段和第二定量肽段;第一定量肽段和第二定量肽段的氨基酸序列如seqidno.1-2所示;第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk;以及二硫苏糖醇溶液,反应后加入碘乙酰胺溶液和胰蛋白酶液。
本发明的有益效果为:本发明提供的利用特征肽段定量检测cyp2e1酶的检测方法,通过特异性的特征肽段,先建立标准曲线,然后通过使用标记肽段建立标准曲线,通过检测得到检测数据,然后通过标准曲线计算,得到样本中cyp2e1酶的精确含量,通过两种不同的肽段,可以起到相互验证的目的;而检测试剂盒能方便实施对cyp2e1酶的检测。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例提供的不同样本的两种肽段表达量检测图;
图2为本发明实验例提供的第一定量肽段空白基质色谱图;
图3为本发明实验例提供的第二定量肽段空白基质色谱图;
图4为本发明实验例提供的第一定量肽段标准血清样本色谱图;
图5为本发明实验例提供的第二定量肽段标准血清样本色谱图;
图6为本发明实验例提供的第一定量肽段微粒体样本色谱图;
图7为本发明实验例提供的第二定量肽段微粒体样本色谱图;
图8为本发明实验例提供的第一定量肽段第一批次线性关系图;
图9为本发明实验例提供的第二定量肽段第一批次线性关系图;
图10为本发明实验例提供的第一定量肽段第二批次线性关系图;
图11为本发明实验例提供的第二定量肽段第二批次线性关系图;
图12为本发明实验例提供的第一定量肽段第三批次线性关系图;
图13为本发明实验例提供的第二定量肽段第三批次线性关系图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的基于特征肽段定量检测cyp2e1酶的检测方法及检测试剂盒进行具体说明。
基于特征肽段定量检测cyp2e1酶的检测方法,检测方法包括以下步骤:
合成根据设计的第一定量肽段、第二定量肽段、第一标记肽段和第二标记肽段并制备梯度浓度的第一定量肽段工作液、第二定量肽段工作液、第一标记肽段工作液和第二标记肽段工作液;
将第一定量肽段工作液和第二定量肽段工作液加入血清,分别配制成梯度浓度标准血清样本,分别加入第一标记肽段工作液和第二标记肽段工作液作为内标,,进行液相色谱-质谱分析,得到第一标准曲线和第二标准曲线;
将待测样本经变性、还原化、烷基化后酶解,得到酶解片段,分成两份为第一检测样本和第二检测样本,第一检测样本与第一标记肽段工作液混合得到第一待检样本,第二检测样本与第二标记肽段工作液混合得到第二待检样本,第一待检样本和第二待检样本分别进行液相色谱-质谱分析,得到第一检测数据和第二检测数据
将第一检测数据利用第一标准曲线计算得到第一含量值,将第二检测数据利用第二标准曲线计算得到第二含量值,根据第一含量值和第二含量值计算,得到样本中cyp2e1酶的含量。
将定量肽段设置成不同梯度浓度样品,进行液相色谱-质谱分析检测,得到浓度与含量关系的标准曲线,将样本中加入标记肽段混合后,测定得到待检样本的数据,代入标准曲线中,计算得到样本中大鼠cyp2e1酶的含量。
实验中将大鼠解剖,每只大鼠获肝微粒体与肝匀浆两种类型样本,将待测样本经变性、还原化、烷基化后,进行酶解,得到酶解片段,分成两份,分别加入第一标记肽段工作液和第二标记肽段工作液进行液相色谱-质谱分析,得到第一检测数据和第二检测数据。
进一步地,在本发明较佳的实施例中,第一定量肽段和第二定量肽段的氨基酸序列如seqidno.1-2所示;第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk。
第一定量肽段seqidno.1的氨基酸序列:finlvpsnlpheatr;第二定量肽段seqidno.2的氨基酸序列:giifnngptwk。
进一步地,在本发明较佳的实施例中,液相色谱-质谱分析中,液相色谱的条件为acquity
0min,a:95%、b:5%;
1min,a:95%、b:5%;
5min,a:88%、b:5%;
10min,a:80%、b:5%;
11min,a:80%、b:20%;
12min,a:40%、b:60%;
14min,a:10%、b:90%;
15min,a:10%、b:90%;
16.5min,a:95%、b:5%。
进一步地,在本发明较佳的实施例中,酶解待检样本前处理包括:将待检样本变性处理,加入二硫苏糖醇溶液,反应后加入碘乙酰胺溶液避光震荡,加入胰蛋白酶液水解,加入终止液,离心取上清液得到酶解片段。
进一步地,在本发明较佳的实施例中,变性的温度为94-97℃,时间为100-150s。
将样本进行变性处理,破坏蛋白的高级结构,有利于后期的胰蛋白酶对样本进行水解。如果蛋白质的高级结构没有破坏,有可能导致胰蛋白酶无法将蛋白质完全水解,从而容易导致检测的片段无法被识别,导致检测结果不准确。
进一步地,在本发明较佳的实施例中,二硫苏糖醇溶液的浓度为28-33mm,二硫苏糖醇溶液由50mm的nh4hco3缓冲液稀释得到。
进一步地,在本发明较佳的实施例中,碘乙酰胺溶液的浓度为75-82mm。
进一步地,在本发明较佳的实施例中,加入胰蛋白液前还包括加入50mm的nh4hco3缓冲液漩涡混合。
进一步地,在本发明较佳的实施例中,胰蛋白酶液的浓度为0.08-0.14μg/μl。
一种利用特征肽段定量检测cyp2e1酶的检测试剂盒,检测试剂盒包括第一定量肽段和第二定量肽段,第一定量肽段和第二定量肽段的氨基酸序列如seqidno.1-2所示;第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk;以及dtt溶液、iaa溶液和胰蛋白酶液。
使用二硫苏糖醇(dtt)溶液以及碘乙酰胺(iaa)溶液等试剂有利于提高检测的准确性。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供利用特征肽段定量检测cyp2e1酶的检测方法,包括以下步骤:根据预设计的定量肽段和标记肽段进行人工合成;定量肽段包括第一定量肽段和第二定量肽段,第一定量肽段和第二定量肽段的氨基酸序列如seqidno.1-2所示;第一定量肽段seqidno.1的氨基酸序列:finlvpsnlpheatr;第二定量肽段seqidno.2的氨基酸序列:giifnngptwk。
标记肽段包括第一标记肽段和第二标记肽段,第一标记肽段和第二标记肽段聚采用同位素标记,第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk。并配制成第一定量肽段工作液、第二定量肽段工作液、第一标记肽段工作液和第二标记肽段工作液。
将第一定量肽段工作液、第二定量肽段工作液配制成40、80、200、400、800、1600、3200、12800ng/ml的系列浓度梯度的定量工作液;然后取上述系列浓度梯度的定量工作液各20μl,加入180μl大鼠血清作为替代基质,得到浓度分别为2、4、10、20、40、80、160、320ng/ml的系列浓度梯度的第一定量肽段标准血清样本溶液、第二定量肽段标准血清样本溶液,分别加入第一标记肽段工作液和第二标记肽段工作液作为内标,进行液相色谱-质谱分析;液相色谱-质谱分析中,液相色谱的条件为acquity
0min,a:95%、b:5%;
1min,a:95%、b:5%;
5min,a:88%、b:5%;
10min,a:80%、b:5%;
11min,a:80%、b:20%;
12min,a:40%、b:60%;
14min,a:10%、b:90%;
15min,a:10%、b:90%;
16.5min,a:95%、b:5%。
根据第一定量肽段标准血清样本溶液相应的样本的峰面积与浓度的关系得到第一标准曲线,根据第二定量肽段标准血清样本溶液相应的样本的峰面积与浓度的关系得到第二标准曲线。
取总蛋白浓度为2μg/μl的待检样本20μl,在94℃的温度进行100s的变性处理,然后加入28mm的二硫苏糖醇(dtt)溶液10μl(原浓度300mm,用50mm的nh4hco3缓冲液稀释得到),漩涡混匀,于56℃条件下反应20min;冷却后,加入新配制浓度为75mm的碘乙酰胺(iaa)溶液10μl(原浓度400mm,用50mm的nh4hco3缓冲液稀释得到);涡旋混匀,37℃下恒温避光震荡20min,加入50mm的nh4hco3缓冲液处理,涡旋反应,加入浓度为0.08μg/μl的胰蛋白酶溶液5μl,总反应体系60μl,在37℃条件下酶解15-20h,加入40μl的终止液(50%的乙腈含有0.1%的脂肪酸)终止反应,漩涡混匀,离心取上清液得到酶解片段样本。
将得到的酶解片段样本分成两份为第一检测样本和第二检测样本,第一检测样本与第一标记肽段工作液混合得到第一待检样本,第二检测样本与第二标记肽段工作液混合得到第二待检样本,第一待检样本和第二待检样本分别进行液相色谱-质谱分析,得到第一检测数据和第二检测数据
将第一检测数据利用第一标准曲线计算得到第一含量值,将第二检测数据利用第二标准曲线计算得到第二含量值,根据第一含量值和第二含量值计算,得到样本中cyp2e1酶的含量。
实施例2
本实施例提供利用特征肽段定量检测cyp2e1酶的检测方法,包括以下步骤:根据预设计的定量肽段和标记肽段进行人工合成;定量肽段包括第一定量肽段和第二定量肽段,第一定量肽段seqidno.1的氨基酸序列:finlvpsnlpheatr;第二定量肽段seqidno.2的氨基酸序列:giifnngptwk。
标记肽段包括第一标记肽段和第二标记肽段,第一标记肽段和第二标记肽段均采用同位素标记,第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk。并配制成第一定量肽段工作液、第二定量肽段工作液、第一标记肽段工作液和第二标记肽段工作液。
将第一定量肽段工作液、第二定量肽段工作液配制成40、80、200、400、800、1600、3200、12800ng/ml的系列浓度梯度的定量工作液;然后取上述系列浓度梯度的定量工作液各20μl,加入180μl大鼠血清作为替代基质,得到浓度分别为2、4、10、20、40、80、160、320ng/ml的系列浓度梯度的第一定量肽段标准血清样本溶液、第二定量肽段标准血清样本溶液。分别加入第一标记肽段工作液和第二标记肽段工作液作为内标,进行液相色谱-质谱分析;液相色谱-质谱分析中,液相色谱的条件为acquity
0min,a:95%、b:5%;
1min,a:95%、b:5%;
5min,a:88%、b:5%;
10min,a:80%、b:5%;
11min,a:80%、b:20%;
12min,a:40%、b:60%;
14min,a:10%、b:90%;
15min,a:10%、b:90%;
16.5min,a:95%、b:5%。
根据第一定量肽段标准血清样本溶液相应的样本的峰面积与浓度的关系得到第一标准曲线,根据第二定量肽段标准血清样本溶液相应的样本的峰面积与浓度的关系得到第二标准曲线。
取总蛋白浓度为2μg/μl的待检样本20μl,在97℃的温度进行150s的变性处理,然后加入33mm的dtt溶液10μl(原浓度300mm,用50mm的nh4hco3缓冲液稀释得到),漩涡混匀,于56℃条件下反应20min;冷却后,加入新配制浓度为82mm的iaa溶液10μl(原浓度400mm,用50mm的nh4hco3缓冲液稀释得到);涡旋混匀,37℃下恒温避光震荡20min,加入50mm的nh4hco3缓冲液处理,涡旋反应,加入浓度为0.14μg/μl的胰蛋白酶溶液5μl,总反应体系60μl,在37℃条件下酶解15-20h,加入40μl的终止液(50%的乙腈含有0.1%的脂肪酸)终止反应,漩涡混匀,离心取上清液得到酶解片段。
将得到的酶解片段分成两份为第一检测样本和第二检测样本,第一检测样本与第一标记肽段工作液混合得到第一待检样本,第二检测样本与第二标记肽段工作液混合得到第二待检样本,第一待检样本和第二待检样本分别进行液相色谱-质谱分析,得到第一检测数据和第二检测数据
将第一检测数据利用第一标准曲线计算得到第一含量值,将第二检测数据利用第二标准曲线计算得到第二含量值,根据第一含量值和第二含量值计算,得到样本中cyp2e1酶的含量。
实施例3
本实施例提供基于特征肽段定量检测大鼠cyp2e1酶的检测方法,包括以下步骤:根据预设计的定量肽段和标记肽段进行人工合成;定量肽段包括第一定量肽段和第二定量肽段,第一定量肽段seqidno.1的氨基酸序列:finlvpsnlpheatr;第二定量肽段seqidno.2的氨基酸序列:giifnngptwk。标记肽段包括第一标记肽段和第二标记肽段,第一标记肽段和第二标记肽段均采用同位素标记,第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk。并配制成第一定量肽段工作液、第二定量肽段工作液、第一标记肽段工作液和第二标记肽段工作液。
将第一定量肽段工作液、第二定量肽段工作液配制成40、80、200、400、800、1600、3200、12800ng/ml的系列浓度梯度的定量工作液;然后取上述系列浓度梯度的定量工作液各20ul,加入180μl大鼠血清作为替代基质,得到浓度分别为2、4、10、20、40、80、160、320ng/ml的系列浓度梯度的第一定量肽段标准血清样本溶液、第二定量肽段标准血清样本溶液。分别加入第一标记肽段工作液和第二标记肽段工作液作为内标,进行液相色谱-质谱分析;液相色谱-质谱分析中,液相色谱的条件为acquity
0min,a:95%、b:5%;
1min,a:95%、b:5%;
5min,a:88%、b:5%;
10min,a:80%、b:5%;
11min,a:80%、b:20%;
12min,a:40%、b:60%;
14min,a:10%、b:90%;
15min,a:10%、b:90%;
16.5min,a:95%、b:5%。
根据第一定量肽段标准血清样本溶液相应的样本的峰面积与浓度的关系得到第一标准曲线,根据第二定量肽段标准血清样本溶液相应的样本的峰面积与浓度的关系得到第二标准曲线。
取浓度为2μg/μl的待检样本20μl,在95℃的温度进行120s的变性处理,然后加入30mm的dtt溶液10μl(原浓度300mm,用50mm的nh4hco3缓冲液稀释得到),漩涡混匀,于56℃条件下反应20min;冷却后,加入新配制浓度为80mm的iaa溶液10μl(原浓度400mm,用50mm的nh4hco3缓冲液稀释得到);涡旋混匀,37℃下恒温避光震荡20min,加入50mm的nh4hco3缓冲液处理,涡旋反应,加入浓度为0.10μg/μl的胰蛋白酶溶液5μl,总反应体系60μl,在37℃条件下酶解15-20h,加入40μl的终止液(50%的乙腈含有0.1%的脂肪酸)终止反应,漩涡混匀,离心取上清液得到酶解片段。
将得到的酶解片段分成两份为第一检测样本和第二检测样本,第一检测样本与第一标记肽段工作液混合得到第一待检样本,第二检测样本与第二标记肽段工作液混合得到第二待检样本,第一待检样本和第二待检样本分别进行液相色谱-质谱分析,得到第一检测数据和第二检测数据
将第一检测数据利用第一标准曲线计算得到第一含量值,将第二检测数据利用第二标准曲线计算得到第二含量值,根据第一含量值和第二含量值计算,得到样本中cyp2e1酶的含量。
实施例4
本实施例提供一种基于特征肽段定量检测大鼠cyp2e1酶的检测试剂盒,该检测试剂盒包括第一定量肽段和第二定量肽段,第一定量肽段的氨基酸序列:finlvpsnlpheatr;第二定量肽段的氨基酸序列:giifnngptwk。第一标记肽段的同位素标记方式为:finl(13c615n1)vpsnlpheatr;第二标记肽段的同位素标记方式为gii(13c615n1)fnngptwk;以及dtt溶液、iaa溶液和胰蛋白酶液。
实验例
本实验例利用实施例3提供的基于特征肽段定量检测大鼠cyp2e1酶的检测方法对待检样本进行检测。
储备液及工作液的配制:取分别5mg的第一定量肽段(pep1)和第二定量肽段(pep2)用水溶解,得到浓度为0.95mg/ml的储备液。然后将储备液用含0.1%的甲酸的水溶液分别稀释成浓度为40ng/ml、80ng/ml、200ng/ml、400ng/ml、800ng/ml、1600ng/ml、3200ng/ml和12800ng/ml系列工作液。
质控工作液:将制备得到的浓度为0.95mg/ml的储备液用含0.1%的甲酸的水溶液分别稀释成浓度为60ng/ml(lqc)、300ng/ml(mqc)和2400ng/ml(hqc)作为质控工作液及浓度为10ng/ml的定量下限(lloq)工作液。取上述四个浓度的质控工作液各20μl,加入180μl大鼠血清作为替代基质,得到浓度分别为2ng/ml(lloq)、6ng/ml(lqc))、30ng/ml(mqc)、240ng/ml(hqc)的系列质控标准血清样本。
按照工作液的配制的方法,将第一标记肽段和第二标记肽段分别配制成浓度为0.95mg/ml的储备液。用含0.1%的甲酸的水溶液分别稀释得到浓度为25μg/ml第一标记肽段工作液(is1)和第二标记肽段工作液(is2),将第一标记肽段工作液和第二标记肽段工作液作为内标工作液,再用50%乙腈(含0.1%甲酸)淬灭剂稀释成2.5μg/ml的工作液待用。
标准血清样本配制与处理:取蛋白浓度为2μg/μl的血清样品20μl于2mlep管中,于95℃下反应2min使之变性。再加入30mm的dtt(原浓度300mm,用50mm的nh4hco3缓冲液稀释得到)溶液10μl,涡旋混匀,于56℃反应20min。待冷却后,立即加入新鲜配置的80mm的iaa(原浓度400mm,用50mm的nh4hco3缓冲液稀释得到)溶液10μl,涡旋混匀,于37℃下恒温避光震荡20min。加入50mm的nh4hco3缓冲液15μl,涡旋混匀,加入20μg/200μl的胰蛋白酶溶液5μl(0.5μg)离心(13200rpm,4℃,10min),总反应体系为60μl,于37℃下酶解16h,加入40μlsil-is混合溶液(50%乙腈含0.1%fa)终止酸化。涡旋混匀,离心,取上清液5μl进样分析。
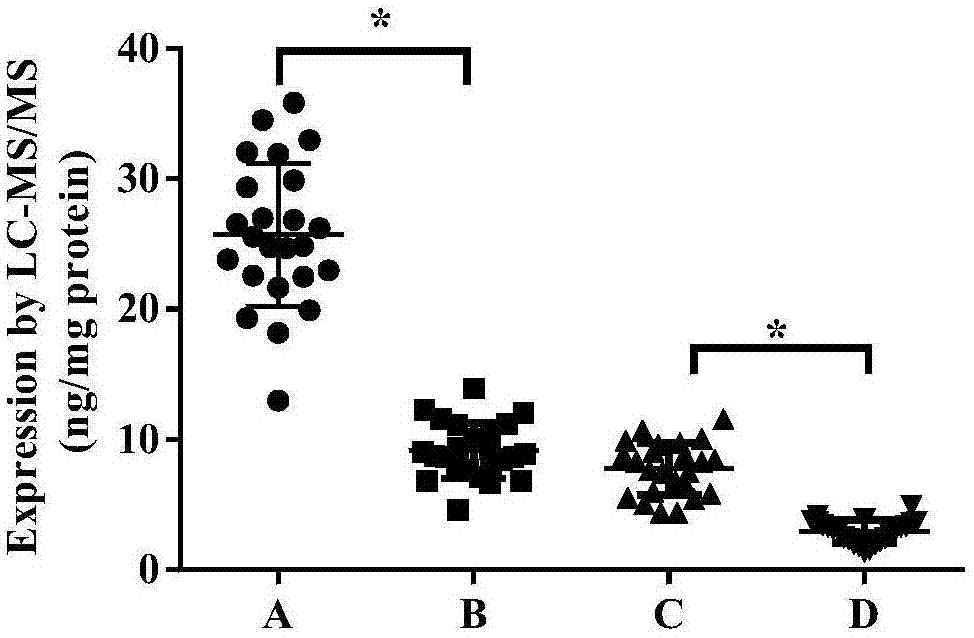
取24只大鼠肝匀浆或大鼠肝匀浆进一步纯化得到的肝微粒体作为样本,分别进行上述样本处理步骤,进行检测分析。检测结果如图1和表1所示。
表124只大鼠cyp2e1酶定量检测结果
结果如图1和表1所示,图1中a和c表示第一定量肽段(pep1)的检测结果,b和d表示第二定量肽段(pep2)的检测结果;a和b表示大鼠肝微粒样本,c和d表示肝匀浆样本。在方法建立时发现,同等浓度下,pep1的响应明显高于ppe2。定量结果显示,同一样本,经pep1测得的cyp2e1含量水平约为pep2的3倍。这可能是两条肽段被酶解的难易程度不同,酶解效率存在差异所致。
为了验证酶解效率,分别使用第一定量肽段和第二定量肽段的延长肽段进行酶解效率实验。延长肽段的酶解效率实验结果如图2所示。
从图2可以看出,pep1的酶解效率约为85%,pep2的酶解效率为60%,因此第一定量肽段和第二定量肽段出现结果偏差,是由于酶解效率不同导致。
验证检测方法的准确性,配制三种样本,验证检测方法的选择性,空白基质溶液(酶解后的大鼠血清溶液)、标准血清样本溶液、大鼠肝微粒体或肝匀浆溶液进行检测。分别用第一定量肽段和第二定量肽段进行检测结果如图3、图4和图5所示。
从图中可以看出,空白基质对pep1、pep2均无干扰,同位素内标is1与is2不影响肽段检测,说明第一定量肽段和第二定量肽段选择合理。
标准曲线及其线性关系:第一定量肽段和第二定量肽段与相应内标的峰面积比值为纵坐标(y),肽段的浓度为横坐标(x),1/x2为加权值,建立标准曲线。分析三批。结果如图6、图7和图8所示。
从图6、图7和图8可以看出,pep1与pep2均在2~320ng/ml的浓度范围内线性关系良好,两条肽段的lloq均为2ng/ml。
第一定量肽段(pep1)和第二定量肽段(pep2)的批间以及批内的精密度和准确度考察,检测结果如表2和表3所示。
表2pep1的批内、批间精密度与准确度
表3pep2的批内、批间精密度与准确度
结果如表2和表3所示,pep1四个浓度的批间与批内精密度不超过6.2%,准确度落于85%~115%范围,pep2四个浓度的批间与批内精密度rsd%值不超过6.7%,准确度落于85%~115%范围。
样品稳定性:为了验证样品的稳定性,进行了pep1与pep2在进样条件下置放24h后再进样、-20℃条件下放置20d、-20℃条件下反复冻融3次,进行检测。检测结果如表4和表5所示。
表4pep1稳定性
表5pep2稳定性
从表4和表5可以看出,第一定量肽段工作液和第二定量肽段在多种条件下都具有较好的稳定性,利于检测。
综上所述,本发明实施例提供的利用特征肽段定量检测cyp2e1酶的检测方法,能快速精确的测定样本中cyp2e1酶的含量,操作简单;利用特征肽段定量检测cyp2e1酶的检测试剂盒,包含的定量检测肽段具有较好的线性关系、精密度和准确度均较高,稳定性较强,具有较高的实用性和较高的推广应用价值。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
sequencelisting
<110>余鹏
<120>基于特征肽段定量检测大鼠cyp2e1酶的检测方法及检测试剂盒
<160>2
<170>patentinversion3.5
<210>1
<211>15
<212>prt
<213>人工合成
<400>1
pheileasnleuvalproserasnleuprohisglualathrarg
151015
<210>2
<211>11
<212>prt
<213>人工合成
<400>2
glyileilepheasnasnglyprothrtrplys
1510
- 还没有人留言评论。精彩留言会获得点赞!