一种凝胶培养基中β-内酰胺酶的酶活力定量检测方法与流程
本发明涉及药品领域,具体涉及一种凝胶培养基中β-内酰胺酶的酶活力定量检测方法。
背景技术:
β-内酰胺酶检测从方法学上可以分为以下两种:1)通过测定未分解的酶促反应底物(青霉素)的含量来间接推算体系中β-内酰胺酶的浓度。该方法以生物测定法(杯碟法)及配体-受体检测法为代表,其特点是原理明确、特异性强。2)通过测定底物青霉素分解产物的方法,青霉素经过β-内酰胺酶的分解之后生成稳定的中间产物-青霉噻唑酸,通过测定体系中青霉噻唑酸的含量将能够计算出β-内酰胺酶的含量。该方法以碘量法、产色头孢菌素法为代表。上述方法的不足在于或者耗时长或者偏差大或者属于半定量性质,无法满足“快速、准确”的检验要求。此外,沈祝飞等开发的“一种β-内酰胺酶培养基平板的活性检测方法”,也是一种半定量检测方法,而且该方法不能适用于表面凸起的接触皿。
因β-内酰胺类抗生素的大量及广泛使用,对各种β-内酰胺类抗生素的耐药菌不断增多,且耐药性不断增强,而产生β-内酰胺酶是出现耐药性的最主要原因,主要是由于它将β-内酰胺类抗生素分子中的β-内酰胺环水解,形成青霉噻唑酸,使β-内酰胺类抗生素失效。
目前中国药典中只有对液体β-内酰胺酶活性检测方法的规定(碘量法),对凝胶培养基所含β-内酰胺酶的有效酶活力定量测定没有相应的方法和标准,国内外专利和文献尚无有关报道,现在市场上的加酶平皿均是以加酶量表示而无成品有效酶活标识,因此市场上的许多无菌β-内酰胺酶平皿的质量不合格(酶活力),致使大量用户的环境监测结果不可信。
技术实现要素:
本发明的目的是提供一种凝胶培养基中β-内酰胺酶的酶活力定量检测方法,该方法能快速、准确地定量检测出凝胶培养基所含的有效的β-内酰胺酶酶活力单位。
为达此目的,本发明采用以下技术方案:
1.采用明确效价单位数的青霉素g钠标准品,用ph7.0的磷酸盐缓冲溶液精确配制不同浓度的青霉素g钠标准品溶液(mg/ml),浓度范围从0~6mg/ml。
2.取各不同浓度的青霉素g钠标准品溶液1ml,加入中性羟胺(ph6.75)1ml、95%乙醇1ml,反应3min,再加入硫酸铁胺溶液2ml,混匀&显色,待反应气泡消失后,测定od515值即a值。
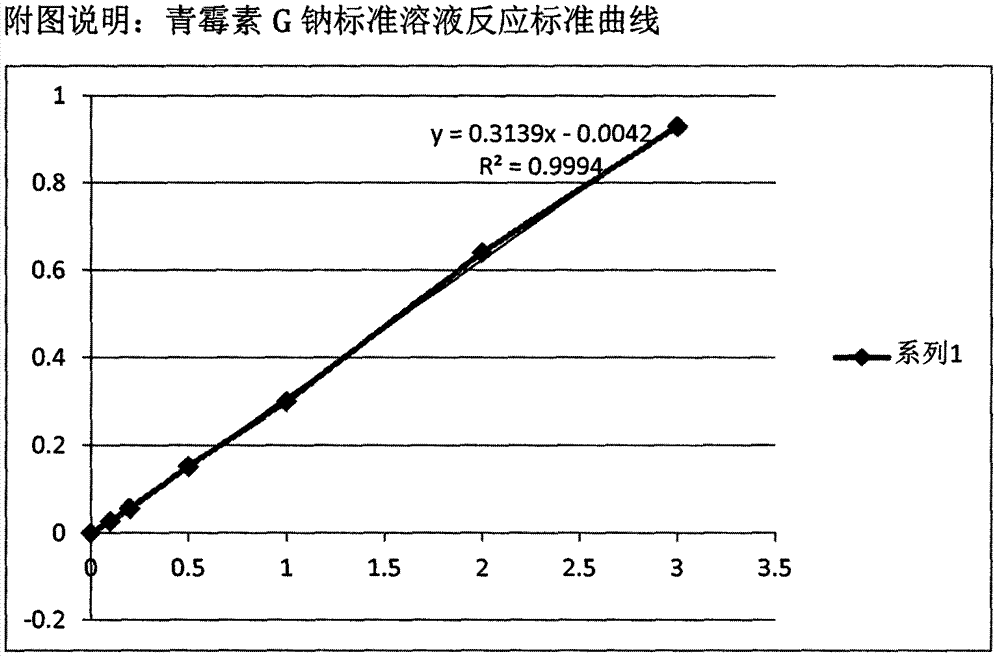
3.以青霉素g钠浓度或单位数为横坐标,以od515值即a值为纵坐标,绘制标准曲线(图),得到回归方程y=ax+b,r2≥0.999。
4.精密称取含酶凝胶培养基(0.01g),加入ph7.0的磷酸盐缓冲液浆化(酶解)制成澄明溶液,作为样品处理液。必要时于37±1℃保温1小时使样品溶液澄清。
5.将含酶平皿培养基的样品处理液用ph7.0的磷酸盐缓冲溶液按“1、2、3、4、5......倍数稀释”,即得样品稀释液。样品处理液若不稀释,稀释倍数=1。
6.按样品处理液或样品稀释液的估计酶活力单位数,取适量体积(ml)的样品(稀释)溶液于三角瓶中,按“1∶1.5~5.0”比例加入适量青霉素g钠标准品溶液,定容至20-40ml体积,得样品保温反应混合液,于37±1℃保温计时。
7.按步骤2.方法操作,于保温“0”hr时取1ml样品保温反应混合液,加入各反应溶液,混匀&显色,待反应气泡消失后,测定od515值即a0样。其余样品保温混合液于37±1℃保温计时1hr,于“1”hr时取1ml样品保温反应混合液,测定od515值即a1样。
8.样品溶液检测时须做阴性对照测定,测定得到a0阴和a1阴。
9.依据测定结果,计算反应液的酶活,最终计算出每克培养基所含酶活力单位数。
10.作为优选,反应缓冲液为磷酸盐缓冲液(0.05m,ph7.0);中性羟胺溶液为0.125m,ph6.75(盐酸羟胺与碱性缓冲液混合制得。碱性缓冲液ph12.5,由氢氧化钠4.32g,三水合乙酸钠0.862g水溶后,定容至500m);硫酸铁胺溶液为0.25m。水解酶用量为20-60u/g;反应体系的体积为20~40ml,保温时间为1hr,保温温度37±1℃。β-内酰胺酶酶与底物反应比为“1∶1.5~5.0”。
11.检出限
20次空白样的检测结果od值:
平均值:
标准偏差:
检测限:cl(或ql)=k·sb/m=0.028(mg/ml),cl=0.028×1650=46(u/g)
附图说明
图1是实施例1和实施例2的青霉素g钠标准品溶液显色测定标准曲线及回归方程。
具体实施方式
溶液配制:
(1)0.125mol/l中性羟胺溶液(ph6.75):取盐酸羟胺8.685g,以水溶解,定容至500ml,得0.25mol/l盐酸羟胺溶液。取氢氧化钠4.32g和三水合乙酸钠0.862,混合溶解后定容至500ml,得碱性缓冲液(ph12.5)。
将中性羟胺溶液和碱性缓冲液进行等体积混合,即得。
(2)0.25mol/l硫酸铁胺溶液:取98%的浓硫酸4.1ml,定容至500ml,得0.15mol/l硫酸溶液。取硫酸铁胺60.25g,以0.15mol/l硫酸溶液悬浮,加热使之溶解,冷却后以0.15mol/l硫酸定容至500ml,即得0.25mol/l硫酸铁胺溶液。
(3)0.05m磷酸盐缓冲液(ph7.0):取磷酸氢二钾9.39g与磷酸二氢钾3.5g,加纯化水定容至500ml,过滤,在115℃灭菌30min,即得0.1m磷酸盐缓冲液,备用。
临用时,取适量体积的0.1m磷酸盐缓冲液用灭菌纯化水稀释一倍体积,即得。
(4)配制浓度范围为0~6mg/ml的青霉素g钠标准品溶液。按技术方案的方法进行测定,根据测定结果,绘制标准曲线,得到回归方程y=ax+b,r2=0.999。
实施例1(tsac测定)
1、取头孢菌素酶冻干粉一瓶(××生物技术有限公司,头孢菌素酶批号:7041630d),采用中国药典方法测得酶活力单位为1009.8万单位/g。
2、将酶冻干粉精密称定,用0.05m磷酸盐缓冲液(ph7.0)定容,使之成30万单位/ml的酶溶液。
3、取一瓶300ml灭菌后冷却至55-56℃的tsa(大豆酪蛋白琼脂),加入10ml酶溶液,轻轻摇晃混合均匀,按20ml液体/皿倒皿制备15个φ90mm加酶平皿,得到约为20万单位/皿的加酶平皿。10个平皿完整装袋包装,8k辐照灭菌;5个装袋包装,不辐照。
4、酶活测定
测定方法:精确称取待测的加酶tsac(0.01g)15g,加入4倍量磷酸盐缓冲液(必要时加入胶体水解酶30u/g),浆化制备成澄明溶液,37±1℃保温1hr。
依据本技术方案之方法进行酶活力测定。
测定结果:
实施例2(tsam测定)
1、取金属β-内酰胺酶冻干粉一瓶(杭州××生物技术有限公司,金属β-内酰胺酶批号:6021639d),采用中国药典方法测得酶活力单位为730.2万单位/g。
2、将酶冻干粉精密称定,用0.05m磷酸盐缓冲液(ph7.0)定容,使之成30万单位/ml的酶溶液。
3、取一瓶300ml冷却至55-56℃的tsa(大豆酪蛋白琼脂),加入10ml酶溶液,轻轻摇晃混合均匀,按20ml液体/皿倒皿制备15个φ90mm加酶平皿,得到约为20万单位/皿的加酶平皿。10个加酶平皿完整装袋包装,8k辐照灭菌;5个加酶平皿装袋包装,不辐照。
4、酶活测定
测定方法:精确称取待测的加酶tsam(0.01g)15g,加入4倍量磷酸盐缓冲液(必要时加入胶体水解酶30u/g),浆化制备成澄明溶液,37±1℃保温1hr。
依据本技术方案进行酶活力测定。
测定结果:
- 还没有人留言评论。精彩留言会获得点赞!